文章信息
- 崔振, 李昌晓, 贺燕燕, 李晓雪, 任庆水
- Cui Zhen, Li Changxiao, He Yanyan, Li Xiaoxue, Ren Qingshui
- 中华金叶榆和银水牛果苗木的生长和光合作用对土壤锌污染的响应
- Responses of Growth, Photosynthesis of Ulmus pumila 'Jinye' and Shepherdia argentea to Soil Zinc Contamination
- 林业科学, 2017, 53(9): 114-122.
- Scientia Silvae Sinicae, 2017, 53(9): 114-122.
- DOI: 10.11707/j.1001-7488.20170914
-
文章历史
- 收稿日期:2016-12-30
- 修回日期:2017-02-20
-
作者相关文章
重金属污染已成为当前全球面临的主要环境问题之一(Lin et al., 2012)。一些重金属元素是植物生长与发育所必需的,但在其过高浓度时会表现出非常大的毒性(Rout et al., 2003)。锌(Zn)作为植物必需的一种微量元素,在植物体内新陈代谢中具有重要作用,如锌是植物体内许多酶的组成成分和活化剂(Li et al., 2013),参与植物光合作用及其体内的氮代谢、生长素合成等(Cakmak, 2000)。然而土壤中过量的锌会阻碍植物生长和发育(Vaillant et al., 2005),破坏叶绿素的生物合成、影响植物的光合作用(Doncheva et al., 2001)。此外,锌的毒性会对植物体的离子传输和代谢过程产生不利影响,蒸腾作用、光合作用、氮代谢相关的酶活性都会受到限制(Reichman et al., 2001),减少作物产量,进入食物链危害人类健康(Hassan et al., 2011)。
目前锌污染在我国及全球环境中日益严重(Luo et al., 1995;孙铁珩, 2005)。随着我国西部大开发战略实施,西部地区已遭受到明显、普遍的锌污染,危及城乡人居环境安全与人民群众身体健康,因而迫切需要适宜的方法解决土壤锌污染问题(崔德杰等, 2004; 钱鹏等, 2010; 王幼奇等, 2014; 2016; 王美娥等, 2016)。针对锌污染土壤,植物修复技术因其成本低、效率高,同时具有美观和长时间适用性特点而备受关注(Ahemad, 2014)。在锌污染土壤植物修复中,植物吸收土壤中的锌并转移到地上部分,或通过锌在根部积累、沉淀, 或根表吸收来加强土壤中锌的固化(Zhang et al., 2010)。因此筛选合适的植物物种用于锌污染土壤修复是非常重要的。
中华金叶榆(Ulmus pumila ‘Jinye’)属榆科(Ulmaceae)灌木,具有很高的观赏和经济价值,对寒冷、干旱气候具有极强的适应性,抗逆性强,可耐-36 ℃的低温,同时有很强的抗盐碱性(曹书敏等,2011; 段龙飞等,2014),常作为行道树和园林绿化的优良树种。银水牛果(Shepherdia argentea)为胡颓子科(Elaeagnaceae)灌木,于2002年从美国科罗拉多引进到中国西部地区,用于当地的植被重建与绿化,适合生长于弱碱性和盐渍土中,具有耐贫瘠土壤,耐盐、耐寒等特点(陈静等, 2009; 张雪等, 2016)。然而有关中华金叶榆和银水牛果是否适合在锌污染土壤栽植和应用于锌污染土壤生态修复,尚未见相关报道。因此,开展中华金叶榆(本地种)和银水牛果(引进种)2个树种在锌污染土壤上的生长、光合以及耐受适应特征研究,为我国西部地区耐锌树种的引进与应用提供科学依据。
1 材料与方法 1.1 试验材料和设计试验材料为银川市森淼植物园提供的生长基本一致的中华金叶榆和银水牛果2年生苗木。供试土壤采自宁夏银川市森淼植物园,模拟当地土壤类型,使用沙土和壤土1:1比例混合的沙壤土进行试验。2015年5月底,将沙壤土过4 mm的筛,将Zn(CH3COO)2·2H2O以溶液形式均匀喷洒在沙壤土中,混合均匀。供试土壤基底值锌含量为125 mg·kg-1。参照《土壤环境质量标准》(GB15618—1995),采用完全随机区组设计,设置4个锌添加浓度处理组:CK(0,对照)、T1(300 mg·kg-1)、T2(500 mg·kg-1)、T3(1 000 mg·kg-1)(以添加的纯锌和风干土计)。处理过得土壤经陈化1个月后,装入塑料桶(高30 cm×内径30 cm)中,防止浇水时锌流失,每桶装土7.5 kg。于2015年7月10日,将中华金叶榆[苗高(66±2.83) cm]和银水牛果[苗高(42±2.07) cm]幼树各20株,随机移栽入盛有含锌土壤的塑料桶中,每个处理5盆,每盆1株幼树。将所有盆栽试验用苗置于银川市森淼植物园种苗生物工程国家重点实验室实验基地大棚下(棚顶透明,四周开敞)培养,整个试验期间进行常规田间浇水管理。在试验进行90天时,进行各项指标的测定,并进行破坏性取样。
1.2 气体交换参数的测定每个处理随机选择5株植株,采用德国WALZ公司生产的GFS-3000便携式光合仪,在植物健康成熟的功能叶片中部(从植株顶端往下数第3—4片叶)测定。测定时间为9:30—11:30,保证测定时天气状况为晴天。采用GFS-3000的光源和温度控制系统,设置饱和光照强度为1 000 μmol·m-2s-1,叶室温度为25 ℃。测定内容包括中华金叶榆和银水牛果各处理组的净光合速率(net photosynthetic rate, Pn)、气孔导度(stomatal conductance, Gs)、胞间CO2浓度(intercellular CO2 concentration, Ci)、蒸腾速率(transpiration rate, Tr)。
1.3 光合色素含量的测定收集测定光合指标的叶片,用于测定光合色素含量。叶片经充分研磨、浸提后,用普析TU-1901双光束紫外可见分光光度计,测定645和663 nm处的吸光度,根据高俊凤(2006)的方法,计算叶绿素a(Chl a)、叶绿素b(Chl b)及总叶绿素(Chls)含量。
1.4 生物量和锌含量的测定于2015-10-10试验结束取样时,量取植株株高,然后把植物分为根、地上部分2部分。植物地上部分使用超纯水彻底洗净;植物根部使用超纯水洗净后,用20 mmol·L-1 EDTA-Na2洗5 min,去除根表面吸附的锌离子,然后再用超纯水冲洗干净。在烘箱中80 ℃下烘干至恒质量,称取质量后用不锈钢植物粉碎机粉碎,储存于聚乙烯瓶中备用。用万分之一分析天平精确量取植物各部分样品干粉各0.050 g,用微波消解仪(Leeman SW-4, German)进行消解定容。消解液采用电感耦合等离子体发射光谱法(ICP-OES, ThermoFisheriCAP 6300, UK)进行重金属Zn2+含量测定。
1.5 数据分析耐性指数(tolerance index,Ti)计算公式(Wilkins, 1978)为:
Ti=[(LR + LS + WR + WS) /4]× 100%。
式中:LR、LS、WR、WS分别为各锌胁迫组的平均总根长、株高增长量、根平均生物量、地上部分平均生物量与对照组相应指标的比值。
采用植物对重金属的生物富集系数(bio-concentration factor, BCF)和转移系数(translocation factor, TF)评价其对锌的富集能力和转移到地上部分的能力(Zacchini et al., 2009),计算公式分别为:
BCF=CR/CS;TF=CA/CR。
式中:CR、CS、CA分别为植物根中积累的锌含量、土壤中锌含量、植物地上部分积累的锌含量。
利用统计分析软件SPSS 22.0和Excel 2010进行试验数据分析与处理。采用单因素方差分析(One-way ANOVA),揭示不同浓度重金属锌胁迫对中华金叶榆和银水牛果的光合生理、生长与生物量及对锌吸收积累的影响,并用Duncan检验法检验每个指标在不同处理组的差异显著性(P<0.05)。采用Origin 8.5作图。
2 结果与分析 2.1 锌胁迫对苗木生长的影响锌胁迫对苗木生长具有显著影响(图 1)。中华金叶榆株高随土壤锌胁迫浓度的增高呈显著下降趋势(P<0.05),在T3浓度时达到最低值,3个锌胁迫组的株高分别为对照的95%、90%、72%;3个锌胁迫组银水牛果的株高随土壤锌胁迫浓度的增高也呈现显著下降趋势(P<0.05),分别为对照的88%、82%、69%。随土壤锌胁迫浓度增加,中华金叶榆和银水牛果的根系、地上部分生物量均显著下降(P<0.05),在T3浓度时达到最低,分别为对照的51%、63%(中华金叶榆)和36%、47%(银水牛果)。中华金叶榆的生物量根冠比在T1、T2浓度时无显著性差异,在T3浓度胁迫下显著下降(P<0.05),为对照的81.05%;银水牛果3个锌胁迫组的生物量根冠比与对照组比均显著下降(P<0.05),分别为对照的91%、77%、77%。中华金叶榆和银水牛果的耐性指数Ti均随土壤锌胁迫浓度增加而显著降低(P<0.05),3个锌胁迫组的中华金叶榆和银水牛果Ti分别对照的81%、66%、36%和73%、57%、29%。
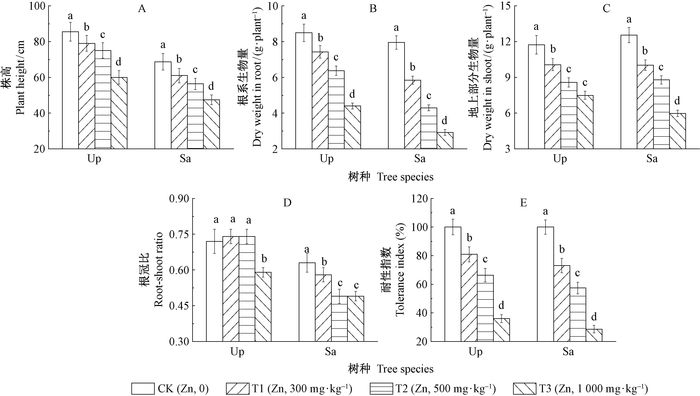
|
图 1 不同浓度锌胁迫对中华金叶榆(Up)和银水牛果(Sa)株高、生物量、根冠比和耐性指数的影响 Fig.1 Effects of different Zn concentrations on the plant height, biomass, root-shoot ratio and tolerance index of Ulmus pumila 'Jinye' (Up) and Shepherdia argentea(Sa) 图中数据为5株植株的生长指标平均值和标准误;不同字母表示各指标在P<0.05水平差异显著。下同。 Data shown are means ± standard error (n=5), and different letters present significant difference at P < 0.05. The same below. |
中华金叶榆和银水牛果T1处理组的叶绿素a与对照组相比无显著差异,T2、T3组均显著降低(P<0.05),分别为对照的79%、58%和82%、70%(图 2A)。中华金叶榆T1处理组的叶绿素b与对照组相比无显著差异,T2、T3组显著下降(P<0.05),分别为对照的65%和50.95%;银水牛果的叶绿素b在T1、T2、T3处理组相较于对照组呈现显著降低趋势(P<0.05),分别为对照的82%、69%和55%(图 2B)。中华金叶榆的总叶绿素含量T1、T2、T3处理组与对照组相比均显著降低(P<0.05),分别为对照的84%、72%和53%;银水牛果的总叶绿素含量与对照组相比,T1处理组无显著变化,T2、T3处理组均显著降低(P<0.05),分别为对照的78%和66%(图 2C)。中华金叶榆叶绿素a/b随锌胁迫浓度增高呈增加趋势,但T1、T2组与对照组无显著性差异,T3处理组显著高于对照组(P<0.05);银水牛果的叶绿素a/b在T1、T2、T3处理组均显著高于对照组(P<0.05),分别为对照的116%、117%、127% (图 2D)。

|
图 2 锌胁迫对中华金叶榆(Up)和银水牛果(Sa)叶绿素含量的影响(平均值±标准误) Fig.2 The effects of Zn stress on chlorophyll contents of Ulmus pumila 'Jinye' (Up) and Shepherdia argentea (Sa)(mean ± SE) |
锌胁迫对中华金叶榆和银水牛果的光合作用具有抑制作用。中华金叶榆和银水牛果的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)均随Zn胁迫浓度增加呈下降趋势。其中,净光合速率与胞间CO2浓度在不同处理组间的变化趋势及显著性基本一致,而不同处理组气孔导度与蒸腾速率也具有相同的显著性变化。与对照相比,中华金叶榆和银水牛果在T1、T2、T3组的净光合速率均显著下降(P<0.05),分别为对照的72%、45%、44%和74%、53%、26%(图 3A);中华金叶榆和银水牛果在T1、T2、T3组的气孔导度比对照组显著下降(P<0.05),分别为对照的72%、50%、40%和52%、35%、16%(图 3B);中华金叶榆和银水牛果在T1、T2、T3组的胞间CO2浓度比对照组显著下降(P<0.05),分别为对照的98%、96%、89%和96%、80%、77%(图 3C);与对照植株相比,中华金叶榆和银水牛果在T1、T2、T3组的蒸腾速率显著下降(P<0.05),分别为对照的91%、64%、58%和85%、36%、23%(图 3D)。
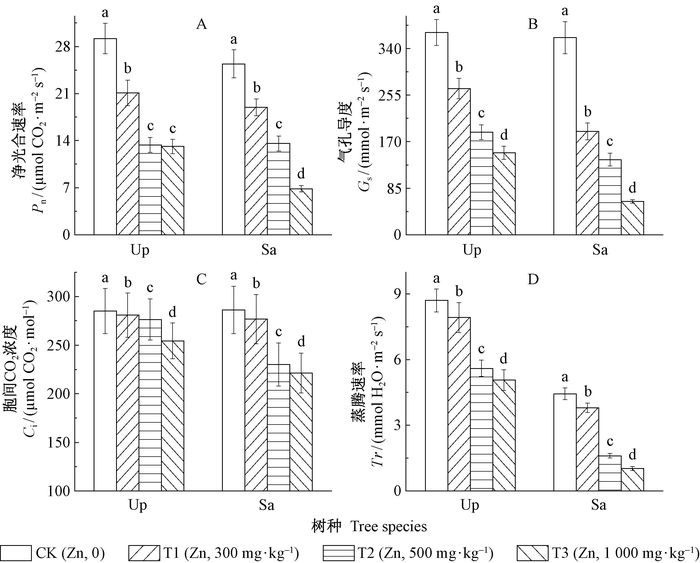
|
图 3 锌对中华金叶榆(Up)和银水牛果(Sa)光合作用的影响(平均值±标准误) Fig.3 Effect of Zn on the photosynthesis of Ulmus pumila 'Jinye' (Up) and Shepherdia argentea(Sa) (mean± SE) |
随锌胁迫浓度增高,中华金叶榆和银水牛果在T1、T2、T3组的根部累积的Zn含量都显著高于对照组(P<0.05),在T3组达到最大;3个Zn胁迫组中华金叶榆和银水牛果根部累积的Zn含量分别为92.17、152.05、345.31 mg·kg-1 DW和61.75、90.52、159.51 mg·kg-1 DW;T1、T2、T3组中华金叶榆的根部Zn含量均高于银水牛果根部Zn含量(P<0.05)(图 4A)。中华金叶榆和银水牛果地上部分Zn含量随Zn浓度增加呈现显著增高趋势(P<0.05),均在T3水平达到最大;3个Zn胁迫组中华金叶榆和银水牛果地上部分累积的Zn含量分别为110.30、154.03、296.18 mg·kg-1 DW和68.49、126.02、139.75 mg·kg-1 DW;中华金叶榆地上部分Zn含量均高于银水牛果地上部分Zn含量(P<0.05)(图 4B)。在T1浓度胁迫下,中华金叶榆根富集系数与对照组相比无显著差异(P>0.05),T2、T3组均显著高于对照组(P<0.05),为对照的119%和148%;随Zn胁迫浓度增加,银水牛果的根富集系数与对照组相比均显著下降(P<0.05),但组间无显著差异(图 4C)。中华金叶榆和银水牛果的转移系数随Zn胁迫浓度增加均呈现先升后降趋势;中华金叶榆的转移系数介于0.84~1.19之间,在T1浓度达到最大值;银水牛果的转移系数介于0.62~1.39之间,在T2浓度达最大(图 4D)。

|
图 4 中华金叶榆(Up)和银水牛果(Sa)根部、地上部锌含量及富集、转移系数(平均值±标准误) Fig.4 Zn contents in root, above-ground part, bio-concentration factor and translocation factor of Ulmus pumila 'Jinye'(Up) and Shepherdia argentea(Sa) (mean± SE) |
植物在遭受过量锌胁迫时,会表现出与其他重金属胁迫类似的症状,如限制根的生长、产生氧化胁迫、诱导变色病产生、改变植物组织中的磷含量,也会干扰其他微量元素的吸收与利用(Marschner, 1995; Baccio et al., 2003)。本试验中,中华金叶榆和银水牛果的株高、根生物量和地上部分生物量均随锌胁迫浓度增加而降低,这与生长在高锌介质中的杞柳(Salix integra)(杨卫东等, 2009)、灰杨(Populus canescens)(张莹等, 2011)、欧洲栓皮栎(Quercus suber)(Disante et al., 2011)、茶树(Camellia sinensis)(Mukhopadhyay et al., 2012)等的研究结果一致,高浓度锌限制植物生长并减少了植物体生物量积累。植物生物量根冠比,即植物地下部分和地上部分生物量的比值,是植物体光合作用产物分配的重要体现(耿浩林等, 2008),反映植物的生长状况及环境对根系与地上部分生长的不同影响(王艳哲等, 2013)。中华金叶榆的根冠比在T3浓度(Zn 1 000 mg·kg-1)显著降低,银水牛果的根冠比在T1(Zn 300 mg·kg-1)、T2(Zn 500 mg·kg-1)、T3(Zn 1 000 mg·kg-1)浓度与对照组相比都显著下降,表明锌胁迫限制植物根部生长,这将影响植物根部吸收水分与养分,进一步对植物自身生长和生物量积累起限制作用。植物的耐性指数Ti(%)可综合反映植物对重金属耐性的大小,有学者把植物耐性分为敏感型(Ti<35)、中等程度耐受性(35<Ti<60) 和高耐受性(Ti>60)3种类型(Lux et al., 2004)。3个锌胁迫浓度下中华金叶榆和银水牛果的耐性指数分别为81%、66%、36%和73%、57%、29%。表明中华金叶榆对T1、T2浓度有较高的锌耐受性,对T3浓度锌耐受性低,响应敏感;银水牛果锌耐受性对T1浓度较高,对T2浓度中等,对T3浓度较低。2树种在T1、T2浓度都表现出了较好的耐受性,而中华金叶榆对锌的耐受能力优于银水牛果。
叶绿素含量减少会对植物光合作用不利,最终导致植物生物量降低(Gupta et al., 2011)。本试验中,随锌胁迫浓度增大,中华金叶榆和银水牛果的叶绿素a、叶绿素b和总叶绿素含量表现出不同的降低趋势。相关研究(Shakya et al., 2008; Cherif et al., 2010)也报道了高浓度锌对植物光合色素积累有抑制作用,原因是高浓度的重金属锌进入细胞后的毒害作用会引起细胞膨压增大,溶解类囊体结构(张莹等, 2011);同时还会与叶绿素合成有关酶类肽链中富含巯基(SH)的部分结合,取代其上的铁离子和镁离子,从而阻碍叶绿素的合成(Assche et al., 1990; Küpper et al., 1998; 邱昌恩等, 2007)。叶绿素a/b的比值可以反映捕光色素复合体Ⅱ(LHCⅡ)在含有叶绿素的结构中的比重(李磊等, 2011)。在本研究中,中华金叶榆Chl a/Chl b在T3浓度显著升高,银水牛果的Chl a/Chl b在T1、T2、T3浓度胁迫组与对照组相比显著升高,表明了在这些处理浓度下2种植物体内的叶绿素b更易被抑制,锌胁迫降低叶绿素b对光能的吸收和传递,调控光合机构天线的大小和维持LHCⅡ稳定性的功能遭到破坏(郭春爱等, 2006)。
光合作用对满足植物自身生长发育及维持生存至关重要(程建峰等, 2012)。重金属的毒性会对植物体光合器官产生毒害,影响植物光合功能(Bertrand et al., 2005)。逆境条件下,引起植物叶片光合作用降低的原因可分2个方面:气孔限制和非气孔限制,评价依据是胞间CO2浓度值的大小。在净光合速率、气孔导度和胞间CO2浓度值同时下降时,净光合速率的下降为气孔限制,否则非气孔限制为主导因素(Farquhar et al., 1982)。在本研究中,中华金叶榆和银水牛果的净光合速率、气孔导度、胞间CO2浓度与对照组相比均显著降低,说明在高锌胁迫下,气孔关闭导致2种植物的净光合速率下降。胁迫介导的气孔关闭将限制CO2同化,造成能量过剩,使H2O2积累,光合作用的集光复合体被扰乱(Sayed, 2003),导致光合作用降低。在本研究中,叶绿素含量随胁迫浓度增加显著降低,进而影响植物光合作用,也成为导致2种植物净光合速率下降的重要原因之一(Mukhopadhyay et al., 2012)。2种植物的蒸腾速率和气孔导度随锌浓度的增加的变化趋势相近,蒸腾速率下降可能是由于锌引起了叶片内源脱落酸(ABA)水平增加而导致的气孔关闭(Yang et al., 2011)。中华金叶榆的净光合速率在T3浓度下与对照相比虽显著降低,但与T2浓度处理组间无显著性差异;同时,在同等浓度的锌胁迫下中华金叶榆的Pn、Gs、Ci、Tr的值均高于银水牛果,进一步说明中华金叶榆的光合适应性大于银水牛果。在高锌胁迫下,由于2个树种苗木的净光合速率下降,有机物合成减少,导致植物的株高和生物量显著下降。
土壤中重金属含量增加与根和地上部分累积的重金属含量具有非饱和线性关系(Lasat et al., 1998)。本试验中,中华金叶榆和银水牛果的根和地上部分锌含量均随土壤锌浓度增加而上升,均在T3组达到最大值,本文研究结果与之一致。在对锌矿区的植物修复研究中,耐锌树种旱柳(Salix matsudana)、盐肤木(Rhus chinensis)对锌的转移系数均大于1,对尾矿污染的治理成效显著(施翔等,2012)。对锌的超富集植物东南景天(Sedum alfredii)的研究表明,地上部分积累的锌含量远大于根部的锌含量,具有很高的锌转移能力(Huang et al., 2013)。而在重金属污染地区的植物修复中,根部累积的重金属含量一般大于地上部分,但中华金叶榆和银水牛果对锌的积累特性呈现了地上部分累积的锌含量大于根部,这种特性与耐锌树种旱柳、盐肤木和超富集树种东南景天是相同的。这表明中华金叶榆和银水牛果更倾向于将锌转移到地上部分,利用体内的解毒机制来减少锌的毒害作用,这种策略可能与植物体内存在的植物螯合肽和金属硫蛋白有关。植物体内的重金属离子在向地上部分转运的过程中,其体内的膜转运蛋白起到决定性的作用,重金属ATP酶(heavy metal transporting ATPase,HMA)就是其中一类,HMA的一个亚类HMA4在植物受到高浓度的Zn胁迫时,可将根部的锌运输到地上部(Hanikenne et al., 2008),中华金叶榆和银水牛果高的锌转移系数可能与HMA4有关。2树种在T1、T2浓度处理下地上部分转移锌的能力较高,且作为灌木树种本身具有大的生物量,在土壤中锌含量625 mg·kg-1时,中华金叶榆和银水牛果均具有较好的锌耐受能力,因此可在西部锌污染区作为绿化树种推广。
4 结论中华金叶榆和银水牛果的生长和光合作用随锌胁迫浓度升高受到的抑制程度增加,但在土壤锌含量为625 mg·kg-1时,均具有较好的锌耐受性和向地上部分的迁移能力。因此中华金叶榆作为乡土适生树种,可在西部锌污染地区用于绿化;银水牛果作为外来引进树种,其在西部锌污染区具有一定的绿化应用潜力。
| [] |
曹书敏, 杨晴, 杨俊明, 等. 2011. 家榆和金叶榆光合·蒸腾及荧光参数对水分胁迫的响应. 安徽农业科学, 39(22): 13477–13480.
( Cao S M, Yang Q, Yang J M, et al. 2011. Research on the response of the photosynthesis, transpiration and fluorescence index of Ulmus pumila L. and Ulmus pumila cv. Jinye to water stress. Journal of Anhui Agricultural Sciences, 39(22): 13477–13480. DOI:10.3969/j.issn.0517-6611.2011.22.083 [in Chinese] ) |
| [] |
陈静, 秦景, 贺康宁, 等. 2009. 水分胁迫对银水牛果生长及光合气体交换参数的影响. 西北植物学报, 29(8): 1649–1655.
( Chen J, Qin J, He K N, et al. 2009. Influences of water-stress on Shepherdia argentea seedlings growth and photosynthetic gas-exchange parameters. Acta Botanica Boreali-Occidentalia Sinica, 29(8): 1649–1655. [in Chinese] ) |
| [] |
程建峰, 陈根云, 沈允钢. 2012. 植物叶片特征与光合性能的关系. 中国生态农业学报, 20(4): 466–473.
( Cheng J F, Chen G Y, Shen Y G. 2012. Relational analysis of leaf characteristics and photosynthetic capacities of plants. Chinese Journal of Eco-Agriculture, 20(4): 466–473. [in Chinese] ) |
| [] |
崔德杰, 张玉龙. 2004. 土壤重金属污染现状与修复技术研究进展. 土壤通报, 35(3): 366–370.
( Cui D J, Zhang Y L. 2004. Current situation of soil contamination by heavy metals and research advances on the remediation techniques. Chinese Journal of Soil Science, 35(3): 366–370. [in Chinese] ) |
| [] |
段龙飞, 尚爱芹, 杨敏生, 等. 2014. 中华金叶榆不同无性系光合特性和叶绿素荧光参数日变化研究. 中国农业科技导报, 16(6): 21–27.
( Duan L F, Shang A Q, Yang M S, et al. 2014. Studies on diurnal variations of photosynthetic characteristics and chlorophyll fluorescence parameters of different clones of Ulmus pumila cv. 'Zhonghuajinye. Journal of Agricultural Science and Technology, 16(6): 21–27. [in Chinese] ) |
| [] |
高俊凤. 2006. 植物生理学实验指导. 北京, 高等教育出版社: 214-215.
( Gao J F. 2006. Plant physiology experiment instruction. Beijing, Higher Education Press: 214-215. [in Chinese] ) |
| [] |
耿浩林, 王玉辉, 王风玉, 等. 2008. 恢复状态下羊草(Leymus chinensis)草原植被根冠比动态及影响因子. 生态学报, 28(10): 4629–4634.
( Geng H L, Wang H Y, Wang F Y, et al. 2008. The dynamics of root-shoot ratio and its environmental effective factors of recovering Leymus chinensis steppe vegetation in Inner Mongolia. Acta Ecologica Sinica, 28(10): 4629–4634. DOI:10.3321/j.issn:1000-0933.2008.10.002 [in Chinese] ) |
| [] |
郭春爱, 刘芳, 许晓明. 2006. 叶绿素b缺失与植物的光合作用. 植物生理学通讯, 42(5): 967–973.
( Guo C A, Liu F, Xu X M. 2006. Chlorophyll-b deficient and photosynthesis in plants. Plant Physiology Communications, 42(5): 967–973. [in Chinese] ) |
| [] |
李磊, 李向义, 林丽莎, 等. 2011. 两种生境条件下6种牧草叶绿素含量及荧光参数的比较. 植物生态学报, 35(6): 672–680.
( Li L, Li X Y, Lin L S, et al. 2011. Comparison of chlorophyll content and fluorescence parameters of six pasture species in two habitats in China. Chinese Journal of Plant Ecology, 35(6): 672–680. [in Chinese] ) |
| [] |
钱鹏, 郑祥民, 周立旻, 等. 2010. 312国道沿线土壤、灰尘重金属污染现状及影响因素. 环境化学, 29(6): 1139–1146.
( Qian P, Zheng X M, Zhou L M, et al. 2010. Heavy metal pollution in roadside soil and dust along G312 highway and it's influencing factors. Environmental Chemistry, 29(6): 1139–1146. [in Chinese] ) |
| [] |
邱昌恩, 毕永红, 胡征宇. 2007. Zn2+胁迫对绿球藻生长、生理特性及细胞结构的影响. 水生生物学报, 31(4): 503–508.
( Qiu C E, Bi Y H, Hu Z Y. 2007. The effects of Zn2+ stress on the growth, physiological characteristics and cell structure of Chlorococcum sp. Acta Hydrobiologica Sinica, 31(4): 503–508. [in Chinese] ) |
| [] |
施翔, 陈益泰, 王树凤, 等. 2012. 废弃尾矿库15种植物对重金属Pb、Zn的积累和养分吸收. 环境科学, 33(6): 2021–2027.
( Shi X, Chen Y T, Wang S F, et al. 2012. Pb, Zn accumulation and nutrient uptake of 15 plant species grown in abandoned mine tailings. Environmental Science, 33(6): 2021–2027. [in Chinese] ) |
| [] |
孙铁珩. 2005. 土壤污染形成机理与修复技术. 北京, 科学出版社.
( Sun T H. 2005. Soil pollution formation mechanism and repair technology. Beijing, Science Press.[in Chinese]. [in Chinese] ) |
| [] |
王美娥, 彭驰, 陈卫平. 2016. 宁夏干旱地区工业区对农田土壤重金属累积的影响. 环境科学, 37(9): 3532–3539.
( Wang M E, Peng C, Chen W P. 2016. Impacts of industrial zone in arid area in Ningxia province on the accumulation of heavy metals in agricultural soils. Environmental Science, 37(9): 3532–3539. [in Chinese] ) |
| [] |
王艳哲, 刘秀位, 孙宏勇, 等. 2013. 水氮调控对冬小麦根冠比和水分利用效率的影响研究. 中国生态农业学报, 21(3): 282–289.
( Wang Y Z, Liu X W, Sun H Y, et al. 2013. Effects of water and nitrogen on root/shoot ratio and water use efficiency of winter wheat. Chinese Journal of Eco-Agriculture, 21(3): 282–289. [in Chinese] ) |
| [] |
王幼奇, 白一茹, 王建宇. 2014. 引黄灌区不同尺度农田土壤重金属空间分布及污染评价:以银川市兴庆区为例. 环境科学, 35(7): 2714–2720.
( Wang Y Q, Bai Y R, Wang J Y. 2014. Distribution of soil heavy metal and pollution evaluation on the different sampling scales in farmland on yellow river irrigation area of Ningxia:a case study in Xingqing county of Yinchuan city. Environmental Science, 35(7): 2714–2720. [in Chinese] ) |
| [] |
王幼奇, 白一茹, 王建宇. 2016. 基于GIS的银川市不同功能区土壤重金属污染评价及分布特征. 环境科学, 37(2): 710–716.
( Wang Y Q, Bai Y R, Wang J Y. 2016. Distribution of urban soil heavy metal and pollution evaluation in different functional zones of Yinchuan city. Environmental Science, 37(2): 710–716. [in Chinese] ) |
| [] |
杨卫东, 陈益泰. 2009. 不同品种杞柳对高锌胁迫的忍耐与积累研究. 中国生态农业学报, 17(6): 1182–1186.
( Yang W D, Chen Y T. 2009. Tolerance of different varieties of Salix integra to high zinc stress. Chinese Journal of Eco-Agriculture, 17(6): 1182–1186. [in Chinese] ) |
| [] |
张雪, 贺康宁, 史常青, 等. 2016. 盐胁迫对银水牛果幼苗生长和生理特性的影响. 水土保持学报, 30(1): 212–217.
( Zhang X, He K N, Shi C Q, et al. 2016. Effects of salt stress on growth and physiological characteristics of Shepherdia argentea seedlings. Journal of Soil and Water Conservation, 30(1): 212–217. [in Chinese] ) |
| [] |
张莹, 魏安智, 杨途熙, 等. 2011. 锌胁迫对灰杨幼苗生长和光合特性的影响. 东北林业大学学报, 39(3): 19–21.
( Zhang Y, Wei A Z, Yang T X, et al. 2011. Effect of zinc stress on growth and photosynthetic characteristics of Populus canescens. Journal of Northeast Forestry University, 39(3): 19–21. [in Chinese] ) |
| [] | Ahemad M. 2014. Remediation of metalliferous soils through the heavy metal resistant plant growth promoting bacteria:paradigms and prospects. Arabian Journal of Chemistry, 11(2): 158. |
| [] | Assche F, Clijsters H. 1990. Effects of metals on enzyme activity in plants. Plant Cell & Environment, 13(3): 195–206. |
| [] | Baccio D D, Tognetti R, Sebastiani L, et al. 2003. Responses of Populus deltoides×Populus nigra (Populus×euramericana) clone I-214 to high zinc concentrations. New Phytologist, 159(2): 443–452. DOI:10.1046/j.1469-8137.2003.00818.x |
| [] | Bertrand M, Poirier I. 2005. Photosynthetic organisms and excess of metals. Photosynthetica, 43(3): 345–353. DOI:10.1007/s11099-005-0058-2 |
| [] | Cakmak I. 2000. 111-possible roles of zinc in protecting plant cells from damage by reactive oxygen species. New Phytologist, 146(2): 185–205. DOI:10.1046/j.1469-8137.2000.00630.x |
| [] | Cherif J, Derbel N, Nakkach M, et al. 2010. Analysis of in vivo chlorophyll fluorescence spectra to monitor physiological state of tomato plants growing under zinc stress. Journal of Photochemistry & Photobiology B Biology, 101(3): 332–339. |
| [] | Disante K B, Fuentes D, Cortina J. 2011. Response to drought of Zn-stressed Quercus suber L. seedlings. Environmental & Experimental Botany, 70(2): 96–103. |
| [] | Doncheva S, Stoynova Z, Velikova V. 2001. Influence of succinate on zinc toxicity of pea plants. Journal of Plant Nutrition, 24(6): 789–804. DOI:10.1081/PLN-100103774 |
| [] | Farquhar G D, Sharkey T D. 1982. Stomatal conductance and photosynthesis. Annual Reviews of Plant Physiology, 33(33): 317–345. |
| [] | Gupta B, Pathak G C, Pandey N. 2011. Induction of oxidative stress and antioxidant responses inVigna mungo by zinc stress. Russian Journal of Plant Physiology, 58(1): 85–91. DOI:10.1134/S1021443711010079 |
| [] | Hanikenne M, Talke I N, Haydon M J, et al. 2008. Evolution of metal hyperaccumulation required cis-regulatory changes and triplication of HMA4. Nature, 453(7193): 391–395. DOI:10.1038/nature06877 |
| [] | Hassan Z, Aarts M G M. 2011. Opportunities and feasibilities for biotechnological improvement of Zn, Cd or Ni tolerance and accumulation in plants. Environmental & Experimental Botany, 72(1): 53–63. |
| [] | Huang H, Wang K, Zhu Z, et al. 2013. Moderate phosphorus application enhances Zn mobility and uptake in hyperaccumulator Sedum alfredii. Environmental Science and Pollution Research, 20(5): 2844. DOI:10.1007/s11356-012-1175-7 |
| [] | Küpper H, Küpper F, Spiller M. 1998. In situ detection of heavy metal substituted chlorophylls in water plants. Photosynthesis Research, 58(2): 123–133. DOI:10.1023/A:1006132608181 |
| [] | Lasat M M, Baker A J, Kochian L V. 1998. Altered Zn compartmentation in the root symplasm and stimulated Zn absorption into the leaf as mechanisms involved in Zn hyperaccumulation in Thlaspi caerulescens. Plant Physiology, 118(3): 875–883. DOI:10.1104/pp.118.3.875 |
| [] | Li X, Yang Y, Jia L, et al. 2013. Zinc-induced oxidative damage, antioxidant enzyme response and proline metabolism in roots and leaves of wheat plants. Ecotoxicology & Environmental Safety, 89(11): 150–157. |
| [] | Lin W, Xiao T, Wu Y, et al. 2012. Hyperaccumulation of zinc by Corydalis davidii in Zn-polluted soils. Chemosphere, 86(8): 837–842. DOI:10.1016/j.chemosphere.2011.10.060 |
| [] | Luo Y, Rimmer D L. 1995. Zinc-copper interaction affecting plant growth on a metal-contaminated soil. Environ Pollut, 88(1): 79–83. DOI:10.1016/0269-7491(95)91050-U |
| [] | Lux A, Sottníková A, Opatrná J, et al. 2004. Differences in structure of adventitious roots in Salix clones with contrasting characteristics of cadmium accumulation and sensitivity. Physiologia Plantarum, 120(4): 537–545. DOI:10.1111/ppl.2004.120.issue-4 |
| [] | Marschner H. 1995. Mineral nutrition of higher plants. Journal of Ecology, 76(4): 681–861. |
| [] | Mukhopadhyay M, Das A, Subba P, et al. 2012. Structural, physiological, and biochemical profiling of tea plantlets under zinc stress. Biologia Plantarum, 57(3): 474–480. |
| [] | Reichman S M, Asher C J, Mulligan D R, et al. 2001. Seedling responses of three Australian tree species to toxic concentrations of zinc in solution culture. Plant and Soil, 235(2): 151–158. DOI:10.1023/A:1011903430385 |
| [] | Rout G R, Das P. 2003. Effect of metal toxicity on plant growth and metabolism:I. Zinc. Sustainable Agriculture, 144(1): 3–11. |
| [] | Sayed O H. 2003. Chlorophyll fluorescence as a tool in cereal crop research. Photosynthetica, 41(3): 321–330. DOI:10.1023/B:PHOT.0000015454.36367.e2 |
| [] | Shakya K, Chettri M K, Sawidis T. 2008. Impact of heavy metals (copper, zinc, and lead) on the chlorophyll content of some mosses. Archives of Environmental Contamination & Toxicology, 54(3): 412–421. |
| [] | Vaillant N, Monnet F, Hitmi A, et al. 2005. Comparative study of responses in four Datura species to a zinc stress. Chemosphere, 59(7): 1005–1013. DOI:10.1016/j.chemosphere.2004.11.030 |
| [] | Wilkins D A. 1978. The measurement of tolerance to edaphic factors by means of root growth. New Phytologist, 80(3): 623–633. DOI:10.1111/nph.1978.80.issue-3 |
| [] | Yang Y, Sun C, Yao Y, et al. 2011. Growth and physiological responses of grape (Vitis vinifera"Combier") to excess zinc. Acta Physiologiae Plantarum, 33(4): 1483–1491. DOI:10.1007/s11738-010-0687-3 |
| [] | Zacchini M, Pietrini F, Mugnozza G S, et al. 2009. Metal tolerance, accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics. Water, Air and Soil Pollution, 197(1/4): 23–34. |
| [] | Zhang X, Xia H, Li Z, et al. 2010. Potential of four forage grasses in remediation of Cd and Zn contaminated soils. Bioresource Technology, 101(6): 2063–2066. DOI:10.1016/j.biortech.2009.11.065 |
 2017, Vol. 53
2017, Vol. 53

