文章信息
- 成方妍, 王传宽
- Cheng Fangyan, Wang Chuankuan
- 树种和组织对树干非结构性碳水化合物储量估测的影响
- Impacts of Tree Species and Tissue on Estimation of Nonstructural Carbohydrates Storage in Trunk
- 林业科学, 2016, 52(2): 1-9
- Scientia Silvae Sinicae, 2016, 52(2): 1-9.
- DOI: 10.11707/j.1001-7488.20160201
-
文章历史
- 收稿日期:2015-02-02
- 修回日期:2015-12-31
-
作者相关文章
非结构性碳水化合物(nonstructural carbohydrates,NSC)是植物光合产物的暂储形式(董蕾等,2013)。树干NSC储量是树木存活和生长的主要缓冲库(Mei et al.,2015),反映了树木碳收支的时间动态 (Gough et al.,2009; Richardson et al.,2013)。估算树干NSC储量及其分配,是揭示树木碳代谢及其应对环境胁迫能力的基础,也是构建森林碳循环模型的需要(Le Roux et al.,2001; Richardson et al.,2013)。
树干NSC储量在不同树种、组织和树干高度上均存在差异,但 在树干NSC储量估算时却很少考虑这种变异性。Hoch等(2003)报道,不同材性树种的树干NSC储量径向变化以环孔材最大,无孔材次之,散孔材最小。Gholz等(1991)和Richardson等(2013)分别仅采用胸径处树干木质组织最外侧2 cm的生长芯估算林分和个体尺度的NSC储量。张海燕等(2013)仅采用树干1.3 m处外侧4 cm木质组织的NSC储量估算白桦(Betula platyphylla)和紫椴(Tilia amurensis)树干木质部NSC储量时相对误差达10%以上。此外,虽然树皮对树干NSC储量的贡献率可达30%(Oren et al.,1988; Zhang et al.,2014),但大多数研究未包括树皮。可见,忽略NSC储量的树种、组织及其空间变异会导致个体和生态系统水平上NSC储量及其分配的估算产生不确定性。本研究以黑龙江帽儿山地区的无孔材树种兴安落叶松(Larix gmelinii)、半环孔材树种胡桃楸(Juglans m and shurica)和环孔材树种春榆(Ulmus japonica)为对象,量化树种、组织和树干高度对 NSC储量的影响,以期为构建温带森林碳循环模型的提供数据和理论基础。
1 研究区概况研究区位于黑龙江省帽儿山森林生态站(127.66°E,45.40°N),平均海拔400 m,坡度10°~15°。土壤为暗棕壤。该区属大陆性温带季风气候,年均降水量629 mm,集中在6—8月; 年均气温3.1 ℃,1月平均气温-18.5 ℃,7月平均气温22.0 ℃。现有 主要植被为温带天然次生林和人工林。
2 研究方法 2.1 野外取样和室内分析选择研究区常见的材性不同且心边材界限清晰可辨的 针叶无孔材树种兴安落叶松、阔叶半环孔材树种胡桃楸和环孔材树种春榆 3个树种为对象。样株位于南向缓坡下部48年生针阔混交林中,其中兴安落叶松为人工栽植,胡桃楸和春榆为天然更新。该林分密度为1 833株·hm-2,平均胸径 (23.1±6.5)cm,平均树高(19.5±4.5)cm。
为了减小林木分化对树木生长和碳分配的影响(李巍等,2015),在该林分中3个树种随机选取3株优势木作为样木; 兴安落叶松、胡桃楸和春榆样木的胸径分别为(27.5±6.4),(22.6±4.6)和(28.0±3.0)cm,树高分别为(22.1±0.4),(20.4±0.4)和(20.0±0.6)m。
2012年8月5—20日,采用全收获法伐倒样木(刘家霖等,2014; 李巍等,2015); 之后,从树干基部至树梢,每隔1 m截取区分段,测定其总鲜质量; 同时,在胸径高处(1.3 m)(Gholz et al.,1991)和每个区分段底部截取1个5 cm厚圆盘,测量圆盘的去皮直径、边材宽度、总鲜质量、树皮鲜质量和木质部鲜质量; 然后,将所有圆盘样品在105 ℃下杀青20 min使酶变性,再在65 ℃恒温下烘干测定其干质量,用于计算样品 含水率;从烘干的圆盘中取树皮适量(包含韧皮部和老皮),作为树皮样品以备分析; 对每个烘干圆盘的木质部 区分心材和边材作为样品,以备分析。
可溶性糖和淀粉含量(%,干质量百分比)采用苯酚硫酸改进法测定(Buysse et al.,1993;于丽敏等,2011)。因为可溶性糖和淀粉占NSC总量的90%以上(Hoch et al.,2003),因此,本研究将可溶性糖与淀粉之和定义为总非结构性碳水化合物(Zhang et al.,2014)。
2.2 数据分析
每区分段心、边材生物量由木质部生物量乘以该区分段圆盘样品中各组分占木质部生物量的比例获得; 求算该比例时,心、边材生物量由其体积和密度的乘积获得(于丽敏等,2011)。采用排水法测定各组织的密度和体积(Zhang et al.,2014)。圆盘NSC储量(Cd,%)为各组织质量加权的平均
,其计算公式为:
${C_d} = \sum\limits_{j = 1}^3 {\left({{B_{{\rm{d}} - j}} \times {C_{{\rm{d}} - j}}} \right)/\sum\limits_{j = 1}^3 {{B_{{\rm{d}} - j}}} } $。
(1)
树干i区分段的树皮、边材或心材NSC储量(Ci)的计算公式为:
${C_i} = \left({{B_{{\rm{t}} - i}} \times {C_{{\rm{t}} - i}} + {B_{{\rm{b}} - i}} \times {C_{{\rm{b}} - i}}} \right)/\left({{B_{{\rm{t}} - i}} + {B_{{\rm{b}} - i}}} \right)$。
(2)
树干树皮、边材或心材NSC储量(Ctis)的计算公式为:
${C_{{\rm{tis}}}} = \sum\limits_{i = 1}^n {\left( {{B_i} \times {C_i}} \right)} /\sum\limits_{i = 1}^n {{B_i}} $。
(3)
整个树干NSC储量(Ctru)的计算公式为:
${C_{{\rm{tis}}}} = \sum\limits_{j = 1}^3 {\left( {{B_{{\rm{tis}} - j}} \times {C_{{\rm{tis}} - j}}} \right)/\sum\limits_{j = 1}^3 {\left( {{B_{{\rm{tis}} - j}}} \right)} } $。
(4)
不同树干高度NSC储量的绝对变化量为其最大值与最小值的差值; 相对变化量为绝对变化量与最大值的比值(Hoch et al.,2003)。估算树干NSC储量时,为了消除样木生物量差异对不同树种NSC储量的影响,对样木树干生物量进行标准化,每个样木树干的总生物量均假设为B; B为胸径30 cm兴安落叶松的树干总生物量,采用Wang(2006)的方法获得; 标准化后,树干树皮、边材或心材NSC储量(CTtis,kg)的计算公式为:
${\rm{C}}{{\rm{T}}_{{\rm{tis}}}} = B \times \sum\limits_{i = 1}^n {\left( {{B_i} \times {C_i}} \right)/\left( {100 \times {B_t}} \right)} $。
(5)
整个树干NSC储量(CTtru)的计算公式为:
${\rm{C}}{{\rm{T}}_{{\rm{tru}}}} = \sum\limits_{j = 1}^3 {\left( {{\rm{C}}{{\rm{T}}_{{\rm{tis}} - j}}} \right)} $。
(6)
本研究分别量化了树种间、树种内NSC储量变异对树干NSC储量估算的影响。
1)树种间NSC储量的变异分别对比3个树种的树皮、边材和心材NSC储量以及整个树干的NSC储量,所得误差绝对值的平均值即为树种差异对NSC储量估测误差的贡献率。
2)树种内NSC储量的变异针对NSC储量的组织及其树干高度变化,参考以往文献中测定树干NSC储量的取样方法,设置5种不同方法: Ⅰ.以胸高处边材的NSC储量代替整个树干的NSC储量(忽略树干NSC储量的组织间和树干高度变化)作估算(Richardson et al.,2013); Ⅱ.以胸高处边材和心材的质量加权平均NSC储量(忽略树皮NSC和各组织NSC储量随树干高度的变化)作估算(Gough et al.,2009); Ⅲ.以胸高处树皮和边材的平均NSC储量(模拟生长芯取样,忽略心材NSC和各组织高度变化,以径向深度和组织密度的乘积为权重计算平均NSC储量)作估算(Würth et al.,2005); Ⅳ.以胸高处3个组织的平均NSC储量(模拟生长芯取样,忽略各组织高度变化,以径向深度和组织密度的乘积为权重计算平均NSC储量)作估算(Mei et al.,2015); Ⅴ.以胸高处3个组织的质量加权平均NSC储量(以髓心为圆点的近似圆盘取样,忽略各组织高度变化,以各组织生物量为权重计算平均NSC储量)作估算。
以由式(6)所得的数值为基准值,预测值分别由5种方法得到的NSC储量乘以相应的生物量获得。由于方法Ⅰ,Ⅱ和Ⅲ均部分忽略组织间差异并完全忽略高度差异,而方法Ⅴ只忽略高度差异,因此,方法Ⅰ,Ⅱ和Ⅲ的误差与方法Ⅴ的误差的差值可大体作为忽略组织间差异的相对误差。
利用式(7)分别计算5种方法的NSC储量相对误差(relative error,RE),用以评价种内变异对NSC储量估测误差的贡献率:
RE=(F - S)/S × 100%
(7)
采用方差分析和LSD多重比较检验树种和组织间NSC储量差异的显著性,统计分析采用SPSS 21.0软件进行。
3 结果与分析 3.1 树种及其组织间NSC储量的变异树种、组织及二者的交互作用对树干NSC储量的影响极显著(P < 0.01,表 1)。组织间NSC储量差异极显著,3个树种树皮的NSC平均储量(8.31%)分别为边材(2.77%)和心材(1.54%)的3和5倍。其中,树皮和边材的NSC组成以可溶性糖含量略高(春榆树皮除外),心材则以淀粉含量略高(胡桃楸心材除外)。兴安落叶松树皮的NSC储量显著高于胡桃楸和春榆; 边材的NSC储量种间差异显著(P< 0.05),以兴安落叶松最低; 心材的NSC储量种间差异虽不显著,但以兴安落叶松最高(表 2)。整体上,兴安落叶松和胡桃楸整个树干的NSC组成以可溶性糖含量略高,分别占NSC组成的53%和62%,而春榆则以淀粉含量略高(58%)。
|
|
|
|
树干高度及其与组织的交互作用对NSC储量和可溶性糖含量的影响均显著(表 1),但对淀粉含量的影响不显著(P > 0.05)。3个树种树皮NSC储量随着树干高度升高均有增大,但兴安落叶松树冠上部的树干NSC储量则出现降低趋势(图 1); 边材和心材的NSC储量随树干高度升高波动幅度较小,平均枝下高(约7 m)以下2种组织的NSC储量多随树干高度升高而略有降低(图 1); 3个树种树干NSC储量随树干高度的变化趋势相似,整体NSC储量随着树干高度升高而略有增加(图 2)。除了兴安落叶松淀粉之外,3个树种树干整体的NSC及其组分含量与树干高度均显著线性相关(P < 0.05),平均决定系数为0.565(图 2)。
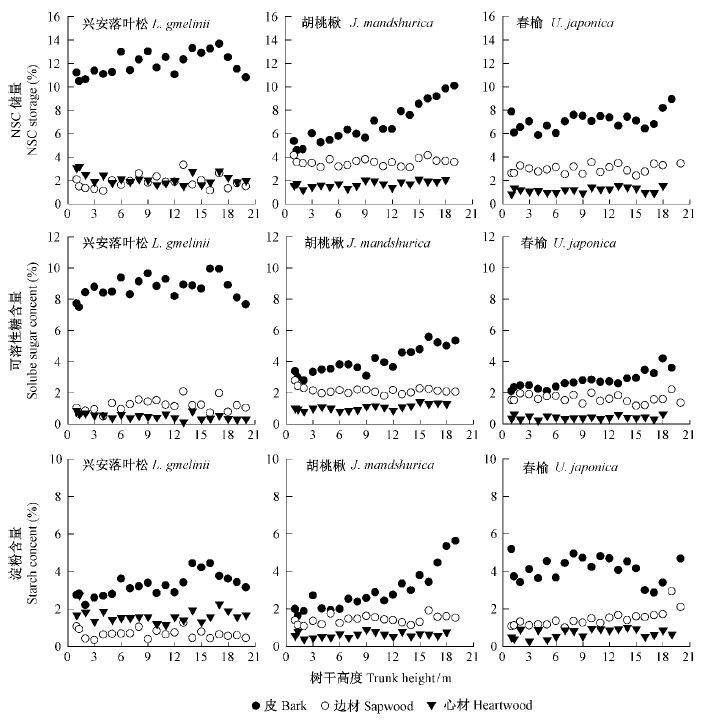
|
图1 3个树种不同树干高度各组织NSC储量及其组分含量的变化 Fig.1 Vertical changes of NSC storage and its components content by tree species and tissues |
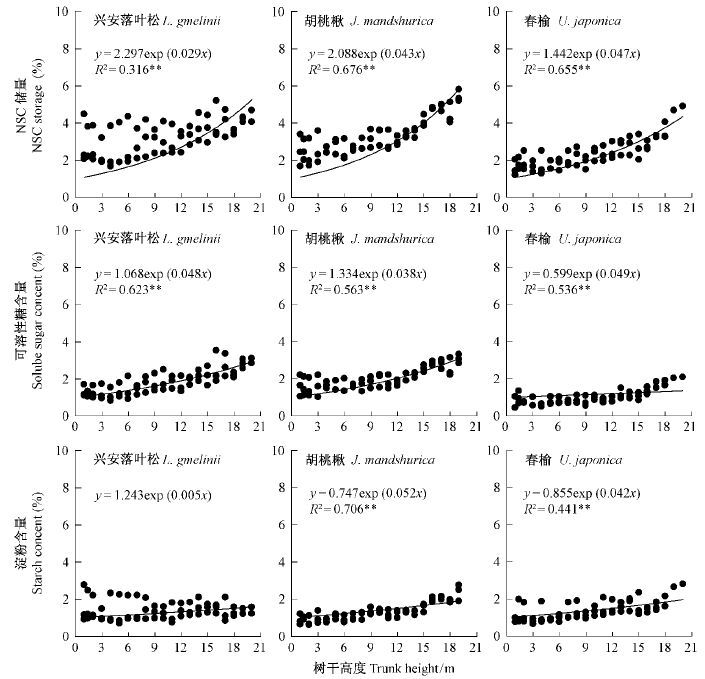
|
图2 3个树种不同树干高度树干NSC储量及其组分含量的变化 Fig.2 Vertical changes of NSC storage and its components content for the total trunk |
3个树种不同树干高度树皮、边材、心材和整个树干NSC储量的平均绝对变化量分别为4.93%,1.99%,1.32%和2.78%,平均相对变化量分别为45%,51%,59%和59%。树干不同高度NSC储量的绝对变化量为0.96%(春榆心材)~5.69%(兴安落叶松树皮),相对变化量为38%(兴安落叶松树皮)~65%(兴安落叶松边材)。
3.3 树干NSC储量的估测误差树种间差异对树皮、边材、心材和整个树干NSC储量相对误差的贡献率分别为40%,49%,24%和32%,对可溶性糖含量相对误差贡献率较大,为52%(心材)~129%(树皮),对淀粉含量相对误差的贡献率为15%(树干整体)~82%(心材)(图 3)。
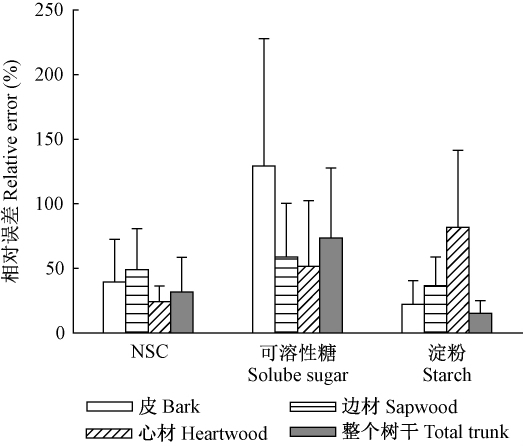
|
图3 树种引起树干及其组织NSC储量估算的相对误差 Fig.3 Relative errors in estimates of NSC storage by tissues and NSC components induced from tree species |
本研究采用5种方法量化树种内NSC储量变异对树干NSC储量相对误差的影响。总体上,5种方法的相对误差为-61%~71%; 而且对于同一树种,同一方法的NSC组分含量误差的波动方向大体相似,但是不同方法之间相对误差的大小略有不同(表 3)。方法Ⅰ估算树干整体的NSC储量时,不同树种的误差相差较大,兴安落叶松低估47%,胡桃楸和春榆分别高估12%和18%; 而方法Ⅱ,Ⅲ,Ⅳ和Ⅴ均低估了NSC储量,3个树种的平均误差分别为-37%,-48%,-23%和-9%。去除高度差异对树干NSC储量误差的贡献,仅考虑组织间差异的贡献时,方法Ⅰ中,兴安落叶松、胡桃楸和春榆的相对误差分别为41%,25%和26%,方法Ⅱ和Ⅲ中3个树种的平均误差分别为-28%和39%。
|
|
值得注意的是,虽然方法Ⅳ和Ⅴ因考虑了树干NSC组织间变异而误差较低,但二者均低估了树皮和心材NSC储量,高估了边材NSC储量(表 4)。其中方法Ⅳ树皮、边材和心材NSC储量相对误差的绝对值(73%,144%和71%)均高于方法Ⅴ(27%,98%和45%)。
|
|
兴安落叶松边材的NSC储量低于胡桃楸和春榆(表 2),这与以往研究(Hoch et al.,2003; Woodruff et al.,2011; Richardson et al.,2013; Zhang et al.,2014)中环孔材和半环孔材树种树干边材NSC储量均高于无孔材树种的结果相似。NSC储量的种间差异可能与不同材性树种的NSC分配有关。Palacio等(2011)研究发现,环孔材树种无梗花栎(Quercus petraea)木质组织生长所需的碳55%~70%来源于储备碳库,而兴安落叶松和欧洲落叶松(Larix decidua)储备碳库对木质组织生长的贡献仅为43%~46%(Kagawa et al.,2006; von Felten et al.,2007),因此环孔材树种可能倾向于维持高储量的NSC以满足生长需求。此外,环孔材树种的导管较大,与无孔材相比需要更多的NSC维持水分安全(Holbrook et al.,2005; Taneda et al.,2008; Sala et al.,2012),这可能是环孔材树种边材NSC储量较高的另一原因。
本研究表明,兴安落叶松树皮NSC储量显著高于胡桃楸和春榆(表 2); 而Zhang等(2014)报道落叶松树皮NSC储量显著高于春榆,但与胡桃楸差异并不显著。引起这一分歧的原因可能与取样时间有关。本研究采用树干解析法在8月完成1次采样,而Zhang等(2014)则采用生长芯法于4—10月取7次采样平均值,其中胡桃楸8月的NSC储量处于较低水平(张海燕,2013)。3个树种心材NSC储量差异不显著,与Zhang等(2014)结果一致。以往对树干的研究多集中于边材这一水分运输组织,而对树皮和心材NSC储量的研究仍很缺乏,但树皮和心材也是值得关注的NSC储库(Zhang et al.,2014)。
此外,与兴安落叶松和胡桃楸不同,春榆树干的NSC组成以淀粉略高(表 2),这可能与不同材性树种的碳 储存形式有关。Sinnott(1918)按照树木的碳储存方式不同将其分为“脂肪”型、“淀粉”型和中间型,多数环孔材为“淀粉”型树种,本研究结果说明春榆可能属于“淀粉”型树种。
树皮的NSC储量分别是边材和心材的3和5倍(表 2),树干中这种径向梯度差异与以往研究结果相似(Saranpää et al.,1989; Fischer et al.,1992; Landhäusser et al.,2003)。NSC由树冠通过韧皮部筛管运至树干、树根等碳汇端,用于植物体构建或存储以备用。在运输过程中,部分NSC卸载至韧皮部的薄壁细胞以淀粉等形式储存下来,这部分NSC既可以作为长期储备,也可以重新装载用于树干生长(Holbrook et al.,2005)。因此,树皮既是NSC的主要运输通道,也是NSC的临时存储库,故其NSC储量也较高。从形成层至髓心方向,随着组织年龄增加,部分树种的边材转化为心材,在转化过程中消耗大量淀粉,存储NSC的射线薄壁细胞也逐渐死亡(Pallardy,2008),从而形成NSC储量的径向梯度。
从基部至树梢,3个树种树干整体的NSC储量均随着树干高度升高逐渐增大(图 2),这与以往研究结果相似(Barbaroux et al.,2003; Wong et al.,2003)。树干NSC储量梯度与NSC从冠层到地下的运输梯度相同(Kozlowski,1992; Woodruff et al.,2011; Sala et al.,2012),说明NSC储量的高度变异可能与影响韧皮部有机物运输的因素相关(Woodruff et al.,2011);然而,兴安落叶松树干组织的NSC储量随着树干高度升高先增大,在接近冠中位置时逐渐减小(图 1)。Kozlowskii(1992)研究发现,部分针叶树种树干的年内最大生长量出现在冠基至冠中之间具有强光合作用的树枝下,而径向生长为NSC存储提供了空间(Lacointe,2000),这可能导致位于冠下位置的树干具有较高的NSC储量。
3个树种边材和心材的NSC储量在平均枝下高以下多随着高度升高略有降低(图 1),这与以往研究中树干基部尤其是根颈附近NSC储量随高度增加而降低的趋势一致(Piispanen et al.,2001; Wong et al.,2003; Silpi et al.,2007)。树干基部是树木重要的NSC储备库之一,可为环境干扰后植物体重建以及早春 树木复苏生长提供NSC(Haddad et al.,1995; Pallardy,2008),所以树干基部的含量可能也较高。
树种间差异对树皮和边材NSC储量误差的贡献要大于心材,这可能是因为前二者作为主要的运输和存储组织,其生理活性比心材更活跃,所以NSC储量树种间差异在树皮和边材中也表现得更明显。此外,边材NSC储量误差较高也与不同树种的边材生物量分配比例差异显著有关(F2,8=24.1,P < 0.01)。兴安落叶松、胡桃楸和春榆的边材生物量分别为树干总生物量的38%,24%和16%。树干生物量标准化后,种间差异对整个树干NSC储量估算的相对误差贡献率高达32%(图 3)。所以,在估算生态系统尺度NSC储量时,需要考虑树种间NSC储量的差异(Zhang et al.,2014)。
考虑NSC储量种内变异的5种取样方法的比较分析发现,方法Ⅰ,Ⅱ,Ⅲ的相对误差高于Ⅳ和Ⅴ(表 3),这与树干高度差异对树干NSC储量误差的贡献率(9%)低于组织间差异(高于25%)有关,其中,模拟生长芯取样方法Ⅳ的低估程度高于近似圆盘取样方法Ⅴ(表 4)。这表明以往研究常采用生长芯取样测定NSC储量,且未考虑各组织的质量权重(Sala et al.,2009; Woodruff et al.,2011; Richardson et al.,2013; Mei et al.,2015)的做法,会低估外部、高估内部木质部的权重。一般而言,树干径向由外向内NSC储量逐渐降低,因此采用生长芯取样估算木质部的NSC储量而不考虑树干不同深度木质部的权重时其低估程度可能更高。单一生长芯法具有避免对树木的毁灭性破坏的优点,但难以兼顾不同深度木质部的权重。本研究考虑了树干不同深度木质部NSC储量的权重(Gholz et al.,1991),是一种简易实用的取样方法。尽管方法Ⅴ的相对误差较低,但仍然波动在-21%和20%之间,而且低估了树皮和心材的NSC储量(平均相对误差分别为-27%和-45%)、高估了边材的NSC储量(98%,表 4)。因此,在树干NSC储量估算时,除了考虑树种和组织间NSC储量变异之外,还应考虑NSC储量的高度变化(张海燕等,2013; Zhang et al.,2014)。
5 结论胡桃楸和春榆树干边材的NSC储量高于兴安落叶松,而兴安落叶松树皮和心材的NSC储量却高于另外2个树种。3个树种树干NSC储量随树干高度增加的变化趋势相似,其中树皮的NSC储量均随着高度增加而增大,边材和心材在平均枝下高以下均随着高度增大略有降低。NSC储量的树种、组织及其高度变化均影响树干NSC储量的估算精度,其中种间差异引起的误差最大,组织间差异次之,高度差异贡献率最低。因此,树干NSC储量的估算需要考虑NSC储量的树种、组织及其空间差异。
| [1] |
董蕾, 李吉跃. 2013. 植物干旱胁迫下水分代谢、碳饥饿与死亡机理. 生态学报, 33(18):5477-5483. (Dong L, Li J Y. 2013. Relationship among drought, hydraulic metabolic, carbon starvation and vegetation mortality. Acta Ecologica Sinica, 33(18):5477-5483.[in Chinese])(  1) 1)
|
| [2] |
李巍, 王传宽, 张全智. 2015. 林木分化对兴安落叶松异速生长方程和生物量分配的影响. 生态学报, 35(6):1679-1687. (Li W, Wang C K, Zhang Q Z. 2015. Differentiation of stand individuals impacts allometry and biomass allocation of Larix gmelinii trees.Acta Ecologica Sinica, 35(6):1679-1687.[in Chinese])(  2) 2)
|
| [3] |
刘家霖, 王传宽, 张全智. 2014. 不同分化等级兴安落叶松林木心材和边材空间变异. 林业科学, 50(12):114-121. (Liu J L, Wang C K, Zhang Q Z. 2014. Spatial variations in stem heartwood and sapwood for Larix gmelinii trees with various differentiation classes. Scientia Silvae Sinicae, 50(12):114-121.[in Chinese])(  1) 1)
|
| [4] |
于丽敏, 王传宽, 王兴昌. 2011. 三种温带树种非结构性碳水化合物的分配. 植物生态学报, 35(12):1245-1255. (Yu L M, Wang C K, Wang X C. 2011. Allocation of nonstructural carbohydrates for three temperate tree species in Northeast China. Chinese Journal of Plant Ecology, 35(12):1245-1255.[in Chinese])(  2) 2)
|
| [5] |
张海燕. 2013. 中国温带森林12个树种树干和树枝的非结构性碳时空变异. 哈尔滨:东北林业大学博士学位论文. (Zhang H Y. 2013. Spatiotemporal variability in non-structural carbohydrates of stem and branch for twelve tree species in Chinese temperate forest. Harbin:PhD thesis of Northeast Forestry University.[in Chinese])(  2) 2)
|
| [6] |
张海燕, 王传宽, 王兴昌, 等. 2013. 白桦和紫椴树干非结构性碳水化合物的空间变异. 应用生态学报, 24(11):3050-3056. (Zhang H Y, Wang C K, Wang X C, et al. 2013. Spatial variation of non-structural carbohydrates in Betula platyphylla and Tilia amurensis stems. Chinese Journal of Applied Ecology, 24(11):3050-3056.[in Chinese])(  1) 1)
|
| [7] |
Barbaroux C, Bréda N, Dufrêne E. 2003. Distribution of above-ground and below-ground carbohydrate reserves in adult trees of two contrasting broad-leaved species (Quercus petraea and Fagus sylvatica). New Phytologist, 157(3):605-615.( 1) 1)
|
| [8] |
Buysse J, Merckx R. 1993. An improved colorimetric method to quantify sugar content of plant tissue. Journal of Experimental Botany, 44(267):1627-1629.( 1) 1)
|
| [9] |
Fischer C, H ll W. 1992. Food reserves of scots pine (Pinus sylvestris L.) II. seasonal changes and radial distribution of carbohydrate and fat reserves in pine wood. Trees, 6(3):147-155.( 1) 1)
|
| [10] |
Gholz H L, Cropper W P. 1991. Carbohydrate dynamics in mature Pinus elliottii var. elliottii trees. Canadian Journal of Forest Research, 21(12):1742-1747.( 3) 3)
|
| [11] |
Gough C M, Flower C E, Vogel C S, et al. 2009. Whole-ecosystem labile carbon production in a north temperate deciduous forest. Agricultural and Forest Meteorology, 149(9):1531-1540.( 2) 2)
|
| [12] |
Haddad Y, Clair-Maczulajtys D, Bory G. 1995. Effects of curtain-like pruning on distribution and seasonal patterns of carbohydrate reserves in plane (Platanus acerifolia Wild) trees. Tree Physiology, 15(2):135-140.( 1) 1)
|
| [13] |
Hoch G, Richter A, K rner C. 2003. Non-structural carbon compounds in temperate forest trees. Plant, Cell and Environment, 26(7):1067-1081.( 4) 4)
|
| [14] |
Holbrook N M, Zwieniecki M A. 2005. Vascular transport in plants. Lundon:Academic Press.( 2) 2)
|
| [15] |
Kagawa A, Sugimoto A, Maximov T C. 2006. Seasonal course of translocation, storage and remobilization of 13C pulse-labeled photoassimilate in naturally growing Larix gmelinii saplings. New Phytologist, 171(4):793-804.( 1) 1)
|
| [16] |
Kozlowski T T. 1992. Carbohydrate sources and sinks in woody plants. The Botanical Review, 58(2):107-222.( 2) 2)
|
| [17] |
Lacointe A. 2000. Carbon allocation among tree organs:a review of basic processes and representation in functional-structural tree models. Annals of Forest Science, 57(5):521-533.( 1) 1)
|
| [18] |
Landhäusser S M, Lieffers V J. 2003. Seasonal changes in carbohydrate reserves in mature northern populus tremuloides clones. Trees-Structure and Function, 17(6):471-476.( 1) 1)
|
| [19] |
Le Roux X, Lacointe A, Escobar-Gutiérrez A, et al. 2001. Carbon-based models of individual tree growth:a critical appraisal. Annals of Forest Science, 58(5):469-506.( 1) 1)
|
| [20] |
Mei L, Xiong Y, Gu J,et al. 2015. Whole-tree dynamics of non-structural carbohydrate and nitrogen pools across different seasons and in response to girdling in two temperate trees. Oecologia, 177(2):333-344.( 3) 3)
|
| [21] |
Oren R, Schulze E D, Werk K S, et al. 1988. Performance of two Picea abies (L.) Karst. stands at different stages of decline I. Carbon relations and stand growth. Oecologia, 75(1):25-37.( 1) 1)
|
| [22] |
Palacio S, Paterson E, Sim A, et al. 2011. Browsing affects intra-ring carbon allocation in species with contrasting wood anatomy. Tree Physiology, 31(2):150-159.( 1) 1)
|
| [23] |
Pallardy S G. 2008. Physiology of woody plants:3rd edn. Burlington:Academic Press.( 2) 2)
|
| [24] |
Piispanen R, Saranpää P. 2001. Variation of non-structural carbohydrates in silver birch (Betula pendula Roth) wood. Trees, 15(7):444-451.( 1) 1)
|
| [25] |
Richardson A D, Carbone M S, Keenan T F, et al. 2013. Seasonal dynamics and age of stemwood nonstructural carbohydrates in temperate forest trees. New Phytologist, 197(3):850-861.( 6) 6)
|
| [26] |
Sala A, Hoch G. 2009. Height-related growth declines in ponderosa pine are not due to carbon limitation. Plant, Cell and Environment, 32(1):22-30.( 1) 1)
|
| [27] |
Sala A, Woodruff D R, Meinzer F C. 2012. Carbon dynamics in trees:feast or famine?.Tree Physiology, 32(6):764-775.( 2) 2)
|
| [28] |
Saranpää P, H ll W. 1989. Soluble carbohydrates of Pinus sylvestris L. sapwood and heartwood. Trees-Structure and Function, 3(3):138-143.( 1) 1)
|
| [29] |
Silpi U, Lacointe A, Kasempsap P, et al. 2007. Carbohydrate reserves as a competing sink:evidence from tapping rubber trees. Tree Physiology, 27(6):881-889.( 1) 1)
|
| [30] |
Sinnott E W. 1918. Factors determining character and distribution of food reserves in woody plants. Botanical Gazette, 66(2):162-175.( 1) 1)
|
| [31] |
Taneda H, Sperry J S. 2008. A case-study of water transport in co-occurring ring- versus diffuse-porous trees:contrasts in water-status, conducting capacity, cavitation and vessel refilling. Tree Physiology, 28(11):1641-1651.( 1) 1)
|
| [32] |
von Felten S, Hättenschwiler S, Saurer M,et al. 2007. Carbon allocation in shoots of alpine treeline conifers in a CO2 enriched environment. Trees, 21(3):283-294.( 1) 1)
|
| [33] |
Wang C K. 2006. Biomass allometric equations for 10 co-occurring tree species in Chinese temperate forests. Forest Ecology and Management, 222(1/3):9-16.( 1) 1)
|
| [34] |
Wong B L, Baggett K L, Rye A H. 2003. Seasonal patterns of reserve and soluble carbohydrates in mature sugar maple (Acer saccharum). Botany, 81(8):780-788.( 2) 2)
|
| [35] |
Woodruff D R, Meinzer F C. 2011. Water stress, shoot growth and storage of non-structural carbohydrates along a tree height gradient in a tall conifer. Plant, Cell and Environment, 34(11):1920-1930.( 3) 3)
|
| [36] |
Würth M K R, Pelaez-Riedl S,Wright S J,et al. 2005. Non-structural carbohydrate pools in a tropical forest. Oecologia, 143(1):11-24.( 1) 1)
|
| [37] |
Zhang H, Wang C, Wang X. 2014. Spatial variations in non-structural carbohydrates in stems of twelve temperate tree species. Trees, 28(1):77-89.( 9) 9)
|
 2016, Vol. 52
2016, Vol. 52

