文章信息
- 罗淋淋, 吴华俊, 林同
- Luo Linlin, Wu Huajun, Lin Tong
- 松墨天牛ATP合成酶D亚基基因的鉴定与表达
- Characterization and Expression of Subunit D Gene of ATP Synthase from Monochamus alternatus
- 林业科学, 2015, 51(7): 60-68
- Scientia Silvae Sinicae, 2015, 51(7): 60-68.
- DOI: 10.11707/j.1001-7488.20150707
-
文章历史
- 收稿日期:2014-07-11
- 修回日期:2014-10-07
-
作者相关文章
ATP是细胞内绝大多数生命活动的直接能源物质。在生物有机体中,生物体需要不断得到能量来维持其一系列的代谢活动,其中ATP的合成是主要的化学反应之一(徐卫红,2004;林江波等,2014)。ATP合成酶(ATP synthase)是线粒体能量守恒中的核心酶(Hong et al.,2008),被描述为分子机器(Boyer,1997),广泛分布于线粒体内膜、叶绿体类囊体、异养菌和光合菌的质膜上,其利用电子流跨膜产生的质子原动力由ADP和无机磷酸盐合成ATP,为生物体提供能量(Mitchell,1966;赵婷等,2014),能完成合成和水解真核细胞和细菌中ATP的双重任务(Cruz et al.,2012)。ATP合成酶主要包括2个功能不同的部分,即F1和F0: F1催化ATP的合成和水解;F0嵌合在膜上,是一个疏水蛋白复合体,在膜内控制H+的运输(Arnold et al.,1988;Leslie et al.,2000)。
迄今为止,微生物和植物ATP合成酶的研究相对较多,昆虫ATP合成酶的研究极少,仅意大利蜜蜂(Apis mellifera)(Younis et al.,2002; 2011)有相关报道。作为无脊椎动物,昆虫与微生物、植物等有很大区别; 虽然同样具有ATP合成酶,但在昆虫体内有其独特的作用机制。因此,克隆昆虫ATP合成酶基因,对研究其调控方式、表达模式,进而分析其与昆虫能量转换之间的关系具有重要意义。
Younis等(2002;2011)研究表明,DDT可抑制意大利蜜蜂ATP合成酶的水解活性。通过聚丙烯酰胺凝胶电泳(PAGE)分析发现,昆虫酶活被DDT抑制与分子质量为23 kDa的蛋白有关。这一蛋白存在于对DDT敏感的昆虫中,而在对DDT不敏感的昆虫酶制剂中却缺失。如果从酶中移除该蛋白,昆虫则表现为对DDT不敏感;如果将该蛋白直接纯化,加入到对DDT不敏感的昆虫ATP合成酶中,则DDT敏感性重新恢复。因此,ATP合成酶中的蛋白即是DDT的靶标蛋白。
松墨天牛(Monochamus alternatus Hope)又名松褐天牛、松天牛,主要危害松树,是重要的蛀干害虫;在日本和中国,松墨天牛还是松材线虫(Bursaphelenchus xylophilus)病的主要传播媒介(Kobayashi et al.,1984;Yang et al.,1989)。松材线虫与松墨天牛协同危害,对森林资源、自然景观和生态环境产生了重大危害,给我国造成了巨大的经济损失(杨远亮等,2013)。有效防治松墨天牛是控制松材线虫传播的关键。 化学防治是治理松墨天牛的重要方法,但松墨天牛分子毒理的基础研究还较薄弱,限制了农药的科学使用。DDT作用于ATP合成酶,对ATP合成酶的抑制作用与对目标生物的毒性作用相类似; 且DDT对昆虫酶活的抑制作用是独特的,与寡霉素或N,N-双环己基碳二亚胺(DCCD)不同(Younis et al.,2002),因此为探索不同类型农药杀虫机制与ATP合成酶的关系提供了参考。
本文从松墨天牛cDNA文库中克隆出ATP合成酶基因相似序列,通过序列分析和氨基酸相似性比较,推测其为松墨天牛ATP合成酶D亚基基因; 分析该基因在松墨天牛中的表达特性,旨在为开展昆虫ATP合成酶基因研究提供分子信息和参考,为深入研究昆虫ATP合成酶基因功能、能量代谢与农药胁迫的关系、不同类型农药影响松墨天牛ATP合成酶基因的表达模式以及科学指导松墨天牛防治实践奠定基础。
1 材料与方法 1.1 供试天牛松墨天牛幼虫由广东省林业科学研究院惠赠,用人工饲料方式(徐金华等,2009)在避光的人工气候箱内饲养至成虫,饲养温度为25 ℃,相对湿度为70%~75%。
1.2 主要试剂E.Z.N.A. TM Total RNA Kit II总RNA提取试剂盒购自OMEGA公司,3′-Full RACE Core Set with PrimeScriptTMRTase试剂盒、LA Taq DNA聚合酶、pMD20-T Vector试剂盒、大肠杆菌(Eescheria coli)DH5 α Competent Cells、PrimeScript® RT reagent Kit With gDNA Eraser反转录试剂盒、SYBR® Premix Ex TaqTM实时荧光定量试剂盒购自TaKaRa公司,通用型DNA纯化回收试剂盒、质粒提取试剂盒购自天根生物有限公司,IPTG、X-Gal等试剂购自上海生工生物工程有限公司。
1.3 样本准备和总RNA提取选取30头大小一致的3龄幼虫,清洗、体表消毒、麻醉后,剪破腹足,轻压虫体,收集血淋巴于同一无菌离心管中,用液氮迅速冷冻后放入-80 ℃冰箱保存备用。将提取完血淋巴的幼虫固定在蜡盘上,置于解剖镜下解剖,分离体壁、脂肪体、马氏管和中肠,用PBS 缓冲液冲洗后,将相同组织存放于同一无菌离心管中,迅速用液氮冷冻,置于-80 ℃冰箱内保存备用(孙猛等,2014)。分别取松墨天牛3龄幼虫、2日龄蛹、2日龄成虫、成虫头(去触角)、胸、腹、足、触角和翅,加入液氮在研钵内研为粉末。用Trizol Reagent提取总RNA,操作按Trizol提取说明书进行。
1.4 引物合成本实验室已经构建了松墨天牛cDNA文库(韦春梅等,2014),从中克隆出一条序列与GenBank数据库中的序列进行Blast比对,得到与昆虫ATP合成酶基因的相似序列。根据此序列设计引物(表 1),用于后续3′cDNA末端快速扩增(rapid-amplification of cDNA ends,3′RACE)和实时荧光定量PCR(RT-qPCR),以扩增基因3′末端进行基因全序列拼接并用于基因表达分析。引物合成由上海生物工程有限公司完成。
|
|
以特异引物(外)及试剂盒中提供的通用引物(外)进行第1轮PCR,特异引物(内)及通用引物(内)通过巢式PCR。PCR反应条件: 94 ℃预变性3 min;94 ℃30 s; 55 ℃(第1轮)、58 ℃(巢式)30 s、72 ℃ 1 min,35个循环; 72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析。回收目的片段,与pMD20-T载体连接,转化大肠杆菌,挑选阳性克隆测序。
1.6 序列分析将RACE反应测定的序列与cDNA文库中获得的序列进行拼接,用ORF Finder程序(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析开放阅读框(ORF),用Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性比对,用在线软件ProtParam tool(http://web.expasy.org/protparam/)分析蛋白质结构。
1.7 系统发育树从GenBank数据库NCBI(http://www.ncbi.nlm.nih.gov/)中检索昆虫ATP合成酶的氨基酸序列,用DNAMAN软件对松墨天牛ATP合成酶及其他昆虫ATP合成酶进行相似性比对; 用MEGA 4.0软件构建系统发育树(NJ法),自举检测(bootstrap)1 000次计算树内各分枝置信度。
1.8 实时荧光定量PCR以总RNA为模板,合成cDNA第1链; 以肌动蛋白(β-actin)为内参基因,无菌超纯水为阴性对照,ATP合成酶基因在3龄幼虫整体的表达量为标准参量,ATP synthase F和R(表 1)特异性引物做RT-qPCR,测定ATP合成酶基因在幼虫、蛹、成虫整体以及幼虫体壁、脂肪体、血淋巴、中肠和马氏管的相对表达量; 以ATP合成酶基因在成虫整体的表达量为标准参量,测定其在2日龄成虫头(去触角)、胸、腹、触角、足和翅的表达量。反应条件为: 95 ℃预变性5 min; 95 ℃变性10 s、60 ℃复性20 s,共40个循环; 40 ℃冷却30 s。反应仪器为LightCycler 480荧光定量PCR仪,每个样品设3次重复,反应结束后采集目标基因的 Ct 值和内参基因的 Ct 平均值,利用 2-ΔΔCt相对定量法计算相对表达量(Livak et al.,2001)。采用DPS软件的Duncan’s单因素方差分析法对RT-qPCR数据进行统计分析。
2 结果与分析 2.1 基因克隆与序列分析本研究从本实验室已构建的松墨天牛cDNA文库中克隆一条表达序列标签(EST),通过在线Blast比对,发现与昆虫的ATP合成酶D亚基基因有很高的同源性。通过3′RACE反应,将获得的扩增序列与cDNA文库中的序列进行拼接,最终获得一条长度为1 133 bp的 cDNA。经ORF检索和同源比对,发现该序列5′端非编码区长89 bp,3′端非编码区长294 bp,ORF长750 bp,编码ATP合成酶D亚基,命名为MaATPSE(GenBank登录号:KM101044)。MaATPSE编码249个氨基酸残基,推测的分子式为C1 248H2 063N351O369S10,预测分子质量为28.21 kDa,等电点为9.40,稳定系数为31.13,为稳定蛋白。MaATPSE含有3个丝氨酸磷酸化位点、4个苏氨酸磷酸化位点、2个酪氨酸磷酸化位点和1个糖基化位点(图 1)。
 |
起始密码子ATG用下划线表示,终止密码子TAA以* 表示,特异性引物(外)以双下划线表示,特异性引物(内)以下划波浪线表示,3个丝氨酸磷酸化位点以下划粗线表示,4个苏氨酸磷酸化位点以圆点表示; 2个酪氨酸磷酸化位点以矩形表示,1个糖基化位点以正方形表示,加尾信号AATAA用矩形框标注。The translation start codon is underlined with a single line, and the stop codon is marked with asterisk. The specific primer (outer) is underlined with a double-underlined, three serine phosphorylation sites are marked in bold, four threonine phosphorylation sites are designated with a dot, two tyrosine phosphorylation sites and a glycosylation site are designated with a rectangle and a square, respectively, the polyadenylation signal AATAA is marked with rectangles. 图 1 MaATPSE的核苷酸及推导的氨基酸序列 Fig.1 Nucleotide and deduced amino acid sequences of MaATPSE |
昆虫的D亚基相似程度较高,相似性在80%以上。将MaATPSE与NCBI 数据库中其他17种昆虫的ATP合成酶氨基酸序列进行相似性比较(图 2),结果表明: MaATPSE与赤拟谷盗(Tribolium castaneum)最为相似,与黑腹果蝇(Drosophila melanogaster)和家蚕(Bombyx mori)的相似性均为83%。参与比对的昆虫种类和相应的GenBank登录号等信息列于表 2。基于昆虫ATP合成酶氨基酸序列构建的系统发育树(neighbor-joining tree)显示,松墨天牛与赤拟谷盗聚成一支,相似性为87%(图 3),与其他非鞘翅目昆虫的遗传距离较远。
 |
图 2 MaATPSE与其他17种昆虫ATP合成酶氨基酸序列比对 Fig.2 Amino acid sequence alignment of ATP synthase from M. alternatus and other insects |
|
|
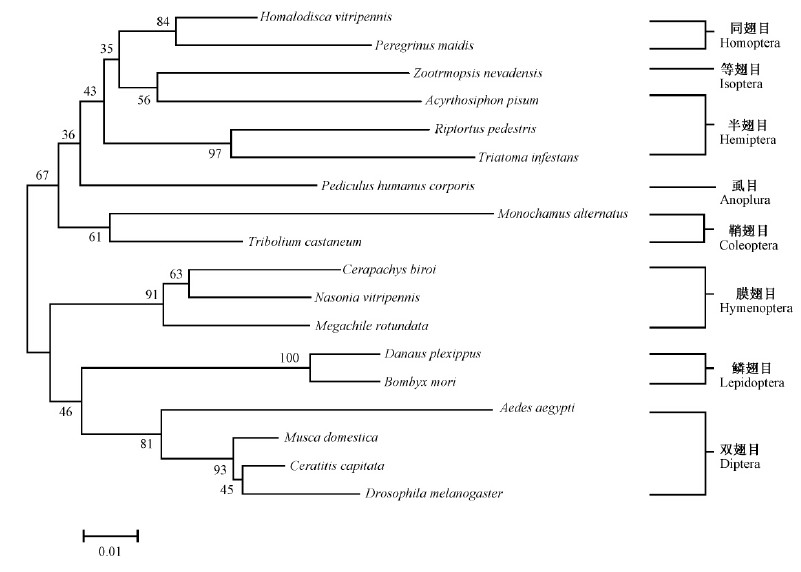 |
图 3 昆虫ATP基因系统发育树分析 Fig.3 Phylogenetic relationships of ATP genes of insects 昆虫名称和GenBank登录号与表 2相同。The origin names of insects, and the GenBank accession No. are the same as those in Fig.2. |
用实时荧光定量PCR分析了MaATPSE在不同虫态、成虫各部位和幼虫组织中的表达特性,结果显示: MaATPSE在蛹和幼虫的相对表达量分别是成虫的3.70和2.65倍,各虫态之间表达有显著差异(P < 0.05)(图 4); MaATPSE在幼虫各组织中均有表达,其中在脂肪体中的表达量最高,为对照的5.94倍,其次是体壁和血淋巴,分别为对照的3.93和2.88倍; 中肠和马氏管的表达量较低,为对照的0.24和0.28倍; 除马氏管和中肠的相对表达量无显著差异外,各组织均有显著差异(P < 0.05)(图 5)。在成虫头、腹、触角、足和翅的相对表达量分别为对照的2.24,3.0,3.52,3.39和4.45倍,胸部的表达量较低,为对照的0.68倍; 成虫各部位之间相对表达量有显著差异(P < 0.05)(图 6)。
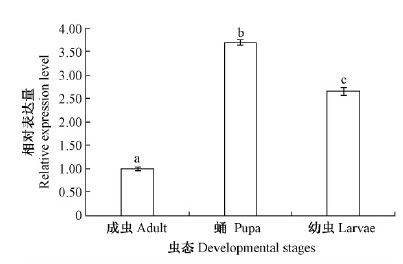 |
图 4 MaATPSE在松墨天牛各虫态的表达 Fig.4 Expression of MaATPSE in developmental stages of M. alternatus |
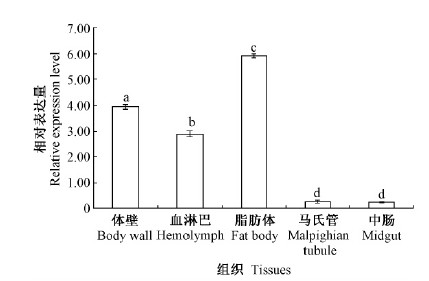 |
图 5 MaATPSE在松墨天牛幼虫各组织中的表达情况 Fig.5 Expression of MaATPSE in various tissues of M. alternatus larvae |
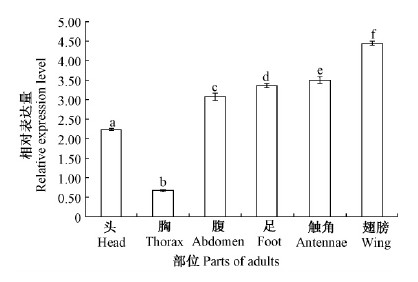 |
图 6 MaATPSE在松墨天牛成虫各部位的表达 Fig.6 The expression of MaATPSE in various parts of M. alternatus adults |
松墨天牛虽然是重大害虫,但迄今为止还没有进行过基因组测序。赤拟谷盗作为具有全基因组序列的鞘翅目昆虫,为本研究提供了重要的数据资源,MaATPSE的开放阅读框的确定就是以比对赤拟谷盗基因组为参考序列的。在克隆和拼接的基因序列中,笔者找到了完整的开放阅读框、3′末端PolyA尾巴和加尾信号特征序列AATAA; 通过同源比对,发现克隆的序列与昆虫的ATP合成酶D亚基基因相似,相似性在80%以上; 相似性程度最高的是赤拟谷盗,这也是比对到的唯一的鞘翅目昆虫。综上,笔者推测克隆的基因为松墨天牛ATP合成酶D亚基基因。
大多数昆虫的ATP合成酶D亚基或相似序列由约250个氨基酸组成,在本研究中,克隆到的松墨天牛MaATPSE的编码区编码249个氨基酸,与多数昆虫ATP合成酶的长度一致。意大利蜜蜂ATP合成酶D亚基(GenBank: XP394769)有174个氨基酸(Younis et al.,2011),与松墨天牛MaATPSE的相似性为82%; 但其氨基酸序列和分子质量都不同于牛心和鼠类肝脏,牛ATP合成酶没有同源物(Higuti et al.,1993),鼠和牛相应的酶结构都含有160个氨基酸,笔者也没有发现与松墨天牛MaATPSE相对应的鼠或牛的相似序列。这表明昆虫与动物的ATP合成酶基因无论是序列大小还是相似性都有较大差别。
蛋白质的磷酸化反应是把磷酸基团从一个化合物转移到另一个化合物上的过程,是生物体内存在的一种普遍的调节方式。真核细胞的蛋白质磷酸化位点主要发生在丝氨酸、苏氨酸和酪氨酸残基侧链的羟基上。在本研究中,生物信息学分析显示: 松墨天牛MaATPSE含有3个丝氨酸磷酸化位点、4个苏氨酸磷酸化位点和2个酪氨酸磷酸化位点,这些磷酸化表明ATP合成酶在细胞信号的传递过程中发挥重要作用。MaATPSE还含有1个糖基化位点,MaATPSE经过糖基化作用,形成糖蛋白,这一修饰对ATP合成酶的功能起调节作用。
Mangiullo等(2008)从分离出来的正常组织的细胞外表面,如鼠的肝细胞上发现了ATP合成酶。肝脏在功能上和昆虫的脂肪体相似。本研究中的RT-qPCR分析显示,蛹、翅、脂肪体中的MaATPSE分别在 3 种虫态、成虫 6 个部位和幼虫 5 种组织中表达量最高,这说明由于蛹中进行剧烈的组织和器官的重构、翅行使飞行功能、脂肪体要进行中间代谢和一些生化合成、转化反应等,因而这些虫态或组织器官的能量代谢处于较高的水平。此外,保幼激素结合蛋白(JHBP)分子在脂肪体细胞中合成后,脂肪体膜上的ATP 合成酶与 JHBP 在脂肪体上相互作用,利用 ATP 参与了 JHBP 分子的运输(Mangiullo et al.,2008),这也可能是MaATPSE在脂肪体中高表达的重要因素之一。笔者还发现MaATPSE在足和触角中相对表达量也较高,这与足是重要的运动器官、成虫触角在补充营养时经常摆动以搜寻食物或配偶相适应。线粒体 ATP 合成酶结构复杂,由 5 种基本亚基构成,不同生物亚基组成不同。亚基增加会使酶结构更加复杂,以激发酶的调节作用。虽然 ATP 合成酶是 ATP 合成的复合酶,但 ATP 合成酶还参与多种生物过程,如埃及伊蚊(Aedesaegypti)中肠刷状缘中的ATP 合成酶β亚基是细胞表面蛋白复杂网络的组成部分(Paingankar et al.,2010); 在大蜡螟(Galleria mellonella)脂肪体细胞中,ATP 合成酶作为 JHBP 膜结合蛋白,存在于线粒体、胞液和质膜上,在JHBP蛋白运输中发挥作用(Mangiullo et al., 2008); ATP 合成酶是在烟芽夜蛾(Heliothis virescens)中肠膜蛋白质组中发现的CrylAc毒蛋白的结合蛋白(Krishnamoorthy et al.,2007)。Heazlewood等(2003)鉴定了拟南芥(Arabidopsis thaliana)的ATP合成酶D亚基,但其功能并不清楚。Younis等(2011)用 2D 凝胶和质谱分析方法鉴定了意大利蜜蜂的一种 23 kDa 的蛋白,该蛋白是ATP合成酶D亚基和寡霉素敏感给予蛋白(OSCP)的混合物。DDT和OSCP、D亚基的相互作用可能会使 ATP 合成酶不能机械旋转,并阻碍 ATP 的合成。D亚基可能在与 DDT 结合和选择中发挥作用,昆虫的这种选择性蛋白亚基也许在阻遏酶活中起关键作用(Younis et al.,2011),但昆虫可能缺失 ATP 合成酶基因D亚基蛋白,以此结构调节机制适应环境中的农药胁迫。
本文克隆了松墨天牛ATP合成酶D亚基亚基基因,并在mRNA水平分析了其表达动态和在松墨天牛重要组织、器官的表达分布特征,旨在为研究ATP合成酶基因在松墨天牛毒理中的作用和其他功能奠定基础。下一步工作方向将是重点研究农药单独与D亚基作用还是与其他亚基一起作用; 用X射线对农药与ATP合成酶各亚基的作用途径做出清晰的展示,查看农药是如何贮藏于酶之中的,这样就能为理解农药与酶的互作方式提供必要的分子结构信息。
| [1] |
林江波,王伟英,邹晖,等.2014.中国水仙叶绿体ATP合成酶基因NtATPF的克隆与序列分析.福建农业学报,29(6):546-549. (Lin J B, Wang W Y, Zou H. 2014. Cloning and sequence analysis of chloroplast ATP synthase gene NtATPF from Narcissus tazetta var. chinensis. Fujian Journal of Agricultural Science, 29(6): 546-549[in Chinese]).(  1) 1)
|
| [2] |
孙猛,陆明星,汤小天,等.2014.大螟HSC70基因克隆及表达模式分析.昆虫学报,57(7): 787-797. (Sun M, Lu M X, Tang X T, et al. 2014. Molecular cloning and expression profiling of HSC70 gene in Sesamiainferens(Lepidoptera: Noctuidae). Acta Entomologica Sinica, 57(7): 787-797[in Chinese]).(  1) 1)
|
| [3] |
韦春梅,罗淋淋,吴华俊,等.2014.松墨天牛幼虫cDNA文库的构建及EST分析.基因组学与应用生物学,33(1):113-120. (Wei C M, Luo L L, Wu H J, et al. 2014. cDNA library construction and EST analysis of Monlchamus alternatus larvae. Genomics and Applied Biology, 33(1): 113-120[in Chinese]).(  1) 1)
|
| [4] |
徐金华, 黄秀凤, 徐华潮, 等. 2009. 松墨天牛室内人工饲养及其生物学特性观察. 浙江林业科技, 29(4):86-88. (Xu J H, Huang X F, Xu H C, et al. 2009. Rearing and biological properties of Monochamus alternatus. Journal of Zhejiang Forestry Science and Technology, 29(4): 86-88[in Chinese]).(  1) 1)
|
| [5] |
徐卫红. 2004. ATP 合成酶及其功能机制综述. 上饶师范学院学报, 24(3):36-40. (Xu W H. 2004. ATP synthase and its function mechanism summary. Journal of Shangrao Normal College, 24(3): 36-40[in Chinese]).(  1) 1)
|
| [6] |
杨远亮,杨忠岐,王小艺,等.2013.应用花绒寄甲防治松褐天牛.林业科学,49(3):103-109. (Yang Y L, Yang Z Q, Wang X Y, et al. 2013. Biological control of Monochamus alternatus(Coleoptera: Cerambycidae) by releasing eggs and adults of Dastarcus helophoroides (Coleoptera: Bothrideridae). Scientia Silvae Sinicae, 49(3): 103-109[in Chinese]).(  1) 1)
|
| [7] |
赵婷,牛超,阮丹丹,等.2014.ATP合成酶的翻译后修饰. 药物生物技术,21(1):91-94. (Zhao T, Niu C, Ruan T T, et al. 2014. Post-translational modification of ATP synthase. Pharmaceutical Biotechnology, 21(1): 91-94[in Chinese]).(  1) 1)
|
| [8] |
Arnold I, Pfeiffer K, Neupert W, et al.1988. Yeast mitochondrial F1F0ATP synthase exists as a dimer: identification of three dimer specific subunits. EMBO J, 17 (24): 7170-7178.( 1) 1)
|
| [9] |
Boyer P D. 1997. The ATP synthase —a splendid molecular machine. Annu Rev Biochem, 66:717-749.( 1) 1)
|
| [10] |
Cruz O M, Barca A M, Carvajal S U, et al. 2012. The function of mitochondrial FOF1 ATP-synthase from the white leg shrimp Litopenaeus vannamei muscle during hypoxia.Comparative Biochemistry and Physiology, 162:107-112.( 1) 1)
|
| [11] |
Heazlewood J L, Whelan J, Millar A H. 2003. The products of the mitochondrial or f25 and or fB genes are F0 components in the plant F1F0 ATP synthase. FEBS Letters,540:201-205.( 1) 1)
|
| [12] |
Higuti J, Takeda A M, Paggi A C.1993. Distribuição espacial das larvas de Chironomidae (Insecta, Diptera) do rio Baía (MS-Brasil). Rev Unimar, 15: 65-81.( 1) 1)
|
| [13] |
Hong S, Pedersen P L. 2008. ATP synthase and the actions of inhibitors utilized to study its roles in human health, disease, and other scientific areas. Microbiol Mol Biol Rev, 72:590-641.( 1) 1)
|
| [14] |
Kobayashi F, Yamane A, Ikeda T. 1984. The Japanese pine sawyer beetle as the vector of pine wilt disease. Annu Rev Entomol, 29: 115-135.( 1) 1)
|
| [15] |
Krishnamoorthy M, Jurat-Fuentes J L, McNall R J, et al.2007.Identification of novel CrylAc binding proteins in midgut membranes from Heliothisvirescens using proteomic analyses. Insect Biochem Molec, 37: 189-201.( 1) 1)
|
| [16] |
Leslie A G W, Walker J E. 2000. Structural model of F1-ATPase and the implications for rotary catalysis. Philos Trans R Soc Lond B Biol Sci, 355: 465-472.( 1) 1)
|
| [17] |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402-408.( 1) 1)
|
| [18] |
Mangiullo R, Gnoni A, Leone A, et al. 2008.Structural and functional characterization of F0F1-ATP synthase on the extracellular surface of rathepatocytes.Biochim Biophys Acta, 1777:1326-1335.( 3) 3)
|
| [19] |
Mitchell P. 1966. Chemiosmotic coupling in oxidative and photosynthetic phosphorylation. Biol Rev, 41:455-502.( 1) 1)
|
| [20] |
Paingankar M S, Gokhale M D, Deobagkar D N. 2010.Dengue-2-virus interacting polypeptides involved in mosquito cell infection. Arch Virol, 155:1453-1461.( 1) 1)
|
| [21] |
Yang B J, Wang Q. 1989. Distribution of the pine wood nematode in China and susceptibility of some Chinese and exotic pines to the nematode. Can J For Res, 19(12):1527-1530.( 1) 1)
|
| [22] |
Younis H M, Abo-El-Saad M M, Abdel-Razik R K, et al. 2002.Resolving the DDT target protein in insects as a subunit of the ATP synthase. Appl Biochem, 35:9-17.( 3) 3)
|
| [23] |
Younis H M, Serrano R, Reda K. 2011. The insecticide DDT targets the OSCP and subunit D of the Apis mellifera ATP synthase. J Bioenerg Biomembr, 43:457-463.( 5) 5)
|
 2015, Vol. 51
2015, Vol. 51

