文章信息
- 叶松涛, 杜旭华, 宋帅杰, 李黎, 卢杨, 应叶青
- Ye Songtao, Du Xuhua, Song Shuaijie, Li Li, Lu Yang, Ying Yeqing
- 水杨酸对干旱胁迫下毛竹实生苗生理生化特征的影响
- Effect of Salicylic Acid on Physiological and Biochemical Characteristics of Phyllostachys edulis Seedlings under Drought Stress
- 林业科学, 2015, 51(11): 25-31
- Scientia Silvae Sinicae, 2015, 51(11): 25-31.
- DOI: 10.11707/j.1001-7488.20151104
-
文章历史
- 收稿日期:2014-12-28
- 修回日期:2015-04-04
-
作者相关文章
2. 国家林业局竹子研究开发中心 浙江省竹子高效加工重点实验室 杭州 310012
2. Key Laboratory of High Efficent Processing of Bamboo of Zhejiang Province China National Bamboo Research Center Hangzhou 310012
中国竹类资源丰富,有竹类植物39属、500 多种,竹类资源、竹林面积、竹材蓄积量和产量均居世界首位,是世界上最主要的产竹国。截至2008 年,全国竹林面积达到 538.10 万 hm2,其中毛竹(Phyllostachys edulis)林面积 386.83 万 hm2(杨开良,2012)。毛竹是禾本科(Gramineae)竹亚科(Bambusoideae)刚竹属植物,是我国竹类植物中分布范围最广、栽培面积最大、蓄积量最多、经济价值最高的一个材用和笋用竹种(庄若楠等,2013)。毛竹主要生长在山地和丘陵地带,对水的需求主要依靠自然降水,在幼苗阶段随着水分胁迫程度的加强,毛竹幼苗净光合速率(Pn)、蒸腾速率(Tr)显著下降(P<0.01),降幅分别达54.7%和49.7%(应叶青等,2011);在生长过程中,特别是在出笋期和笋芽分化期遭遇季节性的干旱会对毛竹的生长和竹笋的产量造成很大的影响,可使毛竹林出笋株数下降30.12%,出笋产量下降 54.18%,竹笋的单株质量下降18.75%,翌年的新竹留养株数下降13.79%,新竹的胸径下降10.95%,枝下高下降25.61%,全高减少11.90%,明显地降低了单位面积的竹笋和竹材的产量和质量(何奇江等,2001)。干旱胁迫已成为影响竹林质量与效益的重要因子,因此研究毛竹的抗旱生理,提高毛竹的抗干旱能力具有非常重要的现实意义。
水杨酸(SA)是植物体内普遍存在的一种简单的小分子酚类化合物,是肉桂酸的衍生物,具有多种重要的生理作用(孟雪娇等,2010)。SA是重要的能够激活植物过敏反应(HR)和系统获得性抗性(SAR)的内源信号分子(Malamy et al., 1990;Choudhary et al., 2014),不仅可以调节植物的某些生长发育过程,还能诱导植物产生抗逆性,抵抗不良因素造成的伤害(Argueso et al., 2012)。在干旱胁迫时植物的内源SA的含量比正常生长时的含量多,对干旱胁迫起一定的防御作用(孟雪娇等,2010)。SA及其功能类似物所具有的高效、低成本、无毒、无残留等特点,在农林业生产中具有广阔的应用前景(崔婧,2007)。关于SA对植物抗逆性的作用国内外已有不少报道,SA对不同植物以及同种植物的不同时期的作用不尽相同。代其林等(2008)对豇豆(Vigna unguiculata)幼苗研究表明,在干旱胁迫下,随胁迫时间的延长,叶片中各种抗氧化酶活性和相对含水量都逐渐下降,但经SA预处理的叶片含水量高于同期水处理叶片含水量,POD,SOD和CAT活性都明显高于同期对照的叶片酶活性。曹翠玲等(2004)叶面喷施0.2 g·L-1 SA可以增强玉米(Zea mays)幼苗累积可溶性糖和脯氨酸,降低光合速率、气孔导度、蒸腾速率,提高了叶片内的水分含量和生物量。而Németh等(1990)发现,0.5% SA虽然能够提高玉米幼苗的抗冷性,但在干旱胁迫条件下,经SA预处理幼苗的电解质外渗率甚至高于无SA处理的对照,干旱危害加剧。目前,有关SA对植物抗旱性的作用的报道多集中在农作物和蔬菜水果上,对竹类植物抗旱生理的影响还未见报道。本文以1年生毛竹实生苗为材料,通过干旱胁迫下,施加外源SA的处理方法,探究SA对毛竹实生苗抗旱生理及抗旱性的影响,这对丰富植物的抗旱生理研究及改善毛竹的抗旱表现具有一定的理论与现实意义。
1 材料与方法 1.1 试验材料2013年1月15日将毛竹种子(从广西桂林生长健壮的毛竹单株上采集)播种于培养钵中,放置于浙江农林大学智能实验楼的培养室,出苗后移到智能温室中培育。3月28日换盆,每盆1株实生苗。盆规格为上口直径16.5 cm、下口直径13.5 cm、高16.0 cm。松鳞∶ 泥炭∶ 黄泥按2∶2∶1混合为基质,并混入复合肥为底肥,基质pH4.3。之后进行常规的水肥管理,待毛竹实生苗平均株高长到15.2 cm,且生长健壮稳定后,于7月15日选取生长一致的盆栽实生苗进行试验。
1.2 试验设计试验采用随机区组设计,设置正常供水(CK)、干旱(D)、干旱+0.5 mmol·L-1 SA(DS1)、干旱+1.0 mmol·L-1 SA(DS2)和干旱+2.0 mmol·L-1 SA(DS3)5个处理,每个处理5个重复,每个重复4株。盆栽毛竹幼苗于7月15日—7月17日每天下午17:00,分别用200 mL 0.5,1.0,2.0 mmol·L-1 的SA根施处理,对照加等量的水。通过称重法每天确定土壤含水量,7月24日盆栽苗基质含水量达到中度干旱(土壤含水量占田间持水量45%~50%),在盆栽苗基质含水量达到中度干旱后补水保持;正常供水处理的土壤含水量保持在田间持水量的70%~85%。分别于7月24日、7月31日和8月7日上午7: 00采集从上往下数第2~3节位成熟叶片,测定毛竹幼苗叶片保护酶活性、叶绿素含量、可溶性糖等生理生化指标;每个处理重复5次。8月23号上午8: 00,每个处理选取5株未采集过叶片的完整植株测定全株的生物量。
1.3 试验方法游离脯氨酸含量的测定采用酸性茚三酮闭塞法(李合生,2013),可溶性糖采用蒽酮提取法(李合生,2013),可溶性蛋白采用考马斯亮蓝G-250染色法(邹琦,2000),过氧化物酶(POD)活性的测定采用愈创木酚比色法(李合生,2013),过氧化氢酶(CAT)活性测定采用紫外吸收法(邹琦,2000),超氧化物歧化酶(SOD)活性测定采用南京建成生物公司生产的SOD试剂盒(96T),细胞膜透性测定采用电导法(郑炳松,2006),叶绿素含量测定采用直接浸提法(邹琦,2000),叶片含水量采用烘干法(李合生,2013)。
1.4 数据分析数据分析采用DPS数据处理系统,运用Duncan’检验法进行多重比较。
2 结果与分析 2.1 水杨酸对干旱胁迫下毛竹生物量的影响由图 1可知,干旱胁迫30天后,毛竹实生苗的生物量显著低于正常浇水的毛竹实生苗(P<0.05),其干质量下降48.73%。干旱胁迫下施加 SA处理后,毛竹生物量显著增加(P<0.05);0.5,1.0和2.0 mmol·L-1 SA 处理过的毛竹叶片干质量分别增加了10.82%,20.68%和32.51%,在0.5~2.0 mmol·L-1 范围内,SA的效应随SA浓度的增加而增强。
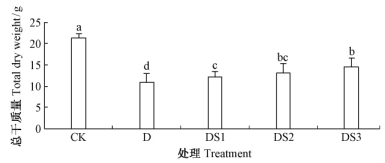 |
图 1 水杨酸对干旱胁迫下毛竹实生苗生物量的影响
Fig. 1 The influence of salicylic acid on biomass of P. edulis seedlings under drought stress
CK:正常水分;D:干旱;DSI:干旱+0.5 mmol·L-1SA;DS2:干旱+1.0 mmol·L-1SA;DS3:干旱+2.0 mmol·L-1SA。图中误差棒为平均值的标准误,n=5; 不同字母表示该指标在不同处理之间是存在显著差异(P<0.05)。下同。 |
由图 2可知,干旱胁迫下,毛竹叶片含水量随着干旱时间的延长不断下降;SA处理后,毛竹叶片含水量上升,其效应随外源SA浓度的增加而增强,2.0 mmol·L-1 时达到显著水平(P<0.05);SA处理14天后,0.5和1.0 mmol·L-1 SA处理的毛竹叶片含水量与干旱对照差异不明显,而2.0 mmol·L-1 SA处理的毛竹实生苗的叶片含水量仍显著高于干旱对照(P<0.05)。上述结果表明,外源SA处理能提高干旱胁迫下毛竹实生苗的叶片含水量;在0.5~2.0 mmol·L-1 范围内,其效应及其持续的时间随着浓度的增加而增强,但随着干旱时间的延长而减弱。
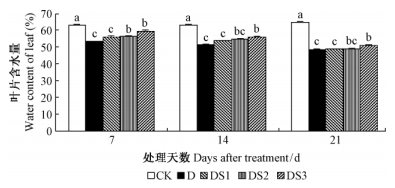 |
图 2 水杨酸对干旱胁迫下毛竹叶片含水量的影响 Fig. 2 The influence of salicylic acid on water content of P. edulis leaf under drought stress |
由图 3可知,在干旱胁迫下施加外源SA,在处理7天时,各处理的叶片叶绿素含量差异均不显著(P>0.05);处理14天后,干旱胁迫显著降低了毛竹叶片叶绿素含量(P<0.05),外源SA对提高叶片叶绿素含量没有明显作用;处理21天后,1.0和2.0 mmol·L-1 SA显著提高了毛竹叶片叶绿素含量(P<0.05)。结果表明,毛竹实生苗叶片叶绿素含量相对稳定,短期(7天)的干旱胁迫和施加外源SA处理不会显著影响其含量;较长时间后(21天),1.0~2.0 mmol·L-1 SA显著提高了毛竹实生苗叶片叶绿素含量。
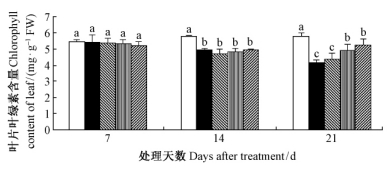 |
图 3 水杨酸对干旱胁迫下毛竹叶片叶绿素含量的影响 Fig. 3 The influence of salicylic acid on chlorophyll content of P. edulis leaf under drought stress |
由图 4可知,干旱条件下,毛竹叶片电导率显著增加(P<0.05)。施加外源SA后,毛竹实生苗叶片电导率下降,且SA浓度越高下降越明显。随着处理时间的延长,外源SA对降低毛竹实生苗叶片电导率的效应呈先增强后减弱的趋势;7天时,仅2.0 mmol·L-1 SA处理的显著下降,14和21天时3种SA处理均出现显著下降(P<0.05);21天时SA处理的毛竹叶片的电解质外渗率要显著(P<0.05)高于14天,且显著高于正常供水组。
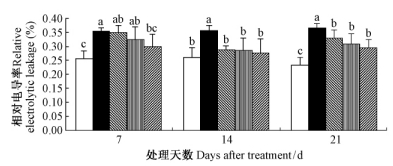 |
图 4 水杨酸对干旱胁迫下毛竹叶片相对电导率的影响 Fig. 4 The influence of salicylic acid on relative electrolytic leakage of P. edulis leaf under drought stress |
由图 5可知,干旱胁迫下,毛竹实生苗叶片POD活性显著降低(P<0.05);在0.5~2.0 mmol·L-1SA范围内,随着浓度的提高,SA的施用效应加强,但随着时间的持续,不同浓度处理间的差异减小;2.0 mmol·L-1 外源SA显著增加了POD的活性(P<0.05),使其与正常水分条件下的叶片POD活性保持同一水平。
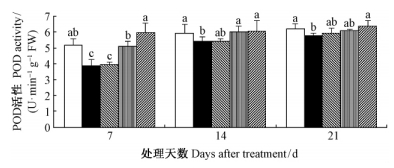 |
图 5 水杨酸对干旱胁迫下毛竹叶片POD活性的影响 Fig. 5 The influence of salicylic acid on activity of POD in P. edulis leaf under drought stress |
由图 6可知,干旱胁迫7天时,毛竹实生苗叶片CAT活性显著升高(P<0.05);随着外施SA浓度的增加,毛竹实生苗叶片CAT活性下降,在1.0~2.0 mmol·L-1 时,达到了显著水平(P<0.05),与正常供水叶片CAT活性保持同一水平。干旱胁迫14和21天时,各处理差异均不显著(P<0.05)。
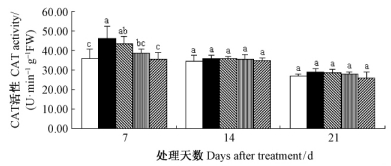 |
图 6 水杨酸对干旱胁迫下毛竹叶片CAT活性的影响 Fig. 6 The influence of salicylic acid on activity of CAT in P. edulis leaf under drought stress |
由图 7可知,干旱胁迫7天时,各处理下毛竹实生苗叶片SOD活性差异均不显著(P<0.05);随着时间的持续,14天后,毛竹实生苗叶片SOD活性显著升高(P<0.05),2.0 mmol·L-1 SA处理显著降低了叶片SOD活性,使其与正常水分条件下处于同一水平,但其效果随着时间的持续有减弱的趋势。
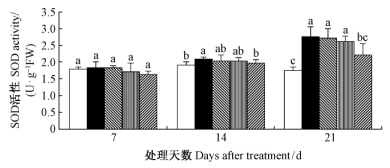 |
图 7 水杨酸对干旱胁迫下毛竹叶片SOD活性的影响 Fig. 7 The influence of salicylic acid on activity of SOD in P. edulis leaf under drought stress |
由图 8可知,干旱胁迫7天时,毛竹叶片游离脯氨酸含量显著增加(P<0.05);14天时差异不显著(P<0.05),21天时显著降低(P<0.05)。干旱胁迫下施加SA,在初期(7天),随着SA浓度的增加,毛竹叶片游离脯氨酸含量持续下降,在1.0~2.0 mmol·L-1时达到了显著(P<0.05)水平;14天后,随着SA浓度的增加,毛竹叶片脯氨酸含量持续增加,并达到了显著(P<0.05)水平。
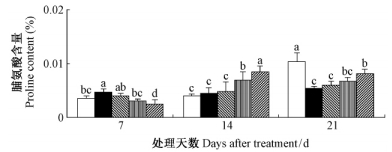 |
图 8 水杨酸对干旱胁迫下毛竹叶片游离脯氨酸含量的影响 Fig. 8 The influence of salicylic acid on content of free proline in P.edulis leaf under drought stress |
由图 9可知,干旱胁迫下毛竹实生苗叶片可溶性蛋白呈先升高后降低的趋势,达到显著水平(P<0.05)。干旱胁迫下施加不同浓度的外源SA,7天时1.0 mmol·L-1 SA和2.0 mmol·L-1 SA处理组毛竹叶片可溶性蛋白含量显著下降(P<0.05);14天时叶片可溶性蛋白含量出现回升,但与干旱处理组无显著差异(P<0.05);21天时2.0 mmol·L-1 SA处理组可溶性蛋白含量显著高于干旱处理组(P<0.05)。SA处理后,毛竹实生苗叶片可溶性蛋白含量与脯氨酸变化趋势大致相同,总体呈现先降后升的趋势,2.0 mmol·L-1 时该趋势最明显。
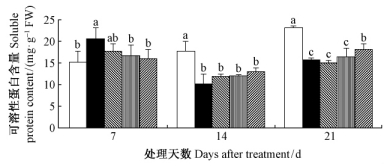 |
图 9 水杨酸对干旱胁迫下毛竹叶片可溶性蛋白含量的影响 Fig. 9 The influence of salicylic acid on content of solute protein in P. edulis leaf under drought stress |
由图 10可知,干旱胁迫下,毛竹实生苗叶片可溶性糖含量呈现降低—升高—再降低的趋势,变幅达到了显著水平(P<0.05)。7天时2.0 mmol·L-1 SA处理组毛竹叶片可溶性糖含量显著增加(P<0.05);14天时各处理均无显著差异;21天时SA处理组毛竹实生苗叶片可溶性糖含量均显著增加(P<0.05),不同浓度间没有显著差异,与正常水分条件下处于同一水平。以上数据说明,干旱胁迫下,外源SA对维持毛竹实生苗叶片可溶性糖含量具有积极的作用;在后期(14~21天),在0.5~2.0 mmol·L-1范围内,SA的浓度对其效应没有显著影响。
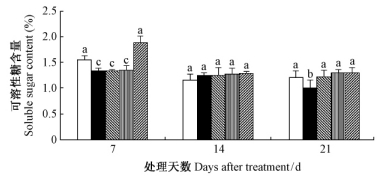 |
图 10 水杨酸对干旱胁迫下毛竹叶片可溶性糖含量的影响 Fig. 10 The influence of salicylic acid on content of solute sugar in P. edulis leaf under drought stress |
干旱是植物生长过程中遭受的主要环境胁迫之一。SA可以调控植物的生长和对逆境的反应,提高植物对干旱胁迫的适应能力(Loutfy et al., 2012)。本试验中,干旱胁迫下施加外源SA,显著提高了毛竹实生苗的叶片含水量,以及干旱胁迫后期叶片叶绿素含量,毛竹实生苗生物量显著增加,呈现外源SA浓度越高,效果越明显的趋势,这结果与Singh等(2003)在小麦(Triticum aestivum)上的研究结果一致。Khan等(2003)的研究也表明,SA 及其类似物可以增加玉米和大豆(Glycine max)的叶面积和干物质量。Ying等(2013)通过对水分胁迫下的杨梅(Myrica rubra)喷施2 mM SA发现,杨梅的叶片含水量和叶绿素含量显著提高,干旱适应能力增强。
3.2 干旱胁迫下SA对毛竹实生苗渗透调节机制的影响渗透调节是植物适应干旱逆境的重要生理机制,渗透调节能力的强弱也是植物抗旱性的一个重要特征。脯氨酸、可溶性蛋白和可溶性糖都是重要的渗透调节物质(赵丽英等,2004)。这些物质可以通过渗透调节促使植物在干旱条件下加强吸水,维持细胞膨压,从而保持细胞生长、气孔开放和光合作用等生理过程的进行。本试验中,干旱胁迫后期,外源SA显著提高了毛竹实生苗游离脯氨酸、可溶性蛋白和可溶性糖的含量(P<0.05),这与种培芳等(2006)、束良佐等(2002)和曹翠玲等(2004)的研究结果一致,干旱胁迫下外源SA能有效提高植物叶片的渗透调节物质含量,保持植物叶片含水量,维持体内各种生理代谢过程。然而,在SA 处理后0~7天内,毛竹实生苗游离脯氨酸和可溶性蛋白含量出现下降趋势,这一现象还少有相关报道。这可能因为SA本身也是一种化学信号物质,在干旱初期或在轻度干旱条件下,会启动以脯氨酸和某些可溶性蛋白为底物的其他防御途径;也可能在干旱下毛竹实生苗合成脯氨酸有一个缓冲期,具体的机制需要进一步探索。
3.3 干旱胁迫下SA对毛竹实生苗保护酶的影响干旱等胁迫下,植物体内的保护酶可以通过清除自由基,保护膜系统,避免植物逆境伤害。本试验结果显示,施用外源SA后毛竹实生苗的POD活性显著提高;CAT活性在处理0~7天内出现下降,SOD活性则在试验后期(21天)有下降趋势,其他时间段SA对二者没有显著影响。这与黄清泉等(2004)的研究结果类似,都表现为POD活性的显著提高。CAT出现下降,可能是SA通过抑制CAT的活性而积累的H2O2作为第二信使,诱导一些防卫基因的激活或表达(Chen et al., 1993; Rasin,1992)。康国章等(2004)也推测,SA在抗环境胁迫方面的正负效应可能与其诱导的H2O2水平有关。干旱胁迫下,3种保护酶活性的此消彼长维持了毛竹实生苗的生理稳定,对毛竹实生苗抗干旱逆境有积极作用。
本研究表明,外源SA提高了毛竹实生苗的干旱适应性,在浓度0.5~2.0 mmol·L-1时,SA处理的效应随浓度的增加而增加,随着干旱时间的持续而减弱。然而,本试验结果为2.0 mmol·L-1 SA对干旱胁迫下毛竹实生苗的缓解作用最强,未掌握在进一步增加浓度下SA对毛竹实生苗抗旱的影响,这是本试验的不足。这与所参考植物的种类、生长发育阶段及栽培基质有关,应在以后的试验中加以补充和完善。另外,外源SA提高毛竹实生苗抗旱能力的作用途径有很多种,如增强干旱信号的传导,提高毛竹某些保护酶(主要是POD)的活性,直接参与氧自由基的清除,以及增强毛竹的渗透调节能力等。然而,这些途径之间的相互关联还未完全清楚,SA对毛竹实生苗干旱适应能力的作用途径有待进一步的挖掘和完善。
| [1] |
曹翠玲,刘林丽,田强兵. 2004.水杨酸对玉米幼苗抗旱性的影响.玉米科学, (1):103-104. (Cao C L, Liu L L, Tian Q B. 2004. Effect of salicylic acid on maize seedling drought-resistibility. Journal of Maize Sciences, (1):103-104[in Chinese]).(  2) 2)
|
| [2] |
种培芳,杨江山. 2006.水杨酸对水分胁迫下甜瓜幼苗生理特性的影响.甘肃农业大学学报, 41(3):44-47. (Chong P F, Yang J S. 2006. Effects of salicylic acid on physiological characteristics of melon seedling under water stress. Journal of Gansu Agricultural University, 41(3):44-47[in Chinese]).(  1) 1)
|
| [3] |
崔婧. 2007.水杨酸与植物抗逆性.安徽农学通报, (9):35-38. (Cui Q. 2007. Effects of salicylic acid on resisting adversity of plants. Anhui Agricultural Science Bulletin, (9):35-38[in Chinese]).(  1) 1)
|
| [4] |
代其林,王劲,万怀龙,等. 2008.水杨酸对干旱胁迫下豇豆幼苗抗氧化酶活性的影响.四川大学学报:自然科学版, 45(5):1258-1262. (Dai Q L, Wang J, Wan H L, et al. 2008. Effects of salicylic acid on the anti-oxidant enzymes reactivity of cowpea seedlings under drought stress. Journal of Sichuan University:Natural Science Edition, 45(5):1258-1262[in Chinese]).(  1) 1)
|
| [5] |
何奇江,汪奎宏. 2001.毛竹笋用林供水试验研究初报.浙江林业科技, 21(5):17-19. (He Q J,Wang K H. 2001. Preliminary report on experiment of watering bamboo stand for shoot. Journal of Zhejiang Forestry Science and Technology, 21(5):17-19[in Chinese]).(  1) 1)
|
| [6] |
黄清泉,孙歆,张年辉,等. 2004.水杨酸对水分胁迫黄瓜幼苗叶片生理过程的影响.西北植物学报, 24(12):2202-2207. (Huang Q Q, Sun X, Zhang N H, et al. 2004. Effects of salicylic acid on leaves of cucumber seedlings under water stress. Acta Botanica Boreali-Occidentalia Sinica, 24(12):2202-2207[in Chinese]).(  1) 1)
|
| [7] |
康国章,孙谷畴,王正询. 2004.水杨酸在植物抗环境胁迫中的作用.广西植物, 24(2):178-183. (Kang G Z, Sun G C, Wang Z X. 2004. Salicylic acid and its environmental stress tolerance in plants. Guihaia, 24(2):178-183[in Chinese]).(  1) 1)
|
| [8] |
李合生. 2003.植物生理生化实验原理和技术.北京:高等教育出版社. (Li H S. 2003. The principle and technology of plant physiology and biochemistry experiment. Beijing:Higher Education Press.[in Chinese]) |
| [9] |
孟雪娇,邸昆,丁国华. 2010.水杨酸在植物体内的生理作用研究进展.中国农学通报, (15):207-214. (Meng X J, Di K, Ding G H. 2010. Progress of study on the physiological role of salicylic acid in plant. Chinese Agricultural Science Bulletin, (15):207-214[in Chinese]).(  2) 2)
|
| [10] |
束良佐,李爽. 2002.水杨酸浸种对水分胁迫下玉米幼苗某些生理过程的影响.南京农业大学学报, 25(3):9-11. (Shu L Z, Li S. 2002. Effects of salicylic acid pretreatment on some physiological processes of maize seedlings under water stress. Journal of Nanjing Agricultural University, 25(3):9-11[in Chinese]).(  1) 1)
|
| [11] |
杨开良. 2012.我国竹产业发展现状与对策.经济林研究, (2):140-143. (Yang K L. 2012. Development status and strategies of Chinese bamboo industry. Nonwood Forest Research, (2):140-143[in Chinese]).(  1) 1)
|
| [12] |
应叶青,郭璟,魏建芬,等. 2011.干旱胁迫对毛竹幼苗生理特性的影响.生态学杂志, 30(2):262-266. (Ying Y Q, Guo J, Wei J F, et al. 2011. Effects of drought stress on physiological characteristics of Phyllostachys edulis seedlings. Chinese Journal of Ecology, 30(2):262-266[in Chinese]).(  1) 1)
|
| [13] |
赵丽英,邓西平,山仑. 2004.水分亏缺下作物补偿效应类型及机制研究概述.应用生态学报, 15(3):523-526. (Zhao L Y, Deng X P, Shan L. 2004. A review on types and mechanisms of compensation effect of crops under water deficit. Chinese Journal of Applied Ecology, 15(3):523-526[in Chinese]).(  1) 1)
|
| [14] |
郑炳松. 2006.现代植物生理生化研究技术.北京:气象出版社. (Zheng B S.2006. Modern plant physiological and biochemical research technology. Beijing:China Meteorological Press.[in Chinese])(  1) 1)
|
| [15] |
庄若楠,金爱武. 2013.施肥对毛竹秆型特征的影响.中南林业科技大学学报, (1):80-84. (Zhuang R N, Jin Ai W. 2013. Effects of fertilization on culm form characteristics of Phyllostachys pubescens. Journal of Central South University of Forestry & Technology, (1):80-84[in Chinese]).(  1) 1)
|
| [16] |
邹琦. 2000.植物生理学实验指导.北京:中国农业出版社. (Zou Q. 2000. Experimental guide of physiology of plant. Beijing:China Agriculture Press.[in Chinese])(  2) 2)
|
| [17] |
Argueso C T, Ferreira F J, Epple P, et al. 2012. Two-component elements mediate interactions between cytokinin and salicylic acid in plant immunity. PLoS Genetics, 8(1):e1002448.( 1) 1)
|
| [18] |
Chen Z, Silva H, Klessig D F. 1993. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid. Science, 262(5141):1883-1886.( 1) 1)
|
| [19] |
Choudhary K K, Agrawal S B. 2014. Cultivar specificity of tropical mung bean (Vigna radiata L.) to elevated ultraviolet-B:Changes in antioxidative defense system, nitrogen metabolism and accumulation of jasmonic and salicylic acids. Environmental and Experimental Botany, 99:122-132.( 1) 1)
|
| [20] |
Khan W,Prithviraj B, Smith D L. 2003. Photosynthetic responses of corn and soybean to foliar application of salicylate. J Plant Physiol, 160:485-492.( 1) 1)
|
| [21] |
Loutfy N, El-Tayeb M A, Hassanen A M, et al. 2012. Changes in the water status and osmotic solute contents in response to drought and salicylic acid treatments in four different cultivars of wheat (Triticum aestivum). Journal of Plant Research, 125(1):173-184.( 1) 1)
|
| [22] |
Malamy J, Carr J P, Klessig D F, et al. 1990. Salicylic acid:a likely endogenous signal in the resistance response of tobacco to viral infection. Science, 250(4983):1002-1004.( 1) 1)
|
| [23] | Németh M, Janda T, Horváth E, et al. 2002. Exogenous salicylic acid increases polyamine content but may decrease drought tolerance in maize. Plant Science, 162(4):569-574. |
| [24] |
Rasin I.1992. Role of salicylic acid in plants. Ann Rev Plant Physiol Mol Biol, 43:439-463.( 1) 1)
|
| [25] |
Singh B, Usha K. 2003. Salicylic acid induced physiological and biochemical changes in wheat seedlings under water stress. Plant Growth Regulation, 39(2):137-141.( 1) 1)
|
| [26] |
Ying Y, Yue Y, Huang X, et al. 2013. Salicylic acid induces physiological and biochemical changes in three Red bayberry (Myric rubra) genotypes under water stress. Plant Growth Regulation, 71(2):181-189.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51

