文章信息
- 徐明, 徐福元, 吴小芹
- Xu Ming, Xu Fuyuan, Wu Xiaoqin
- Bt+灭幼脲混剂对美国白蛾幼虫中肠蛋白酶、血淋巴蛋白的影响
- Effects of the Mixture of Bt and Chlorbenzuron on the Activity of Midgut Proteinase, Haemolymph Proteins on 4th Instar Larvae of Hyphantria cunea
- 林业科学, 2015, 51(11): 137-144
- Scientia Silvae Sinicae, 2015, 51(11): 137-144.
- DOI: 10.11707/j.1001-7488.20151118
-
文章历史
- 收稿日期:2014-12-15
- 修回日期:2015-07-28
-
作者相关文章
2. 南京林业大学林学院 南京 210037
2. Forestry College, Nanjing Forestry University Nanjing 210037
美国白蛾(Hyphantria cunea)是一种危险性的食叶害虫,具有食性杂、危害大、繁殖快、易传播等特点,属世界性检疫对象。2010年起该虫在江苏连云港、徐州、宿迁和盐城等地暴发,并向周边地区扩散蔓延,目前蔓延的势头仍在加剧,严重威胁当地的城市绿化、林果业和养蚕业的发展。防治该虫所使用的有机磷和菊酯类等农药,对家蚕(Bombyx mori)(马惠等,2005)、鱼虾(冷春梅等,2012)具有高毒性,迫切需要对该虫开展高效安全、可持续、无污染新型防治方法(罗成等,2011)和生物控制方法的研究。用苏云金杆菌(Bacillus thuringiensis,Bt)与灭幼脲(chlorbenzuron)混剂防治白蛾幼虫有显著的致死增效作用(徐明等,2013),为白蛾生物、无公害防控提供了新的研究方向。Bt与灭幼脲混剂均为昆虫食后发生作用的菌剂,据喻子牛(1990)报道,Bt毒蛋白和灭幼脲杀虫机制研究涉及中肠,中肠是昆虫消化吸收食料的重要场所和组织。Bt的主要杀虫机制是昆虫食入毒蛋白晶体后,在中肠高pH环境和蛋白水解酶的作用下,毒蛋白晶体溶解并被激活;活化的蛋白引起中肠膜上皮细胞裂解、中肠麻痹,使昆虫几天内死亡。Bt被昆虫取食后必须被中肠蛋白酶水解激活,才能释放出具有杀虫活性的毒素蛋白,如果毒素水解不充分或是被过度水解,都可能造成昆虫对Bt产生抗性(谭声江等,2001;徐艳聆等,2006a; 2006b;赵霞等,2013)。经灭幼脲Ⅰ号处理后约1 h,中肠蛋白酶的活力便受到影响;严重时,约60%的酶活力受到抑制。同时观察到,经灭幼脲Ⅰ号处理后,蚊幼体质量普遍减轻,同时幼虫中肠的蛋白酶活力下降,这是由于灭幼脲Ⅰ号影响了蚊幼虫的取食(吴秋雁,1990)。试验表明取食转API基因棉对棉铃虫(Helicoverpa armigera)中肠强碱性类胰蛋白酶和类胰凝乳蛋白酶活性具有抑制作用(刘贤进等,2003)。在昆虫的开放式循环系统中,血淋巴是代谢和代谢过程中各种物质储存和交换的重要场所。血淋巴在昆虫的防御、免疫、损伤应答、抗冻等方面都起到重要作用。昆虫血淋巴含有多种蛋白质,包括形成组织所需蛋白、供应卵母细胞发育的卵黄原蛋白、激素和脂类的载体蛋白、多种酶等,这些蛋白质与组织形成和物质代谢有关(张国洲等,2000;谭树乾等,2013;魏纪珍等,2012)。目前,Bt、灭幼脲及其混剂处理对白蛾4龄幼虫体内中肠蛋白酶和体内血淋巴蛋白与防效研究尚未见报道。本文采用生化测定法研究了其对白蛾4龄幼虫血淋巴蛋白(haemolymph protein)和中肠蛋白酶(midgut proteinase)活力的影响,初步探讨了Bt+灭幼脲混剂对防治白蛾增效作用的生理生化机制,以期为该混剂的研发和推广运用提供理论依据。
1 材料与方法 1.1 供试昆虫2013年6-10月,江苏省新沂市窑湾镇欧美杨无性系72杨(Populus euramericana cv.I-72)林内采集美国白蛾(简称白蛾)4龄幼虫。
1.2 供试药剂Bt(苏云金杆菌)悬浮剂毒力效价为8 000 IU·μL-1(扬州绿源生物化工有限公司生产),25%灭幼脲(安阳市瑞泽农药有限公司生产)。
1.3 仪器恒温水浴锅(上海申生科技有限公司),SpectraMax M2酶标仪(美国分子仪器公司),Heraeus biofuge台式高速离心机(D37520型,德国Kendrc公司),台式低速离心机(TD5A-WS型,长沙湘仪离心机仪器有限公司),分析天平(0.1 mg)(BS110S,赛多利斯),电热恒温干燥箱(DHG-9070A型,上海精宏实验设备有限公司),混合球磨仪(德国莱驰 RETSCH MM400),电泳槽(Bio-Rad Mini Protean Tetra Cell),电泳电源(Bio-Rad PowerPac Basic)。
1.4 Bt+灭幼脲混剂对白蛾4龄幼虫的室内联合毒力1)药剂配制(1)单剂: 将供试Bt分别等比稀释为0.8,0.4,0.2,0.1和0.05 IU·μL -1 5个浓度;将供试灭幼脲分别等比稀释为2.5,1.25,0.625,0.313和0.156 μL·L-1 5个浓度。
(2)混剂: Bt+灭幼脲混剂是将上述2种供试单剂各减半混配后,分别将其等比稀释为0.4 IU·μL-1+1.25 μL·L-1,0.2 IU·μL-1+0.625 μL·L-1,0.1 IU·μL-1+0.313 μL·L-1,0.05 IU·μL-1+0.156 μL·L-1和0.025 IU·μL-1+0.078 μL·L-1 5个浓度。
2)供试幼虫取样 将新鲜复叶槭(Acer negundo)叶片在上述各浓度药液中速浸20 s,晾干后放入直径15 cm的大培养皿中,每处理浓度接4龄幼虫30头,以无菌水为对照,重复3次,分别于药剂处理后6,12,24,36,48,72和96 h测定白蛾4龄幼虫供血淋巴蛋白和中肠蛋白酶的活力。
1.5 白蛾4龄幼虫血淋巴蛋白和中肠蛋白酶活力测定方法1)中肠蛋白酶测定(1)样品粗酶液的提取 中肠样品: 每管样品为1 mL进行球磨匀浆。球磨条件为频率10次·s-1、时长1 min,重复3次。匀浆液于4 ℃,12 000 r·min-1 条件下离心5 min,取上清液即为粗酶提取液。
(2)蛋白酶活力测定参照魏纪珍等(2012)的方法。①酪氨酸标准曲线的制作: 取7个1.5 mL Ependoff管(标号0,1-6),按顺序分别加入0,0.02,0.04,0.06,0.08,0.10和0.12 mL标准酪氨酸溶液,再用水补足到0.20 mL,摇匀后各加入0.55 mol·L-1 碳酸钠1.0 mL,摇匀,加入Folin-酚试剂0.20 mL,摇匀并计时,于30 ℃水浴锅中保温15 min。然后680 nm处测定吸光值(以0号管作对照)。以酪氨酸含量(μg·mL-1)作横坐标,吸光值为纵坐标绘制标准曲线。②酶活力测定: a.酶反应: 将一1.5 mL Ependoff管加入0.4 mL0.5%的酪蛋白溶液,于30 ℃水浴中预热5 min,再加入0.2 mL已预热好的样液并计时,保温水浴10 min,取出后立即加入0.4 mL的10%三氯醋酸液,摇匀静置数分钟,8 000 r·min-1离心2 min,取上清液(A液)。将另一1.5 mL Ependoff管加入0.2 mL 已预热好的样液和0.4 mL 的10%三氯醋酸液,摇匀,放置数分钟,再加0.4 mL0.5%的酪蛋白溶液,然后于30 ℃保温水浴10 min,同样离心,得上清液(对照液即B液)。以上A,B液各做1次平行试验。b.滤液中酪氨酸含量的测定: 将3个1.5 mL Ependoff管分别加入0.2 mL 水、A 液、B 液,然后各加入1.0 mL 0.55 mol·L-1 碳酸钠溶液和0.2 mL Folin-酚试剂,摇匀按标准曲线制作方法保温并测吸光度值。分别求出A液与水、B液与水的吸光度差值,由标准曲线查出A、B 液中酪氨酸含量差值,即可推算出酶的活力单位。c.酶活力单位定义: 在上述条件下,每1 min水解酪蛋白产生1 μg酪氨酸酶量定义为1个蛋白酶活力单位(U)。
2)血淋巴蛋白测定(1)考马斯亮蓝染色法测定血淋巴蛋白 将血淋巴样品在12 000 r·min-1下离心10 min,取上清做为样品。测定时用0.9%生理盐水对样品进行适当稀释。血淋巴总蛋白测定采用Bradford蛋白浓度测定试剂盒。具体操作按文献方法(Bradford,1976)。
(2)聚丙烯酰胺凝胶电泳与血淋巴总蛋白测定及含量计算 ①凝胶配制: a.按仪器说明装好玻璃板,制作的胶的厚度为1.0 mm;b.配制7.5%和10%的分离胶各15 mL,混匀,超声波脱气灌制;c.在凝胶液面上小心加水覆盖,以使界面平滑; d.凝固后(约 30~45 min),配制浓缩胶(5%,5 mL):水 3.4 mL,30%丙烯酰胺溶液 0.83 mL,1.5 mol·L-1 Tris-HCl(pH6.8)0.63 mL,10% SDS 0.05 mL,10%过硫酸铵0.05 mL,TEMED 0.005 mL,混匀,灌制;e.胶插上梳子形成上样孔,约 30~45 min后可用。 ②加样电泳: a.取 10μL样品,加入2 μL 6×上样缓冲液混匀; b. 5 000 r·min-1离心,取上清加样; c. 30 V电泳至样品进入分离胶(约 90 min),再调至60 V电泳1.5 h,最后调至90 V电泳到溴酚蓝移至凝胶下边界时停止。每槽血淋巴上清液加样量 6 μL,1-9号样所用分离胶浓度 7.5%,10-112号样所用分离胶浓度 10%。 ③蛋白的染色及含量分析计算: a.染色液的配制。 1%考马斯亮蓝 R250:称取 1 g的考马斯亮蓝 R250溶于 99 mL乙酸中,过滤后置于 4 ℃冰箱待用。10%三氯乙酸(TCA)溶液:在装有 500 g TCA的瓶中加入 227 mL水,形成密度为1.454 g·mL-1的100%(m/V)TCA的溶液,再稀释到溶液体积的10倍。12.5%三氯醋酸稀释到溶液体积的12.5倍,7.5%三氯醋酸稀释到溶液体积的7.5倍。苏丹黑 B酒精饱和液(饱和苏丹黑 B染液)取苏丹黑 B约 5 g,溶于无水乙醇中,使其呈饱和状态。 b.蛋白染色: 1%考马斯亮蓝 R250用 12.5%三氯醋酸稀释 20倍后染色 12 h,用 7.5%三氯醋酸脱色至背景白色透明。普通蛋白被染成深蓝色。 c.蛋白含量分析计算:用凝胶分析仪拍照,再对图谱进行分析。计算各蛋白质谱带相对迁移率(Rf)=(谱带迁移距离(cm)/溴酚蓝迁移距离(cm),或用核酸蛋白电泳成像仪扫描仪对蛋白质谱带进行扫描定量(曹传旺等,2009;程惊秋等,1986)。
1.6 数据统计分析采用DPS 7. 0. 5 软件进行方差分析,采用Duncan 邓肯氏(新复极差法)分别在0.05和0.01 水平检验各处理间的差异显著性。
2 结果与分析 2.1 Bt、灭幼脲及其混剂处理对白蛾4龄幼虫体内中肠蛋白酶活力的影响1)不同浓度Bt处理对白蛾4龄幼虫体内中肠蛋白酶活力的影响 Bt被昆虫取食后必须被中肠蛋白酶水解激活,才能释放出具有杀虫活性的毒素蛋白,5个浓度Bt处理白蛾 4龄幼虫6 h后,除0.05 IU·μL-1和0.1 IU·μL-1处理的幼虫体内中肠蛋白酶活力9.71 U·mL-1和8.46 U·mL-1高于对照的8.42 U·mL-1外,其余浓度处理的中肠蛋白酶活力均低于对照,并于12 h后其活力下降明显,且与处理时间呈负相关(r=-0.74);处理后4龄幼虫体内中肠蛋白酶活力明显降低,与对照组相比下降显著(P<0.01)(图 1)。
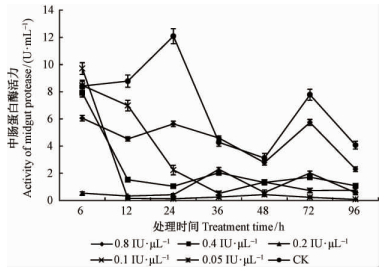 |
图 1 Bt处理对美国白蛾4龄幼虫体内中肠蛋白酶活力的影响
Fig. 1 Effects of the activity of midgut protease on 4th instar larvae of H. cunea by different concentration of B. thuringiensis treatment
图中数据经邓肯氏新复极差检验法(DMRT)检验在P<0.01水平差异显著。 Data is tested by Duncan multiple range test, P<0.01.下同The same below. |
2)不同浓度灭幼脲处理对白蛾4龄幼虫体内中肠蛋白酶活力的影响 5个浓度灭幼脲处理对美国白蛾4龄幼虫中肠蛋白酶活力的影响如图 2所示: 处理6 h的 0.625 μL·L-1处理的中肠蛋白酶的活力10.71 U·mL-1高于对照的8.42 U·mL-1,处理36 h的0.625 μL·L-1和1.25 μL·L-1处理的中肠蛋白酶的活力分别为6.04 U·mL-1、5.81 U·mL-1,高于对照的4.28 U·mL-1,除上述处理外,其他处理均受到影响。处理白蛾4龄幼虫体内中肠蛋白酶的活力低于对照,并于12 h后其活力均低于对照,下降明显,且与处理时间呈负相关(r=-0.60);处理后4龄幼虫体内中肠蛋白酶活力明显降低,与对照组相比下降显著(P<0.01),中肠蛋白酶活力受到抑制。
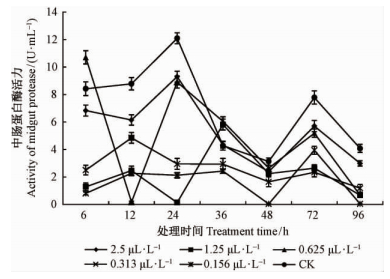 |
图 2 灭幼脲处理对美国白蛾4龄幼虫体内中肠蛋白酶活力的影响 Fig. 2 Effects of the activity of midgut protease on 4 th instar larvae of H. cunea by the treatment of different concentration of chlorbenzuron |
3)不同浓度Bt+灭幼脲混剂处理对白蛾4龄幼虫体内中肠蛋白酶活力的影响 5个浓度的Bt+灭幼脲混剂处理白蛾4龄幼虫后,除处理36 h的0.2 IU·μL-1+ 0.625 μL·L-1处理的中肠蛋白酶的活力4.34 U·mL-1高于对照的4.28 U·mL-1和处理48 h的0.4 IU·μL-1+1.25 μL·L-1处理中肠蛋白酶的活力3.43 U·mL-1高于对照的3.13 U·mL-1 外,6 h后美国白蛾4龄幼虫体内中肠蛋白酶的活力均低于对照,并于虫取食12 h后混剂处理同单剂处理一样,幼虫中肠蛋白酶的活性较对照低,但各浓度处理间差异显著。处理24 h各浓度处理幼虫中肠蛋白酶的活力较对照明显降低,其活力下降明显,且与处理时间呈负相关(r=-0.84);处理后4龄幼虫体内中肠蛋白酶活力明显降低,与对照组相比下降显著(P<0.01)(图 3),中肠蛋白酶活力受到抑制。这会直接影响到虫的取食,破坏昆虫营养吸收与平衡,干扰昆虫生长,是幼虫加快死亡的一个原因。
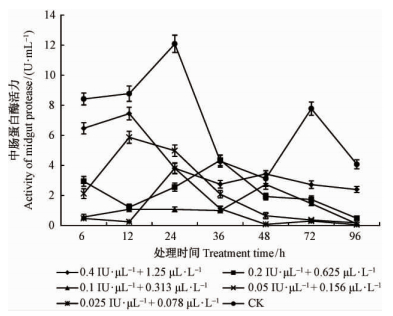 |
图 3 Bt+灭幼脲混剂处理对美国白蛾4龄幼虫体内中肠蛋白酶活力的影响 Fig. 3 Effects of the activity of midgut protease on 4th instar larvae of H. cunea by the treatment of different concentration of the mixture of Bt and chlorbenzuron |
1)不同浓度Bt处理对白蛾4龄幼虫体内血淋巴蛋白的影响 5个浓度Bt处理白蛾4龄幼虫6 h后,处理组4龄幼虫的血淋巴蛋白含量分别为19.6,19.6,20.2,23.3和16.0 mg·mL-1,对照的白蛾4龄幼虫血淋巴蛋白含量为14.0 mg·mL-1,说明药剂能够使得白蛾4龄幼虫启动防御反应,血淋巴中蛋白质含量增加。当处理12 h后,血淋巴中部分蛋白质被消耗或破坏,处理组血淋巴蛋白含量下降明显,且与处理时间呈负相关(r=-0.65);处理组4龄幼虫体内血淋巴蛋白含量至72 h分别为7.2,4.9,7.3,4.7和·6.7 mg·mL-1,至96 h分别为5.5,6.3,7.2,5.5和7.1 mg·mL-1,均明显低于对照72 h的13.3 mg·mL-1和96 h的15.1 mg·mL-1,与对照组相比处理组4龄幼虫体内血淋巴蛋白下降显著(P<0.01)(表 1),中肠血淋巴蛋白受到破坏,加快幼虫死亡。
|
|
2)不同浓度灭幼脲处理对白蛾4龄幼虫体内血淋巴蛋白的影响 不同浓度灭幼脲处理后其4龄幼虫体内血淋巴蛋白的含量受到影响。不同浓度灭幼脲处理12 h后高于对照,说明白蛾4龄幼虫启动防御反应,血淋巴中蛋白质含量增加。当处理36 h后血淋巴中部分蛋白质被消耗或破坏,其含量降低明显,且与处理时间呈负相关(r=-0.88);至96 h后处理组4龄幼虫体内血淋巴蛋白含量分别为4.9,5.2,7.5,5.1和8.2 mg·mL-1,明显低于对照的15.1 mg·mL-1,与对照组相比处理组4龄幼虫体内血淋巴蛋白下降显著(P<0.01)(表 2),中肠血淋巴蛋白受到破坏,加快幼虫死亡。
|
|
3)不同浓度Bt+灭幼脲混剂处理对白蛾4龄幼虫体内血淋巴蛋白的影响 5个浓度Bt+灭幼脲混剂处理白蛾4龄幼虫6 h后,处理组白蛾4龄幼虫体内血淋巴蛋白含量分别为15.8,18.0,19.7,23.4和13.9 mg·mL-1,高于对照的14.0 mg·mL-1,说明白蛾4龄幼虫启动防御反应,血淋巴中蛋白质含量增加;当处理12 h后血淋巴中部分蛋白质被消耗或破坏,其含量降低明显,且与处理时间呈负相关(r=-0.62);处理组4龄幼虫体内血淋巴蛋白含量至72 h后分别为6.2,8.9,2.3,3.2和9.0 mg·mL-1,至96 h分别为5.6,9.0,6.5,4.5和9.2 mg·mL-1,均明显低于对照72 h的13.3 mg·mL-1和96 h的15.1 mg·mL-1,与对照组相比处理组4龄幼虫体内血淋巴蛋白下降显著(P<0.01)(表 3),中肠血淋巴蛋白受到破坏是加快幼虫死亡的另一个原因。
|
|
综上所述,5个浓度Bt、灭幼脲单剂及其混剂处理6 h白蛾4龄幼虫,其体内中肠蛋白酶的平均活力分别为6.85,5.09和3.50 U·mL-1,处理72 h白蛾4龄幼虫体内中肠蛋白酶的平均活力分别为3.04,4.60和2.39 U·mL-1,说明混剂处理对白蛾4龄幼虫体内中肠蛋白酶活力的抑制作用均大于单剂;5个浓度Bt、灭幼脲单剂和其混剂处理12 h白蛾4龄幼虫体内血淋巴蛋白平均含量分别为15.60,9.40和9.70 mg·mL-1;处理72 h白蛾4龄幼虫体内血淋巴蛋白平均含量分别为11.60,7.30和7.16 mg·mL-1,说明混剂处理对白蛾4龄幼虫体内血淋巴蛋白含量的抑制作用均大于单剂。总之,Bt+灭幼脲混剂对白蛾4龄幼虫体内中肠蛋白酶活力和血淋巴蛋白的抑制作用均大于单剂,混剂均有较强的抑制作用和增效作用,并加快了白蛾4龄幼虫的死亡速度,提高了死亡率(徐明等,2013;喻子牛,1990;吴秋雁等,1991)。
3 讨论室内外毒力测定和防治试验结果表明,Bt+灭幼脲混剂对防治白蛾2,3代幼虫有较强的增效作用(徐明等,2013)。许多研究表明药剂处理后中肠蛋白酶的活力便受到影响,严重时约60%的酶活力受到抑制(龚国玑等,1988)。这会直接影响到昆虫的取食,导致体质量减轻,是使幼虫生长发育缓慢的另一个原因。针对昆虫中肠蛋白酶与Bt毒力活性的大量研究表明,蛋白酶直接影响Bt毒素蛋白的杀虫专一性、作用方式及其抗性(Brar et al., 2007;张宗炳等,1990;张少燕等,2004);活体PuGV-Ps包涵体中碱性蛋白酶的存在,增强了Bt晶体蛋白的酶解活性,提高了Bt对小菜蛾(Plutella xyllostella)的毒力(徐健等,2008)。Oppert等(1996)发现丝氨酸蛋白酶类是Bt的主要消化酶。20世纪50年代Birk等发现含有大豆胰蛋白酶抑制素的大豆(Glycine max)浸提物可抑制赤拟谷盗(Tribolium castaneum)幼虫的生长(刘贤进等,2003),Hilder等(1987)首次证实了转蛋白酶抑制素基因植物的抗虫作用。蛋白酶抑制素对昆虫的作用方式在于影响多种蛋白酶的活性,如强碱性类胰蛋白酶的活性降低,而弱碱性类胰蛋白酶的活力反而提高,最终破坏昆虫消化过程中重要蛋白酶的协调性,导致昆虫生长受阻(王琛柱等,1995)。进食转API基因棉后生长受明显抑制的棉铃虫幼虫,蛋白酶活性下降,引起昆虫对食物中蛋白质消化的障碍,并影响昆虫进一步摄食,破坏昆虫营养吸收与平衡,干扰昆虫生长,最终导致昆虫死亡(刘贤进等,2003;梁革梅等,2001),这方面研究很多,但未见有关Bt、灭幼脲及其混剂处理对白蛾4龄幼虫体内血淋巴蛋白和中肠蛋白酶活力影响的报道。本研究表明: 1)Bt+灭幼脲混剂处理使白蛾4龄幼虫中肠蛋白酶活力受到明显抑制并破坏了昆虫营养吸收与平衡,加速了白蛾4龄幼虫的死亡。本试验5个浓度Bt+灭幼脲混剂处理白蛾4龄幼虫6 h后,中肠蛋白酶的活力便受到影响。药剂处理白蛾4龄幼虫体内中肠蛋白酶活力低于对照,并于取食12 h后混剂处理同单剂处理一样,幼虫中肠蛋白酶的活力较对照略有降低,但在各浓度处理间差异显著。处理24 h各浓度处理幼虫中肠蛋白酶的活性较对照显著下降,且与处理浓度呈负相关;处理后4龄幼虫体内中肠蛋白酶活力明显降低,与对照组相比4龄幼虫体内中肠蛋白酶活力也下降显著。2)Bt+灭幼脲混剂处理使白蛾4龄幼虫体内血淋巴蛋白质含量下降显著,使其失去了防御、免疫、损伤应答、抗冻等方面的功能。5个浓度Bt+灭幼脲混剂处理白蛾4龄幼虫6 h后,处理组白蛾4龄幼虫体内血淋巴蛋白含量分别为15.8,18.0,19.7,23.4和13.9 mg·mL-1,高于对照的14.0 mg·mL-1,说明白蛾4龄幼虫启动防御反应,血淋巴中蛋白质含量增加;当处理12 h后,血淋巴中部分蛋白质被消耗或破坏,蛋白质含量降低明显,且与处理时间呈负相关;处理组4龄幼虫体内血淋巴蛋白含量至72 h后分别为6.2,8.9,2.3,3.2和9.0 mg·mL-1,至96 h分别为5.6,9.0,6.5,4.5和9.2 mg·mL-1,均明显低于对照72 h的13.3 mg·mL-1和96 h的15.1 mg·mL-1。相关研究表明,微孢子虫寄生引起意蜂(Apis mellifera)中肠上皮细胞破坏、脱落,肠壁溃烂,肠道对蛋白质和其他营养物质的吸收功能降低,然而意蜂血淋巴总蛋白质含量的降低并不表示微孢子虫感染后意蜂的防御反应功能的减弱或抑制(周婷等,2004;谢伟东,1988;张仙红等,2006)。但本研究发现,Bt+灭幼脲混剂处理使白蛾4龄幼虫体内血淋巴蛋白受到破坏是加快幼虫死亡的另一个原因。
| [1] |
曹传旺,杨传平,高彩球. 2009.昆虫生化与分子生物学实验技术.哈尔滨:东北林业大学出版社,72-74. (Cao C W, Yang C P, Gao C Q. 2009.Experimental Technique of Biochemical and Molecular Biology of Insects. Haerbin:Northeast Forestry University Publishing House,72-74.[in Chinese])(  1) 1)
|
| [2] |
程惊秋,周警疆,廖华明.1986.九种天牛血淋巴蛋白质的电泳研究.西南农业大学学报,(3):l38-143. (Cheng J Q,Zhou J J, Liao H M.1986. Study of hemolymph proteins with electrophoresis in 9 species of longicorn beetles.Journal of Southwest Agricultural University,(3):138-143[in Chinese]).(  1) 1)
|
| [3] |
龚国玑,王荫长,尤子平.1988.灭幼脲对小地老虎、粘虫及黄粉甲幼虫内部器官和组织的作用及毒理.昆虫学报,3l(4):358-365. (Gong G J, Wang Y C, You Z P. 1988. Effects of diflubenzuron on internal organs and tissues in black cutworm, armyworm and yellow mealworm. Acta Entomologica Sinica,3l(4):358-365[in Chinese]).(  1) 1)
|
| [4] |
冷春梅,王亚楠,董贯仓,等.2012.黄河三角洲河口区浮游植物组成及多样性分析.环境保护科学,38(1):37-40. (Leng C M, Wang Y N, Dong G C, et al. 2012. Analysis on species composition and diversity of phytoplankton in the estuary of yellow river delta. Environmental Protection Science, 38(1):37-40[in Chinese]).(  1) 1)
|
| [5] |
梁革梅,谭维嘉,郭予元. 2001.棉铃虫Bt抗感种群问数种解毒酶和中肠蛋白酶活性的比较.植物保护学报,28(2):133-137. (Liang G M, Tan W J, Guo Y Y. 2001. Comparison of some detoxification enzyme and midgut protease activities between resistant and susceptible cotton bollworm population to Bt. Acta Phitophylagica Sinica,28(2):133-137[in Chinese]).(  1) 1)
|
| [6] |
刘贤进,余向阳,王冬兰,等.2003.转基因棉对棉铃虫幼虫生长及中肠蛋白酶活性的影响.植物保护学报,30(3):232-236. (Liu X J, Yu X Y, Wang D L, et al. 2003. Influence of API-transgenic cotton plants on growth and midgut proteases activity to Helicoverpa armigera larvae. Acta Phitophylagica Sinica,30(3):232-236[in Chinese]).(  3) 3)
|
| [7] |
罗成,应盛华,冯明光.2011.球孢白僵菌对斜纹夜蛾高毒菌株筛选与制剂的研发.中国生物防治学报, 27(2):188-196. (Luo C, Ying S H, Feng M G. 2011. Selection and formulation of a Beauveria bassiana strain with high virulence towards Spodoptera litura (Lepidoptera:Noctuidae). Chinese Journal of Biological Control, 27(2):188-196[in Chinese]).(  1) 1)
|
| [8] |
马惠,姜辉,陶传江,等.2005.27种农药对家蚕的毒性评价研究.农药学学报,7(2):156-159. (Ma H, Jiang H, Tao C J, et al. 2005. Toxicity evaluation of twenty-seven pesticides to Bombyx mori. Chinese Journal of Pesticide Science, 7(2):156-159[in Chinese]).(  1) 1)
|
| [9] |
谭声江,陈晓峰,李典谟.2001.昆虫对Bt毒素的抗性机理研究进展.昆虫知识,38(1):12-22. (Tan S J, Chen S F, Li D M. 2001. Advance of research on the mechanism of resistance to Bt toxin in insects. Entomological Knowledge,38(1):12-22[in Chinese]).(  1) 1)
|
| [10] |
谭树乾,尹姣,刘春琴,等.2013.Cry8Ga1蛋白对华北大黑鳃金龟幼虫主要酶活性的影响.植物保护,39(3):1-6. (Tan S Q, Yin J, Liu C Q, et al. 2013. Effect of the main enzymatic activity of Cry8Ga1 protein on larvae of Holotrichia oblita. Plant Protection, 39(3):1-6[in Chinese]).(  1) 1)
|
| [11] |
王琛柱,项秀芬,张书芳.1995.大豆胰蛋白酶抑制剂对棉铃虫幼虫消化生理和生长发育的影响.昆虫学报,38(3):272-277. (Wang C Z, Xiang X F, Zhang S F. 1995.Effect of soybean trypsin inhibitor on the growth and digestive physiology of Helicoverpa armigera larvae. Acta Entomologica Sinica, 38(3):272-277[in Chinese]).(  1) 1)
|
| [12] |
魏纪珍,梁革梅,高希武,等.2012.Cry2Ab及CrylAc杀虫蛋白对棉铃虫中肠蛋白酶活性的影响.应用昆虫学报,49(4):839-846. (Wei J Z, Liang G M, Gao X W, et al. 1995.The effects of Cry2Ab and Cry1Ac insecticidal proteins on protease activity in the midgut of Helicoverpa armigera. Chinese Journal of Applied Entomology, 38(3):272-277[in Chinese]).(  2) 2)
|
| [13] |
吴秋雁.1990.灭幼脲I号对致倦库蚊幼虫磷酸酶活力的影响.昆虫学报,33(1):71-76. (Wu Q Y. 1990.Effects of diflubenzuron on phosphatase activities in the larvae of Culex pipiens Fatigans. Acta Entomologica Sinica, 33(1):71-76[in Chinese]).(  1) 1)
|
| [14] |
吴秋雁,仇序佳.1991.灭幼脲作用机制的研究进展.昆虫知识,28(3):180-181. (Wu T Y, Qiu X J. 1991.Advances of research on the mechanism of activition of diflubenzuron on the insects. Entomological Knowledge, 28(3):180-181[in Chinese]).(  1) 1)
|
| [15] |
谢伟东.1988.微孢子虫感染对蓖麻蚕体内两种酶活性及血淋巴蛋白的影响.蚕业科学,11(1):44-46. (Xie W D. 1988.Effects of microsporidia infection on the activity of two enzymes and the haemolymph protein in the eri silkworm. Acta Sericologica Sinica, 11(1):44-46[in Chinese]).(  1) 1)
|
| [16] |
徐健,刘琴,姚远,等.2008.粘虫颗粒体病毒对苏云金杆菌δ-内毒素的酶解活化作用.植物保护学报,35(3):263-269. (Xu J, Liu Q, Yao Y,et al. 2008.Effect of Psedualetia unipuncta granulovirus on the degradation of δ-endotoxin from Bacillus thuringiensis. Acta Phytophylacica Sinica, 35(3):263-269[in Chinese]).(  1) 1)
|
| [17] |
徐明,刘冬梅,徐福元,等.2013. Bt与灭幼脲混剂对美国白蛾第2,3代幼虫的联合毒力及防治效果.林业科学, 49(12):171-174. (Xu M, Liu D M, Xu F Y,et al. 2013.Joint-toxicity and control effect of the mixture of Bt and chlorbenzuron to the second and third generation larvae of Hyphantria cunea. Scientia Silvae Sinicae, 49(12):171-174[in Chinese]).(  3) 3)
|
| [18] |
徐艳聆,王振营,何康来,等. 2006a.转Bt基因抗虫玉米对亚洲玉米螟幼虫几种主要酶系活性的影响.昆虫学报,49(4):562-567. (Xu Y L, Wang Z Y, He K L, et al. 2006a.Effects of transgenic Bt corn expressing Cry1Ab toxin on activities of some enzymes in larvae of the Asian corn borer, Ostrinia furnacalis (Guenée)(Lepidoptera:Pyralidae). Acta Entomologica Sinica, 49(4):562-567[in Chinese]).(  1) 1)
|
| [19] |
徐艳聆,王振营,何康来,等. 2006b.对Bt抗性和敏感亚洲玉米螟解毒酶和中肠蛋白酶的比较.农业生物技术学报,14(6):889-893. (Xu Y L, Wang Z Y, He K L, et al. 2016b.Comparative analysis of detoxificationenzyme and midgut proteinase activities of Bacillus thuringiensis-resistant and -susceptible Ostrinia furnacalis (Lepidoptera:Crambidae). Journal of Agricultural Biotechnology, 14(6):889-893.[in Chinese]) (  1) 1)
|
| [20] |
喻子牛.1990.苏云金杆菌.北京:科学出版杜. (Yu Z N. 1990.Bacillus thuringiensis. Beijing:Science Press.[in Chinese])(  2) 2)
|
| [21] |
岳书奎,王志英,黄玉清,等.1996. Bt生物增效剂的研究.东北林业大学学报,24(4):46-50. (Yue S K, Wang Z Y, Huang Y Q, et al. 1996.Biological synergist of Bacillus thuringiensis preparation. Journal of Northeast Forestry University, 24(4):46-50[in Chinese]). |
| [22] |
张国洲,王亚维,徐汉虹. 2000.β-谷甾醇等化合物对昆虫血淋巴蛋白质含量的影响.湖北农学院学报,20(3):201-202. (Zhang G Z, Wang Y W, Xu H H.2000.Affection of β-sitosterol etc.on the protein content in haemolymph of insects. Journal of Hubei Agricultural College,20(3):201-202[in Chinese]).(  1) 1)
|
| [23] |
张少燕,李典谟,谢宝瑜. 2004.Bt毒蛋白对棉铃虫的生长发育和相关酶活性的影响.昆虫知识,41(6):536-540. (Zhang S Y, Li D M, Xie B Y. 2004.Effects of Bt toxic protein on development and activities of several relative enzymes in Helicoverpa armigera. Entomological Knowledge, 41(6):536-540[in Chinese]).(  1) 1)
|
| [24] |
张仙红,王宏民,李文英,等.2006.菜青虫感染玫烟色拟青霉后血淋巴蛋白质含量及几种保护酶活力的变化.昆虫学报,49(2):230-234. (Zhang X H, Wang H M, Li W Y, et al. 2006.Changes in the protein content in haemolymph and activities of protective enzymes of Pieris rapae infected by Paecilomyces fumosoroseus (Deuteromycotina:Hyphomycetes). Acta Entomologica Sinica, 49(2):230-234[in Chinese]).(  1) 1)
|
| [25] |
张宗炳,曹骥.1990.害虫防治:策略与方法.北京:科学出版社,143-154. (Zhang Z B, Cao J. 1990.Pest control:Strategies and methods. Beijing:Science Press,143-154.[in Chinese])(  1) 1)
|
| [26] |
赵霞,贾苗,王磊,等. 2013.马拉硫磷对东亚飞蝗解毒酶活性的影响.环境昆虫学报,35(2):165-170. (Zhao X, Jia M, Wang L, et al. 2000.Influence of malathion on detoxification enzymes of Locusta migratoria manilensis Meyen. Journal of Environmental Entomology,35(2):165-170[in Chinese]).(  1) 1)
|
| [27] |
周婷,姚军,王强,等. 2004.微孢子虫和狄斯瓦螨分别侵染后的意蜂血淋巴蛋白质含量变化.昆虫学报,47(4):530-533. (Zhou T, Yao J, Wang Q, et al. 2000.Changes in content of hemolymph protein in the honeybee (Apis mellifera L.) workers infected by Nosema apis and Varroa destructor respectively. Acta Entomologica Sinica,47(4):530-533[in Chinese]).(  1) 1)
|
| [28] |
Brar S K, Verma M, Tyagi R D, et al. 2007. Bacillus thuringiensis proteases:production and role in growth, sporulation and synergism. Process Biochemistry, 42(5):773-790.( 1) 1)
|
| [29] |
Bradford M M.1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding. Anal Biochem, 72:248-254.( 1) 1)
|
| [30] |
Hilder V A, Gatehouse A M, Sheeman S E. 1987. A novel mechanism of insect resistance engineered into tobacco. Nature, 330:160-163.( 1) 1)
|
| [31] |
Oppert B, Kramer K J, Johnson D, et al. 1996. Luminal proteinases from Plodia interpunctella and the hydrolysis of Bacillus thuringiensis CrylA(c) protoxin. Insect Biochem Mol Biol, 26(6):571-583.( 1) 1)
|
 2015, Vol. 51
2015, Vol. 51
