文章信息
- 程子彰, 贺靖舒, 占明明, 黄乾明, 苏光灿, 胡伟, 陈华萍
- Cheng Zizhang, He Jingshu, Zhan Mingming, Huang Qianming, Su Guangcan, Hu wei, Chen Huaping
- 油橄榄果生长与成熟过程中油脂的合成
- Synthesis of Olive Oil during Olive Development and Ripening
- 林业科学, 2014, 50(5): 123-131
- Scientia Silvae Sinicae, 2014, 50(5): 123-131.
- DOI: 10.11707/j.1001-7488.20140516
-
文章历史
- 收稿日期:2012-12-07
- 修回日期:2014-03-11
-
作者相关文章
2. 四川农业大学风景园林学院 成都 611130;
3. 四川省凉山州中泽新技术开发有限责任公司 西昌 615000
2. College of Landscape Architecture, Sichuan Agricultural University Chengdu 611130;
3. Sichuan Liangshan New Technology Development Co., Ltd Xichang 615000
油橄榄(Olea europaea)是世界著名的四大木本食用油料经济树种之一,为木犀科(Oleaceae)木犀榄属亚热带常绿乔木,主要分布于地中海沿岸,距今已有4 000多年的栽培历史(Riley,2002)。自20世纪60年代,我国开始引种油橄榄,主要种植于甘肃、四川、云南等地区,目前种植面积已达5.3万hm2(邓明全等,2011)。与其他油料植物相比,油橄榄果中除油脂含量丰富、单不饱和脂肪酸(主要为油酸)含量高外,而且ω-3脂肪酸和ω-6脂肪酸组成比率与人乳极其相似为1∶4,极易被人体吸收(Nelson et al.,2011;李聚桢,2010;Servili,2009)。此外研究还显示,油橄榄果中还含有角鲨烯、橄榄多酚等多种有益生物活性物质,具有预防心血管疾病、增强人体免疫力、防癌、延缓衰老等功效(Gromadzka et al.,2011;Justynay et al.,2011;邓斌等,2011;Servili et al.,2009),具有巨大的营养价值,近年来人们对橄榄油需求越来越大。
近年来,国外研究人员对油橄榄果生长成熟过程中油脂的合成过程进行研究,但国内未见相关报道。有研究表明,油橄榄果在不同生长发育阶段油脂的合成呈现显著差别(Piravi-vanak et al.,2012;刘泉,2012;Connor et al.,2005;Carlos et al.,2008),油橄榄果收获的时间将直接影响橄榄油的产量、质量、风味和稳定性(Dag et al.,2011;Issaoui et al.,2011;Ayton et al.,2001)。在实际生产过程中油橄榄的最佳采收时间因各地环境、气候、地理位置等条件的不同而难于确定,而且产量不高(李聚桢,2010;Carlos et al.,2008)。本文从油橄榄果生长发育过程中果实的生理生化变化、脂肪酸及三酰基甘油(Triacylglycerol,TAG)合成等方面进行综述,并探讨油橄榄果中独特脂肪酸组成的原因以及不同生长发育时期油橄榄果中油脂的合成情况,为确定油橄榄果的最佳收获时期和从遗传上对油橄榄在生化、营养上进行定向改造提供理论基础,提高经济效益。
1 油橄榄果的生长与发育过程 1.1 油橄榄果从植物学角度,油橄榄果属于核果,果实中含有坚硬的果核; 由外果皮(exocarp)、中果皮(mesocarp)、内果皮(endocarp)、种子组成(图 1)。其中中果皮(果肉)占果实总质量的70%~90%,内果皮(即果核但不包括核仁)占果实总质量的9%~27%,种子(即核仁)占果实总质量的2%~3%(Carlos et al.,2008)。
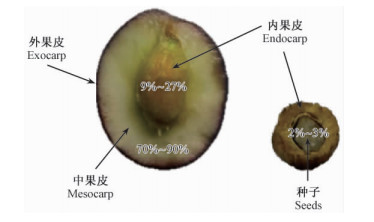 |
图 1 油橄榄果结构
Fig. 1 The structure of olive fruit
|
一般在作为油用采收时,油橄榄果实中含油率约为20%,此时中果皮的含水率约为60%、含油率约为30%、含糖4%、含蛋白3%、剩余其他多为纤维等; 内果皮水含量约为10%、含纤维素30%、含油1%; 而种子中含水30%、含油27%、含碳水化合物27%、含蛋白10%(Connor et al.,2005)。这表明在油橄榄果中的油脂主要集中在中果皮中。该时期整个油橄榄果实中油脂组成为: 油酸含量最高(55.0%~83.0%),其次是棕榈酸(7.5%~20.0%)、亚油酸(3.5%~21.0%)、硬脂酸(0.5%~5.0%)、亚麻酸(0.5%~3.0%)、棕榈油酸(0.3%~3.5 %)、花生酸(0.3%~0.6 %)、角鲨烯(0.13%~0.78%)和二十碳烯酸(0.2%~0.4%)(李聚桢,2010)。
1.2 油橄榄果的生长与成熟油橄榄从子房发育为成熟果实的整个过程持续约5个月,而随着油橄榄果的生长成熟,果实内部组成的变化会直接体现在其颜色、硬度等外观改变上(Lavee,1996)。根据整个生长发育过程中果实生理机构的变化可将其分为受精和坐果、种子的生长、果核的变硬、中果皮的生长、果实的成熟5个阶段(程子彰,2013; Lavee,1996; Manrique et al.,1999; Proietti et al.,1999)(图 2)。
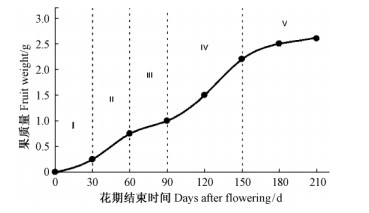 |
图 2 油橄榄果生长发育过程中的不同阶段
Fig. 2 Growth and development stages of olive fruits (Lavee,1996)
阶段Ⅰ Stage Ⅰ:受精和坐果Fertilization and fruit set; 阶段Ⅱ Stage Ⅱ: 种子生长Seed development;
阶段Ⅲ Stage Ⅲ:种子/果核变硬Seed/pit hardening;
阶段Ⅳ Stage Ⅳ: 中果皮的生长Monocarp development;
阶段Ⅴ Stage Ⅴ: 成熟Ripening. |
受精和坐果阶段是指油橄榄花受粉后的0~30天,在该阶段子房细胞快速分裂,受精卵发育成胚并迅速长大,最终形成早期的果实。种子生长阶段(30~60天),作为油橄榄果发育的第1个快速增长时期,期间种子形成并迅速增大,中果皮生长缓慢,果实中糖类被大量积累,是脂肪合成的准备阶段。果核变硬阶段(60~90天),在此期间,内果皮细胞中木质素迅速积累并逐渐停止分裂使果核变硬,该过程中中果皮细胞虽分裂迅速,但由于细胞并不长大,因此该阶段整个果实大小变化不大。中果皮生长阶段(90~150天)是油橄榄果发育过程中第2个快速生长时期,持续约60天,该阶段中果实中原有果皮细胞迅速膨大,油脂进一步被合成、积累和储藏,果实质量迅速增大。成熟阶段(150~210天),在该阶段中,油橄榄果中油脂的含量逐渐达到最大,果实逐渐从暗灰绿色变成浅绿色并最终变成紫色或黑色; 期间中果皮由硬变软,脂肪酸合成逐渐停止,果实中水分逐渐减少并最终变干并从树上掉落(Lavee,1996; Carlos et al.,2008)。上述油橄榄果在不同生长阶段的生理生化变化表明,在不同生长阶段,果实中所进行的物质代谢有着明显的不同。
2 油橄榄果中油脂的合成油橄榄果实生长发育过程中,油脂的合成、积累与其他油料植物一样,只有在果实生长到一定程度后才开始迅速大量积累油脂(图 3)。在油橄榄果实生长前期(花期结束后0~60天),油脂合成较少,维持在本底水平(含量7 <3%),该时期果实生长旺盛,并形成完整的果实结构,同时糖类物质被大量积累,为后续果实中油脂提供物质基础,是油脂合成的准备时期、动员时期; 当进入果核变硬阶段(花期结束后60天左右),油橄榄果实中脂肪大量合成,之后随着果实的长大成熟,油脂含量逐渐增高,当果实成熟时达到最高; 其中花期结束后60~150天是油脂的主要积累时期(Migliorini et al.,2011; 刘泉,2012)。
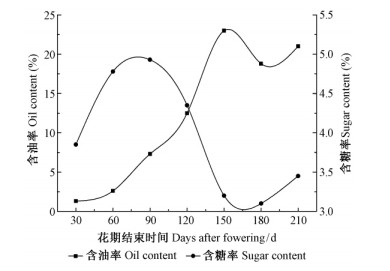 |
图 3 油橄榄果实生长、成熟过程中油脂、糖含量的变化
Fig. 3 The oil and sugar content of fruit during olive development
and ripening (Migliorini et al.,2011)
|
植物细胞需要糖来合成脂肪。在植物细胞中,乙酰-CoA(Acetyl coenzyme A)作为脂肪酸合成的起始底物,所有脂肪酸的碳骨架均来自于它,而合成乙酰-CoA的底物则是来自糖类糖酵解途径的丙酮酸。在细胞质中糖酵解生成的丙酮酸被转运到质体中,然后在质体中被丙酮酸脱氢酶复合物催化生成乙酰-CoA(Harwood et al.,2000); 或在叶绿体中,被水解成乙酸然后转移到质体中,在乙酰-CoA合成酶作用下产生乙酰-CoA(Sánchez et al.,2002)。然后乙酰-CoA在一系列酶催化下合成脂肪酸。
油橄榄果中生长发育过程中糖的积累主要发生在油橄榄花期结束后的0~60天,该时期油橄榄果实中糖含量迅速增大,为后续果实中油脂的迅速积累提供重要物质基础,是油橄榄果实油脂合成的初始期时期(图 3)。大量研究结果表明:在油橄榄果生长发育过程中糖的来源主要有2部分: 由果实自身光合作用产生以及通过韧皮部的糖转运从邻近成熟叶片转移而来。其中,后者是果实中糖的主要来源途径(Carlos et al.,2008)。在油橄榄果生长发育过程中,果实会在相当长的一段时间里保持绿色,并在成熟变色后保持叶绿素活性,并进行光合作用,表明油橄榄果自身可进行光合作用合成糖。此外Sánchez(1995)研究发现,进行遮光处理的油橄榄果实呈黄色,与正常生长的果实相比其含油率、油质明显降低,这表明油橄榄果实的光合作用对中果皮的生长和脂肪酸的合成密切相关,具有促进作用。但研究显示,油橄榄果自身光合作用产生的糖远远不能满足其自身的生长和脂肪酸的合成,这在油橄榄生长早期阶段尤为明显(Carlos et al.,2008)。因此,油橄榄果实还需要从邻近其他部位转运糖来供给自身的生长、发育。通过对叶片中14CO2的脉冲追踪和韧皮部分泌物的检测进行研究使其得到证实(Zimmermann et al.,1975; Gucci et al.,1998)。该研究的结果显示:在叶片中合成的糖类在一系列载体和酶作用下经共质体途径从韧皮部被转移到果实中,而被转运的糖类同化物则主要是棉籽糖家族的寡聚糖和蔗糖以及一些甘露糖。在油橄榄果实整个生长发育过程中,邻近其他部位糖的持续转移,为果实的生长及果实中油脂的持续合成提供重要保障。
2.2 脂肪酸的合成油脂主要由2部分组成: 脂肪酸和甘油,因此在油橄榄果中油脂的合成分为2部分,即脂肪酸和酰基甘油的合成。脂肪酸作为生物油脂重要组成部分,与其他植物一样油橄榄果中脂肪酸的合成主要发生在质体(plastid,如叶绿体等)中,在一系列酶的作用下,通过一系列的重复反应使乙酰-CoA的乙酰基部分结合到酰基载体蛋白(acyl carrier protein,ACP)上,直到C16或C18酰基化合物形成(Stoops et al.,1975)。
脂肪合成酶体系中,乙酰-CoA羧化酶(Acetyl-CoA carboxylase,ACCase)和磷脂酸磷酸化酶(Phosphatide phosphatase,PPase)作为2个关键酶,其活性直接影响着果实中脂肪酸和三酰基甘油的合成速度。刘泉(2012)对油橄榄果实生长发育过程中ACCase和PPase的活性研究发现(图 4),脂肪酸的合成几乎发生在油橄榄果实的整个发育过程中,但在生长前期(花期结束后0~60天)由于ACCase,PPase等活性较低,因此脂肪酸的合成维持在本底水平,但之后随着果实的长大其活性逐渐增强,并在花期结束后90~150天期间达到最大值,是油脂合成的最旺盛时期; 当果实完全成熟时其活性迅速降低,油脂合成速度迅速降低,此时含油率达到最大。同时整个过程中ACCase始终比PPase活性小,这就使得油橄榄果中脂肪酸合成速度始终低于甘油三脂的合成速度,保证果实中游离脂肪酸始终维持在较低水平。此外,Sánche等(1992)以放射性标记的丙二酰-ACP(malonyl-ACP)为底物观察了其在油橄榄果肉(中果皮生长阶段)水溶性组分中(含脂肪酸合酶复合物)的变化情况,结果在该体系中检测到大量含有8~18个碳原子的饱和脂肪酸,表明油橄榄果实中脂肪酸合成主要集中在中果皮生长阶段(花期结束后90~150天)。
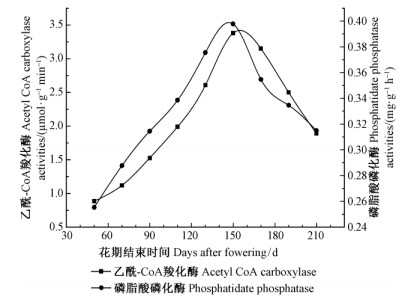 |
图 4 油橄榄果实生长、成熟过程中ACCase
和PPase活性的变化
Fig. 4 The ACCase and PPase content activity of fruit
during olive development and ripening
|
在油橄榄果实中,脂肪酸的合成起始于HCO3-在ACCase催化下形成丙二酰-CoA(Sánchez et al.,2002)。其中,ACCase作为脂肪酸合成途径的一种重要调节蛋白,调节着整个脂肪酸合成途径的速率。ACCase是一种由4个亚基异聚复合形成的依赖于生物素辅基的分子量超过650 kDa的复合蛋白。包含生物素载体蛋白(biotin carboxylase carrier protein,BCCP)、生物素羧化酶(biotin carboxylase)以及由α,β亚基组成的羧基转移酶(carboxyl transferase)3个不同区域(Carlos et al.,2008; Li et al.,2008)。
丙二酰-CoA的合成作为脂肪酸合成反应的第一步反应,首先在ATP提供能量(1ATP)生物素羧化酶作用下,HCO3-与BCCP生物素环上的N原子结合; 然后在羧基转移酶作用下,乙酰-CoA进攻BCCP上韧性的生物素臂,使激活的CO2基团并使其从生物素上转移到乙酰-CoA上,最终形成丙二酰-CoA(Knowles,1989; Sánchez et al.,2002)(图 5)。随后丙二酰-CoA在酰基载体蛋白转移酶(ACP transferase)催化下被转移到酰基载体蛋白上,然后在脂肪酸合酶复合物(Fat acid synthase,FAS)催化下通过一系列反应从丙二酰-ACP和乙酰-CoA开始脂肪酸的延伸(图 6)。
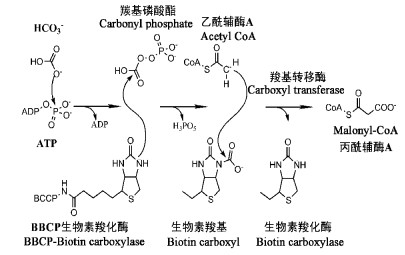 |
图 5 脂肪酸合成过程中丙二酰-CoA的合成
Fig. 5 The synthesis of malonyl-CoA in the fat acid synthesis pathway
|
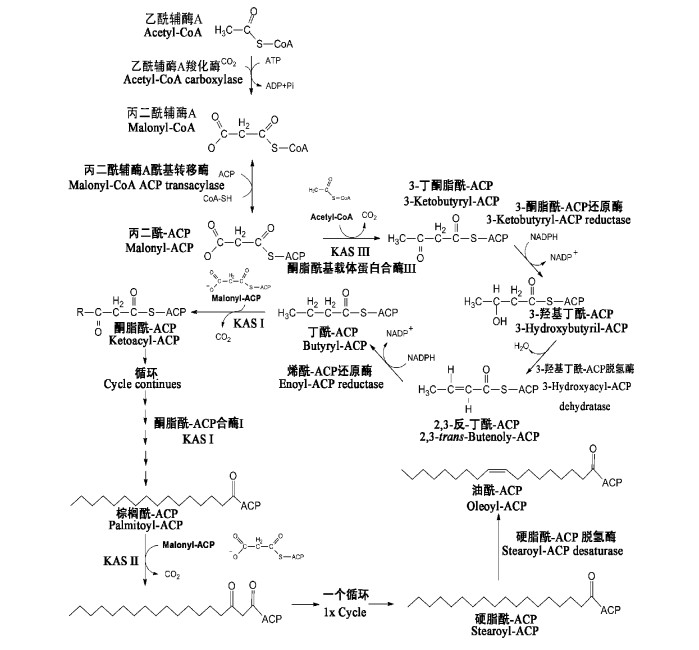 |
图 6 油橄榄果实中脂肪酸的合成
Fig. 6
The synthesis of fat acid in olive fruit(Sánchez et al.,2002; Carlos et al.,2008)
|
脂肪酸的整个合成途径如图 6。在质体中,丙二酰-CoA合成后在丙二酰-CoA酰基转移酶(Malonyl-CoA ACP transferase)作用下催化形成丙二酰-ACP,然后与乙酰-CoA在酮脂酰- ACP合酶III(Ketoacyl-ACP synthase III,KAS III)催化下,丙二酰-ACP中的C2进攻乙酰-CoA的C1反应缩合形成增加2个了C的3-丁酮脂酰-ACP(3-ketoacyl-ACP); 接着3-酮脂酰-ACP在3-酮脂酰-ACP还原酶(3-ketoacyl-ACP reductase)的催化下被还原型辅酶II(Nicotinamide-adenine dinucleotide phosphate,NADPH)还原成3-羟基丁酰-ACP(3-hydroxybutyril-ACP),再在3-羟基丁酰-ACP脱氢酶(3-hydroxyactyl-ACP dehydratase)作用下脱水形成2,3-反-丁酰-ACP(2,3-tanse butenoly- ACP); 而形成的2,3-反-丁酰-ACP紧接着在烯酰-ACP还原酶(enoyl-ACP reductase)作用下被NADPH还原成丁酰-ACP(butyryl-ACP); 最后丁酰-ACP在酮脂酰-ACP合酶I(KAS I)催化下与丙二酰-CoA缩合生成增加2个C的3-己酮脂酰-ACP,到此完成一个增加2个C的乙酰化循环然后再进入下一个循环(Stoops et al.,2002; Joshi et al.,1998; Sánchez et al.,2002)。
在植物体中,棕榈酸合成需7个循环完成,而硬脂酸合成则需8个循环(图 6)。其中,硬脂酸在进行第7个循环生成棕榈酰-ACP后,棕榈酰-ACP与丙二酰-ACP的缩合反应由KAS II催化并形成3-棕榈酮脂酰-ACP(palmitoyl-ACP),再经过一个循环后生成硬脂酰-ACP(stearoyl-ACP)(Harwood,1996)。
2.2.3 油酸、亚油酸及其他高级脂肪酸的形成油橄榄果实生长过程中鲜果油中各脂肪酸含量合成转化过程如图 7。在油橄榄果实中,棕榈酰-ACP(palmitoyl-ACP)被合成后,会被分别转化成少量棕榈油酰-ACP(palmitoleoyl-ACP)和大量硬脂酰-ACP(stearoyl-ACP); 然后产生的硬脂酰-ACP又被大量转化成油酰-ACP(oleoyl-ACP); 接着部分油酰-ACP在相应酶的作用下又被转成亚油酰-ACP(linoleoyl-ACP)和二十碳烯酰-ACP(eicosenoyl-ACP); 产生的亚油酰-ACP和二十碳烯酰-ACP在酶的作用下又分别转化成亚麻酰-ACP(linolenoyl-ACP)和花生酰-ACP(arachidoyl-ACP)(程子彰,2013)。在油橄榄整个脂肪酸合成过程中上述反应将会持续进行,并随着果实的生长、发育果实中各脂肪酸含量在不断增大,但在果实油脂中的脂肪酸组成变化并不大,研究发现这与果实中和成TAG相关酶的特异性密切相关。
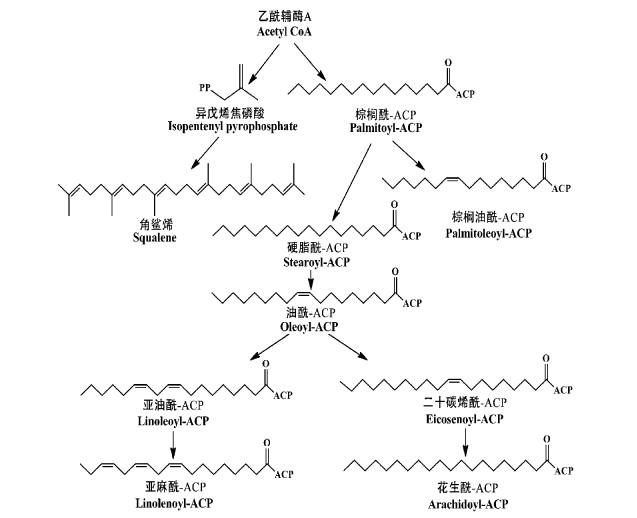 |
图 7 油橄榄果实生长、成熟过程中果实中脂肪酸的合成
Fig. 7 The biosynthesis of fatty acid in fruit during olive development ripening
|
油酸和亚油酸分别作为橄榄油中含量最丰富、最重要的脂肪酸,近年来对其研究较多。研究结果显示,油酸是在硬脂酰-ACP-Δ9-脱氢酶(stearoyl-ACP desaturase)的催化下由硬脂酰-ACP的第9位C-C键脱氢形成,目前在油橄榄果中该酶基因已被成功克隆表达(Padilla et al.,2012; Haralampidis et al.,1998)。研究发现该酶基因的表达不但具有实时、短暂的特点而且是严格受生长调控的。在中果皮细胞中该基因的表达从开花后的13—16周(中果皮生长阶段)以相同水平持续表达; 之后随着果实的继续生长,该酶的转录会积累到非常高的水平,而这种高的转录水平会持续到开花后28周(油橄榄果成熟阶段),这说明在成熟阶段油橄榄果中油酸的合成仍会持续进行(Haralampidis et al.,1998)。
亚油酸(C18:2)作为植物油中最丰富的多不饱和脂肪酸,是人体所需的必需脂肪酸。在油橄榄果中,形成于内质网上,被磷脂酰胆碱酯化的油酸酰基结构在特定油酸去饱和酶的催化下脱氢形成(Carlos et al.,2008)。
2.2.4 脂肪酸合成的终止乙酰C的延伸至C16或C18时延伸反应终止,形成的脂肪酰-ACP有2个去处: 其一,在ACP硫酯酶催化下水解并形成游离的脂肪酸和ACP,然后用于脂质体的合成,通常这一途径被称为脂质体的原生途径(prokaryotic pathway); 其二,在质体中,在脂酰基转移酶作用下被转移到甘油基团上直接用于形成酰基甘油(即油脂)。研究结果显示,在油橄榄果中含有2种乙酰-ACP硫酯酶: Fat A(主要),主要催化水解油酰-ACP; Fat B(微量),主要水解棕榈酰-ACP、其他短链酰基-ACP和饱和酰基-ACP(Harwood,1996)。
2.3 TAG的合成脂肪酸合成后需要与甘油结合才能形成TAG(即油脂)。同样,在油橄榄果中形成的油酸和棕榈酸需要进一步与甘油酯化。Sánchez等(1992)利用生长中的油橄榄果肉的微粒体组分对整个酰基甘油的合成进行了研究。在油橄榄果细胞质体中脂肪酰-ACP合成后会首先在叶绿体上被锁定到辅酶A上,并与其一起转移到细胞质中的内质网(endoplasmic reticulum,ER)上,然后作为脂酰基来源参与TAG的合成。此外,Rutter等(1997)采用同位素示踪法对油橄榄果肉培养组织进行研究还发现,酰基-CoA(Acyl-CoA)组装成TAG似乎还与磷脂酰胆碱(卵磷脂)的初始形成有关。
TAG的合成从质体中甘油醛-3-磷酸(Glycerol-3-phosphate,G3P,图 8)和脂肪酸的形成开始,包括4个系列的反应,分别从Sn1,Sn2,Sn3位形成酯键。
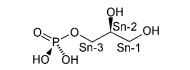 |
图 8 甘油醛-3-磷酸结构
Fig. 8 The structure of glycerol-3-phosphate
|
首先,2个脂肪酰基-CoA分别先后在G3P酰基转移酶(G3P acyltransferase,G3PAT)和溶血磷脂酰基转移酶(lysophosphatidate acyltransferase,LPAAT)催化下,转移到G3P的Sn1和Sn2位上形成磷脂酸(phosphatidic acid,同时也是阴离子磷酸酯合成支路)。形成的磷脂酸在特定的磷脂酸去磷酸化酶(phosphatidate phosphohydrolase)作用下,磷脂酸脱脱去磷酸基团并形成二酰基甘油(diacylglycerol,DAG),研究显示该反应也是两性磷脂合成重要支路。最后,DAG在二酰基甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)催化下与第3个脂酰基辅酶A作用并最终形成DAG(Sánchez et al.,2002)(图 9)。
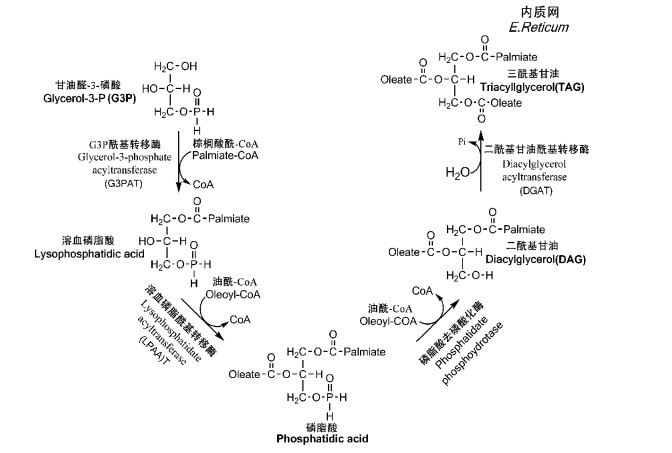 |
图 9 油橄榄果实中油脂的合成
Fig. 9 The synthesis of oil in olive fruit (Carlos et al., 2008)
|
在TAG合成过程中,脂酰基转移酶的特异性决定了最终得到的TAG的特异性,因此也决定了一个特定的植物油的质量。大量研究表明,在植物体中G3PAT对棕榈酸酰-CoA具有很大的偏好性,虽其也可催化其他脂酰基-CoA与G3P作用; 然而Santinelli等(1992)对特级初榨橄榄油进行立体分析显示,在油橄榄果中TAG中Sn-1位却富含亚油酸,这表明在油橄榄果中,G3PAT的作用可能与其他植物存在明显不同,而是更偏好于催化油酰-CoA进入Sn-1位,但目前似乎仍没有编码该酶基因的相关研究报道。在酰基甘油合成过程中,催化Sn-2酯化的LPAAT对不饱和酰基CoA有非常强的选择性,而对饱和酰基CoA没有活性,这也是橄榄油等植物油中的Sn-2位没有饱和脂肪酸的原因(Xu et al.,2006; Stålberg,2009)。DAG中Sn-3位的酰基化在DAGAT作用下催化完成,研究表明该酶作为一种非特异性酰基转移酶可催化多种脂酰基CoA与DAG酯化(Harwood et al.,1994),因此TAG Sn-3位的脂肪酸组成也反映其合成环境中脂酰基CoA的组成。橄榄油脂肪酸组成的分析数据显示,橄榄油中DAG Sn-3位的脂肪酸多为油酸,这表明在油橄榄果中TAG的合成环境中油酸酰-CoA的含量较高(Sánchez et al.,2002)。
所以,在油橄榄果实生长、成熟过程中合成脂肪酸、TAG相关酶的活性决定植物油的质量。如质体中,某种脂肪酸的合成酶受到影响,在肯尼迪途径中TAG合成时其相应的脂酰基-CoA的比例则会大大降低,在酰基转移酶的催化下该脂肪酸进入相应位置的几率也大大降低。但也正因如此,人们可以直接从生物、化学和营养等角度出发通过遗传操作对植物油脂的质量进行定向改变。
3 油橄榄果采收时间的确定随着油橄榄果的长大、成熟,果实中油脂不断积累,并在成熟期达到最大,似乎整个成熟期都可作为油橄榄果实的最佳采收时期,成熟阶段将持续60天(花期结束后150~210天),该时期内不但果实在形态外观和质地上会发生明显的变化(图 10)而且果实中多酚、黄酮等生物活性物质含量会显著改变(Carlos et al.,2008)。在油橄榄果实中果皮生长阶段后期(图 10A中成熟度为2~3,图 10B中10月底),是干物质和油脂合成积累末期,该阶段积累速度虽较慢,但在果实中的饱和脂肪酸与单不饱和脂肪酸的组成比例平衡,同时该阶段果实中酚类物质和维生素含量最丰富,因此无论是从营养、氧化稳定性还是抗自由基能力的角度来看,其价值最高(程子彰,2013; Rotondi et al.,2004)。而当果实完全成熟,果肉变紫或变黑时(图 10A中成熟度为6~7,图 10B中11月中下旬),果实中酚类物质明显降低,油酸继续合成使得油酸和亚油酸的比率改变,同时还伴随着香味、苦味、辣味等风味的改变,导致油质变差(Rotondi et al.,2004)。因此,油橄榄果的采收应在完全成熟前即果实刚开始变色时(成熟度为2~3时)进行为最佳。
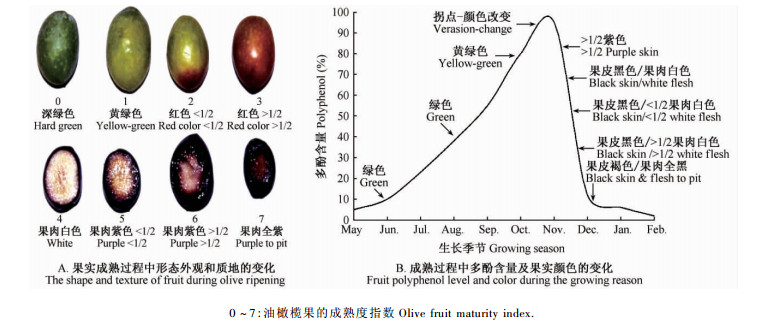 |
图 10 果实成熟过程中形态外观、质地和多酚含量的变化
Fig. 10 The shape, texture and polyphend level of fruit during olive ripening
( Vossen, 1998)
|
油橄榄果实中脂肪酸的合成起始于在果核变硬阶段(花期结束后60天),并随着果实的长大、成熟持续合成,整个过程中脂肪酸的大量合成主要集中在花期结束后的90~150天(中果皮生长阶段)。在中果皮生长阶段,油橄榄果中油脂的合成最旺盛,果实迅速变大,质量增加,因此应避免在该阶段采果; 而当果实进入成熟阶段,果实开始从绿色逐渐变成紫色或黑色,脂肪酸合成逐渐停止,酚类物质明显降低,油质变差。因此油用油橄榄果实的采收应选择在中果皮生长阶段结束到成熟阶段开始之间 (即果实开始变成紫色)。
在油橄榄果实生长、成熟过程中合成脂肪酸、TAG相关酶的活性决定植物油的质量。在果实生长发育过程中中果皮细胞中硬脂酰-ACP-Δ9-脱氢酶的持续大量表达,使前期积累的大量硬脂酸脱氢生成油酸,是油橄榄果中单不饱和脂肪酸含量高的主要原因; TAG合成过程中G3PAT和LPAAT对脂肪酰-CoA 的特异性是橄榄果中独特的脂肪酸组成的直接原因。这为从遗传上对油橄榄在生化、营养上进行定向改造提供重要的理论基础。
目前,虽对橄榄果生长、成熟过程中油脂合成的相关代谢有较为深入的研究,但关于油脂合成过程中相关酶系统的研究较少,对编码这些酶的基因、结构及其表达调控方式(如中果皮生长阶段硬脂酰-ACP-Δ9-脱氢酶为何会持续大量表达等)仍不清楚,需要进行全方位的研究和探讨。
| [1] |
程子彰.2013.西昌引种油橄榄生物学特性研究.雅安:四川农业大学硕士学位论文,36-54.( 3) 3)
|
| [2] |
邓斌,张伟,惠菊,等.2011.橄榄油中极性伴随物研究状况.中国油脂,36(4): 35-39.( 1) 1)
|
| [3] |
邓明全,俞宁.2011.油橄榄引种栽培技术.北京:中国农业出版社.( 1) 1)
|
| [4] |
李聚桢.2010.中国引种发展油橄榄回顾及展望.北京:中国林业出版社.( 3) 3)
|
| [5] |
刘泉.2012.引进油橄榄果肉油脂积累规律及相关合成酶活性的研究.雅安:四川农业大学硕士学位论文,20-38.( 3) 3)
|
| [6] |
Ayton J,Mailer R J,Robards K.2001.Changes in oil content and composition of developing olives in a selection of Australian cultivars.Australian Journal of Experimental Agriculture,41(6): 815-821.( 1) 1)
|
| [7] |
Carlos C,Serge D,Hernáni G.2008.Physiological,biochemical and molecular changes occurring during olive development and ripening.Journal of Plant Physiology,165(2): 1545-1562( 11) 11)
|
| [8] |
Connor D J,Fereres E.2005.The physiology of adaptation and yield expression in olive.Horticulture Review,31(34): 155-229.( 2) 2)
|
| [9] |
Dag A,Kerem Z,Yogev N,et al. 2011.Influence of time of harvest and maturity index on olive oil yield and quality.Sciatica Horticulturae,127(3): 358-366.( 1) 1)
|
| [10] |
Gromadzka J,Wardencki W.2011.Trends in edible vegetable oils analysis.Part A.Determination of different components of edible oils-a review.Polish Journal of Food and Nutrition Sciences,61(1): 33-43.( 1) 1)
|
| [11] |
Gucci R,Moing A,Gravano E,et al. 1998.Partitioning of photosynthetic carbohydrates in leaves of salt stressed olive plants.Australian Journal of Plant Physiology,25(5): 571-579.( 1) 1)
|
| [12] |
Haralampidis K,Milioni D,Snchez J,et al. 1998.Temporal and transient expression of stearoyl-ACP carrier protein desaturase gene during olive fruit development.Journal of Experimental Botany,49(327): 1661-1669.( 2) 2)
|
| [13] |
Harwood J L.1996.Recent advances in the biosynthesis of plant fatty acids.Biochimeca et Biophysica Acta,1301(1/2): 147-156.( 2) 2)
|
| [14] |
Harwood J L,Page R A.1994.Biochemistry of oil synthesis//Murphy D J.Designer oil crops.Weinheim: VCH,165-194.( 1) 1)
|
| [15] |
Harwood J L,Sánchez J.2000.Lipid biosyn thesis in olives//Harwood J L,Aparicio R.Handbook of olive oil.Gaithersburg,MD: Aspen Publishers Inc,61-67.( 1) 1)
|
| [16] |
Issaoui M,Dabbou S,Mechri B,et al. 2011.Fatty acid profile,sugar composition,and antioxidant compounds of table olives as affected by different treatments.European Food Research and Technology,232(5): 867-876.( 1) 1)
|
| [17] |
Joshi A K,Rangan V S,Smith S.1998.Differential affinity labeling of the two subunits of the homodimeric animal fatty acid synthase allows isolation of heterodimers consisting of subunits that have been independently modified.Journal of Biological Chemistry,273(9): 4937-4943 ( 1) 1)
|
| [18] |
Justynay G,Waldemar W.2011.Trends in edible vegetable oils analysis.Part A.determination of different components of edible oils.Polish Journal of Food and Nutrition Sciences,61(1): 33-43.( 1) 1)
|
| [19] |
Knowles J R.1989.The mechanism of biotin-dependent enzymes.Annual Review of Biochemistry,58: 195-221.( 1) 1)
|
| [20] |
Lavee S.1996.Biology and physiology of the olive//World olive encyclopaedia.Madrid: IOOC.( 4) 4)
|
| [21] |
Li Q,Bai H,Fan P.2008.Analysis of acyl-coenzyme A: cholesterol acyltransferase 1 polymorphism in patients with endogenous hypertriglyceridemia in Chinese population.Chin Med Genet,25(2): 206-210.( 1) 1)
|
| [22] |
Manrique T,Rapoport H F,Castro J,et al. 1999.Mesocarp cell division and expansion in the growth of olive fruits.Acta Horticulturae,474: 301-304.( 1) 1)
|
| [23] |
Migliorini M,Cherubini C,Mugelli M,et al. 2011.Relationship between the oil and sugar content in olive oil fruits from Moraiolo and Leccino cultivars during ripening.Sciatica Horticulturae,129(4): 919-921.( 2) 2)
|
| [24] |
Nelson T L,Hokanson J E,Hickey M S.2011.Omega-3 fatty acids and lipoprotein associated phospholipase A(2)in healthy older adult males and females.European Journal of Nutrition,50(3): 185-193.( 1) 1)
|
| [25] |
Padilla M N,Hernandez M L,Sanz C,et al. 2012.Molecular cloning,functional characterization and transcriptional regulation of a 9-lipoxygenase gene from olive.Phytochemistry,74(18): 58-68.( 1) 1)
|
| [26] |
Piravi-Vanak Z,Ghasemi J,Ghavami M,et al. 2012.The Influence of growing region on fatty acids and sterol composition of iranian olive oils by unsupervised clustering methods.Journal of the American Oil Chemists' Society,89(3): 371-378.( 1) 1)
|
| [27] |
Proietti P,Famiani F,Tombesi A.1999.Gas exchange in olive fruit.Photosynthetica,36(3): 423-432.( 1) 1)
|
| [28] |
Riley F R.2002.Olive oil production on Bronze Age crete: nutritional properties,processing methods,and storage life of Minoan olive oil.Oxfoed Journal of Archaeology,21(1): 63-75.( 1) 1)
|
| [29] |
Rotondi A,Bendini A,Cerratani L,et al. 2004.Effect of olive ripening degree on the oxidative stability and organoleptic proprieties of Cv Nostrana di Brisighella extra virgin olive oil.Journal of Agricultural and Food Chemistry,52(11): 3649-3654.( 2) 2)
|
| [30] |
Rutter A J,Sánchez J,Harwood J L.1997.Glycerolipid synthesis by microsomal fractions from Olea europaea fruits and tissue cultures.Phytochemistry,46(2): 265-272.( 1) 1)
|
| [31] |
Santinelli F,Damiani P,Christie W W.1992.The triacylglycerol's structure of olive oil determined by silver ion high performance liquid chromatography in combination with stereospecific analysis.Journal of the American Oil Chemists' Society,69(6): 552-556.( 1) 1)
|
| [32] |
Sánchez J,Cuvillo M T,Harwood J L.1992.Glycolipid biosynthesis by microsomal fractions from olive fruits.Phytochemistry,31(1): 129-134.( 1) 1)
|
| [33] |
Sánchez J,Harwood J L.1992.Fatty acid synthesis in soluble fractions from olive(Olea europaea)fruits.Journal of Plant Physiology,140(4): 129-134.( 1) 1)
|
| [34] |
Sánchez J,Harwood J L.2002.Biosynthesis of triacylglycerols and volatiles in olives.Eur J Lipid Sci Technol,104(9-10): 564-573.( 7) 7)
|
| [35] |
Sánchez J.1995.Olive oil biogenesis.Contribution of fruit photosynthesis//Kader J C,Mazliak P.Plant lipid metabolism.Dordrecht: Kluwer Academic Publications,564-566.( 1) 1)
|
| [36] |
Servili M,Esposto S,Fabiani R,et al. 2009.Phenolic compounds in olive oil: antioxidant,health and organoleptic activities according to their chemical structure.Inflammopharmacology,17(2): 76-84.( 2) 2)
|
| [37] |
Stålberg K,Sthl U,Stymne S,et al. 2009.Characterization of two Arabidopsis thaliana acyltransferases with preference for lysophosphatidylethanolamine.BMC Plant Biol,9(5): 60.( 1) 1)
|
| [38] |
Stoops J K,Arslanian M J,Oh Y H,et al. 1975.Presence of two polypeptide chains comprising fatty acid synthetase.Proc Natl Acad Sci USA,72(5): 1940-1944( 1) 1)
|
| [39] |
Vossen P.1998.Variety and maturity the two largest influences on olive oil quality.Project Report.Univ.California.Davis.http://cesonoma.ucdavis.edu/files/27177.pdf.( 1) 1)
|
| [40] |
Xu C,Yu B,Cornish A J,et al. 2006.Phosphatidylglycerol biosynthesis in chloroplasts of Arabidopsis mutants deficient in acyl-ACP glycerol-3-phosphate acyltransferase.Plant J,47(2): 296-309.( 1) 1)
|
| [41] |
Zimmermann M H,Ziegler H.1975.List of sugars and sugar alcohols in sieve-tube exudates//Zimmermann M H,Milburn J A.Encyclopedia of plant physiology,New Series.Berlin: Springer,480-505.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

