文章信息
- 潘文婷, 姚俊修, 李火根
- Pan Wenting, Yao Junxiu, Li Huogen
- 鹅掌楸属树种自交衰退的SSR分析
- Analysis of Selfing Depression in Liriodendron with SSR Markers
- 林业科学, 2014, 50(4): 32-38
- Scientia Silvae Sinicae, 2014, 50(4): 32-38.
- DOI: 10.11707/j.1001-7488.20140405
-
文章历史
- 收稿日期:2013-05-31
- 修回日期:2013-07-09
-
作者相关文章
2. 中国林业科学研究院亚热带林业实验中心分宜 336600
2. Subtropical Experimental Center, Chinese Academy of Forestry Fenyi 336600
大量研究证实,异交植物的近交导致后代纯合子比率增加,使隐性有害基因得以暴露,进而导致近交衰退(Geburek,1993;Dudash et al.,1997;陈小勇等,2002;王峥峰等,2007)。近交衰退主要表现在子代种子数量和质量下降、出苗率和存活率低以及个体生长发育不良等(Husband et al.,1996;Dudash et al.,1998;Mutikainen et al.,1998;Charlesworth et al.,2000;陈小勇等,1997)。近交使后代承受一定的遗传负荷(genetic load),因为近交使隐性致死基因(或有害基因)纯合的机率提高,且后代缺乏杂合子优势,势必在选择上处于劣势(张大勇,2004)。近交衰退对植物的进化有着直接的作用,是植物交配系统进化过程中的主要选择压(王峥峰等,2003)。近交衰退可出现在植物生长的各个阶段,但通常只有效应较大的有害等位基因才会在其生长的早期表现出来,而中等或危害较小的有害等位基因则在植物生长的后期才表现出来。且有研究表明,规模小、适应性低的种群更易发生近交衰退(Naito et al.,2005;Ishida,2006;Charlesworth et al.,2009;陈小勇,2000;王峥峰等,2005;王明庥,1989;王章荣,2005;刘祖洞,2000)。
大多数森林树种的交配系统主要为异交。异交使隐性有害基因得以杂合体的形式保持下来,从而不会被自然选择所淘汰。林木群体中蕴涵着大量的有害基因,即林木遗传负荷高,近交衰退严重。鹅掌楸属(Liriodendron)是珍贵用材和优良观赏兼用树种。由于人为破坏,加上生境的片段化,导致其种群个体数日益减少,已被列入我国二级珍稀濒危保护树种名录。鉴于鹅掌楸属种群规模小,近交机率高(Reed et al.,2003),而长期的异交使鹅掌楸属种群内积累了大量的隐性有害基因,这2方面的因素叠加起来,会导致鹅掌楸属存在严重的近交衰退风险。而自交衰退是近交衰退的典型例子,因此,开展鹅掌楸属树种自交衰退研究对于探索鹅掌楸属濒危机制及种质资源保育等方面具有理论与实践意义。
1 材料与方法 1.1 试验材料2006年5月,在江苏句容南京林业大学下蜀实习林场的鹅掌楸属种源试验林(李火根等,2005)内,选取鹅掌楸(Liriodendron chinense)1株(编号S)、北美鹅掌楸(L. tulipifera)4株(编号为B,L,M,N1)作为杂交亲本进行人工控制授粉。交配设计包含自交、种内杂交和种间杂交3种类型17个组合。自交组合5个: S×S,B×B,L×L,N1×N1,M×M;种内杂交组合4个: B×L,L×B,M×N1,N1×M;种间杂交组合8个: S×L,L×S,S×M,M×S,S×N1,N1×S,S×B,B×S。
同年10月采种,2007年2月在南京林业大学校园苗圃播种育苗,2008年3月在江苏句容南京林业大学下蜀实习林场营建子代测定林,试验设计为10株小区,3~4次重复,株行距4 m×4 m。2011年6月,采集以上17个组合幸存个体的DNA样品,各组合采样个体数见表 1。
|
|
基因组DNA的提取采用改进的CTAB裂解-硅珠吸附法(Rogers et al.,1985;张博等,2004),用1.0%琼脂糖凝胶检测DNA质量。SSR引物采用10 μL PCR反应体系(朱其卫等,2010)。
1.2.2 鹅掌楸属隐性致死候选基因相关联SSR位点筛选共采用576对SSR引物对17个鹅掌楸属交配组合(其中自交组合5个、种内杂交组合4个、种间杂交组合8个)子代进行PCR检测,筛选与隐性致死基因相关联的候选SSR位点。其中,176对SSR引物来自胥猛等(2008),另400对SSR引物来自Liang等(2011),为排除试验环节可能出现的误差,每一批样品重复3次。筛选原理如下:对于某一基因位点,如双亲基因型都为杂合子ab(SSR电泳图中为双带),正常情况下,其自交子代将出现3种基因型个体,分别为aa,ab和bb(SSR电泳图中为单带、双带和单带,即2种纯合基因型的单带都出现);如果存在隐性致死基因,则其子代就仅出现2种基因型个体,aa和ab,或者ab和bb(SSR电泳图中为单带和双带,或双带和单带,即在自交子代中,某一种纯合子始终没有出现)。
1.2.3 表型性状测定与统计分析2010年11月,对上述17个交配组合子代测量其4年生树高(H)、胸径(DBH),树高精确到1.0 cm、胸径精确到0.1 cm;并调查各组合的存活率。
1)方差v=Σ(x-$\bar{x}$)2/(n-1);标准差s=$\sqrt{\sum {{\left(x-\bar{x} \right)}^{2}}/\left(n-1 \right)}$。式中: x为子代的树高或胸径。
2)变异系数(CV)=$s/\bar{x}$×100%。
3)不同交配类型间及交配类型内不同组合间子代胸径与树高方差分析模型: yij=μ+Ti+T(C)j+εij。式中: yij表示在群体平均值的基础上第i个交配类型第j个交配组合表型值,μ表示群体平均值,Ti表示第i个交配类型效应,T(C)j表示第i个交配类型内第j个交配组合效应,εij表示随机误差。
4)自交衰退水平用δ表示,δ=1-ωs/ωo。式中: ωs和ωo分别为自交和异交后代的适合度。这里,适合度用树高、胸径和存活率度量。
采用SAS6.12,POPGENE3.2分别进行方差分析及相关性、纯合子比率和观测杂合度等的计算。
2 结果与分析 2.1 鹅掌楸属自交子代的衰退表现表 1列出了17个交配组合子代的生长量与存活率。从平均胸径生长量看,最大组合(L×B)是最小组合(B×B)的3.65倍;从平均树高生长量看,最大组合(S×B)是最小组合(B×B)的3.13倍;且变异系数波动也较大,可见各组合在幼林期生长量上存在明显的差异。从存活率看,最高组合(N1×S)是最低组合(N1×N1)的1.91倍。自交组合子代平均存活率为52.09%,种内杂交子代平均存活率为69.87%,种间杂交子代平均存活率为74.58%,分别高出自交子代1.34倍和1.43倍。
统计各交配类型的生长量与存活率(表 2),比较发现,自交子代表现出较强的生长衰退。与种内和种间交配组合子代相比,在胸径生长量上,自交组合子代的衰退程度δ分别为0.46和0.45;在树高生长量上,自交衰退程度δ分别为0.32和0.35;在存活率上,自交衰退程度δ分别为0.25和0.30。胸径生长量由小到大依次为:自交、种间杂交、种内杂交;树高生长量及存活率由小到大均为:自交、种内杂交、种间杂交。
|
|
从表 3可知,不同交配组合子代纯合子比率变异很大,最大M×M较最小S×M高出63.84%。自交的5个交配组合纯合子比率均值为76.82%,种内的4个交配组合纯合子比率均值为36.11%,种间的8个交配组合纯合子比率均值为24.54%。自交组合纯合子比率均值分别高出种内组合和种间组合1.13倍和2.13倍。
|
|
鹅掌楸属不同交配类型子代纯合子方差分析结果(表 4)表明,在3种交配类型间、各交配类型组合间以及不同位点间纯合子比例差异均达极显著水平。
|
|
表 5列出了对每一种交配类型进行方差分析的结果,结果表明,鹅掌楸属子代纯合子比例的显著程度在每种交配类型的2个变异来源中是不一致的。其中在自交交配类型和种内交配组合中,子代纯合子比率无论在各交配组合间还是不同位点间差异均未达到显著水平;而在种间交配类型中,不同交配组合间纯合子比例差异达到显著水平,不同位点间达到了极显著水平。
|
|
利用自交子代纯合子比率估算亲本杂合度。由表 6可知,北美鹅掌楸自交亲本杂合度平均值高出鹅掌楸自交亲本杂合度5.50%。
|
|
根据1.2.2说明的隐性致死基因筛选原理,从576个SSR位点中初步筛选出2个可能与隐性致死基因相关联的位点,分别为Lt337,Lt486。
图 1为隐性致死基因相关联的SSR位点Lt337的筛选结果。由图 1可知,除鹅掌楸S(aa)之外,其他4个亲本(北美鹅掌楸B,L,M,N1)全部为双带(ab),因此仅需对这4个亲本(B,L,M,N1)的自交子代进行检测。从图 1结果中可以看出,4个亲本(B,L,M和N1)的自交子代中均没有出现bb,而且,在这4个亲本的种内杂交子代也没出现bb。因此,可初步认为337号引物对应的bb(250—300 bp)位点很有可能与隐性致死基因相关联,即可初步认定该位点附近可能有1个隐性致死基因。
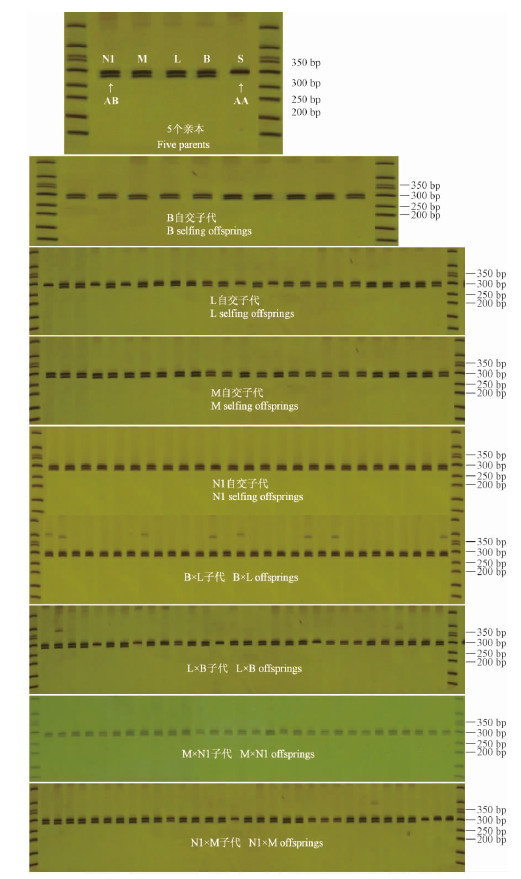 |
图 1 引物337扩增产物的PAGE电泳结果
Fig. 1 The PAGE electrophoresis result of primer 337
|
图 2为隐性致死基因相关联的SSR位点Lt486的筛选结果。由图 2可知,鹅掌楸S和北美鹅掌楸B与M是单带(bb),北美鹅掌楸L和N1是双带(ab),因此只需对这2个亲本(L和N1)的交配组合子代进行分析。在L自交和N1自交中都没出现aa条带。由此可见,Lt486引物对应的aa(250—300bp)位点很有可能与隐性致死有关,即该基因片段为候选的隐性致死基因。
 |
图 2 引物486扩增产物的PAGE电泳结果
Fig. 2 The PAGE electrophoresis results of primer 486
|
进一步对该2个SSR位点所对应的EST序列进行查找与比对,获得其碱基序列。然后利用Blast软件对这2个EST序列在GenBank中进行比对,均未发现有相似的同源序列。说明这2个基因座的功能目前尚不明确,今后需要深入研究。
3 讨论 3.1 林木自交衰退表现近交(自交)使隐性有害基因纯合的机率提高,遗传负荷大;且后代缺乏杂合子优势,势必在自然选择上处于劣势,呈现出近交衰退。一般地,常异花授粉植物如进行近交或自交,将导致后代种子数量少、受精率低、胚发育不良、发芽率低、畸形苗比率高、苗木夭折、抗性差等。可见,近交衰退表现形式多样,且在其生活史各个阶段均有可能表现出来(Husband et al.,1996)。Buza等(2000)对四倍体Swainsona recta的研究表明,近交衰退主要表现在种子萌发阶段,而生长后期性状(如根、茎质量等)并没有表现出明显的近交衰退。作者认为这有可能是由于早期种子萌发特性受少数基因控制,其隐性致死等位基因较容易表现出来;而后期生长性状受多基因控制,其近交衰退的表现依赖于多个效果微小的有害等位基因的积累。Fischer等(2003)的研究表明,通常,效应较大的有害等位基因会在植物生长的早期造成近交衰退,中等有害的等位基因会在植物生长的后期造成近交衰退。而Pic等(2003)对菊科(Compositae)植物Leontodon autumnalis的研究发现,其近交衰退发生在生活史的后期,早期的一些性状未受影响。
本文研究结果显示,无论是生长量还是存活率,鹅掌楸属树种均存在明显的自交衰退。这与朱其卫等(2010)、姚俊修等(2012)研究结论一致。这可以归因于鹅掌楸属的异交交配系统。长期异交必然在种内积累大量的遗传负荷(隐性有害基因),自交状况下隐性有害基因得以表达,进而表现出自交衰退。此外,物种遗传多样性越高,对环境变化的适应能力越强,也就越容易扩展其分布范围和生存空间。自交子代遗传多样性较低,适应性较差,而种间杂交子代应具有较强的适应性。当然,要准确分析林木自交衰退的表现,需要更加精巧的试验设计,比如,设计不同水平的自交组合,比较其受精率、胚发育过程、种子的饱满度、种子发芽率、出苗率、苗期存活率、林期长势、适应性、抗性等,在此基础上,对林木自交衰退可能造成的影响进行科学评估。
3.2 隐性致死基因与自交衰退自交衰退最主要的原因是有害隐性基因的暴露。通常,突变基因绝大多数都是隐性有害的。处于杂合状态时,这些基因的效应可被显性基因所掩盖,从而使其控制的不利性状难以表达。而自交导致有害隐性基因纯合,不利性状得以表达(Ritland ,1990;Fishman,2001;Johnsen et al.,2003)。
在导致自交衰退的隐性有害基因中,隐性致死基因造成的危害无疑是最严重的。致死基因(lethalgene)指一类因突变导致个体或者细胞死亡的基因,分为显性致死基因和隐性致死基因。显性致死基因在杂合体中即可表现致死,而隐性致死基因只有在纯合状态才能表现(向太和等,2003)。由于隐性致死基因的功能难以准确甄别或验证,导致该领域的报道极少。本研究尝试对鹅掌楸属隐性致死基因相关联的位点进行筛选。其研究思路为:设计不同类型的交配组合并获得各类型的交配组合子代,利用SSR分子标记对交配亲本及其子代的基因型进行分析;然后,选择父母本为相同类型的杂合子(ab)的SSR位点,比较其自交或异交子代的SSR基因型;若在其交配的子代(含自交、异交)中始终没有出现另一种纯合条带(aa或bb),则认为该未出现的纯合条带很有可能与隐性致死有关,初步将其作为隐性致死候选基因位点。为排除由于样本量小,使较低频率的纯合基因型检测不到,进而导致将非隐性致死位点误作为隐性致死位点,本研究检测了包含5个亲本、17个交配组合共约300个子代个体,可以认为所用样本量较大,出现抽样误差的几率较低。根据上述原理,最终从576个SSR位点中筛选出2个与隐性致死基因相关联的候选位点: Lt337和Lt486。需要说明的是,对于本文初步筛选的2个与隐性致死相关联的位点,其作用的方式、作用时期尚不清楚。此外,要最终确认这2个位点是否与隐性致死基因相关联,尚需开展进一步的研究。
| [1] |
陈小勇, 宋永昌.1997.黄山钓桥青冈种群的交配系统与近交衰退.生态学报, 17(5): 462-468.( 1) 1)
|
| [2] |
陈小勇.2000.生境片断化对植物种群遗传结构的影响及植物遗传多样性保护.生态学报, 20(1): 884-892.( 1) 1)
|
| [3] |
陈小勇, 林鹏.2002.厦门木麻黄种群交配系统及近交衰退.应用生态学报, 13(11): 1377-1380.( 1) 1)
|
| [4] |
李火根, 陈龙, 梁呈元, 等.2005.鹅掌楸属树种种源试验研究.林业科技开发, 19(5): 13-17.( 1) 1)
|
| [5] |
刘祖洞.2000.遗传学.北京: 高等教育出版社.( 1) 1)
|
| [6] |
王明庥.1989.林木育种学概论.北京: 中国林业出版社.( 1) 1)
|
| [7] |
王章荣.2005.鹅掌楸属树种杂交育种与利用.北京: 中国林业出版社.( 1) 1)
|
| [8] |
王峥峰, 彭少麟.2003.植物保护遗传学.生态学报, 23(1): 158-172.( 1) 1)
|
| [9] |
王峥峰, 彭少麟, 任海. 2005.小种群的遗传变异和近交衰退.植物遗传资源学报, 6(l): 101-107.( 1) 1)
|
| [10] |
王峥峰, 傅声雷, 任海, 等. 2007. 近交衰退: 我们检测到了吗?生态学杂志, 26(2): 245-252.( 1) 1)
|
| [11] |
向太和, 杨剑波, 杨前进, 等.2003.SCAR 标记对水稻苯达松敏感致死基因的辅助选育.中国水稻科学, 17(2): 113-117.( 1) 1)
|
| [12] |
胥猛, 李火根. 2008. 鹅掌楸EST-SSR引物开发及通用性分析.分子植物育种, 6(3): 615-618.( 1) 1)
|
| [13] |
姚俊修, 李火根, 边黎明, 等.2012.鹅掌楸近交子代群体的遗传分析. 东北林业大学学报, 40(7): 1-5.( 1) 1)
|
| [14] |
张大勇. 2004. 植物生活史进化与繁殖生态学. 北京: 科学出版社.( 1) 1)
|
| [15] |
张博, 张露, 诸葛强, 等. 2004.一种高效的树木总DNA提取方法.南京林业大学学报: 自然科学版, 28(1): 13-17.( 1) 1)
|
| [16] |
朱其卫, 李火根.2010. 鹅掌楸不同交配类型子代遗传多样性. 遗传, 32(2): 183-188.( 2) 2)
|
| [17] |
Buza L, Young A, Thrall P. 2000. Genetic erosion, inbreeding and reduced fitness in fragmented populations of the endangered tetraploid pea Swainsona recta. Biological Conservation, 93(2): 177-186.( 1) 1)
|
| [18] |
Charlesworth B, Charlesworth D. 2000. The genetic basis of inbreeding depression. Genetical Research, 74(3): 329-340.( 1) 1)
|
| [19] |
Charlesworth D, Willis J H. 2009. The genetics of inbreeding depression. Nature Reviews Genetics, 10(11): 783-796.( 1) 1)
|
| [20] |
Dudash M R, Carr D E, Fenster C B.1997. Five generations of enforced selfing and outcrossing in Mimulus guttatus: inbreeding depression variation at the population and family level. Evolution, 51(1): 54-65.( 1) 1)
|
| [21] |
Dudash M R, Carr D E.1998. Genetic underlying inbreeding depression in Mimulus with contrasting mating systems. Nature, 393: 682-684.( 1) 1)
|
| [22] |
Fischer M, Hock M, Paschke M. 2003. Low genetic variation reduces cross-compatibility and offspring fitness in populations of a narrow endemic plant with a self-incompatibility system. Conservation Genetics, 4(3): 325-336.( 1) 1)
|
| [23] |
Fishman L. 2001. Inbreeding depression in two populations of Arenaria uniflora (Caryophyllaceae) with contrasting mating systems. Heredity, 86(2): 184-194.( 1) 1)
|
| [24] |
Geburek T.1993.Are genes randomly distributed over space in mature sugar maple (Acer saccharum Marsh.) populations? Annals of Botany, 71(3): 217-222.( 1) 1)
|
| [25] |
Husband B C, Schemske D W.1996. Evolution of the magnitude and timing of inbreeding depression in plants. Evolution, 50(1): 54-70.( 2) 2)
|
| [26] |
Ishida K.2006. Maintenance of inbreeding depression in a highly self-fertilizing tree Magnolia obovata Thunb. Evolutionary Ecology, 20(2): 173-191.( 1) 1)
|
| [27] |
Johnsen K, Major J E, Maier C A. 2003. Selfing resulting in inbreeding depression of growth but not of gas exchange of surviving adult black spruce trees. Tree Physiology, 23(14): 1005-1008.( 1) 1)
|
| [28] |
Liang H Y, Ayyampalayam S, Wickett N, et al. 2011. Generation of a large-scale genomic resource for functional and comparative genomics in Liriodendron tulipifera L. Tree Genetics & Genomes, 7(5): 941-954.( 1) 1)
|
| [29] |
Mutikainen P, Delph L F. 1998. Inbreeding depression in a gynodioecious Lobelia siphilitica: Among-family differences override between-morph differences. Evolution, 52 (6): 1572-1582.( 1) 1)
|
| [30] |
Naito Y, Konuma A. 2005. Selfing and inbreeding depression in seeds and seedlings of Neobalanocarpus heimii (Dipterocarpaceae). Journal of Plant Research, 118(6): 423-430.( 1) 1)
|
| [31] |
Pic F X, Koubek T. 2003. Inbreeding effects on fitness traits in the heterocarpic herb Leontodon autumnalis L. (Asteraceae). Acta Oecologica, 24(5): 289-294.( 1) 1)
|
| [32] |
Reed D H, Frankham R. 2003. Correlation between fitness and genetic diversity. Conservation Biology, 17(1): 230-237.( 1) 1)
|
| [33] |
Ritland K.1990.Inferences about inbreeding depression based on changes of the inbreeding coefficient. Evolution, 44(5): 1230-1241.( 1) 1)
|
| [34] |
Rogers O S, Bendich A J. 1985. Extraction of DNA from milligram amounts of fresh, herbarium and mummified plant tissues. Plant Mo Biol, 5(2): 69-76.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

