文章信息
- 卜文圣, 许涵, 臧润国, 丁易, 张俊艳, 林明献
- Bu Wensheng, Xu Han, Zang Runguo, Ding Yi, Zhang Junyan, Lin Mingxian
- 不同采伐干扰方式对热带山地雨林谱系结构的影响
- Impacts of Different Logging Methods on Phylogenetic Structure in Tropical Montane Ra inforest of Hainan Island, China
- 林业科学, 2014, 50(4): 15-21
- Scientia Silvae Sinicae, 2014, 50(4): 15-21.
- DOI: 10.11707/j.1001-7488.20140403
-
文章历史
- 收稿日期:2013-01-29
- 修回日期:2014-03-03
-
作者相关文章
2. 中国林业科学研究院热带林业研究所广州 510520
2. Research Institute of Tropical Forestry, CAF Guangzhou 510520
物种谱系信号主要反映物种在生物进化过程中的分化时间。分化时间相同的物种具有相近的亲缘关系;而分化时间不同的物种则具有较远的亲缘关系(Webb et al.,2006)。因此,亲缘关系近的物种往往具有相似的生态学策略,而亲缘关系较远的物种则具有相异的生态学策略。通过对群落进行谱系结构分析,能够量化群落的生态进化格局并推断其生态演变过程,从而为现有群落结构的形成过程提供一个历史性的框架(Emerson et al.,2008)。群落的谱系结构往往与环境筛、竞争作用等群落组配规则存在密切的关系。环境筛往往使群落的谱系结构趋于聚集,而竞争作用或者生态位分化往往使群落的谱系结构趋于发散。此外,值得注意的是:即使群落受到强烈的环境筛作用,仍然不能忽视竞争或者其他物种间关联等生物作用对群落的组配过程产生影响(Emerson et al.,2008)。近年来,越来越多的研究者利用物种的谱系信号从个体、物种甚至生物区系的尺度来探讨群落的组配过程(Pennington et al.,2006;Webb et al.,2006;Zhang et al.,2013)。
近几十年间,热带森林遭遇了越来越严重的干扰,如采伐干扰、土地利用变化等(Lambin et al.,2003)。采伐干扰往往对留存的林木、林下植被、土壤产生衍生的影响(Curran et al.,1999;丁易等,2012),同时还对森林水文过程、土壤侵蚀、碳储量等生态系统功能产生影响(Asner et al.,2005)。由于采伐干扰往往对森林的更新和重建过程产生影响,并且干扰体系(包括采伐强度和次数)能够驱动森林生态系统转向一个新的平衡状态,因而,干扰强度和干扰后的景观格局在次生林的演替速度和方向上起决定性作用(Chazdon,2003)。由于采伐干扰能够对森林生态系统产生重大影响,因而对干扰后恢复的次生林谱系结构的研究有助于揭示干扰如何影响群落的谱系结构,也有助于探讨干扰对群落组配过程的影响。
尽管越来越多的生态学家关注群落谱系结构研究(Cavender-Bares et al.,2006;Walter et al.,2011;Vamosi et al.,2009;Norden et al.,2011),但都集中在成熟森林,很少关注干扰对群落谱系结构的影响(Letcher et al.,2011)。热带山地雨林是海南岛热带森林植被中面积最大、分布集中的垂直自然地带性植被类型(蒋有绪,2002),但由于对木材资源需求的增加,大面积热带山地雨林遭到破坏。在海南岛热带林的采伐历程中,依次经历了皆伐、径级择伐、采育择伐等采伐方式。本研究以海南岛热带山地雨林经皆伐或者径级择伐后恢复大约40年的2种次生林和老龄林为研究对象,通过群落学调查和样地环境因子的测定,分析不同干扰方式对群落组成及谱系结构的影响,探讨不同干扰方式下环境因素对群落谱系结构的影响,从而为进一步了解干扰对群落结构动态的影响和机制提供参考,同时也为热带次生林的经营和管理提供科学基础和理论指导。
1 研究区概况研究区位于海南岛尖峰岭自然保护区(108°41'-109°12' E,18°20'-18°57' N),属于亚洲热带森林北缘。尖峰岭自然保护区总面积约640 hm2,海拔从沿海地区至林区最高海拔(尖峰岭顶海拔1 412 m)。年平均气温24.5 ℃,最冷月平均气温19.4 ℃,最热月平均气温27.3 ℃,年平均降水量随海拔的增加从1 300 mm增加到3 500 mm。干湿季明显,雨季为5-10月,旱季为11月至翌年4月(蒋有绪,2002)。从沿海地区至山顶,土壤类型依次为滨海砂土、燥红土、砖红壤、砖黄壤和山地淋溶表潜黄壤;植被类型依次为滨海有刺灌丛、热带稀树草原、热带半落叶季雨林、热带常绿季雨林、热带北缘沟谷雨林、热带山地雨林、热带山地常绿阔叶林和山顶苔藓矮林。
2 研究方法 2.1 样地设置与调查2008年6-10月,以尖峰岭热带山地雨林为研究对象,共设73块25 m×25 m样地,其中老龄林(OG)26块、径级择伐后恢复大约40年的次生林(SF)34块和皆伐后恢复大约40年的次生林(CF)13块。记录样地内DBH≥1 cm的所有木本植物的种名、树高和胸径,同时记录各个样地的海拔。
2.2 土壤测定在每块样地按照梅花五点法使用土钻钻取5个长度为20 cm的圆柱形土样混合成1个混合土样。同时在每块样地中心位置取环刀土样1个,总共采集73个混合土样和73个环刀样品。利用环刀法测定土壤密度(g·cm-3);铝盒烘干法测定土壤含水量(%)。等混合土样自然风干后,采用重铬酸钾氧化-外加热法测定土壤有机质含量(SOM,g·kg-1),采用半微量凯氏法测定土壤全氮含量(TN,g·kg-1g·kg-1)。所有的土壤测定方法依据国家林业行业标准执行(张万儒等,1999)。
2.3 谱系树的构建与谱系结构的计算将样地内的物种及其科属信息输入到植物谱系库软件Phylomatic v3(Webb et al.,2005),该软件以被子植物分类系统Ⅲ(APG Ⅲ,R20120829)为基础数据,输入物种后自动输出其谱系树。使用软件Phylocom 4.2(Webb et al.,2008)提供的BLADJ算法,利用分子及化石定年数据,计算出谱系树中每一个分化节点发生的时间。该算法首先将已知分化时间的节点固定,对所有未知节点采用平均的方法处理。这种方式获得的分枝长度代表连续2次物种分化间隔的时间,利用这种方法建立的谱系树的准确度足以区分群落间的谱系结构(Walter et al.,2011)。由于净谱系亲缘关系指数(net relatednessindex,NRI)能够较好地从整体上描述群落中物种形成的谱系结构(Swenson et al.,2007),因此本研究采用NRI来代表群落的谱系结构。假定由已调查的物种组成局域物种库,该指数首先计算出样方中所有物种对的平均谱系距离(mean phylogeneticdistance,MPD),保持物种数量及物种个体数不变,将样方中物种的物种名从物种库中随机抽取999次,获得该样方中物种在随机零模型下MPD的分布,之后利用随机分布结果将观察值标准化,从而获得NRI。其计算公式(Webb et al.,2008)为:
| $\text{NRI=-1 }\!\!\times\!\!\text{ }\frac{\text{MP}{{\text{D}}_{\text{S}}}\text{-MP}{{\text{D}}_{\text{r}}}}{\text{SD}\left(\text{MP}{{\text{D}}_{\text{r}}} \right)}$ |
式中: MPDs为样方中实际观测的所有物种对的平均谱系距离;MPDr为随机生成样方(总共999个)中观测的所有物种对平均谱系距离的平均值;SD(MPDr)为随机生成样方中观测的所有物种对平均谱系距离的标准偏差。若NRI>0,样方的物种在谱系结构上聚集;若NRI<0,样方中的物种谱系结构发散;若NRI=0,样方的物种在谱系结构上是随机的。
2.4 数据处理为了了解不同干扰类型森林环境因子的差异,对每个环境因子进行单因素方差分析并进行多重比较。干扰对群落内不同径级树木的影响不同,因而划分树木径级为: 1≤DBH<5 cm的幼树、5≤DBH<10 cm的小树、DBH≥10 cm的成年树和总体(即所有个体)。为了阐明干扰对群落内不同径级树木的影响,对不同径级的群落结构特征和谱系结构同样进行方差分析和多重比较。为了探讨不同干扰方式下哪些环境因子对群落谱系结构产生影响,以各个径级的谱系结构作为因变量,以环境因子作为自变量进行多元逐步回归。多元回归模型中最终仅保留P<0.05的环境因子。所有的统计分析及作图均用R 2.14.0软件完成。
3 结果与分析 3.1 干扰方式对群落组成与结构的影响图 1表明,任何一个径级尺度内,不同干扰类型森林之间的物种丰富度差异均不显著。但是就均值而言,幼树和总体的物种丰富度在老龄林中最低,在皆伐后恢复的次生林中最高,而成年树的物种丰富度的趋势则恰好相反。从群落多度的角度来看,幼树、小树和总体的多度均在老龄林中最低,在皆伐后恢复的次生林中最高,而成年树的多度则变化不显著(图 1)。从群落的胸高断面积来看,幼树、小树的胸高断面积在老龄林中最低,在皆伐后恢复的次生林中最高,而成年树和总体的胸高断面积则恰好相反(图 1)。
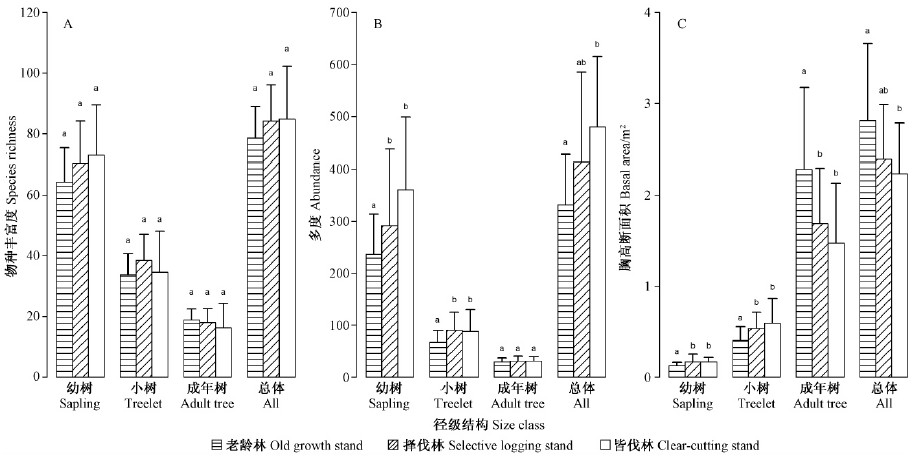 |
图 1 不同干扰类型森林的群落组成与结构特征
Fig. 1 Comparisons of community composition and structure among stands with different disturbance types
|
图 2表明,在不划分径级的情况下,不同干扰类型林分的净谱系亲缘关系并无显著差别,但在老龄林净谱系亲缘关系指数最高,而皆伐后恢复的次生林中最低。从幼树的谱系结构来看,老龄林的净谱系亲缘关系指数显著高于皆伐后恢复的次生林,而择伐后恢复的次生林与老龄林、皆伐后恢复的次生林均无显著差别(图 2)。从小树的谱系结构来看,不同干扰类型林分的净谱系亲缘关系并无显著差别,择伐后恢复的次生林的净谱系亲缘关系指数最高,而老龄林和皆伐后恢复的次生林较低(图 2)。从成年树的谱系结构来看,老龄林的净谱系亲缘关系指数显著低于次生林,而择伐后恢复的次生林和皆伐后恢复的次生林并无显著差别(图)。总的看来,从不受采伐干扰的老龄林、择伐后恢复的次生林到皆伐后恢复的次生林,群落幼树和总体的谱系结构由聚集转向发散,而成年树则恰好相反,小树的谱系结构基本上是随机的。
 |
图 2 不同干扰类型群落的净谱系亲缘关系指数
Fig. 2 Net relatedness index of communities with different human disturbance types
|
图 3表明,大多数群落的净谱系亲缘关系指数受到环境条件的显著影响。在老龄林中,群落总体谱系结构和各径级的谱系结构均受到海拔的影响,并且随着海拔的升高,净谱系亲缘关系指数逐渐增大。同时,幼树、小树谱系结构比成年树谱系结构更易受海拔的影响(图 3)。在择伐后恢复的次生林中,群落内幼树、小树和总体的谱系结构均受到土壤含水量的影响,并且随着土壤含水量的增加,净谱系亲缘关系指数逐渐降低,但是成年树谱系结构则不受土壤含水量的影响(图 3)。在皆伐后恢复的次生林中,群落总体的谱系结构不受土壤有机质含量的影响,但是各径级的谱系结构受到土壤有机质含量的影响。幼树的净谱系亲缘关系指数随土壤有机质含量的增加而逐渐增大,而小树和成年树的净谱系亲缘关系指数则随土壤有机质含量的增加而逐渐减少(图 3)。总的看来,在老龄林中,群落的谱系结构随海拔升高由发散转向聚集。在择伐后恢复的次生林中,群落谱系结构随土壤含水量增加由聚集转向发散。在皆伐后恢复的次生林中,幼树的谱系结构随土壤有机质含量增加由发散转向聚集,而小树和成年树的谱系结构则由聚集转向发散。
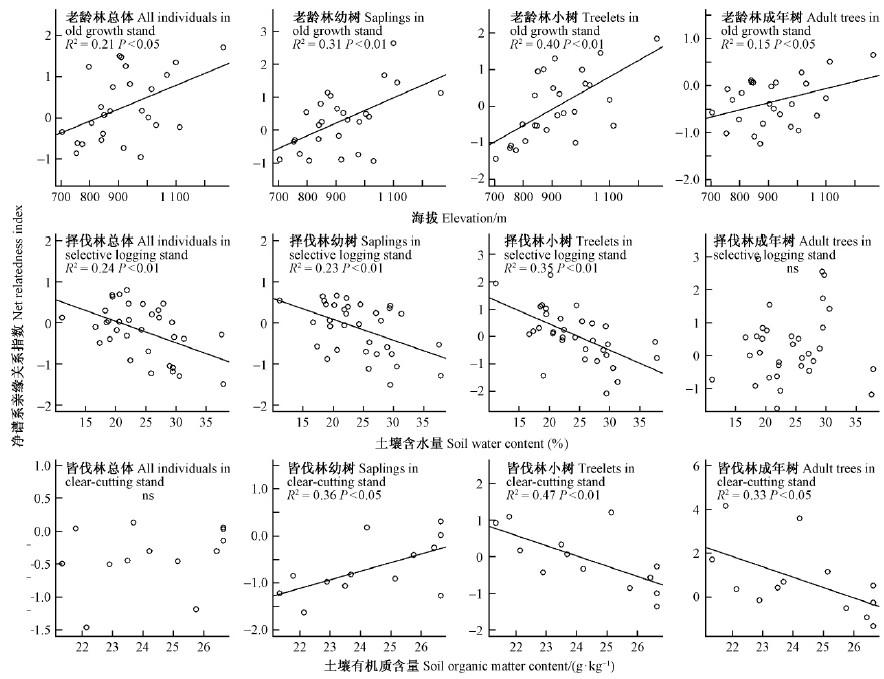 |
图 3 不同干扰类型群落的净谱系亲缘关系指数和环境因子的关系
Fig. 3 Linear regressions between net relatedness index of communities with different human disturbance types and environmental factors
|
不同的干扰方式能够从很多方面影响植被恢复,其中最重要的就是改变群落的组成和结构(Chazdon,2003)。本研究中,任何一个径级尺度内的丰富度在不同干扰类型森林之间差异均不显著(图 1),这一结果说明干扰后经过40年恢复的山地雨林,其物种丰富度可以恢复到老龄林的水平(Letcher et al.,2009)。幼树和小树的多度随着采伐强度的增加而逐渐增大(图 1),可能是因为采伐后留下的林隙能够为新个体的成功定植和生长提供更多的更新生态位(Cannon et al.,1998)。次生林中的幼树和小树的胸高断面积总是比老龄林高(图 1),说明采伐干扰有助于森林的更新。而总的胸高断面积随着干扰强度的增大而逐渐降低意味着尽管历经长达40年的恢复,干扰对于胸高断面积的影响依然存在(Fredeen et al.,2005)。有关干扰对群落结构的研究表明,采伐干扰的强度能够对群落的恢复速度产生重大影响(Bonnell et al.,2011)。
干扰对不同径级的谱系结构影响不同(图 2)。老龄林的幼树谱系结构呈聚集状态,而成年树谱系结构则呈发散状态。皆伐后恢复的次生林的幼树谱系结构呈发散状态,成年树则呈聚集状态。皆伐干扰后历经长达40年的恢复,绝大多数大径级树种仍然为先锋树种。由于先锋树种依旧在群落中起着主导作用(Ding et al.,2012),因而其成年树的谱系结构是聚集的(Norden et al.,2011)。而历经40年的恢复,皆伐后恢复的次生林成年树的多度与老龄林相近(图 1),可以看出林冠层已经完全郁闭,一些耐荫性树种已经侵入到群落中,同时已经成年的先锋树种可以通过种子扩散等传播方式形成一定数量的幼树(Chazdon,2008),这点也可以从皆伐后恢复的次生林幼树的物种丰富度比老龄林的还要多得到证明。由于同时生存了先锋树种和耐荫性树种的幼树,因而皆伐后恢复的次生林幼树的谱系关系呈现发散状态。老龄林中,成年树往往受到生态位分化或者竞争作用等物种间相互作用的影响,因而成年树的谱系结构是发散的(Letcher,2010)。由于群落冠层高度地郁闭,林下只能生存耐荫性的树种,因而,幼树谱系结构的聚集状态有可能由于生境过滤作用所导致。而择伐后恢复的次生林在幼树、成年树和总体的谱系结构中均处于接近随机状态,可能由于在处于中等干扰强度下的择伐林同时受到环境筛和竞争作用的影响,而使群落的谱系结构趋于随机。
在老龄林中,净谱系亲缘关系指数随着海拔的升高逐渐增大。在尖峰岭自然保护区,随着海拔的升高,温度越来越低,而空气湿度则逐渐增加,并且在高海拔地区分布有热带云雾林(龙文兴等,2011)。只有那些能够适应其特殊环境的物种才能够生存,而这一环境筛使得生存下来的物种必须具有适应这一环境的特殊性状。由于生存下来的物种具有相似的性状,而植物性状在谱系结构上往往具有保守性,导致高海拔生存的物种的谱系结构趋于聚集(Swenson et al.,2007;Machac et al.,2011)。另外,幼树、小树谱系结构比成年树谱系结构更易受海拔的影响。由于幼树和小树更容易遭受环境压力的影响,这一结果也进一步指出环境筛可能是导致老龄林谱系结构随海拔的增加而从发散转向聚集的主要原因。
在择伐后恢复的次生林中,群落内幼树、小树和总体的谱系结构均受到土壤含水量的影响,并且随着土壤含水量的增加,净谱系亲缘关系指数逐渐降低。幼树和小树更容易受到土壤水分的影响,较低的土壤水分导致那些适应干旱的幼树和小树才能生存,因而在低的土壤含水量的条件下,物种由于受到水分(环境筛)的限制而使群落的谱系结构呈聚集状态(Vamosi et al.,2009)。而适宜的水分条件能够让更多的物种生存,可能由于物种之间的相互作用导致群落的谱系结构呈发散状态(Schreeg et al.,2010)。此外,成年树谱系结构则不受土壤含水量的影响,可能是因为成年树已经扎根在深层的土壤中,较少受到表层土壤水分的影响。
在皆伐后恢复的次生林中,群落总体的谱系结构不受土壤有机质含量的影响,但是各径级的谱系结构受到土壤有机质含量的影响。幼树的净谱系亲缘关系指数随土壤有机质含量的增加而逐渐增大。皆伐后恢复的次生林中,幼树是由先锋树和耐荫性树种一起组成的。由于有机质含量往往可以代表土壤的肥力,当群落中存在较高的有机质含量时,先锋树种可以在较好的肥力条件下更多地繁殖和生长,因而在有机质含量较高时,群落的谱系结构呈聚集状态(Fine et al.,2011)。同时,小树和成年树的净谱系亲缘关系指数则随土壤有机质含量的增加而逐渐减少。由于小树和成年树主要由先锋树种组成,同时径级也比较大,物种之间可能存在激烈的竞争,或许由于竞争作用、限制相似性等生物因素导致群落的谱系结构走向发散(Letcher,2010)。
尽管以上结果均指出群落的谱系结构受到环境筛的影响,但是仍然不能忽视竞争、密度制约等生物作用对群落组配过程的影响(Emerson et al.,2008)。
| [1] |
丁易, 臧润国. 2012. 采伐方式对海南岛霸王岭热带山地雨林恢复的影响. 林业科学, 47(11): 1-5.( 1) 1)
|
| [2] |
蒋有绪. 2002. 海南岛热带林生物多样性及其形成机制. 北京: 科学出版社.( 2) 2)
|
| [3] |
龙文兴, 丁易, 臧润国, 等. 2011. 海南岛霸王岭热带云雾林雨季的环境特征. 植物生态学报, 35(2): 137-146.( 1) 1)
|
| [4] |
张万儒, 杨光澄, 屠星南.1999. 中华人民共和国林业行业标准——森林土壤分析方法. 北京: 中国标准出版社.( 1) 1)
|
| [5] |
Asner G P, Knapp D E, Broadbent E N, et al. 2005. Selective logging in the Brazilian Amazon. Science, 310(5747): 480-482.( 1) 1)
|
| [6] |
Bonnell T R, Reyna-Hurtado R, Chapman C A. 2011. Post-logging recovery time is longer than expected in an East African tropical forest. Forest Ecology and Management, 261(4): 855-864.( 1) 1)
|
| [7] |
Cannon C H, Peart D R, Leighton M.1998. Tree species diversity in commercially logged Bornean rainforest. Science, 281(5381): 1366-1368.( 1) 1)
|
| [8] |
Cavender-Bares J, Keen A, Miles B. 2006. Phylogenetic structure of floridian plant communities depends on taxonomic and spatial scale. Ecology, 87(sp7): 109-122.( 1) 1)
|
| [9] |
Chazdon R L. 2003. Tropical forest recovery: legacies of human impact and natural disturbances. Perspectives in Plant Ecology, Evolution and Systematics, 6(1/2): 51-71.( 2) 2)
|
| [10] |
Chazdon R L.2008. Chance and determinism in tropical forest succession. Oxford: Wiley-Blackwell Publishing.( 1) 1)
|
| [11] |
Curran L M, Caniago I, Paoli G, et al. 1999. Impact of El Nino and logging on canopy tree recruitment in Borneo. Science, 286(5447): 2184-2188.( 1) 1)
|
| [12] |
Ding Y, Zang R, Liu S, et al. 2012. Recovery of woody plant diversity in tropical rain forests in southern China after logging and shifting cultivation. Biological Conservation, 145(1): 225-233.( 1) 1)
|
| [13] |
Emerson B C, Gillespie R G. 2008. Phylogenetic analysis of community assembly and structure over space and time. Trends in Ecology & Evolution, 23(11): 619-630.( 3) 3)
|
| [14] |
Fine P V A, Kembel S W. 2011. Phylogenetic community structure and phylogenetic turnover across space and edaphic gradients in western Amazonian tree communities. Ecography, 34(4): 552-565.( 1) 1)
|
| [15] |
Fredeen A L, Bois C H, Janzen D T, et al. 2005. Comparison of coniferous forest carbon stocks between old-growth and young second-growth forests on two soil types in central British Columbia, Canada. Canadian Journal of Forest Research, 35(6): 1411-1421.( 1) 1)
|
| [16] |
Lambin E F, Geist H J, Lepers E.2003. Dynamics of land-use and land-cover change in tropical regions. Annual review of environment and resources, 28(1): 205-241.( 1) 1)
|
| [17] |
Letcher S G.2010. Phylogenetic structure of angiosperm communities during tropical forest succession. Proceedings of The Royal Society B: Biological Sciences, 277(1678): 97-104.( 2) 2)
|
| [18] |
Letcher S G, Chazdon R L. 2009. Rapid recovery of biomass, species richness, and species composition in a forest chronosequence in northeastern Costa Rica. Biotropica, 41(5): 608-617.( 1) 1)
|
| [19] |
Letcher S G, Chazdon R L, Andrade A C S, et al. 2011. Phylogenetic community structure during succession: evidence from three Neotropical forest sites. Perspectives in Plant Ecology, Evolution and Systematics, 14(2): 79-87.( 1) 1)
|
| [20] |
Machac A, Janda M, Dunn R R, et al. 2011. Elevational gradients in phylogenetic structure of ant communities reveal the interplay of biotic and abiotic constraints on diversity. Ecography, 34(3): 364-371.( 1) 1)
|
| [21] |
Norden N, Letcher S, Boukili V, et al. 2011. Demographic drivers of successional changes in phylogenetic structure across life-history stages in plant community. Ecology, 93(8): s70-s82.( 2) 2)
|
| [22] |
Pennington R T, Richardson J E, Lavin M. 2006. Insights into the historical construction of species‐rich biomes from dated plant phylogenies, neutral ecological theory and phylogenetic community structure. New Phytologist, 172(4): 605-616.( 1) 1)
|
| [23] |
Schreeg L A, Kress W J, Erickson D L, et al. 2010. Phylogenetic analysis of local-scale tree soil associations in a lowland moist tropical forest. PloS one, 5(10): e13685.( 1) 1)
|
| [24] |
Swenson N G, Enquist B J, Thompson J, et al. 2007. The influence of spatial and size scale on phylogenetic relatedness in tropical forest communities. Ecology, 88(7): 1770-1780.( 2) 2)
|
| [25] |
Vamosi S, Heard S, Vamosi J, et al. 2009. Emerging patterns in the comparative analysis of phylogenetic community structure. Molecular Ecology, 18(4): 572-592.( 2) 2)
|
| [26] |
Walter C, Stefan S. 2011.Tropical forest community ecology. Oxford: John Wiley & Sons, 79-97.( 2) 2)
|
| [27] |
Webb C O, Donoghue M J. 2005. Phylomatic: tree assembly for applied phylogenetics. Molecular Ecology Notes, 5(1): 181-183.( 1) 1)
|
| [28] |
Webb C O, Ackerly D D, Kembel S W.2008. Phylocom: software for the analysis of phylogenetic community structure and trait evolution. Bioinformatics, 24(18): 2098.( 2) 2)
|
| [29] |
Webb C O, Losos J B, Agrawal A A.2006. Integrating phylogenies into commmunity ecology. Ecology, 87(sp7): 1-2.( 2) 2)
|
| [30] |
Zhang J L, Swenson N G, Chen S B, et al. 2013. Phylogenetic beta diversity in tropical forests: implications for the roles of geographical and environmental distance. Journal of Systematics and Evolution, 51(1): 71-85.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

