文章信息
- 林英华, 汪来发, 卢萍, 谭飞, 徐演鹏, 孙楠
- Lin Yinghua, Wang Laifa, Lu Ping, Tan Fei, Xu Yanpeng, Sun Nan
- 不同密度杂种落叶松人工林土壤细菌群落对凋落物分解过程的响应
- Response of Soil Bacteria Community to Leaf Litter Decomposition of Larch (Larix olgensis×Larix kaempferi) Plantation with Different Forest Densities
- 林业科学, 2013, 49(12): 101-107
- Scientia Silvae Sinicae, 2013, 49(12): 101-107.
- DOI: 10.11707/j.1001-7488.20131215
-
文章历史
- 收稿日期:2012-11-06
- 修回日期:2013-07-29
-
作者相关文章
2. 中国林业科学研究院 森林生态环境与保护研究所 国家林业局 森林保护学重点实验室 北京 100091;
3. 东北林业大学野生动物资源学院 哈尔滨 150040;
4. 黑龙江省林业科学院 哈尔滨 150081
2. Key Laboratory of Forest Protection of State Forestry Administration Research Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091;
3. College of Wildlife Resource, Northeast University of Forestry Harbin 150040;
4. Heilongjiang Academy of Forestry Harbin 150081
凋落物分解是生态系统物质循环的重要过程之一,其释放出的养分是维持生态系统生态功能的最基本要素(Schinner,1982)。凋落物分解速率与气候因子和植物种类或凋落物的特征有关(Cornwell et al.,2008),同时,土壤微生物尤其是土壤细菌在凋落物分解过程中具有关键性作用(Nannipieri et al.,2003)。凋落物分解速率反映了土壤细菌活性大小(Chen et al.,2012),土壤细菌群落组成变化则反映了凋落物分解进程中凋落物主要养分含量的变化,二者互为条件(Fraterrigo et al.,2006)。
杂种落叶松是长白落叶松(Larix olgensis)与日本落叶松(Larix kaempferi)的杂交种,因其生长速度快、抗寒性强,一些地区开始大面积种植(孙楠等,2009)。近年来有学者研究并比较了不同造林密度杂种落叶松生长特性与凋落物特性(孙楠等,2009;2012)、土壤微生物分布特征(王树力等,2009),但凋落物分解过程对土壤微生物尤其是土壤细菌群落及其环境的响应未见报道。为此,笔者研究相同立地条件下4种不同造林密度杂种落叶松林凋落物分解中土壤细菌群落及其多样性变化,分析土壤细菌在杂种落叶松凋落物分解过程中的变化规律,为进一步研究杂种落叶松凋落物分解对土壤肥力的影响提供依据。
1 研究区概况与研究方法 1.1 研究区概况研究区设置于黑龙江省林业科学院江山娇试验林场。林场地处张广才岭南端,128° 53' 16″—129°12'42″E,43°44'54″—43°54'12″N,属低山丘陵地区。海拔在356~890 m之间,平均坡度12°。气候属温带大陆性气候,年平均气温3.5 ℃,年平均温度≥10 ℃的年积温2 200 ℃。年降水量在450~550mm之间,6—8月降水量占全年降水量的50%。10月中旬至翌年的4月初为降雪期,积雪时间150天,积雪深达30~50 cm。全年无霜期116~125天。林场地带性土壤为暗棕壤,成土母质为玄武岩。典型植被是红松(Pinus koraiensis)针阔叶混交林和以蒙古栎(Quercus mongolica)为主的次生落叶阔叶林。
1.2 采样方法选择地形条件基本一致、林龄13年的4种密度杂种落叶松人工纯林,分别设定3块25 m×40 m的样地,用常规方法测定土壤主要理化性质(表 1)。2009年5—10月采用凋落物框收集当年凋落物并自然风干后,在90~105 ℃条件下烘干12 h左右至恒质量。称取15 g凋落物放上层网孔2 mm、下层网孔1 mm的凋落物分解袋(20 cm×20 cm)(简称异孔分解袋)内,并选取网孔为1/300 mm凋落物分解袋(简称同孔分解袋)为对照,将凋落袋埋于凋落层和腐殖质层之间。于2010年5,7,9月以及2011年的5,7月,分别采集2种凋落袋下0~5 cm的土壤样品混匀,一部分带回实验室4 ℃保存供土壤细菌分析,另一部土壤样品供土壤含水量测定。
|
|
培养基采用牛肉膏蛋白胨琼脂培养基;用涂抹法接种、稀释平板法计数(陈华癸等,1981)。接种后倒置于30 ℃恒温箱内培养,48 h后计数并进行菌体分离、纯化和保存。
1.4 土壤细菌的16S RNA的PCR扩增、序列测定与相似性分析PCR扩增引物27f/1495r(27F: 5'-AGAGTTTGATCCTGGCTCAG-3';1495R: 5'-CTACGGCTACCTTGTTACG-3')。扩增片段长度约1.5 kb。扩增体系体积20 μL(东秀珠等,2001)。
PCR产物送上海华大生物工程技术有限公司进行测序。测序结果用DNAMAN(美国LynnonBiosoft公司开发)软件进行拼接处理后,在Gen Bank(www. ncbi. nlm. nih. gov)中进行比对分析,根据同源性确定细菌的属。
1.5 数据处理细菌数量(cfu·g-1 dry weight)=菌落平均数×稀释倍数×10/(1-含水量%)。
类群数量等级:菌落数量占全部菌落数量10%以上为优势类群,介于1%~10%之间为常见类群,介于0.1%~1%之间为稀有类群,0.1%以下的为极稀有类群。本文将优势类群和常见类群统归为主要类群,稀有类群和极稀有类群统归为其他类群。
群落多样性指数采用Shannon-Wiener指数、Pielou均匀性指数和辛普森指数,即 $ H' = - \sum\limits_{i = 1}^s {{P_i}\ln {P_i}},J = \frac{{H'}}{{\ln S}} $和$ C = \sum {{{\left({\frac{{{n_i}}}{N}} \right)}^2}} $。式中: Pi为类群i占类群总个体数的比例,S为类群数,N为群落总个体数,n i为第i个种的细菌数。群落相似性采Jaccard(q)指数: q=c/(a+b-c),a,b分别为群落A、群落B的类群数,c为2类群的共有类群数。
采用Bonferroni修正差别检验法,即将土壤微生物数量转化为lg(x+1)后进行方差分析以判断不同取样时间、不同造林密度以及不同类型凋落袋处理之间的差异显著性。用主成分分析与典型相关分析方法分析不同密度落叶松林对土壤细菌群落影响以及与土壤主要性质之间的相互关系。以上运算通过软件SPSS 13.0和CANOCO 4.5完成。
2 结果与分析 2.1 土壤细菌群落组成通过稀释平板法共获得19类16 129个菌落(表 2),其中,芽孢杆菌9株,短杆菌1株,伯克氏菌2株,贪铜菌、赖氨酸芽孢杆菌、类芽孢杆菌、假单胞菌、 Solibacillus、葡萄球菌、节核菌各1株,未活化成功菌落799个。亚麻假单胞菌、台中类芽孢杆菌、卫施泰凡芽孢杆菌、炭疽芽孢杆菌、科氏葡萄球菌均占分离鉴定菌落的10.0%以上,为优势种;酸快生芽孢杆菌、居沉积物伯克氏菌、食丁酸芽孢杆菌、赖氨酸芽孢杆菌属1种、 Solibacillus silvestris、覃状芽孢杆菌、耐寒短杆菌和节核菌属均占分离鉴定菌落的1.0%~10.0%,为常见种;其他均在1.0%以下,为稀有种。在这些优势种中,以细胞芽孢杆菌属、假单胞菌属为主,能分解纤维素的细菌芽胞杆菌和葡萄菌属为主的有机质降解菌在数量上占优势,反映了其在落叶松凋落物的分解过程中的作用。
|
|
在研究时段内,同孔分解袋下共获得1 870.25±280.51个菌落,异孔分解袋下共获得2 157.00±221.66个菌落;2种孔径凋落袋下菌落的变化不一致,其中,同孔分解袋下菌落总数依次是D(2 273)> B(1 955)> A(1 771)> C(1 502),异孔分解袋下菌落总数依次是A(2 334)> B(2 319)>C(2 188)> D(1 786),即同孔分解袋下菌落随造林密度加大而增多,异孔分解袋下菌落数随造林密度增加而减少。
在研究时段内,不同密度杂种落叶松土壤细菌数量变化趋势不同,其中,同孔分解袋D(6.75×10 6cfu·g-1干土)> B(5.01×10 6 cfu·g-1干土)>A(4.38×10 6 cfu·g-1干土)> C(3.68×10 6 cfu·g-1干土),异孔分解袋下B(6.34×10 6 cfu·g-1干土)>A(5.67×10 6 cfu·g-1干土)> C(5.52×10 6 cfu·g-1干土)> D(4.79×10 6 cfu·g-1干土)。同一密度杂种落叶松林,土壤细菌数量凋落物分解基本呈递增的趋势,但在次年的5月则出现下降(图 1)。Bonferroni法检验结果表明:土壤细菌数量在凋落物分解过程中发生显著变化(F=10.97,P < 0.01),除2010年5月与2011年7月外,其他各月份之间均存在一定的差异(P < 0.1),尤其是2011年5月土壤细菌数量与其他各月份土壤细菌数量差异极显著(P < 0.01),但对于不同密度杂种落叶松林,仅C与B、 D之间存在显著差异(P < 0.01)。
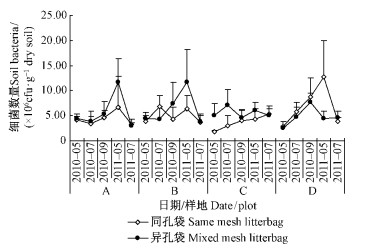 |
图 1 杂种落叶松林凋落物分解过程中土壤细菌变化
Fig. 1 Fluctuation of soil bacteria in litter decomposition of
Larix olgensis × Larix kaempferi
|
多样性指数计算结果表明,同孔分解袋下土壤细菌Shannon-Wiener指数、 Pielou均匀性指数、辛普森指数分别是0.799 5±0.077 5,0.359 1±0.024 2和0.203 7±0.044 4,异孔分解袋下3种指数则分别是0.758 1±0.098 8,0.347 2±0.031 9和0.234 6±0.073 6,表明同孔分解袋下土壤细菌分布不均匀,细菌优势现象明显,多样性较丰富。
2种凋落分解袋下土壤细菌多样性和均匀性变化趋势大致相同,即土壤细菌多样性指数随凋落物分解时间增加呈现出增加趋势,而到了次年的7月递减;Pielou均匀性指数基本与Shannon-Wiener多样性指数变化趋势相同,辛普森指数波动较大(图 2),但2010-05—2011-05总的趋势是,辛普森指数基本呈下降的趋势,而到了次年的7月出现递增。
 |
图 2 杂种落叶松林凋落物分解过程中同孔与异孔分解袋下土壤细菌多样性变化
Fig. 2 Fluctuation of soil bacteria community diversity in litter
decomposition of Larix olgensis × Larix kaempferi
in two types of litterbag
|
不同密度杂种落叶松土壤细菌群落Jaccard(q)指数,即相似性很高(表 3),C,H',J月份间差异显著(F=6.252,F=3.890,F=5.070,P < 0.005)。其中,2010年7月土壤细菌群落H'与当年5,9月以及次年7月存在明显差异(P < 0.01),土壤细菌J仅2010年5月与当年7月存在明显差异(P <0.01),土壤细菌优势度表现为次年5月与上年5月及9月存在明显差异(P < 0.01)。这表明在不同密度杂种落叶松林中,土壤细菌群落具有很高的相似性,反映出杂种落叶松林凋落物对土壤生态系统内部环境进而对土壤细菌群落的影响具有相似性。
|
|
采用主成分(主分量)分析对不同杂种密度落叶松林土壤细菌组成与多样性的分析结果(图 3)表明:同孔袋凋落物分解的第1主成分和第2主成分贡献率分别是69.5%和14.9%,而异孔袋凋落物分解的第1主成分和第2主成分贡献率分别是66.0%和15.2%,反映出土壤细菌的组成与多样性受采样时段明显大于不同杂种密度的影响。第1主成分将第4次采样时段(A4,B4,C4,D4)、第5次采样时段(A5,B5,C5,D5)与其他3次采样时段土壤细菌组成与多样性明显分开,反映出不同采样时段对土壤细菌组成的影响,且不同造林密度对2种孔径凋落袋下土壤细菌群落多样性的影响不同,其中,造林密度2 500株·hm-2对同孔袋分解过程中土壤细菌群落组成的影响较大,异孔袋分解过程中则因采样时间不同而存在差异。第2主成分将第5次采样时段(A5,B5,C5,D5)与其他4次采样时段土壤细菌组成与多样性明显分开,反映出第5次采样与其他采样获得的土壤细菌组成与多样性明显不同,其中,造林密度6 600株·hm-2对异孔袋分解过程中的土壤细菌群落组成与多样性影响较大,反映出造林密度与异孔凋落袋分解过程中土壤细菌群落多样性与复杂性相关,即低密度有益于同孔袋凋落物分解,高密度利于异孔袋凋落物分解。
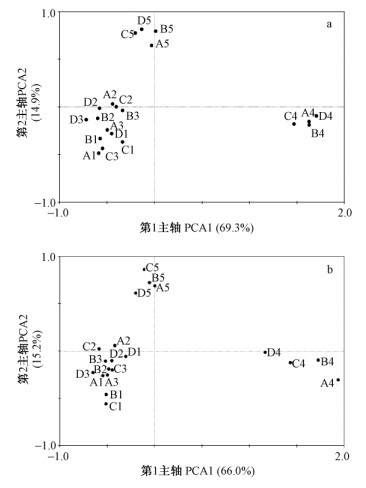 |
图 3 土壤细菌群落主成分分析(PCA)二维空间图
Fig. 3 Principal component analysis (PCA) ordination diagram
a. 同孔袋 Same mesh litterbag; b. 异孔袋 Mixed mesh litterbag;
1 - 5. 采样次数 The sampling times |
芽孢杆菌、短杆菌、类芽孢杆菌、假单孢菌、Solibacillus、葡萄球菌等菌属(表 2)与土壤6项主要因子典型相关分析结果表明,土壤N、 P、 K以及土壤有机质、土壤pH和土壤C/N比6个因子对土壤细菌属的空间分布均有一定影响(图 4),其中土壤pH、土壤P以及土壤K均和第1排序轴呈正相关关系,而土壤N、 P以及土壤pH均和第2排序轴呈正相关关系。土壤主要因子与土壤细菌第1排序轴的相关大小依次为土壤K >土壤pH >土壤P > SOM >土壤N >土壤C/N比,即土壤K对土壤细菌分布影响最大,土壤C/N比对土壤细菌分布影响最弱。除伯克氏菌和贪铜菌2个土壤细菌属外,其他9个细菌属均接近2个排序轴,表明影响这些细菌的环境因子或者适于这些细菌生存的环境条件较为相似。
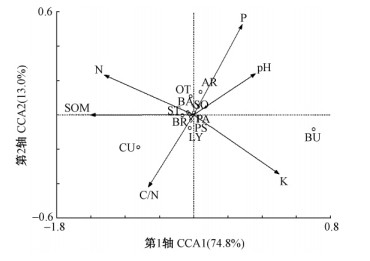 |
图 4 杂种落叶松林土壤细菌与土壤因子CCA二维排序
Fig. 4 Result of Canoco analysis on the soil factor and
the soil bacteria in Larix olgensis + Larix kaempferi
BA: 芽孢杆菌属 Bacillus; BR: 耐寒短杆菌属 Brevibacterium; BU:
伯克氏菌属 Burkholderia; CU: 贪铜菌属 Cupriavidus; LY: 赖氨酸芽孢杆菌属 Lysinibacillus; PE : 台中类芽孢杆菌属 Paenibacillus; PS:
亚麻假单胞菌属 Pseudomonas; SO: Solibacillus; ST: 科氏葡萄球菌属 Staphylococcus; AR: 节细菌属 Arthrobacter; OT: 其他 Other |
一般而言,可利用资源的变化和枯落物提供的物质源直接影响着土壤生物群落及其多样性的变化(Cao et al.,2010)。在本研究中,采用稀释涂板法共分离到土壤中的常见杆状、好气性细菌有芽孢杆菌、假单胞菌、节杆菌(节细菌属)(陈华癸等,1981),这些细菌在土壤适应性中比较强,且在稀释平板上易于生长。研究中同时分离到葡萄球菌、伯克氏菌、赖氨酸芽孢杆菌、 Solibacillus、短杆菌以及贪铜菌,这些细菌除贪铜菌、葡萄球菌外,均为本研究稀释培养获得的优势细菌和常见细菌,这些细菌主要与分解作用相关,如芽孢杆菌多为蛋白质分解者,葡萄球菌、伯克氏菌、赖氨酸芽孢杆菌、 Solibacillus、短杆菌在分解芳香类化合物以及固氮等方面具有一定的作用(Seo et al.,2009),稀有类群中贪铜菌、葡萄球菌可降解芳烃类、苯酚类等有机物(柴立元等,2010)。因此,就本研究获得的19类菌株的生态功能而言,稀释培养获得的细菌均可定义为参与落叶松凋落物分解并发挥着重要作用的菌落。已有研究表明,采用牛肉蛋白胨培养基培养的土壤细菌,一些容易培养的菌类如芽孢杆菌,比较容易分离,而一些耐性较强的菌类不容易分离(McCaig et al.,2001)。这使得土壤细菌群落结构和多样性与实际相比偏低,同时一些单细菌培养受实验室环境因子的制约不易培养,也导致其多度偏低,这与本研究的结果相似,即芽孢杆菌的种类与数量比例偏高。近年来,采用通过分子技术提取土壤DNA的方法提高了土壤细菌优势种的鉴定水平并加深了对其自然生境的理解(Lee et al.,2000),但随着一些目标细菌培养基成分的不断改进,室内细菌培养仍是了解细菌的生态学以及相关知识不可或缺的方法(Kawanishi et al.,2011;Janssen et al.,2002)。
与其他针叶植物相似的是,兴安落叶松(L.gemelinii)因其木质素含量明显高于纤维素和半纤维素而不利于其纤维素与半纤维素的降解,即木质素抑制微生物的生长与扩繁(Melillo et al.,1982),因而兴安落叶松凋落物分解时间相对较长(孙楠等,2012)。凋落物分解除了受凋落物本身化学组成的影响外,环境因子如土壤水分、土壤pH、地表温度、相对湿度也影响着凋落物的分解过程。凋落物分解速率与土壤水分、地表温度和土壤pH呈指数正相关,与相对湿度呈线性正相关(郭继勋等,1993)。本研究区域受欧亚大陆季风气候影响,具有温带季风气候特征,气象要素主要受大气下垫面林型和林地郁闭度影响(陈祥伟等,1995),造林密度在一定意义上增大了林地的郁闭度而利于改善林内小气候。但2种凋落物袋分解过程中土壤细菌数量与郁闭度没有显著的相关性(P > 0.05),且不同造林密度中土壤细菌数量变化不一致,总的趋势是同孔袋分解过程中土壤细菌数量低于异孔袋。在凋落物分解过程中,同孔袋因其网孔过小,阻碍了土壤动物的进出,减少了土壤动物对网孔落叶的粉碎和自身的消化作用,而不利于土壤细菌侵入(林英华等,2005),凋落物分解释放到土壤的养分偏低,因此同孔袋土壤细菌总数低于异孔袋下土壤细菌数,一些适应性较强的细菌数量偏高,即表现为同孔分解袋下土壤细菌分布不均匀,细菌优势现象明显,多样性较丰富现象,但2种凋落袋下土壤细菌群落相似性较高且变化趋势相近,反映出不同造林密度落叶松林对土壤细菌群落组成影响较小,与主成分分析结果相吻合。
3.2 土壤细菌与土壤主要性质相关性土壤微生物生态分布受土壤发育母质、发育历史、土壤肥力、季节、地表植被状况、土壤深度等影响(陈声明等,2007)。本研究选取土壤主要性质以及土壤细菌优势类群与常见类群进行典型相关分析。结果表明:杂种落叶松土壤细菌菌属与土壤因子前2个排序轴相关系数分别为0.98和0.78(表 4),呈现出显著的相关关系;土壤细菌主要类群第1轴与第2轴的相关系数仅为-0.04,即2个轴近乎垂直;土壤因子第1轴与第2轴的相关系数为0,而2个排序轴的贡献率分别是74.8%和87.6%,表明CCA分析的排序结果可信。相关分析结果还进一步表明:细菌的9个属中,仅短杆菌、伯克氏菌、贪铜菌、 Solibacillus细菌与土壤主要理化性质存在显著的相关性(表 4),反映出仅部分土壤细菌,如伯克氏菌、 Solibacillus与土壤pH、土壤全氮(P < 0.10),贪铜菌与土壤C/N比(P < 0.10)存在显著相关关系,其他均不存在显著的相关性,表明影响土壤细菌多度的因素可能是环境因子综合作用的结果。
|
|
| [1] |
柴立元,陈跃辉,黄燕,等.2010.三国吴简蚀斑可培养微生物的多样性.中南大学学报:自然科学版,41(5): 1674-1679.( 1) 1)
|
| [2] |
陈华癸,李阜康,陈文新,等.1981.土壤微生物学.上海:上海科学技术出版社,10-12.( 1) 1)
|
| [3] |
陈声明,林海萍,张立钦.2007.微生物学导论.北京:高等教育出版社.( 1) 1)
|
| [4] |
陈祥伟,魏占才,曹文英,等.1995.张广才岭西坡人工针叶林小气候效应的研究.东北林业大学学报,23(5): 29-36.( 1) 1)
|
| [5] |
东秀珠,蔡妙英.2001.常见细菌系统鉴定手册.北京:科学出版社.( 1) 1)
|
| [6] |
郭继勋,祝廷成.1993.羊草草原枯落叶分解的研究.生态学报,13(3): 214-219.( 1) 1)
|
| [7] |
林英华,孙家宝,郑桂华,等.2005.帽儿山土壤动物在凋落叶分解过程中的动态和作用.东北林业大学学报,33(6): 33-36.( 1) 1)
|
| [8] |
孙楠,李亚洲,吴瑶.2012.造林密度对杂种落叶松人工林凋落物及其分解速率的影响.黑龙江生态工程职业学院学报,25(3): 17-18.( 2) 2)
|
| [9] |
孙楠,于秀兰,张怡春,等.2009.造林密度对杂种落叶松生长影响的初步分析.吉林林业科技,38(2): 1-4.( 1) 1)
|
| [10] |
王树力,孙悦,沈海燕,等.2009.不同密度杂种落叶松人工林的土壤微生物变化特征.中国水土保持科学,7(3): 59-66.( 1) 1)
|
| [11] |
Cao Y,Fu S,Zou X,et al.2010.Soil microbial community composition under eucalyptus plantations of different age in subtropical China.European Journal of Soil Biology,46: 128-135.( 1) 1)
|
| [12] |
Chen S,Steinberger Y.2012.Microbial functional diversity associated with plant litter decomposition along a climatic.Gradient Microbial Ecology,64: 399-415.( 1) 1)
|
| [13] |
Cornwell W K,Cornelissen J H C,Amatangelo K,et al.2008.Plant species traits are the predominant control on litter decomposition rates within biomes worldwide.Ecology Letter,11: 1065-1071.( 1) 1)
|
| [14] |
Fraterrigo J M,Balser T C,Turner M G.2006.Microbial community variation and its relationship with nitrogen mineralization in historically altered forests.Ecology,87: 570-579.( 1) 1)
|
| [15] |
Janssen P H,Yates P S,Grinton B E,et al.2002.Improved culturability of soil bacteria and isolation in pure culture of novel members of the divisions Acidobacteria,Actinobacteria,Proteobacteria and Verrucomicrobia.Applied and Environmental Microbiology,68: 2391-2396.( 1) 1)
|
| [16] |
Kawanishi T,Shiraishi T,Okano Y,et al.2011.New detection systems of bacteria using highly selective media designed by SMART: Selective medium-design algorithm restricted by two constraints.PLoS ONE,6(1): e16512.( 1) 1)
|
| [17] |
Lee D,Noh S,Kim C.2000.Development of molecular biological methods to analyze bacterial species diversity in fresh water and soil ecosystems.Journal of Microbiology,38(1): 11-17.( 1) 1)
|
| [18] |
McCaig A E,Grayston S J,Prosser J I,et al.2001.Impact of cultivation on characterisation of species composition of soil bacterial communities.FEMS Microbiology Ecology,35: 37-48.( 1) 1)
|
| [19] |
Melillo J M,Aber J D,Muratore F.1982.Nitrogen and lignin control of hardwood leaf litter decomposition dynamics.Ecology,63: 621-626.( 1) 1)
|
| [20] |
Nannipieri P,Ascher J,Ceccherini M T,et al.2003.Microbial diversity and soil functions.European Journal of Soil Science,54: 655-670.( 1) 1)
|
| [21] |
Schinner F.1982.Soil microbial activities and litter decomposition related to altitude.Plant and Soil,65: 87-94.( 1) 1)
|
| [22] |
Seo J,Keum Y,Li Q X.2009.Bacterial degradation of aromatic compounds.International Journal of Environmental Research and Public Health,6: 278-309.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49
