文章信息
- 王志龙, 谭志文, 何月秋, 王国良
- Wang Zhilong, Tan Zhiwen, He Yueqiu, Wang Guoliang
- 黄山栾树裂皮病和病原鉴定
- A New Koelreuteria bipinnata var. integrifoliola Disease—Bark Cracking and the Pathogen Identification
- 林业科学, 2012, 48(10): 95-100.
- Scientia Silvae Sinicae, 2012, 48(10): 95-100.
-
文章历史
- 收稿日期:2011-11-17
- 修回日期:2012-02-20
-
作者相关文章
2. 浙江万里学院生物与环境学院 宁波 315100
2. College of Biological & Environmental Sciences, Zhejiang Wanli University Ningbo 315100
黄山栾树(Koelreuteria bipinnata var. integri-foliola)适应性强、速生,树形高大优美,具有萌蘖力, 抗旱涝、抗风害、抗烟、抗二氧化硫能力较强, 又易于繁殖, 可通过“截干”移植并且易成活,近年来许多城市园林建设中纷纷引种栽植, 是我国城市绿化十大落叶树种之一(陆晓丽等,1999;陆瑞利等,2004;李秀芹等,2006)。2007—2010年在浙江省宁波市区调查发现:树龄近15年,胸径15~20 cm的大树,经过“截干”移植成活已经5~6年的黄山栾树发生严重裂皮病,主干树皮和韧皮部大量开裂、变褐色,然后大块脱落,裸露的木质部也变为褐色。病害严重的树木,叶子萎蔫,随后枯死。
近年来, 利用PCR扩增病原菌核糖体ITS (in-ternal transcribed spacer)基因区段进行病原菌鉴定、检测及病害诊断技术得到了广泛应用(Schubert et al, 1999;Bonants et al, 1997;Volossiouk, 1995)。用特异性引物对病原菌的DNA进行扩增, 结合分子技术进行种类鉴定使鉴定结果更为可靠。为控制该病害的危害,生产上迫切需要对该病害确诊及进行病原菌鉴定,2008—2010年,笔者对该病害进行了初步研究,旨在为有效控制该病提供理论依据。
1 材料与方法 1.1 病害观察与调查 1.1.1 病害症状观察观察地点设在宁波市区内不同程度发生裂皮病的黄山栾树绿化带中。从4月底黄山栾树发新叶开始, 直到11月中旬落叶为止,不定期,定绿化带、定植株进行观测。同时取发病严重树木的主干树皮、韧皮部和枯死树主干的横切面,28 ℃下保湿培养10~15天后观察病部症状。
1.1.2 病害发生情况调查2009年和2010年8—9月,对宁波市4个公园、5所高校和24条道路的园林绿化带中的33个黄山栾树种植带作了随机调查,以独立的黄山栾树种植带为单位,统计发病情况。
1.2 病原菌分离从病树褐色木质部取大约1 mm厚的薄片,自来水冲洗,切成2 mm大小,用0.1%升汞表面消毒30 s,无菌蒸馏水冲洗,马铃薯葡萄糖琼脂(PDA)上28 ℃培养,用单菌丝法获得纯分离菌(方中达,1998)。
1.3 致病性测定选取5年生健康的黄山栾树,用蘸有70%的酒精脱脂棉球轻轻擦拭主干部位接种处,再用蘸有无菌水的棉球搽洗3次,然后用灭菌接种针轻轻刺破其表皮(9针·cm-2),将PDA上培养6天的KL-1-2菌株菌落切成长10 mm、宽10 mm的菌块, 将菌块正面粘贴于受伤的接种处,共接种20株,每株接1菌块。接种后包湿润的脱脂棉和PE保鲜膜保湿。10株接无菌PDA培养基为对照。60天后调查结果,并对试验树木内部木质部变褐色的2个植株再次作上述病原菌分离。
1.4 病原菌的分子鉴定真菌DNA基因组提取试剂盒:Universal DNA Genomic Extraction Kit Ver 3.0(大连TakaRa,Cat#DV811A);PCR扩增试剂盒:TaKaRa PCR Amplification Kit(Cat#DR011)。采用通用引物对ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)对真菌全长ITS区序列(包含18S rDNA,28S rDNA的部分序列和中间的ITS1区﹑5.8S rDNA﹑ITS2区的完整序列)进行PCR扩增。
真菌基因组的提取:菌种来自致病性测定后的黄山栾树裂皮病病原菌的KL-1-2和KL-3-1菌株。取PDA平板上的菌丝体适量于已经灭菌的研钵中,然后加入液氮研磨破碎,按照TaKaRa基因组提取试剂盒上操作说明进行提取基因组。
1.4.1 rDNA-ITS扩增50 μL PCR反应体系中加入通用引物对,真菌基因组模板以及PCR试剂盒中的相关试剂。在一定PCR反应条件下(94 ℃ 2 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 90 s,35 cycles;72 ℃ 7 min),扩增全长序列的ITS。将PCR产物用1%凝胶进行电泳30 min,电泳结束后将凝胶进行染色,然后在凝胶成像仪上观察是否扩增出目的条带。
1.4.2 rDNA-ITS测序与分析将扩增出来的目的核酸片段送杭州华大基因研究院纯化后进行测序。将测序结果提交NCBI(美国国立生物技术信息中心)的GENBANK进行同源性比对,选取同源性靠前的序列,使用MEGA 4软件以Neighbor-Joining方法构建系统发育树,EF429316立枯丝核菌(Rhizoctonia solani)为外类群,经bootstrap法1 000次循环检验系统树可靠性。
1.5 病原菌生物学研究菌种来自致病性测定后黄山栾树裂皮病病原菌的KL-1-2菌株。设计不同碳源、温度、pH值、光照、氮源对黄山栾树裂皮病菌生长的影响等多个试验。用直径5 mm的打孔器在培养48 h的病菌菌落顶端打孔,孔内的菌饼随机放入各处理、各重复的培养基中,48 h后测量菌落直径。
不同碳源试验:以蔡氏培养基为基本培养基,用7种不同碳源替换蔗糖,以PDA为对照,共9个处理、3次重复,在25 ℃人工气候箱中黑暗培养24 h后测定菌落直径。
不同温度试验:蔡氏培养基,设10,15,20,25,30,35,40 ℃ 7个温度梯度。
不同pH试验:蔡氏培养基,用1 mol·L-1的NaOH和HCL溶液配制成pH值分别为3.26,4.01,4.97,5.97,6.86,7.82,9.106,10.41共8种不同处理。
不同光照试验:蔡氏培养基,设黑暗、光照(4 000 lx荧光灯)和半光照(12 h光照/12 h黑暗)等3种光照条件。
不同氮源试验:以蔡氏培养基为基本培养基,用6种不同氮源替换NaNO3(增加1 g·L-1氯化钠),共8个处理。除了不同pH试验外,其他试验的pH自然。各处理3次重复,用人工气候箱中培养24 h后测定菌落直径。各处理的数据用DPS数据处理系统(唐启义等,2007)中的Duncan新复极差法作显著性分析。
2 结果与分析 2.1 病害调查观察病害症状:发病树主干树皮和韧皮部大量开裂、变褐色,以后大块脱落,裸露的木质部也变褐色(图 1-a, b, c)。树皮、韧皮部的开裂常从伤口处开始,特别是移植时的“截干”处理(移植前裁去全部枝条,只留大约3 m左右的主干和根部)造成的巨大伤口(图 1-a)。病害严重的树木,新梢发生少、夏季叶子萎蔫,以后树木枯死。枯死病树根部仍具有一定活力,主干横切面上出现淡褐色大面积病斑,并有深褐色环线(图 2)。

|
图 1 黄山栾树裂皮病症状 Fig.1 Symptoms of Koelreuteria bipinnata var. integrifoliola disease a.截干处及主干上的症状Symptoms of serious bark cracking in cut stem and stem; b.主干中部树皮大量开裂Symptoms of serious bark cracking in middle part of stem; c.主干下部裸露变褐色的木质部Large shedding and exposed xylem turning brown in lower part of stem. |

|
图 2 黄山栾树裂皮病主干横切面病状 Fig.2 Symptoms on cross section of main stem of Koelreuteria bipinnata var. integrifoliola disease 有淡褐色大面积病斑和深褐色环线。There are large light brown lesions and dark brown outer margin. |
发病严重的树木,其主干树皮、韧皮部和枯死树主干的横切面,经保湿培养10~15天后,韧皮部和枯死树主干的横切面上出现大量墨绿色到黑色的霉菌。体视显微镜100倍下观察到病部全是菌丝体,没有子实体。菌丝体经制片镜检发现,菌丝发达、墨绿色,有分隔和不规则分支,有厚垣孢子状的膨大菌丝细胞(图 3)。树皮上生长出多种霉菌,没有发现子实体。

|
图 3 病原菌的菌丝体(a)与分生孢子(b, c) Fig.3 Mycelium (a) and conidia (b, c) of pathogen |
病害发生危害情况调查:33个黄山栾树种植带的发病情况可以分成3类:第1类,裂皮病发病严重并有部分树木全株枯死;第2类,裂皮病发病严重但是树木未枯死;第3类,裂皮病发病但是不严重。调查结果,第1类有3个种植带,占9.09%。该类型特点是裂皮病发病率95%~100%,其中枯死树(绿化养护单位只能用移植新的黄山栾树替换)比例为15%~31.91%,它们的树龄近15~20年,胸径20~25 cm,是经过“截干”移植成活已经5~8年,即“截干”移植时胸径已经达到15 cm以上的大树。第2类有21个种植带,占63.64%。该类型特点是裂皮病发病率65%~95%,但是没有枯死树。它们的树龄近10~15年,胸径15~20 cm,都是经过“裁冠”(移植前裁去树冠,留大约4~5 m以下的全部枝条)或“截干”移植成活已经4~6年,即移植时胸径已经达到10 cm以上的中树。第3类有9个种植带,占27.27%。该类型只有树皮开裂和少量的龟裂,未出现树皮大块脱落。树龄10年左右,胸径10~15 cm,都是经过少量“裁冠”或者不“裁冠”移植成活已经3~5年中树。其中在老城区中发现有一处黄山栾树种植带,此处生长已有20多年,胸径25~35 cm,裂皮病发生轻微,只有树皮开裂,没有龟裂和脱落。根据它们的主干和主要枝条生长情况分析,是经过少量“裁冠”或者不“裁冠”移植成活的。以上调查结果表明裂皮病的发生和危害程度同移植时造成的伤口,特别是大树“截干”造成的大伤口有密切关系。
2.2 病原菌分离病菌在PDA平板上的菌落呈圆形或近圆形。菌落边缘不整齐, 初期灰白色, 后转墨绿色或黑色。菌丝发达, 绒毛状、有分隔、不规则分支,有厚垣孢子状的膨大菌丝细胞(图 3-a)。从3株病树的15个病组织上分离到12个具典型菌落的菌株,其中2个菌株KL-1-2和KL-3-1在PDA平板上28 ℃培养30天可产生
分生孢子器和分生孢子。分生孢子器为黑色颗粒状,周围有绒状灰黑色菌丝。分生孢子椭圆形或卵形, 初期单胞无色, 老熟后变褐色, 近中部有一横隔。分生孢子大小为(23.2~27.0) μm×(10.8~16.2) μm(平均25.3 μm×13.6 μm)(图 3-b, c)。这些形态特征与可可毛色二孢[Lasiodiplodia theobromae=Botryodiplodia theobromae的有性阶段:葡萄座腔菌(Botryosphaeria rhodina)]相符(Fu, 2007)。在研究过程中未发现病原菌的有性型。
2.3 致病性测定共接种20株,致病性测定试验结果表明:有17株接种部位主干树皮和韧皮部开裂,占85%;其中6株树皮龟裂、内部木质部变褐色占33%。再次从变褐色木质部中分离到原接种菌。经柯赫氏法则证明该分离菌是黄山栾树裂皮病的病原菌。
2.4 病原菌的分子鉴定 2.4.1 PCR扩增结果以基因组试剂盒提取的基因组为模板,使用ITS1和ITS4引物对KL-1-2和KL-3-1进行PCR反应,均扩增出大小位于500~750 bp之间的单一条带,其大小符合真菌全长ITS序列长度范围(600 bp左右)。
2.4.2 rDNA-ITS序列测序与比对结果菌株KL-1-2测序结果显示:该真菌全长ITS区序列的长度为541 bp,序列结果如下:TCCGTAGGTGAACCTGCGGAAGGATCATTACCGAGTTTTCGGGCTTCGGCTCGACTCTCCCACCCTTTGTGAACGTACCTCTGTTGCTTTGGCGGCTTCGGCCGCCAAAGGACCTTCAAACTCCAGTCAGTAAACGCAGACGTCTGATAAACAAGTTAA TAAACTAAAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCCTTGGTATTCCGGG GGGCATGCCTGTTCGAGCGTCATTACAACCCTCAAGCTCTGCTTGGAATTGGGCACCGTCCTCACTGCGGACGCGCCTCAAAGACCTCGGCGGTGGCTGTTCAGCCCTCAAGCGTAGTAGAATACACCTCGCTTTGGAGC GGTTGGCGTCGCCCGCCGGACGAACCTTCTGAACTTTTCTCAAGGTGACCTCGGATCAGGTAGGGATACCCGCTGAACTTAAGCATATCAATAAGCGGAGGA
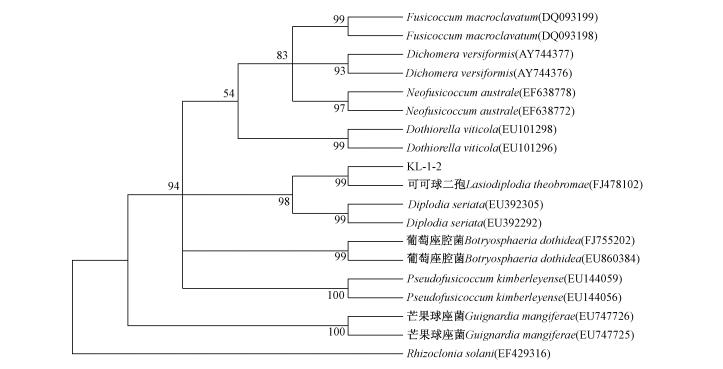
将上述序列在Genbank核酸序列库中进行blastn搜索,结果显示:该真菌的全长ITS序列与可可毛色二孢相似性高达99%(登录号FJ478102.1),二者可以视为同一种。选取Genbank中与该菌株相似性较高的序列,利用MEGA4做进化树。由图 4可知:该真菌株与可可毛色二孢处于同一分支,说明他们的亲缘关系比较近,bootstrap值达到99%。
|
图 4 基于rDNA-ITS序列采用邻接法构建的可可毛色二孢KL-1-2菌株与相关种的系统发育树 Fig.4 ITS rDNA phyolgenetic tree of endophytic L.theobromae KL-1-2 by Negihbor-joninig method |
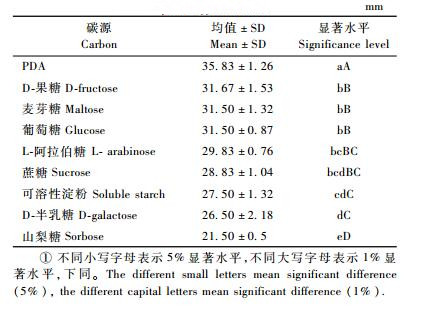
不同碳源对病原菌可可毛色二孢菌落生长试验的结果见表 1。
|
|
表 1结果说明:不同碳源对可可毛色二孢菌落生长差异很大。PDA(马铃薯琼脂培养基)极异显著性好于其他8种以蔡氏培养基为基础的不同碳源处理,表明该菌在半合成培养基的生长极异显著性优于合成培养基上的生长。蔗糖、果糖、麦芽糖、葡萄糖、阿拉伯糖之间没有显著差异,但是果糖、麦芽糖、葡萄糖处理极显著地优于可溶性淀粉、半乳糖、山梨糖的处理。
不同温度试验的结果:温度和菌落直径分别为,10 ℃、0.0 cm,15 ℃、14.17 cm,20 ℃、22.83 cm,25 ℃, 31.17 cm,30 ℃、32.50 cm,35 ℃、29.83 cm,40 ℃、7.33 cm。显著性分析结果,25 ℃、30 ℃和35 ℃之间没有差异,但是极显著优与其他处理。另外20, 15, 40 ℃之间都有极显著差异,表明该菌最适宜的生长温度范围是25~35 ℃。
不同pH试验结果:pH,菌落直径和1%极显著水平(A)分别为,pH 5.97, 32.67 mm,A; pH 4.97, 31.33 mm、AB; pH 6.86、31.0 mm、AB; pH 4.01、39.86 mm、BC; pH 7.82, 29.67 mm、BC; pH 3.26, 28.0 mm, C; pH 9.16, 27.67 mm, C; pH 10.41、22.67、D, 表明在中性和微偏酸性条件下有利于病菌生长。
不同光照处理试验结果为在黑暗、1/2光照和全光照各处理的菌落直径分别为34.17、34.0和31.33 mm, 1%极显著水平之间没有差异,但是5%显著水平时全光照处理显著差于其他2处理,表明4 000 lx荧光灯连续处理对该菌的生长有一定的抑制作用。
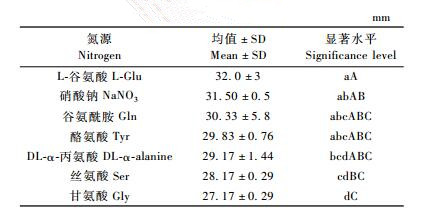
不同氮源对可可毛色二孢菌落生长试验的结果见表 2。
|
|
表 2的数据表明:该菌的生长对氮源不很敏感。除了谷氨酸极显著优于丝氨酸、甘氨酸外,其他几种氮源处理之间在1%极显著水平上没有差异。
3 结论与讨论黄山栾树裂皮病是近年发生的一种新病害。作者进行了4年的调查并首次对其病原菌进行了鉴定, 明确了其, 明确了其侵染性、分类归属和生物学特性。这些结果对进一步研究该病害的防治技术提供了科学依据。
以真菌的形态学、生理生化特性等为依据的真菌分类学是传统的鉴定手段。随着分子遗传学的发展,人们发现rDNA-ITS区序列在真菌的分类学鉴定上具有十分重要的意义,可以作为真菌分子进化的系统研究,为真菌的鉴定提供了新的依据。Renske等(2003)提出,在进行ITS的同源性比对时,序列相似性≥99%,可鉴定为相同种;序列相似性在95%~99%之间,可鉴定为相同属;序列相似性≤95%,可鉴定为相同科。根据对本文的目标菌的形态学观察、生理生化特性,经柯赫氏法则证明该分离菌即为该病害的致病菌,另根据rDNA-ITS序列的分析结果,将黄山栾树裂皮病菌鉴定为可可毛色二孢。黄山栾树裂皮病病部裸露木质部变褐色,主干横切面上有淡褐色大面积病斑等症状同多主枝黑心菌(Botryodiplodia theobromae)危害柿(Diospyros kaki), 板栗(Castanea mollissima), 茶(Camellia)等,并使木质部分变黑枯死(魏景超,1979)相似。
可可毛色二孢在DPA平板上生长较快,25 ℃、24 h达到35.8 mm, 同肉桂枝枯病病原可可毛色二孢在30 ℃的条件下,菌落直径扩展速率可达7 cm·d-1(文新等,1995)相近,这可能是黄山栾树裂皮病菌的生长特点。本研究分离到12个菌株,只有2个菌株KL-1-2和KL-3-1在PDA平板上28 ℃培养30天可产生分生孢子器和分生孢子。文新等(1995)报道孢子器的产生则需要20天左右。张居念等(2005)认为产生子座的最适温度为30 ℃, 最适pH为6.0。史国英等报道(2010)该菌在pH 3~4的培养基上可产生子座, 培养60天后可见成熟的分生孢子,而在其他pH培养基上均未观察到子座的形成。表明不同寄主上的可可毛色二孢和可可毛色二孢种内不同菌株之间在形成分生孢子器的条件等有比较大的差异。
调查表明,黄山栾树裂皮病的发生和危害程度同移植时造成的伤口,特别是大树“截干”造成的大伤口有密切关系。建议园林绿化单位在移植时尽量通过少量“裁冠”或者不“裁冠”的方法移植黄山栾树,并且对伤口喷、涂具保护和内吸作用的杀菌剂,预防黄山栾树裂皮病的严重发生和危害。
| [] | 方中达. 1998. 植病研究法. 3版. 北京, 中国农业出版社. |
| [] | 李秀芹, 张欢亭, 张国斌. 2006. 黄山栾树大苗培育技术. 林业实用技术, 12: 38–39. |
| [] | 陆晓丽, 窦全琴. 1999. 优良观赏绿化树种-黄山栾树. 江苏绿化(4): 25. |
| [] | 陆瑞利, 胡丰林, 丁晓娟, 等. 2004. 黄山栾树叶中具有清除自由基活性物质的分离和制备. 安徽农业大学学报, 31(2): 207–211. |
| [] | 唐启义, 冯明光. 2007. DPS数据处理系统. 北京, 科学出版社. |
| [] | 魏景超. 1979. 真菌鉴定手册. 上海, 上海科学技术出版社: 434-442. |
| [] | 文新, 宋力, 黎启枪, 等. 1995. 肉桂枝枯病病原研究. 微生物学报, 35(3): 152–185. |
| [] | 史国英, 胡春锦, 罗掉爱, 等. 2010. 毛葡萄穗轴褐腐病病原菌鉴定及其生物学特性. 植物病理学报, 40(3): 242–249. |
| [] | 张居念, 林河通, 谢联辉, 等. 2005. 龙眼焦腐病菌及其生物学特性. 福建农林大学学报:自然科学版, 34(4): 426–429. |
| [] | Bonants P, Weerdt M H, Lacourt I, et al. 1997. Detection and identification of Phytophthora fragariae by the polymerase chain reaction. European Journal of Plant Pathology, 103(4): 345–355. DOI:10.1023/A:1008640227432 |
| [] | Fu G, Huang S L, Wei J G, et al. 2007. First record of Jatropha podagrica gummosis caused by Botryodiplodia theobromaein China. Australasian Plant Disease Notes, 2(1): 75–76. DOI:10.1071/DN07030 |
| [] | Renske L, Paula L, ThomW K. 2003. Molecular dientificatoin of ectomycorrhizal myceilum in soli horzions. Appiled and Envrionmental Mciroboiolgy, 69(1): 327–333. |
| [] | Schubert R, Bahnweg G, Nechwatal J, et al. 1999. Detection and quantification of Phytophthora species which are associated with root-rot diseases in European deciduous forests by species-specific polymerase chain reaction. European Journal of Forest Pathology, 29(3): 169–188. DOI:10.1046/j.1439-0329.1999.00141.x |
| [] | Volossiouk T, Robb E J, Nazar R N. 1995. Direct DNA extraction for PCR-mediated assay of soil organisms. Applied and Environmental Microbiology, 61(11): 3972–3976. |
 2012, Vol. 48
2012, Vol. 48