文章信息
- 马飞, 徐婷婷, 张晓玮, 赵长明
- Ma Fei, Xu Tingting, Zhang Xiaowei, Zhao Changming
- 肋果沙棘幼苗对CO2浓度升高的生理生态响应
- Ecophysiological Responses of Seedlings of Hippophae neurocarpa to Elevated Carbon Dioxide
- 林业科学, 2012, 48(10): 30-35.
- Scientia Silvae Sinicae, 2012, 48(10): 30-35.
-
文章历史
- 收稿日期:2011-09-23
- 修回日期:2012-04-13
-
作者相关文章
2. 宁夏大学生命科学学院 银川 750021;
3. 兰州大学生命科学学院 干旱与草地教育部重点实验室 兰州 730000
2. School of Life Science, Ningxia University Yinchuan 750021;
3. Key Laboratory of Arid and Grassland Ecology, Ministry of Education School of Life Sciences, Lanzhou University Lanzhou 730000
据美国夏威夷Mauna Loa观测站记录显示:1958年大气CO2浓度为315 μmol·mol-1,2005年上升到379 μmol·mol-1,并每年以1~2 μmol·mol-1的速度继续增加。预计到21世纪末,大气CO2浓度将升高至大约700 μmol·mol-1(IPCC,2007)。CO2是植物光合作用的底物,其浓度的升高不仅直接作用于植物生长发育的重要生理过程,如光合、呼吸、蒸腾作用等;且CO2浓度升高所引起的气候变暖和其他极端气候事件及它们的交互效应也将间接作用于植物的生理生态过程(Stitt et al., 1999;Pal et al., 2005;Albert et al., 2011),影响植物生长和发育,进而影响植被的组成、结构和功能。自20世纪90年代,植物对CO2浓度升高的生理生态响应及适应机制成为生理生态学一个重要的研究热点,并开展了诸多关于CO2浓度升高对植物光合作用(Bunce,1992;Garcia et al., 1998;Rey et al., 1998;Centritto et al., 2002;Reddy et al., 2010)、水分利用效率(Centritto et al., 2002)、生物量累积(Drake et al., 1997;Centritto et al., 1999;Reddy et al., 2010;曹兵等,2011)、叶片性状(Centritto et al., 2002)以及光合作用关键酶含量(Sage et al., 1989)等方面的研究。由于种类、品种、土壤条件、其他环境因子以及植物适应能力的不同,植物对CO2浓度升高的生理生态响应也存在差异(Curtis et al., 1998)。
青藏高原是对气候与环境变化最为敏感的地区之一(施雅风等,1998)。肋果沙棘(Hippophae neurocarpa)是胡颓子科(Elaeagnaceae)沙棘属的一个仅分布于青藏高原高海拔地区的类群,为群落演替的先锋物种,生态价值突出同时又具有重要的医用、药用和食用价值,特别是沙棘油的医用和药用价值高,在中国、俄罗斯、中亚以及欧洲等地得到了广泛的开发利用。全面了解肋果沙棘对以CO2浓度和温度升高为主要特征的气候变化的响应及适应机制,有助于分析和预测该种在气候变化下的生长潜力和发展应用前景,同时对研究其他树种对气候变化的响应机制也具有一定的指导意义。虽然目前对肋果沙棘的风媒传粉特征(张玉娜等,2009)、种子萌发特性(孙坤等,2009)、谱系地理(孟丽华等,2008)等进行了一些研究,但是缺乏其对气候变化的响应和适应机制的研究。本文拟以青藏高原的特有种肋果沙棘为研究对象,通过研究当前和倍增CO2浓度下肋果沙棘幼苗的气体交换特征、水分利用效率、叶片性状和生长特性,以期揭示肋果沙棘对大气CO2浓度升高的生理生态响应及适应机制。
1 材料与方法 1.1 试验材料本试验的研究对象为3个月的肋果沙棘实生苗,种子于2007年9月采自西藏邦达。
1.2 试验设计2009年5月初将健康、长势一致的肋果沙棘实生苗移植花盆中,土壤为泥炭土和蛭石混合物(泥炭土:蛭石为1:2),每盆1株,并随机摆放于探入式植物生长箱内(Conviron,E7/2,Canada)。生长箱具有上下2个箱体,每个箱体体积约为0.5 m3,并由系统独立控制箱体内光照、温度、湿度和CO2浓度。在经过一周的适应生长后,将实生苗随机选择,分置于生长箱的2个处理箱内开始进行CO2浓度倍增处理。试验设置2个处理:对照[CK,CO2浓度为(360±10)μmol·mol-1]和倍增处理[DT,CO2浓度为(720±10)μmol·mol-1],每个处理设置10盆作为重复。箱内的CO2浓度由气候箱的控制系统自动控制,气源为固体CO2钢瓶;2个箱体内的环境条件从试验初始(2009-05-11)到试验结束(2009-08-15)的整个过程中始终控制在:光照强度200~250 μmol·m-2s-1,光照周期12 h/12 h(昼/夜),温度25 ℃/18 ℃(昼/夜),相对湿度为50%~60%。另外,每天对所有花盆进行充分浇水,并将2个处理箱定期轮换进行CO2倍增处理。
1.3 试验方法 1.3.1 气体交换特征测定在试验末期,选取健康植株中上部完全展开的叶片置于便携式光合作用测量系统LI-COR6400(LI-COR Lincoln,NE,USA)的叶室内,在LI-6400-02B LED红蓝光源下适应15~20 min,然后测定不同光照强度下的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)。光照强度设定分为1 000,800,500,300,150,80,40,0 μmol·m-2 s-1,CO2浓度由LI-6400的CO2泵控制在与处理相同的CO2浓度水平,温度和湿度与气候室基本保持一致。每个种选取3~4棵植株进行气体交换测定作为重复。标记测定气体交换的叶片并测其面积,以便计算单位面积的光合作用速率、气孔导度、蒸腾速率。水分利用效率表示为净光合速率与蒸腾速率的比值(Pn/Tr)。然后通过软件拟合出最大净光合速率、表观量子效率、光补偿点、光饱和点、暗呼吸速率等重要光合生理指标。
1.3.2 生长测定处理前测定各株幼苗株高、基径和总叶片数,试验收获时再次测定植株株高、基径和总叶片数,同时将试验植株分割为根、茎和叶3部分,置于烘箱内70 ℃烘干至恒质量,称干质量,计算出总生物量积累量及生物量的分配情况。
1.3.3 叶片碳、氮元素含量的测定试验结束时,在测定气体交换参数叶片的周围选取5~10片叶,测定面积,然后置烘箱内70 ℃烘干,称质量,计算平均单叶面积和比叶面积。叶片碳元素和氮元素含量测定方法参照马飞等(2009)。
1.3.4 数据分析采用SPSS 16.0统计软件对数据进行差异显著性检验,所有数据用Origin 8.0软件作图。
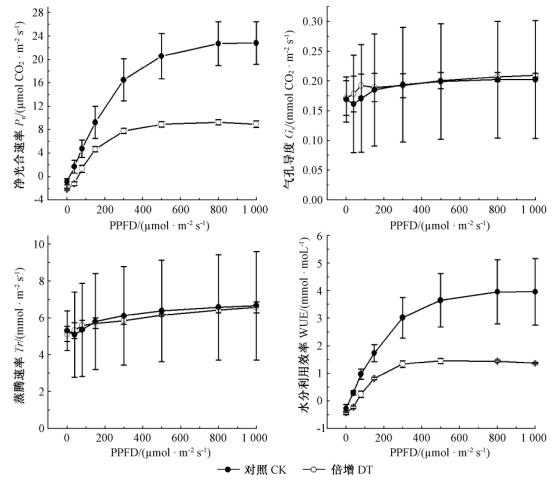
2 结果与分析 2.1 倍增CO2浓度对肋果沙棘叶片气体交换的影响由图 1可知:倍增CO2浓度显著提高肋果沙棘叶片的净光合速率(P < 0.01)。与对照相比,高CO2浓度下叶片的最大光合速率、表观量子效率、光饱和点分别增加152%,81%,34%,光补偿点和暗呼吸强度分别下降59%,38%(表 1)。而且,由于CO2浓度升高对气孔导度和蒸腾速率影响不明显(P>0.05),从而使CO2浓度倍增条件下的水分利用效率(WUE)明显升高。
|
图 1 升高CO2浓度对肋果沙棘幼苗叶片气体交换特征和水分利用效率的影响 Fig.1 Effect of elevated [CO2] on leaf gas exchange and water use efficiency of seedlings of H. neurocarpa |
|
|
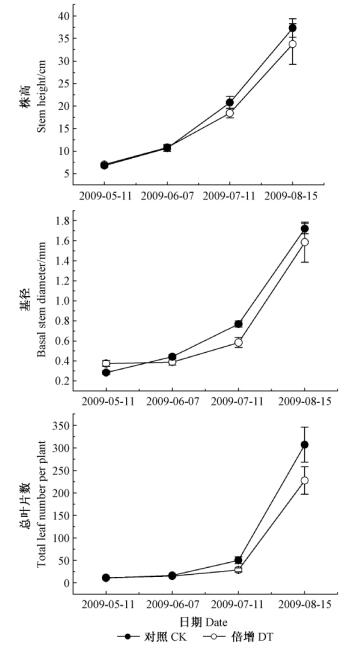
由图 2可知:测定肋果沙棘幼苗的株高、基径和总叶片数,结果表明:在试验初期(5月和6月),肋果沙棘幼苗的株高、基径和总叶片数对照和处理间不存在明显差异,但是在试验后期(7月和8月)的测定结果表明两者之间出现明显差异,尤其是收获时,与对照相比,生长于高CO2浓度下的肋果沙棘幼苗的株高、基径和总叶片数分别增加14%,19%和38%。
|
图 2 升高CO2浓度对肋果沙棘幼苗株高、基径和总叶片数的影响 Fig.2 Effect of elevated [CO2] on stem height, basal stem diameter and total leaf number of seedlings of H. neurocarpa |
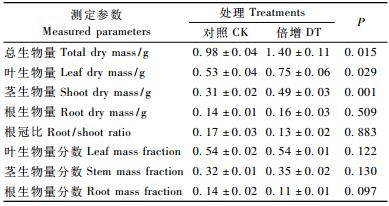
由表 2可知:CO2浓度倍增处理的肋果沙棘幼苗的总生物量、叶生物量、茎生物量和根生物量分别比对照增加了43%,42%,57%和18%。虽然倍增CO2处理并未对肋果沙棘的根冠比、叶生物量分数、茎生物量分数、根生物量分数产生显著影响(P>0.05),但本试验结果表明在高CO2浓度下,肋果沙棘的根冠比降低24%,茎生物量分数增加9%,根生物量分数降低21%。
|
|
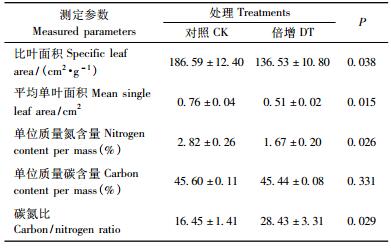
由表 3可知:CO2浓度倍增处理下,肋果沙棘的比叶面积和平均单叶面积均呈下降趋势。与对照相比,CO2浓度倍增处理使比叶面积和平均单叶面积分别显著下降27%和33%(P < 0.05)。肋果沙棘叶片元素含量在处理和对照间也表现出较大差异。同时,倍增CO2浓度还使肋果沙棘幼苗的叶片氮含量显著降低(P < 0.05),碳氮比明显增加(P < 0.05),但对叶片碳含量的影响不明显(P>0.05)。与CK相比,倍增CO2浓度处理使叶片氮含量降低41%,碳氮比分别增加73%。
|
|
本文通过对青藏高原特有种肋果沙棘的研究发现:在经过CO2浓度倍增处理后,肋果沙棘幼苗的最大净光合速率与对照相比提高了152%(表 1),说明高CO2浓度对肋果沙棘幼苗光合作用具有明显的促进作用。这与其他一些植物对CO2浓度的响应试验中高CO2浓度能促进植物光合作用的研究结果一致,即CO2的“施肥效应”明显(高素华等,2004;Centritto et al., 2002;Reddy et al., 2010)。同时,本研究表明:在高CO2浓度下,肋果沙棘幼苗的表观量子效率和光饱和点明显高于对照,光补偿点和暗呼吸强度明显下降(表 1),这也与之前研究结果一致(陈德祥等,2004;张小全等,2000)。
光合作用与植物的生长密切相关,光合速率的高低直接决定着植物物质积累能力的高低,在一定程度上也决定了植物生长的快慢。然而,植物对高CO2浓度的响应因物种(光合途径差异)、处理时间和其他环境因子的差异而不同,从而使植物在高CO2下的干物质积累也表现出较大差异(Curtis et al., 1998)。通过对大量研究结果的综合分析可以看出:由于植物的光合作用途径的差异,倍增CO2浓度处理可使C3,C4,CAM植物的生物量分别增加44%(Wand et al., 1999;Poorter et al., 1992),33%(Kimball,1983)和35%(Drennan et al., 2000)。这与笔者研究结果一致,在高CO2浓度下,肋果沙棘幼苗的总生物量累显著高于对照(P < 0.05),增长幅度为43%(表 2)。而且,肋果沙棘的根冠比在倍增CO2浓度下降低24%,这可能是肋果沙棘减少了地下部分的生长,将更多的生物量分配到地上部分,且主要是茎的生长(表 2),这种改变将促进植株向上生长,可能有助于植物获取更多光能,在竞争中处于优势地位。
气孔是植物进行CO2和水气交换的重要通道,而气孔导度是反映植物叶片气体交换能力的一个重要生理指标,高CO2浓度对气孔导度的影响就很重要。诸多研究表明:植物的气孔导度对大气CO2变化敏感,高CO2浓度可降低植物的气孔导度,如在CO2倍增时,栓皮栎(Quercus variabilis)下降14% (谢会成等,2002),垂枝桦(Betula pendula)下降21% (Rey et al., 1998),纸桦(Betula papyrifera)、美洲落叶松(Larix laricina)、黑云杉(Picea mariana)、北美短叶松(Pinus banksiana)下降10%~25%(Tjoelker et al., 1998);也有研究表明:高CO2浓度对气孔导度没有明显影响,如苹果(Malus domestica)、栗栎(Quercus prinus)、夏栎(Quercus robur)、挪威云杉(Picea abies)在高CO2浓度下几乎没变化(Bunce,1992;Roberntz et al., 1998)。气孔导度对高CO2浓度的响应因物种不同而存在较大差异,而造成这种差异响应的原因,目前尚不清楚(王亚萍等,2008)。本研究结果与后者一致,即倍增CO2浓度并未显著影响肋果沙棘幼苗的气孔导度和蒸腾作用,从而致使肋果沙棘的水分利用效率在CO2倍增下显著提高,这也与其他研究结果一致(Centritto et al., 2002;高素华等,2004).
升高CO2浓度有利于植物组织中碳水化合物的积累,降低含氮量,使C/N比增加,而且植物叶片氮含量在高CO2浓度下的降低被认为是植物产生“光合下调”的原因之一,是对高CO2浓度的一种适应性表现(Pitelka,1994;Coudteaux et al., 1999;Booker,2000)。本研究表明:叶片氮含量在高CO2浓度下明显降低,C/N比显著增加,碳含量与对照差异不明显,而且高CO2浓度显著降低了肋果沙棘幼苗的比叶面积和平均单叶面积,增加叶片厚度,说明肋果沙棘的光合机构在经过一段时间的高CO2处理后,在一定程度上对高CO2浓度产生了适应性。
青藏高原特有种肋果沙棘幼苗的净光合速率、水分利用效率和生长特性包括各营养器官(根、茎、叶)的生物量积累、总生物量、株高、基径和叶片数在CO2倍增处理下明显提高,说明高CO2浓度的“施肥效应”对肋果沙棘的影响显著,而且在CO2倍增处理下,肋果沙棘的比叶面积、平均单叶面积和叶片氮含量显著降低,C/N比的显著上升,说明肋果沙棘对高CO2浓度产生了一定的适应,同时这些性状的改变有利于其适应更为复杂的生存环境(Fernández et al., 2000;Booker,2000)。
| [] | 曹兵, 宋培建, 康建宏, 等. 2011. 大气CO2浓度倍增对宁夏枸杞生长的影响. 林业科学, 47(7): 193–198. DOI:10.11707/j.1001-7488.20110730 |
| [] | 陈德祥, 李意德, 骆土寿, 等. 2004. 短期CO2浓度升高对雨林树种盘壳栎光合特性的影响. 生态学报, 24(8): 1622–1628. |
| [] | 高素华, 郭建平. 2004. CO2浓度和土壤湿度对羊草光合特性影响机理的初探. 草业科学, 21(5): 23–27. |
| [] | 马飞, 姬明飞, 陈立同, 等. 2009. 油松幼苗对干旱胁迫的生理生态响应. 西北植物学报, 29(3): 548–554. |
| [] | 孟丽华, 杨慧玲, 吴桂丽, 等. 2008. 基于叶绿体DNA trnL-F序列研究肋果沙棘的谱系地理学. 植物分类学报, 46(1): 32–40. |
| [] | 施雅风, 李吉均, 李炳元. 1998. 青藏高原晚新生代隆升与环境变化. 广州, 广东科技出版社. |
| [] | 孙坤, 唐洁涓, 苏雪, 等. 2009. 青藏高原特有植物肋果沙棘种子萌发对不同温度的响应. 西北师范大学学报:自然科学版, 45(3): 83–86. |
| [] | 王亚萍, 王开运, 张远彬, 等. 2008. 川西亚高山森林优势种对CO2浓度倍增的光合生理响应. 生态环境, 17(4): 1514–1517. |
| [] | 谢会成, 姜志林. 2002. 栓皮栎对CO2增长的生理生态响应. 西南林学院学报, 22(1): 1–4. |
| [] | 张小全, 徐德应, 赵茂盛, 等. 2000. CO2增长对杉木中龄林针叶光合生理生态的影响. 生态学报, 20(3): 390–396. |
| [] | 张玉娜, 孙坤, 张辉, 等. 2009. 肋果沙棘(Hippophae neurocarpa SW Liu et TN He)自然种群的风媒传粉特征. 生态学报, 29(1): 508–514. |
| [] | Albert K R, Mikkelsen T N, Michelsen A, et al. 2011. Interactive effects of drought, elevated CO2 and warming on photosynthetic capacity and photosystem performance in temperate heath plants. Journal of Plant Physiology, 168(13): 1550–1561. DOI:10.1016/j.jplph.2011.02.011 |
| [] | Booker F L. 2000. Influence of carbon dioxide enrichment, ozone and nitrogen fertilization on cotton (Gossypium hirsutum L.) leaf and root composition. Plant Cell and Environment, 23(6): 573–583. |
| [] | Bunce J A. 1992. Stomatal conductance, photosynthesis and respiration of temperate deciduous tree seedlings grown outdoors at an elevated concentration of carbon dioxide. Plant Cell and Environment, 15(5): 541–549. DOI:10.1111/pce.1992.15.issue-5 |
| [] | Centritto M, Lee H, Jarvis P G. 1999. Long-term effects of elevated carbon dioxide concentration and provenance on four clones of Sitka spruce (Picea sitchensis).Ⅰ.Plant growth, allocation and ontogeny. Tree Physiology, 19(12): 799–806. DOI:10.1093/treephys/19.12.799 |
| [] | Centritto M, Lucas M E, Jarvis P G. 2002. Gas exchange, biomass, whole plant water use efficiency and water uptake of peach (Prunus persica) seedlings in response to elevated carbon dioxide concentration and water availability. Tree Physiology, 22(10): 699–706. DOI:10.1093/treephys/22.10.699 |
| [] | Coudteaux M M, Kurz K, Bottner P, et al. 1999. Influence of increased atmospheric CO2 concentration on quality of plant material and litter decomposition. Tree Physiology, 19(4-5): 301–311. DOI:10.1093/treephys/19.4-5.301 |
| [] | Curtis P S, Wang X. 1998. A meta-analysis of elevated CO2 effects on woody plant mass, form, and physiology. Oecologia, 113(3): 299–313. DOI:10.1007/s004420050381 |
| [] | Drake B G, Gonzalez-Melar M A, Long S P. 1997. More efficient plants:a consequence of rising atmospheric CO2. Annual Review of Plant Physiology and Plant Molecular Biology, 48: 609–639. DOI:10.1146/annurev.arplant.48.1.609 |
| [] | Drennan P M, Nobel P S. 2000. Responses of CAM species to increasing atmospheric CO2 concentrations. Plant Cell Environment, 23(8): 761–781. |
| [] | Fernández R J, Reynolds J F. 2000. Potential growth and drought tolerance of eight desert grasses:lack of a trade-off?. Oecologia, 123(1): 90–98. DOI:10.1007/s004420050993 |
| [] | Garcia R L, et al. 1998. Photosynthesis and conductance of spring wheat leaves:field response to continuous free-air atmospheric CO2 enrichment. Plant Cell and Environment, 21(7): 659–669. DOI:10.1046/j.1365-3040.1998.00320.x |
| [] | IPCC. 2007. Summary for Policymakers of the Synthesis Report of the IPCC Fourth Assessment Report. Cambridge, Cambridge University Press. |
| [] | Kimball B A. 1983. Carbon dioxide and agricultural yield:an assemblage and analysis of 430 prior observations. Agronomy Journal, 75(5): 779–788. DOI:10.2134/agronj1983.00021962007500050014x |
| [] | Pal M, Rao L S, Jain V, et al. 2005. Effects of elevated CO2 and nitrogen on wheat growth and photosynthesis. Biologia Plantarum, 49(3): 467–470. DOI:10.1007/s10535-005-0031-8 |
| [] | Pitelka L F. 1994. Ecosystem response to elevated CO2(Workshop, San Miniato, Italy, October 1993). Trends in Ecology and Evolution, 9(6): 204–207. DOI:10.1016/0169-5347(94)90243-7 |
| [] | Poorter H, Gifford R M, Kriedemann P E, et al. 1992. A quantitative analysis of dark respiration and carbon contents as factors in the growth response of plants to elevated CO2. Australian Journal of Botany, 40(5): 501–511. DOI:10.1071/BT9920501 |
| [] | Reddy A R, Rasineni G K, Raghavendra A S. 2010. The impact of global elevated CO2 concentration on photosynthesis and plant productivity. Current Science, 99(1): 46–57. |
| [] | Rey A, Jarvis P G. 1998. Long-term photosynthetic acclimation to increased atmospheric CO2 concentration in young birch (Betula pendula) trees. Tree Physiology, 18(7): 441–450. DOI:10.1093/treephys/18.7.441 |
| [] | Roberntz P, Stockfors J. 1998. Effects of elevated CO2 concentration and nutrition on net photosynthesis, stomatal conductance and needle respiration of field-grown Norway spruce trees. Tree Physiology, 18(4): 233–241. DOI:10.1093/treephys/18.4.233 |
| [] | Sage R F, Sharkey T D, Seemann J R. 1989. Acclimation of photosynthesis to elevated CO2 in five C3 species. Plant Physiology, 89(2): 590–596. DOI:10.1104/pp.89.2.590 |
| [] | Stitt M, Krapp A. 1999. The interaction between elevated CO2 and nitrogen nutrition:the physiological and molecular background. Plant Cell Environment, 22(6): 583–621. DOI:10.1046/j.1365-3040.1999.00386.x |
| [] | Tjoelker M G, Oleksyn J, Reich P B. 1998. Seedlings of five boreal tree species differ in acclimation of net photosynthesis to elevated CO2 and temperature. Tree Physiology, 18(11): 715–726. DOI:10.1093/treephys/18.11.715 |
| [] | Wand S J E, Midgley G Y F, Jones M H, et al. 1999. Responses of wild C4 and C3 grass (Poaceae) species to elevated atmospheric CO2 concentration:a meta-analytic test of current theories and perceptions. Global Change Biology, 5(6): 723–741. DOI:10.1046/j.1365-2486.1999.00265.x |
 2012, Vol. 48
2012, Vol. 48