文章信息
- 陈海波, 张真, 王鸿斌, 孔祥波, 刘随存
- Chen Haibo, Zhang Zhen, Wang Hongbin, Kong Xiangbo, Liu Suicun
- 红脂大小蠹诱导油松树干挥发性单萜相对含量的变化
- Variance in Relative Concentration of Induced Volatile Monoterpenes Composition of Pinus tabulaeformis by Dendroctonus valens
- 林业科学, 2012, 48(1): 97-102.
- Scientia Silvae Sinicae, 2012, 48(1): 97-102.
-
文章历史
- 收稿日期:2010-05-06
- 修回日期:2010-07-20
-
作者相关文章
2. 黑龙江省农垦总局八五五农场 密山 158327;
3. 山西省林业科学研究院 太原 030012
2. 855 Farm, Heilongjiang General Bureau of Agricultural Reclamation Mishan 158327;
3. Shanxi Academy of Forestry Taiyuan 030012
针叶树的防御体系包括原生性抗性(preformed resistance)和诱导性抗性(induced resistance)。原生性抗性由针叶树木的防御性构造及相关防御性细胞产生的防御反应构成, 是抵御小蠹虫侵害的第一道防线。针叶树木遭受小蠹虫及其伴生真菌入侵后, 可产生诱导性抗性, 诱导抗性防御是针叶树木对外物入侵的一类典型防御机制(Lieutier, 2002; Wagner et al., 2002)。针叶树木对外物入侵的防御过程中, 一直伴随挥发性萜烯类物质的释放。萜烯类物质是针叶树中一类重要的抗虫物质, 分泌含有高浓度的单萜类的树脂是针叶树抗虫的主要手段, 而且这类化合物大多是调节植物、植食性昆虫及其天敌三者间相互关系的生物活性物质(刘兴平等, 2003; 娄永根等, 2000)。萜类化合物在针叶树中通常以复杂的混合物形式存在, 其数量和特性, 特别是其对映体组成, 对潜在的致病菌和植食性昆虫有防御作用。萜类化合物具有重要的生态作用, 特别是单萜化合物在寄主的识别选择、信息素信号(引导小蠹虫聚集和侵殖)及3层营养关系中具有不可替代的作用(龚治等, 2010)。研究表明β-蒎烯具有抗虫作用(曹骥, 1984)。松树向周围挥发单萜类α -蒎烯、β-蒎烯、β-水芹烯、香叶烯、柠檬烯对一些小蠹虫有毒杀作用, 欧洲赤松(Pinus sylvestris)通过释放α-蒎烯和β-蒎烯对纵坑切梢小蠹有忌避作用, 柠檬烯对大小蠹属(Dendroctonus)中的南松大小蠹(D.frontalis)、西松大小蠹(D.brevicomis)与山松大小蠹(D.ponderosae)均有毒害作用(Coyne et al., 1976; Smith, 1975; Raffa et al., 1983)。
王鸿斌等(2005)对健康油松(P.tabulaeformis)树干挥发性单萜的研究发现:(-)-α-蒎烯、(-) - β-蒎烯与(+)-3-蒈烯为主要成分, 其相对含量分别为29.46%, 26.98%与42.52%。张龙娃等(2009)研究发现健康油松树干释放的主要挥发性萜烯以α-蒎烯为主, 且占到97%以上。人工损伤油松仍以α-蒎烯为主, 但(+)-3-蒈烯上升显著。曾被小蠹虫钻蛀, 并且很少再有小蠹虫侵害的抗性油松, 与健康油松比较, α-蒎烯所占比率下降, 而(+)-3-蒈烯含量相当。龚治等(2008)通过RT-PCR研究红脂大小蠹(D.valens)(red turpentine beetle, RTB)蛀食油松树干, 其韧皮部初期的单萜合成酶表达变化时, 成功克隆到α-蒎烯合成酶基因片段。利用实时荧光定量PCR, 对α -蒎烯合成酶基因在RTB侵害油松树干韧皮部早期的表达进行了研究, 发现α-蒎烯合成酶基因在RTB侵害的初期被积极动员, 表达水平在侵害后的第4天达到最大值。随后, α-蒎烯合成酶基因的表达水平逐渐下降(待发表)。而针对RTB侵害油松过程中, 油松树干各种挥发性单萜在不同阶段的相对含量变化未曾有研究。
本研究主要分析RTB成虫危害油松过程中, 油松树干主要单萜挥发性成分的变化规律。通过本次研究, 结合RTB的生物学特点, 有助于认识RTB危害后油松的防御策略, 进一步揭示油松挥发性物质变化与RTB选择寄主之间的关系, 完善对RTB监测与控制技术体系。
1 材料与方法 1.1 研究地点与虫源研究地点设在山西省沁源县太岳林业局灵空山林场的油松林。该林场位于太岳林区中部, 沁源县西南部, 面积4 931 hm2, 地理坐标为112° 02'— 112°09'E, 36° 31'—36° 43' N。林场平均海拔1 500 m, 最高2 088 m, 最低1 150 m。岩石主要是石灰岩, 土壤主要是褐土和棕壤。气候属暖温带大陆性季风气候, 年均气温8 ℃, 最高气温21.5 ℃, 最低气温-5 ℃, 无霜期125天左右。年降雨量650 mm, 集中于6—9月份。年平均相对湿度65%。RTB采自该林场, 区分雌雄后放入盛虫盒内, 饥饿1天, 第2天用于接入油松1 m的树干部位。
1.2 样树的选择与处理根据野外观察与文献报道, RTB主要危害阳坡、林缘、树龄约20年且树干基部1 m以下的油松(Liu et al., 2008), 为此, 2008年7月, 选择位于阳坡、林缘、树龄在20年左右, 胸径18 ~ 24 cm的油松共12株, 设置为3个处理:1)对照油松, 自然状态下, 未做任何处理; 2)人工损伤油松, 用干锥在树干1 m以下钻5个直径为5 mm的孔且均匀分布于树干基部, 钻到韧皮部为止; 3) RTB危害油松, 作与2)相同的处理后, 分别在每个孔中接入RTB雌虫1头, 4天后再在每个侵入孔中接入雄虫。
1.3 油松萜烯类挥发性成分的收集与鉴定 1.3.1 收集方法第1次收集为空白采样, 接入雌虫后再连续3天收集样树的挥发物成分。第4天在3)处理样树上, 在每个虫口内接入RTB雄虫1头。然后, 从空白采样时间记起, 按时间序列5, 7, 9, 11, 15, 19, 23天, 继续收集各处理油松树干挥发物成分。
采用动态顶空收集法采集油松树干挥发物, 所用吸附剂为Porapak Q(美国Alltech公司), 每个吸附管(3 mm × 16 mm)含有100 mg。利用加拿大Toppits公司保鲜袋(45 cm × 55 cm)包裹树干, 采样袋两端内垫缚脱脂棉后, 用铁丝扎紧使之成为一个密闭的空间。先用QC-1大气采样仪(北京市劳动保护科学研究所)将其中的空气抽空后, 再插入吸附管控制气体流速为500 mL·min-1, 每次抽样时间为1 h。在野外每次抽样结束后用锡纸与Parafilm封口膜封闭两端, 置于冰筒内, 带回林场放于冰箱内- 20 ℃保存。
1.3.2 样品分析用正已烷洗脱吸附管, 洗脱液为2 mL。运用气相色谱质谱联用仪(GC-MS, TRACE DSQ100), 通过核对NIST 02图库中的质谱图进行定性分析。用标准样品在Agilent公司气相色谱(GC-FID, 7890A)标定主要单萜的保留时间后, 按峰面积百分法定量分析相对含量。GC-FID条件:色谱柱采用手性柱BETA DEXTM 120(60 m × 0.25 mm × 0.25 μm)。进样量1 μL, 不分流进样。程序升温:以3 ℃·min-1, 从50 ℃升至200 ℃, 并在200 ℃保持10 min。高纯氮气作为载气。检测器及气化室温度为250 ℃, 氢火焰检测器(FID)。GC-MS的分析条件如下:色谱柱采用DB-5MS(30 m × 0.25 mm × 0.25 μm)。高纯氦气作载气, 压力69 kPa。进样量1 μL, 分流进样, 分流比为1 : 10。进样温度230 ℃。程序升温:以3 ℃·min-1, 从50 ℃升至200 ℃, 并在200 ℃保持15 min。GC-MS传输线温度240 ℃, 质谱离子源温度230 ℃, 电离能70 eV, 扫描范围m/z 50 ~ 600。
1.4 数据分析使用Windows SPSS 16.0统计软件对所有数据进行转换与分析。所有方差分析均使用StudentNewman-Keuls进行多重比较。
2 结果与分析 2.1 不同处理检测到的油松主要挥发性单萜类组分不同处理的油松检测到的主要挥发性单萜种类没有明显变化, 各处理油松中主要挥发性单萜的保留时间、标准样品纯度以及生产厂家, 见表 1。另外, 在各处理中萜品油烯、β-水芹烯、长叶烯仅微量存在, 且在不同处理阶段相对含量变化不大。
|
|
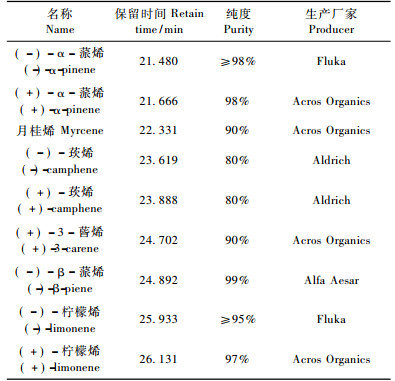
如图 1所示:在对照处理中(-)-α-蒎烯的相对含量维持在7.10% ~ 8.88%。在接入雌虫第2, 3天后, 在损伤油松与虫害油松中即有明显降低, 分别达到4.70%, 3.09%。从第4天开始, 损伤油松中的(-)-α-蒎烯相对含量总体趋势在不断升高至6.57%, 而虫害油松中的相对含量不断下降至2.58%。在9种单萜挥发物中各处理(+)-α-蒎烯的相对含量均为最高, 对照油松中(+)-α-蒎烯的相对含量在67.58% ~ 74.92%之间。在损伤油松中, (+)-α-蒎烯的相对含量从第2天至第4天一直升高至90.11%, 且第2天的升高幅度最大, 第4天开始降低直至79.46%。在虫害油松中, (+)-α-蒎烯的相对含量在第2天即升至91.76%, 随后在第4天降至90.11%, 从第4天开始(+)-α-蒎烯的相对含量逐步升高至93.23%。接入雌虫的3次采样中, 虫害与损伤的(+)-α -蒎烯含量不存在差异的显著性(P>0.05), 而两者与对照油松的差异存在显著性(P<0.05);在接入雄虫后, 虫害、损伤与对照油松三者之间差异存在显著性(P<0.05)。
|
图 1 不同处理的油松中(+)-α-蒎烯(左)与(-)-α-蒎烯(右)的相对含量变化 Figure 1 The variance of relative content of(+) -α-pinene(left) and(-) -α-pinene(right) in different treatments of P.tabulaeformis |
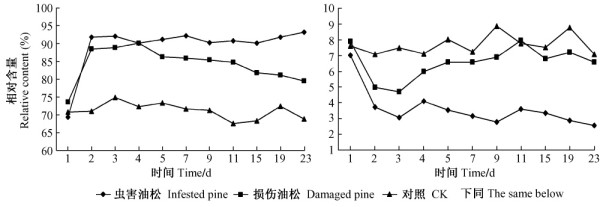
在各处理中月桂烯的相对含量变化不大, 均在1.07% ~ 2.22%之间。从各处理的总体趋势看, 损伤油松中月桂烯的相对含量较低, 而在虫害油松中月桂烯的相对含量却高于其他2处理, 最高达2.22%。接入雄虫后第12天后, 各处理中月桂烯的相对含量变化趋于稳定, 接近对照中的相对含量。在接入雄虫后, 虫害和对照油松分别与损伤油松之间的差异存在显著性(P<0.05, P<0.05)图 2(左)。
|
图 2 不同处理的油松中月桂烯(左)与(+)-3-蒈烯(右)的相对含量变化 Figure 2 The variance of relative content of myrcene(left) and(+) -3-carene(right) in different treatments of P.tabulaeformis |
在对照油松中(+)-3-蒈烯的相对含量在10.45% ~ 13.90%之间, 且明显高于其他2处理, 在不同阶段中对照油松与虫害油松的(+)-3-蒈烯相对含量的差异存在显著性(P<0.05)。虫害油松中(+)-3-蒈烯的相对含量均在最低水平, 且有不断下降的趋势, 最低值为0.74%。损伤油松中, (+)-3-蒈烯的相对含量前3天下降至2.14%, 而后不断上升接近对照油松水平。
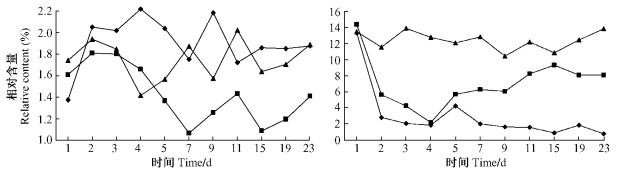
2.2.4 (-)-β-蒎烯在不同处理中的时间变化对照油松中(-)-β-蒎烯的相对含量在0.84% ~ 3.07%之间, 且不同阶段之间变化较大, 但对照油松中的相对含量始终高于其他2组处理。损伤油松中(-)-β-蒎烯相对含量在0.55% ~ 1.13%之间, 不同阶段中相对含量均高于虫害油松低于对照油松, 从处理第2天起有上升趋势。虫害油松中(-)-β-蒎烯的相对含量最低在0.30% ~ 0.50%之间。接入雌虫后, 对照油松分别与虫害和损伤油松之间存在显著性差异(P<0.05, P<0.05)。在接入雄虫后, 损伤油松分别与虫害和对照油松之间存在显著性差异(P<0.05, P<0.05) (图 3)。
|
图 3 不同处理的油松中(-)-β-蒎烯的相对含量变化 Figure 3 The variance of relative content of(-) -β-pinene in different treatments of P.tabulaeformis |
莰烯的2异构体在单萜挥发性物质中相对含量较少, 对照油松中(-)-莰烯在0.24% ~ 1.11%之间, (+)-莰烯在0.51% ~ 1.51%之间(图 4)。在各阶段(+)-莰烯的相对含量明显高于(-)-莰烯, 接入雄虫后第6天开始2对照处理与虫害油松的差异具有显著性(P<0.05)。莰烯的相对含量变化不大, 莰烯与(+)-3-蒈烯是单萜中对小蠹虫毒害作用最小的物质(Raffa et al., 1983)。
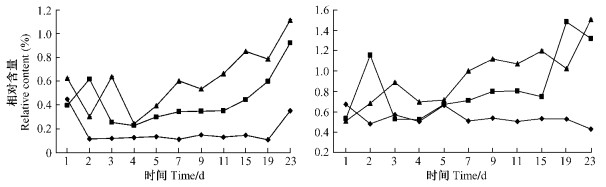
|
图 4 不同处理的油松中(-)-莰烯(左)与(+)-莰烯(右)的相对含量变化 Figure 4 The variance of relative content of(-) -camphene(left) and(+) -camphene(right) in different treatments of P.tabulaeformis |
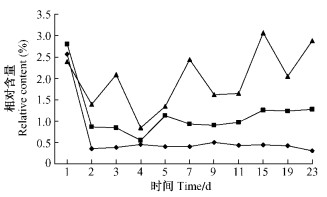
(-)-柠檬烯与(+)-柠檬烯在单萜类挥发性物质中的相对含量较低, (-)-柠檬烯在各处理中没有明显差异, 基本在1.26% ~ 0.13%之间(图 5)。在2对照处理中(+)-柠檬烯的相对含量高于(-)-柠檬烯, 而在虫害油松中2异构体的相对含量的差异无显著性, 均在1.14% ~ 0.29%之间。在单萜挥发物中柠檬烯是对小蠹虫最具有毒性的一种成分(Cook et al., 1988)。在山西野外引诱试验中也证明(-)-柠檬烯对RTB具有显著的驱避作用(苗振旺等, 2004)。
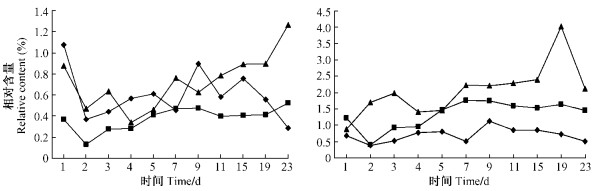
|
图 5 不同处理的油松中(-)-柠檬烯(左)与(+)-柠檬烯(右)的相对含量变化 Figure 5 The variance of relative content of(-) -limonene(left) and(+) -limonene(right) in different treatments of P.tabulaeformis |
笔者发现在虫害油松中α-蒎烯的含量明显上升到94%以上, 而(+)-3-蒈烯含量均下降至2%左右的最低水平; 并且虫害油松中α-蒎烯的含量与其他2组对照相比始终最高, 同时, (+)-3 -蒈烯含量在损伤油松中从与虫害油松相近的低水平, 逐渐回复到对照油松水平; 其他微量单萜含量未有明显上升。以上结果与前人研究存在差异(王鸿斌等, 2005; 张龙娃等, 2009)。这是由于:1)受油松所处的天气条件及坡位的影响, 油松树干挥发性成分含量会发生变化; 2)研究方法中抽样时间、吸附剂种类及其填充数量的差异, 造成对挥发物成分吸附的差异。在第2, 3与4天的各处理挥发物成分中, 可以看出虫害处理α-蒎烯含量与损伤处理比较上升缓慢。第4天后, 虫害处理中α-蒎烯含量持续上升, 而损伤处理中α-蒎烯含量持续下降。结合龚治等(2008)在α-蒎烯合成酶基因方面的研究结果, 表明在接虫与损伤处理后3天油松基本依靠原生性抗性释放挥发性单萜, 虫害处理在第4天后α-蒎烯合成酶基因被积极动员, 表达水平达到最大值, 同时单萜α-蒎烯的释放也持续增加, 而损伤处理中没有诱导产生足够的α-蒎烯合成酶, 所以原生性抗性防御结束后, α-蒎烯的释放即持续下降。同时, α-蒎烯含量的变化与α-蒎烯合成酶基因表达水平变化揭示出萜烯合成酶基因动员表达增高到其产物积累增加具有滞后性。
(+)-3-蒈烯含量在接入RTB和机械损伤处理中, 前4天含量与对照相比存在差异显著性。第4天以后, 即接入雄虫后, 机械损伤处理的(+)-3 -蒈烯含量逐渐向对照水平恢复, 而抗性油松持续维持在较低含量水平。由此可见红脂大小蠹危害油松树干后可诱导(+)-3-蒈烯含量降低。目前(+)-3-蒈烯对RTB引诱效果最好, 但在抗性油松中(+)-3-蒈烯含量最低时, 特别是雌雄虫均接入树干后, 短时间内RTB的聚集现象特别明显。同时, 野外RTB监测工作中发现:在受害树旁悬挂(+)-3-蒈烯诱捕器, 引诱到的RTB数量要远大于健康油松旁的诱捕量。这一现象存在2种假设: 1)寄主选择过程是一个综合各种因子的过程, 而远非对少数寄主挥发性成分的简单识别。(+)-3 -蒈烯可能是一个启动促成因子, 而RTB对树体抗性能力强弱的判断是结合油松挥发性成分比率特征的变化进行的, 这也是油松抗性机制与RTB寄主选择之间的一个互动进化过程; 2)入侵寄主树的小蠹虫和寄主树木代谢物质的联合作用现象, RTB利用单萜成分作为合成聚集信息素的前体, 从而节省个体能量, 并达到聚集危害寄主树的效果。这2个假设在前人研究小蠹虫的试验中分别得到证实(Byers, 1981; Hunt et al., 1986; Pureswaran et al., 2004; Renvick et al., 1976; Tomlin et al., 1997)。Luxová等(2005)检测出RTB释放大小蠹属中常见聚集信息素瘤额大小蠹素(frontalin), 但在中国4省(陕西、山西、河南与河北) RTB的分布区进行野外诱捕试验, 未发现明显效果(数据未发表)。闫争亮等(2004)通过提取RTB雌雄虫后肠, 发现后肠挥发性物质, 没有明显差别, 都含有(-)-α-蒎烯、(-) - β-蒎烯、(+)-3-蒈烯、月桂烯与柠檬烯等单萜烯类化合物以及马鞭草烯醇和马鞭草烯酮。室内趋向反应测定, 马鞭草烯酮在较高含量(100 μL· mL-1)下对RTB具有驱避活性, 而在较低的浓度下(1 μL·mL-1)则具有引诱活性。苗振旺等(2003)利用马鞭烯塑料小囊(verbenone bubble cap)(释放速率每株树100 mg·d-1)和马鞭烯液体进行林间诱捕试验, 表明马鞭烯塑料小囊和喷液均具明显驱避作用。综合上述, 笔者认为结合油松各挥发物比率变化特征, 进一步检测RTB是否存在信息素, 对于增强RTB监测与控制技术体系的有效性具有重要意义。
曹骥. 1984. 作物抗虫原理及应用[M]. 北京: 科学出版社.
|
龚治, 李典谟, 张真. 2010. 针叶树萜类合成酶研究进展[J]. 林业科学, 46(1): 123-130. DOI:10.11707/j.1001-7488.20100120 |
刘兴平, 戈峰, 陈春平, 等. 2003. 我国松树诱导抗虫性研究进展[J]. 林业科学, 39(5): 119-128. DOI:10.11707/j.1001-7488.20030518 |
娄永根, 程家安. 2000. 虫害诱导的植物挥发物:基本特性、生态学功能及释放机制[J]. 生态学报, 20(6): 1097-1106. |
苗振旺, 张钟宁, 王培新, 等. 2004. 外来入侵害虫红脂大小蠹对寄主挥发物的反应[J]. 昆虫学报, 47(3): 360-364. |
苗振旺, 赵明梅, 王立忠, 等. 2003. 强大小蠹植物源引诱剂林间应用技术[J]. 昆虫知识, 40(4): 346-350. DOI:10.7679/j.issn.2095-1353.2003.091 |
王鸿斌, 王玉刚, 张真, 等. 2006. 油松挥发性物质分析及红脂大小蠹的触角电位反应[J]. 林业科学, 42(5): 84-88. |
王鸿斌, 张真, 孔祥波. 2005. 油松萜烯类挥发物释放规律与红脂大小蠹危害关系研究[J]. 北京林业大学学报:自然科学版, 27(2): 75-80. |
闫争亮, 方宇凌, 孙江华, 等. 2004. 红脂大小蠹后肠挥发性物质的鉴定、触角电位和室内趋向实验[J]. 昆虫学报, 47(6): 695-700. |
张龙娃, 刘柱栋, 姚剑. 2009. 油松萜烯成分变化与红脂大小蠹的反应特性[J]. 昆虫知识, 46(2): 249-255. DOI:10.7679/j.issn.2095-1353.2009.044 |
Byers J A. 1981. Pheromone biosynthesis in the bark beetle, Ips paraconfusus, during feeding or exposure to vapors of host plant precursors[J]. Insect Biochem, 11(5): 563-569. DOI:10.1016/0020-1790(81)90024-X |
Cook S P, Hain F P. 1988. Toxicity of host monoterpenes to Dendroctous frontalis and Ips calligraphus(Coleoptera:Scolytidae)[J]. J Entomol Sci, 23(3): 287-292. DOI:10.18474/0749-8004-23.3.287 |
Coyne J F, Lott L H. 1976. Toxicity of substances in pine oleoresin to southern pine beetles[J]. Journal of the Georgia Entomological Society, 11: 301-305. |
Hunt D W A, Borden J H, Pierce H D, et al. 1986. Sex-specific production of ipsdienol and myrcenol by Dendroctonus ponderosae(Coleoptera:Scolytidae) exposed to myrcene vapors[J]. J Chem Ecol, 12: 1579-1586. DOI:10.1007/BF01020265 |
Lieutier F.2002.Mechanisms of resistance in conifers and bark beetle attack strategies∥Wagner M R, Clancy K M, Lieutier F, et al.Mechanisms and Deployment of Resistance in Trees to Insects.The Netherlands:Kluwer Academic Publishers, 31-77 http://onlinelibrary.wiley.com/doi/10.1111/nph.12174/references
|
Liu Z D, Zhang L W, Shi Z H, et al. 2008. Colonization patterns of the red turpentine beetle, Dendroctonus valens(Coleoptera:Curculionidae) in the Luliang Mountains, China[J]. Insect Science, 15: 349-354. DOI:10.1111/ins.2008.15.issue-4 |
Luxová A, Gries R, Tolasch T, et al.2005.Analysis of pheromone production by the red turpentine beetle, Dendroctonus valens.21st Annual Meeting of the International Society of Chemical Ecology(ISCE).23-27 July, Washington, D C.
|
Pureswaran D S, Gries R, Borden J H. 2004. Quantitative variation in monoterpenes in four species of conifers[J]. Biochem System Ecol, 32(12): 1109-1136. DOI:10.1016/j.bse.2004.04.006 |
Renvick J A A, Hughes P R, Krull J S. 1976. Selective production of cis and trans-verbenol from(-)-and(+)-a-pinene by a bark beetle[J]. Science, 191: 199-201. DOI:10.1126/science.1246609 |
Raffa K F, Berryman A A. 1983. Physiological aspects of lodgepole pine wound responses to fungal sym-point of mountain pine beetle Dendroctonus ponderosae(Coleoptera:Scolytidae)[J]. Canadian Entomologist, 115(7): 723-734. DOI:10.4039/Ent115723-7 |
Smith R H. 1975. Formula for describing effect of insect and host tree factors on resistance to western pine beetle attack[J]. Journal of Economical Entomology, 68(6): 841-844. DOI:10.1093/jee/68.6.841 |
Tomlin E S, Borden J H, Pierce Jr H D. 1997. Relationship between volatile foliar terpenes and resistance of Sitka spruce to the white pine weevil[J]. For Sci, 43(4): 501-508. |
 2012, Vol. 48
2012, Vol. 48