文章信息
- 习洋, 胡瑞阳, 王欢, 孙鹏, 袁存权, 李允菲, 戴丽, 李云
- Xi Yang, Hu Ruiyang, Wang Huan, Sun Peng, Yuan Cunquan, Li Yunfei, Dai Li, Li Yun
- 刺槐未成熟合子胚的体细胞胚胎发生和植株再生
- Somatic Embryogenesis and Plant Regeneration from Immature Zygotic Embryos of Black Locust(Robinia pseudoacacia)
- 林业科学, 2012, 48(1): 60-69.
- Scientia Silvae Sinicae, 2012, 48(1): 60-69.
-
文章历史
- 收稿日期:2011-08-18
- 修回日期:2011-11-18
-
作者相关文章
刺槐(Robinia pseudoacacia)原产于美国, 天然分布于美国东部阿柏拉契山脉(Appalachian Mt.)和奥萨克山脉(Ozank Mt.), 20世纪初期引入我国, 引进后得到迅速扩大栽植, 是黄河中下游、淮河流域、海河流域、长江下游诸省用材林、薪炭林、水土保持林、海堤及河堤防护林的主要造林树种, 仅在河北、河南、山东、辽宁、宁夏和山西6省(区)就有40亿株(张江涛等, 2009; 中国林木志编委会, 1978)。刺槐生长速度快, 其材质坚硬、抗压强度大、防腐力强, 是重要的速生用材树种。刺槐根系长有大量根瘤, 可以通过生物固氮增加土壤肥力, 在维持生态平衡、提高林分质量等方面发挥重要作用(刘增文等, 1999)。刺槐的叶片含有粗蛋白, 是优质廉价的家畜饲料资源(张立刚, 2005)。刺槐花营养丰富, 虽花期较短但花量可观, 除直接食用外, 还可生产花蜜、提取香料等(王林等, 2006)。
我国对刺槐的育种研究始于20世纪70年代, 至今已取得很多成就, 但仍不能满足林业生产的需要(潘志刚等, 1994)。体细胞胚再生途径是对树木进行繁育和遗传改良的重要平台, 也是实现基因转化的常用再生体系。体胚发生技术具有繁殖数量多、速度快、不受亲缘关系限制、一旦形成结构完整的体细胞胚一般都可直接萌发形成小植株等特点(栾庆书等, 2001), 是稳定高效的植物再生体系。此外, 体细胞胚胎由单细胞起源, 发育程序与合子胚相似, 可作为胚胎学研究的模式系统(von Arnold et al., 2002), 对细胞全能性表达过程和细胞分化机制等理论问题的研究也具有重要意义(Zimmerman et al., 1993)。刺槐的离体培养研究从20世纪50年代末开始, 80年代以后达到高潮(王树芝等, 1999)。到目前为止, 刺槐通过形成层培养、茎培养、叶片培养、未授粉子房的培养等已获得了完整的植株, 但这些研究都集中在器官发生途径, 通过体细胞胚发生途径的研究还很少。红艳(2007)以刺槐成熟种子的子叶为外植体, 对刺槐体胚培养和诱导不定芽进行了研究, 但体细胞胚发生率最高也仅有36.7%。大量研究表明, 外植体的发育时期是影响体细胞胚发生的关键因素(孙桂君等, 2010), 未成熟合子胚因其细胞全能性高、脱分化容易, 在诱导体细胞胚发生时具有显著优势(Vikrant et al., 2002)。大多数植物离体培养普遍采用未成熟合子胚外植体, 但过于幼嫩或过度成熟的合子胚的体胚诱导率并不理想(Woo et al., 1994)。在整个合子胚的发育过程中, 只有一个较短的阶段具有很强的体胚发生潜能(陈金慧等, 2003; 王睿辉等, 2002)。目前, 未成熟合子胚体细胞胚诱导的研究已有很多, 但就刺槐而言, 国内尚未见相关报道, 国外仅Merkle等(1989)和Arrillaga等(1994)发表了这方面的研究。Merkle等(1989)从花后第1周开始, 每隔1周从选取的3株刺槐树上取未成熟合子胚为外植体, 2, 4-D和BA为诱导因子诱导体细胞胚, 结果仅从1粒开花后4周的未成熟合子胚上观察到体细胞胚通过直接发生途径发生。Arrillaga等(1994)在Merkle等(1989)的研究基础上进一步开展体细胞胚诱导研究, 但是文中指出由于受到所选的3棵植株结实量的限制, 仅能保证开花后1~4周取样平行, 试验结果指出开花后2~3周的外植体体胚诱导率最高, 达到12%。尽管这些研究取得了一定的进展, 但取样量过小、取样平行性差、取样时间跨度也不够全面, 且得到的刺槐体细胞胚诱导率仅有12%, 难以满足刺槐繁殖和育种的需要。另外, 对刺槐体细胞胚发生的直接和间接途径国内外的相关研究中并未涉及, 对2种发生途径中各生长环节的培养条件也未做深入研究, 仍处于空白状态。与其他树种相比, 刺槐的体细胞胚培养目前依然比较困难, 存在体胚诱导率低、畸形胚数量多、体胚质量不高等问题, 严重制约了其遗传改良的程度, 也阻碍了优良无性系的高效繁殖和快速推广, 因此, 建立刺槐高效体胚发生体系势在必行。本文以刺槐不同时期的未成熟胚(从开花第4周开始一直到种子成熟前)为外植体, 采用混合正交试验设计, 系统研究了刺槐体细胞胚通过直接途径发生和间接途径发生时, 幼胚胚龄、不同外源激素种类及浓度对各培养环节的影响, 从而建立了高效的刺槐体胚发生和植株再生体系。
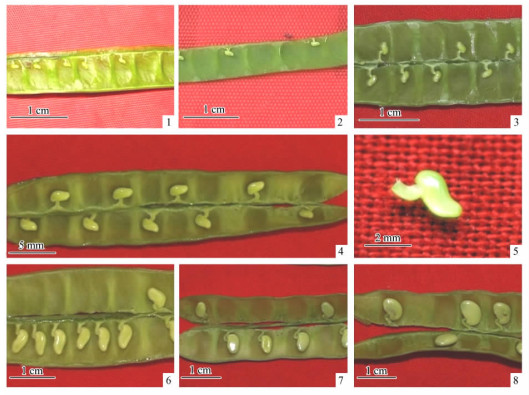
1 材料与方法 1.1 试验材料以北京市延庆米家堡苗圃生长良好的二倍体刺槐实生苗群体为取材资源, 选取10株生长良好、干型较直、结实率高的母树(间隔大于50 m), 在2010年6—9月间, 采集开花后25, 35, 45, 55, 65, 75, 85天的刺槐不同发育阶段的合子胚作为外植体试验材料(图 1), 每间隔10天采集1次, 每次采集500个荚果。将当天采集的荚果用塑料密封袋密封放入冰盒中带回实验室, 之后放在4 ℃的冰箱里冷藏备用, 1周内接种。
|
图 1 采集的不同时期未成熟合子胚外植体 Figure 1 Immature embryo explants of different stages 1-8.分别为开花后25, 35, 45, 55, 65, 75, 85天的外植体。 1-8.Explants collected 25, 35, 45, 55, 65, 75, 85 days post-anthesis, respectively. |
将采集的荚果用水洗净, 从中取出未成熟的种子, 在超净工作台上用75%酒精浸泡30 s, 无菌水冲洗3次, 0.1% HgCl2浸泡5 min, 无菌水冲洗5~6次。在无菌条件下, 将未成熟的合子胚从荚果中取出, 接种到愈伤组织的诱导培养基上。其中4~9周的未成熟合子胚整体接种, 10~12周的未成熟合子胚用解剖刀剥去种皮将胚的各部分切分开后分别接种。
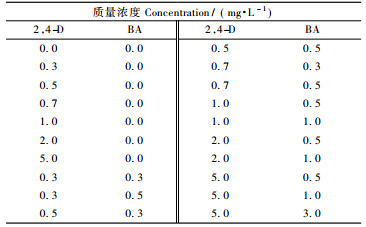
1.3 愈伤组织的诱导培养将经过表面灭菌的开花后25, 35, 45, 55, 65, 75, 85天的未成熟合子胚接种于MS + MES 500 mg·L-1 +蔗糖30 g·L-1 + 0.6%琼脂, 附加不同浓度的2, 4-D和BA(表 1), pH 5.8。每瓶培养基接种10个外植体, 每个浓度做3个重复, 每3~4周继代1次。置于(26±2) ℃条件下, 暗培养。培养6周后统计愈伤组织的诱导率并拍照记录不同类型的愈伤组织。愈伤组织诱导率(%)=诱导出愈伤组织的外植体数/接种外植体总数×100%。
|
|
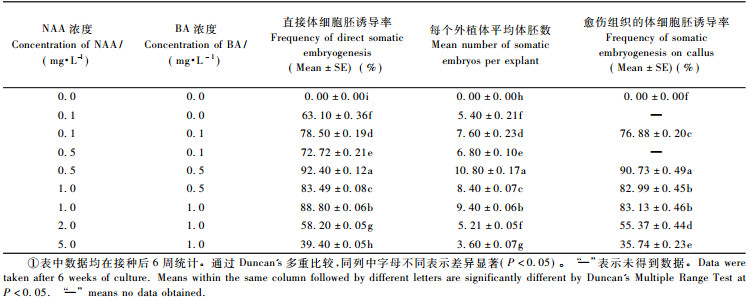
将经过表面灭菌的开花后25, 35, 45, 55, 65, 75, 85天的未成熟合子胚直接接种于培养基MS + MES 500 mg·L-1 +谷氨酰胺250 mg·L-1 +水解酪蛋白500 mg·L-1 +蔗糖30 g·L-1 + 0.6%琼脂, 再附加不同浓度BA(0, 0.1, 0.5, 1.0 mg·L-1)和NAA(0, 0.1, 0.5, 1.0, 2.0, 5.0 mg·L-1), pH5.8。每瓶培养基接种10个外植体, 每个浓度做3个重复, 每3~4周继代1次, 置于(26±2) ℃条件下。培养6周后统计体细胞胚发生率。体细胞胚诱导率(%)=诱导出体细胞胚的外植体数/接种外植体总数×100%。
1.4.2 间接体细胞胚诱导将诱导得到的胚性愈伤组织分割成0.5 cm × 0.5 cm的小块, 转接到MS + MES 500 mg·L-1 +谷氨酰胺250 mg·L-1 +水解酪蛋白500 mg·L-1 +蔗糖30 g·L-1 + 0.6%琼脂, 再附加不同浓度BA(0, 0.1, 0.5, 1.0 mg·L-1)和NAA(0, 0.1, 0.5, 1.0, 2.0, 5.0 mg·L-1), pH 5.8。每瓶培养基接种5块胚性愈伤组织, 每个浓度做3个重复, 每3~4周继代1次。置于(26±2) ℃条件下, 暗培养。培养6周后统计体细胞胚发生率。体细胞胚诱导率(%)=诱导出体细胞胚的愈伤组织块数/接种愈伤组织块总数×100%。
1.5 体细胞胚的成熟将原胚培养物转接到不含有任何外源激素的MS +水解酪蛋白500 mg·L-1 +蔗糖30 g·L-1 + 0.6%琼脂, pH5.8, 置于(26±2) ℃条件下, 暗培养1周后转入光周期为16 h光照/8 h黑暗的条件下培养, 每3~4周继代1次。培养4周后观察试验结果并拍照。
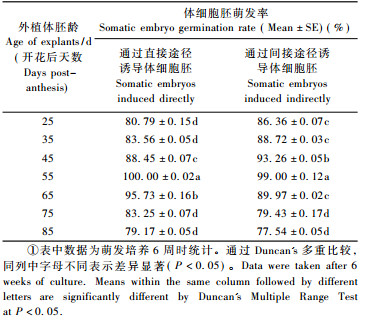
1.6 体细胞胚的萌发与植株再生将成熟的子叶期体细胞胚从外植体块上分离下来, 转接到MS +蔗糖30 g·L-1 + 0.6%琼脂基本培养基上, pH5.8, 置于(26±2) ℃条件下, 在光周期为16 h光照/8 h黑暗条件下培养, 每3周继代1次。培养6周后统计体细胞胚萌发率并拍照记录试验结果。体细胞胚萌发率(%)=萌发的体细胞胚数/接种体细胞胚总数×100%。
1.7 培养物观察与数据分析定期对培养材料进行观察, 并用Sony DSC-T77型数码照相机拍照。选择不同类型的愈伤组织, 用镊子夹取少量于载玻片上, 轻轻夹碎后滴上醋酸洋红染色液, 静置1 min后, 盖上盖玻片, 压片后置于Olympus光学显微镜下观察并拍照。将诱导得到的体细胞胚用琼脂糖包埋固定, 用徕卡UC6型全自动震动超薄切片机切片, 然后用罗丹明染色液染色, 在Olympus光学显微镜下观察并拍照。
所有观察数据都应用SPSS 17.0软件进行方差分析。
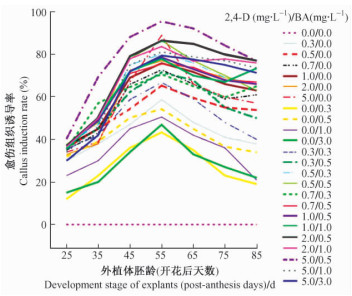
2 结果与分析 2.1 愈伤组织的诱导 2.1.1 未成熟合子胚胚龄对愈伤组织诱导的影响为探索最适的刺槐未成熟合子胚取材时期, 对每个发育阶段的外植体都做了不同外源激素组合的诱导愈伤组织的正交试验。将开花后25, 35, 45, 55, 65, 75, 85天的未成熟合子胚先后接种于MS附加0, 0.3, 0.5, 1.0, 3.0 mg·L-1的BA和0, 0.3, 0.5, 0.7, 1.0, 2.0, 5.0 mg·L-1的2, 4-D的愈伤组织诱导培养基组合上, 进行培养(图 2)。
|
图 2 合子胚发育阶段和植物生长调节剂对愈伤组织诱导的影响 Figure 2 Effects of zygotic embryo development stage and plant growth regulators on callus induction |
外植体胚龄对愈伤组织的诱导率影响显著(P<0.05), 在各个不同生长调节剂组合的培养基诱导下, 未成熟合子胚胚龄对愈伤组织的诱导率的影响趋势大致相同, 在整个试验采集期内, 愈伤组织诱导率均呈低—高—低的抛物线形。试验中观察到3种类型的愈伤组织, 分别为白色疏松型、嫩黄绿色疏松型和绿色结实型。开花后25~45天的外植体过于幼嫩, 拨开种皮后仍可见透明状胚乳结构, 幼胚内营养物质积累还不充分, 诱导愈伤组织得率低、速度慢, 虽然随着胚龄的发育诱导率逐渐提高, 但是诱导出的愈伤组织大多是白色疏松型, 继代培养后其胚性难以保持, 无法诱导得到体细胞胚; 开花后75~85天的外植体已基本成熟, 子叶和胚均体型饱满, 细胞脱分化较难, 愈伤组织的诱导率明显低于开花后55~65天的外植体, 且诱导得到的愈伤组织多为绿色结实型, 无再分化的迹象, 继代后很快褐化死亡, 而且此时期的外植体大部分能够直接萌发, 直接生长为具有根和芽的完整植株。可见, 过嫩(早于开花后45天)或过熟(晚于开花后75天)的幼胚均不能得到理想的愈伤组织诱导结果。开花后55天采集的未成熟合子胚在所有诱导培养基上的出愈率均高于其他时期的外植体, 且诱导得到的愈伤组织生长速度快, 呈嫩黄色或嫩黄绿色, 半透明且结构较松软, 经多次继代仍能保持较高的活力。孙果忠等(2005)在研究小麦(Triticum aestivum)幼胚对ABA敏感性时发现, 不同胚龄的未成熟胚对外源植物激素的敏感性不同。本试验中也观察到了这一现象, 不同胚龄的刺槐未成熟合子胚对外源激素的反应时间存在一定差异。开花后25~35天的外植体对植物生长调节剂的刺激反应较迟缓, 诱导培养5周后, 外观才发生肉眼可见的变化, 主要表现为外植体的膨大、切口边缘部位开始愈伤化, 生长缓慢; 而开花后45~65天的外植体则对外源激素的刺激敏感得多, 在诱导培养3~4周时, 愈伤组织已大部分覆盖了外植体的表面。
试验表明, 外植体的采集时间即未成熟合子胚的发育阶段对胚性愈伤组织诱导至关重要。开花后55天的幼胚是诱导胚性愈伤组织的最佳外植体。
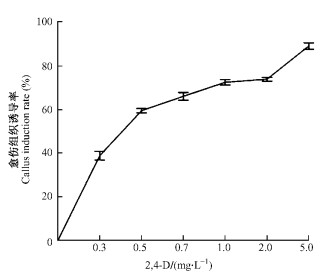
2.1.2 外源植物激素对刺槐愈伤组织诱导的影响1) 2, 4-D对刺槐愈伤组织诱导的影响 将不同发育阶段的刺槐未成熟合子胚接种到附加不同浓度2, 4-D的愈伤组织诱导培养基上, 经过4周左右的暗培养, 外植体已明显膨大。暗培养5周左右, 可以观察到愈伤组织从接种的伤口处出现, 随后逐渐向四周扩展, 在附加不同浓度激素的诱导培养基中, 外植体的愈伤化程度不一致。根据暗培养6周时统计的试验数据可知, 在一定浓度范围内, 2, 4-D浓度的增大对刺槐未成熟合子胚胚性愈伤组织的诱导具有促进作用, 无2, 4-D的培养基不能诱导产生胚性愈伤组织(图 3)。
|
图 3 2, 4-D浓度对外植体愈伤组织诱导的影响 Figure 3 Effects of 2, 4-D on callus induction from explants |
当2, 4-D浓度在0~1.0 mg·L-1, 刺槐未成熟合子胚愈伤组织的诱导率逐渐增加; 当2, 4-D浓度在1.0~2.0 mg·L-1时, 愈伤组织的诱导率仍呈增加趋势, 但上升幅度有所降低; 在2, 4-D浓度为5.0 mg·L-1时, 外植体的愈伤组织诱导率达到最大值88.90%±0.35%, 生长最旺盛。另外, 不同浓度2, 4-D诱导形成的愈伤组织在形态和颜色上也有很大不同, 生长速度也差异较大。低浓度的2, 4-D诱导得到的愈伤组织多为白色疏松型, 成水浸状, 透明或半透明, 生长速度很快但继代后很快丧失分化能力, 易褐化死亡, 后期培养中无法诱导产生体细胞胚, 为非胚性愈伤组织(图 4C)。在光学显微镜下观察这种愈伤组织, 细胞多为长条形, 具有细胞核小、位于细胞边缘、胞质稀薄、细胞壁薄等特点(图 4D)。随着2, 4-D浓度的增大, 愈伤组织的外观形态开始变得复杂多样, 结构致密, 生长速度适中, 继代后仍有较好的生长表现。

|
图 4 刺槐体细胞胚诱导发生和植株再生过程 Figure 4 Somatic embryogenesis and plant regeneration of Black Locust A.胚性愈伤组织; B.胚性愈伤组织的球形细胞; C.非胚性愈伤组织; D.非胚性愈伤组织的条形细胞; E.诱导得到的原胚培养物; F.转到体胚成熟培养基暗培养1周后的体细胞胚; G.逐渐成熟的体细胞胚; H.球形胚; I.心形体细胞胚; J.鱼雷形体细胞胚; K.子叶形体细胞胚; L.未成熟合子胚外植体直接诱导得到的体细胞胚; M.逐渐成熟的体细胞胚; N.子叶期体细胞胚; O.分离下来的体细胞胚下胚轴伸长生长; P.体细胞胚生根; Q.再生植株; R.移栽的再生植株。 A.Embryogenic callus; B.Sphaerocyst of embryogenic callus; C.Non-embryogenic callus; D.Strip cells of non-embryogenic callus; E.Proembryogenic mass initiated from embryogenic callus; F.Somatic embryos transferred to maturation media for 1 week; G.Somatic embryos maturing; H.Globular somatic embryo; I.Heart-shaped somatic embryo; J.Torpedo-shaped somatic embryo; K.Cotyledonary somatic embryos; L.Somatic embryos formed directly from explant; M.Somatic embryos maturing; N.Cotyledonary stage somatic embryos; O.Hypocotyl elongation of separated somatic embryo; P. Root differentiation of somatic embryos; Q.Plantlet regenerated; R.Plantlets transplanted. |
刺槐幼胚在单独附加高浓度2, 4-D的培养基上诱导产生的愈伤组织虽生长速度适中, 具有一定胚性, 但长期继代会使褐化率增高, 胚性严重降低。根据Arrillaga等(1994)的研究, 2, 4-D与细胞分裂素配合使用可有效改善愈伤组织的质地。本试验选用了植物组织培养中常用的细胞分裂素BA, 与2, 4-D配合诱导愈伤组织。
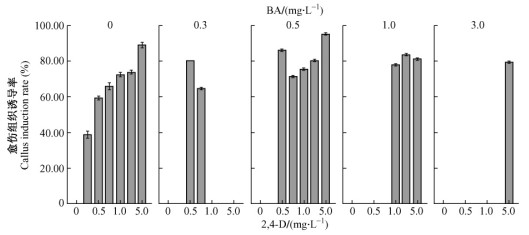
2) 2, 4-D和BA对刺槐愈伤组织诱导的影响 将开花后55天的刺槐未成熟合子胚接种到附加不同浓度2, 4-D和BA的愈伤组织诱导培养基上, 黑暗培养。6周后统计数据发现, 诱导培养基中外源激素的不同浓度组合对愈伤组织的诱导率和生长状况有显著影响(P<0.05)。2, 4-D各浓度结合BA能很好促进未成熟合子胚的脱分化, 且不同浓度的BA与2, 4-D配合使用其诱导效果不同(图 5)。
|
图 5 2, 4-D和BA对外植体愈伤组织诱导的交互作用 Figure 5 The interact effects of 2, 4-D in combination with BA |
2, 4-D结合低浓度BA的效果普遍高于与高浓度BA结合时的效果。外植体接入诱导培养基4周后开始启动, 长出的愈伤组织呈嫩黄绿色颗粒状, 半透明且结构松软适中, 这种胚性愈伤组织生长速度较快, 暗培养2周左右直径可达1.5 cm, 颜色较之前更加嫩黄(图 4A)。经过约6个月的继代后, 仍保持较好的胚性, 易于通过胚状体途径再生, 为胚性愈伤组织(王晓春等, 2010)。在普通光学显微镜下观察这种愈伤组织, 发现细胞较大、多为球形, 且胞质浓厚(图 4B)。综合愈伤组织的诱导率和生长状况, 在所有2, 4-D和BA的浓度组合中, 当2, 4-D为5.0 mg·L-1, BA为0.5 mg·L-1时, 出愈率最高, 达到95.42%±0.02%。
2.2 体细胞胚诱导 2.2.1 未成熟合子胚胚龄对体细胞胚诱导的影响为了研究直接体细胞胚诱导的最适外植体胚龄, 对每个发育阶段的未成熟合子胚都进行了外源激素诱导体细胞胚发生的混合正交试验, 将经过表面灭菌的开花后25, 35, 45, 55, 65, 75, 85天的未成熟合子胚直接接种于MS附加0, 0.1, 0.5, 1.0 mg· L-1的BA和0, 0.1, 0.5, 1.0, 2.0, 5.0 mg·L-1的NAA的体细胞胚诱导培养基上, 进行黑暗培养。5周后, 外植体明显膨大, 切口边缘轻度愈伤化且陆续出现嫩黄色突起, 即早期的体细胞胚。此时对培养物进行光照16 h/黑暗8 h的交替培养, 可逐渐形成肉眼可见的不同发育时期的体细胞胚, 同时不断有大量新的胚状体陆续产生。
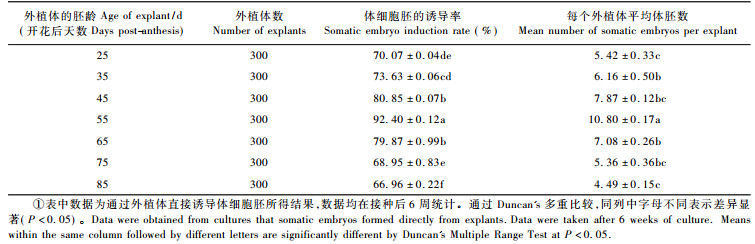
诱导培养6周后统计试验结果(图 6), 从图中可以看出, 外植体胚龄对体细胞胚的直接诱导率影响显著(P<0.05), 过嫩(早于开花后45天)或过熟(晚于开花后65天)的幼胚均不能得到理想的体胚诱导结果。但是各个生长调节剂的浓度组合诱导下的体细胞胚发生率趋势大致相同, 开花后55天采集的未成熟合子胚在各个生长调节剂浓度下的体胚发生率均高于其他发育阶段的外植体。
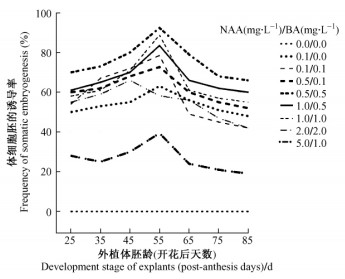
|
图 6 合子胚发育阶段和植物生长调节剂对直接诱导体细胞胚的影响 Figure 6 Effects of zygotic embryo development stage and plant growth regulators on direct somatic embryo induction |
从图 6中的体细胞胚诱导率的高低, 可以初步判断诱导体胚的最佳外植体采集时期, 但是未成熟合子胚的发育阶段对单个外植体的平均体胚诱导数的影响是否符合以上结论还是未知的, 因此又进行了如表 2的统计分析。表 2列出了以MS附加0.5 mg·L-1 NAA和0.5 mg·L-1 BA为诱导培养基时的体细胞胚诱导情况。方差分析结果表明, 外植体胚龄对单个外植体的平均体胚诱导数影响显著(P<0.05)。开花后55天的外植体体胚诱导率为92.40%±0.12%, 每个外植体的平均体胚数为10.80±0.17个, 均明显高于其他时期的外植体。开花后35~45天和开花后65~75天的外植体诱导体细胞胚发生的潜能虽显著低于开花后55天的外植体, 但此4组数据间的差异并不显著。由此可见, 未成熟合子胚的发育阶段对体细胞胚诱导率和单个外植体的平均体胚诱导数的影响规律相同。
|
|
试验结果表明, 就北京延庆地区而言, 在整个采集期内刺槐未成熟合子胚的体细胞胚发生能力呈“低—高—低”的抛物线趋势, 开花后55天为取材的最佳时期。
2.2.2 外源植物激素对体细胞胚诱导的影响将开花后55天采集的刺槐未成熟合子胚和开花后55天外植体诱导得到的胚性愈伤组织分别接种到含有不同浓度生长调节剂的体胚诱导培养基上, 暗培养6周后观察, 发现除不含有任何植物生长调节剂的培养基外, 其他诱导培养基中均产生了不同数量的体细胞胚(图 4E, L)。对数据进行方差分析(表 3), 不同生长调节剂组合对体细胞胚诱导的影响差异显著(P<0.05)。
|
|
较低浓度的NAA与BA组合有利于体细胞胚的诱导, 当NAA浓度大于2.0 mg·L-1时, 未成熟合子胚和胚性愈伤组织的体胚诱导率均显著下降, 且愈伤化趋势明显。在仅含有低浓度NAA的诱导培养基中, 虽然未成熟合子胚的直接体胚诱导率仍可达到63.10%±0.36%, 但会出现褐化现象, 且生长速度较慢, 生长趋势弱, 不利于体细胞胚的后期成熟。当NAA浓度为0.5 mg·L-1, BA浓度为0.5 mg·L-1时, 未成熟合子胚的直接体胚诱导率达到最高, 为92.40%±0.12%, 且每个外植体上的平均体胚数也比较理想, 达到10.80±0.17个, 得到的胚状体多分散在外植体的边缘部位, 突起不太明显且大小不均, 外植体与体细胞胚之间有愈伤化过度。应用相同的外源激素组合诱导体胚发生, 胚性愈伤组织的体胚诱导率略低于未成熟合子胚, 但差异不显著(P>0.05)。当NAA浓度为0.5 mg·L-1, BA浓度为0.5 mg·L-1时, 胚性愈伤组织的体胚诱导率也达到最高, 为90.73%±0.49%, 愈伤组织的表面形成明显的突起的原胚和球形胚, 多集中分布。薄层切片发现, 体细胞胚可通过愈伤组织的表面和愈伤组织内部等方式发生(图 4H, I, J, K)。
2.3 体细胞胚的成熟将上述体细胞胚转接至不添加任何植物生长调节剂的MS +水解酪蛋白500 mg·L-1 +蔗糖30 g·L-1的固体培养基上, 暗培养1周后(图 4F)转至光周期为16 h光照/8 h黑暗的条件下进行成熟培养。培养4周后, 培养物上的体细胞胚个体增大, 颜色逐渐变绿(图 4G, M); 培养6周后, 可以观察到体细胞胚发育到子叶胚阶段(图 4N)。
2.4 体细胞胚的萌发和植株再生将成熟的子叶期体细胞胚从外植体块上分离下来, 转接到MS固体培养基上, 在光周期为16 h光照/8 h黑暗的条件下萌发成幼苗(图 4O, P)。继代2次后, 形成完整小植株(图 4Q)。统计体细胞胚萌发率(表 4)。
|
|
将根长度超过2 cm的再生植株置于有遮光条件(遮光率为50%)的炼苗室内培养5~10天, 然后打开培养瓶瓶盖, 在移栽室中炼苗培养1天后, 取出植株, 用自来水洗净试管植株根部残留的琼脂培养基, 移栽到刺槐无土栽培基质(珍珠岩与蛭石的体积之比为1:1)中在移栽室进行容器培养, 自然光照培养7~10天后, 统计移栽成活率, 达到100%。移栽5~6周后可将刺槐幼苗定植于大田(图 4R)。
3 讨论大量研究表明, 外植体的发育程度可直接影响胚性愈伤组织诱导及体胚发生过程。处于不同发育阶段的外植体对相同的培养条件产生不同反应(宁国贵等, 2010)。一般情况下, 越早期的细胞其全能性越高, 越易脱分化成为胚性细胞(崔凯荣等, 2001)。刘艳芝等(1999)在研究大豆(Glycine max)体细胞胚胎发生的外植体时指出未成熟胚是理想的试验材料。王萍等(2002)以真叶、子叶节、下胚轴以及未成熟合子胚子叶为外植体诱导大豆体细胞胚发生, 仅得到了以未成熟合子胚子叶为外植体的体胚再生植株, 其他外植体诱导的球形胚培养物均未进一步萌发。对其他豆科(Leguminosae)木本植物体胚诱导的研究也发现, 外植体的发育阶段直接影响体胚发生率的高低(Rout et al., 1995; Gupta et al., 1993; Garg et al., 1995)。本试验对每个发育阶段的未成熟合子胚外植体都做了植物生长调节剂诱导胚性愈伤组织和直接体细胞胚发生2个方面的混合正交试验, 结果显示, 在试验涉及的所有外源激素组合的诱导培养基上, 外植体胚龄对愈伤组织和体胚诱导的影响趋势均呈“低—高—低”抛物线型, 且以开花后55天的未成熟合子胚作为外植体的诱导效果最好。
培养基中的外源植物激素是影响组织培养过程中胚性愈伤组织发生的最重要的因素之一(邓正正等, 2009)。大量研究表明, 2, 4-D是诱导愈伤组织必不可少的生长激素(王宏伟等, 2006), 2, 4-D对内源激素的调节和平衡起重要作用(张涛等, 2007), 57.7%的双子叶植物和几乎所有的单子叶植物在体细胞胚的诱导阶段均使用了2, 4-D(Evans et al., 1981), 特别是在大豆等作物中, 薛仁镐等(1995)采用了高达10 mg·L-1浓度的2, 4-D来诱导胚性愈伤组织。本试验单独用2, 4-D诱导刺槐愈伤组织, 在2, 4-D浓度为0~5.0 mg·L-1的范围内, 诱导率与2, 4-D浓度成正相关关系, 但得到的愈伤组织继代后易褐化死亡, 再生频率很低。近年来人们越来越重视细胞分裂素和生长素的协同作用, 特别是BA和2, 4-D的配合使用, 其在被子植物胚性愈伤组织的诱导中效果优于只添加生长素的培养基配方(宁国贵等, 2010; 王晓春等, 2010)。本试验也得出相同结论, 在所有试验组中, 高浓度的2, 4-D结合低浓度的BA取得了比较理想的诱导效果。
乔琦等(2005)在试验中发现降低2, 4-D的浓度或用作用较弱的NAA代替, 可以促进体细胞胚的分化和发育。本试验通过直接和间接途径诱导刺槐体细胞胚, 发现高浓度的外源激素长时间持续刺激外植体会诱导愈伤组织, 且所得愈伤组织进入持续脱分化状态, 不断分裂, 始终不能形成体细胞胚或再生植株; 较低浓度的NAA与BA组合有利于刺槐体细胞胚的发生。
本试验从直接和间接2条途径建立了刺槐体细胞胚再生体系, 并成功诱导获得了再生植株, 较为全面和深入地探讨了外植体发育阶段和外源激素对刺槐体细胞胚诱导的影响。但试验中, 同一采集时期同一培养基的不同外植体间愈伤组织和体细胞胚的发生情况仍存在很大差异, 这可能与外植体的基因型不同有关, 相关方面的研究还有待进一步的探索。
陈金慧, 施季森, 诸葛强, 等. 2003. 杂交鹅掌楸体细胞胚胎发生研究[J]. 林业科学, 39(4): 49-53. DOI:10.11707/j.1001-7488.20030408 |
崔凯荣, 邢更生, 周功克, 等. 2001. 体细胞胚发生的生化基础[J]. 生命科学, 13(1): 28-33. |
邓正正, 王力华, 王庆礼. 2009. 植物生长调节剂对水曲柳组培苗生长及内源激素的影响[J]. 东北林业大学学报, 37(12): 10-13. DOI:10.3969/j.issn.1000-5382.2009.12.004 |
红艳. 2007. 刺槐体细胞胚发生及植株再生的研究. 内蒙古农业大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10129-2007219594.htm
|
刘艳芝, 赵桂兰, 刘莉, 等. 1999. 大豆幼胚子叶诱导胚胎发生[J]. 吉林农业科学, 24(6): 16-18. |
刘增文, 李雅素. 1999. 黄土残塬沟壑区刺槐人工林生态系统的养分循环通量与平衡分析[J]. 生态学报, 19(5): 630-634. |
栾庆书, 罗凤霞. 2001. 刺槐组织培养研究现状[J]. 辽宁林业科技, (5): 28-31. |
宁国贵, 吕海燕, 张俊卫, 等. 2010. 梅花不同外植体离体培养及体细胞胚诱导植株再生[J]. 园艺学报, 37(1): 114-120. |
潘志刚, 游应天. 1994. 中国主要外来树种引种栽培[M]. 北京: 北京科学技术出版社.
|
乔琦, 肖娅苹, 王喆之. 2005. 外源激素对防风体细胞胚发生和发育的影响[J]. 西北大学学报:自然科学版, 35(3): 316-319. |
孙桂君, 孔冬梅, 张丽杰, 等. 2010. 取材时期和母树来源对水曲柳体细胞胚诱导的影响[J]. 东北林业大学学报, 38(1): 28-30. |
孙果忠, 张秀英, 闫长生, 等. 2005. 不同穗发芽抗性的小麦胚对ABA敏感性及抗性机制研究[J]. 麦类作物学报, 25(2): 27-32. DOI:10.7606/j.issn.1009-1041.2005.02.053 |
王宏伟, 史振声, 邢志远. 2006. 玉米幼胚组织培养褐化发生因素的研究[J]. 沈阳农业大学学报, 34(18): 4665-4666. |
王林, 章敏, 胡秋辉. 2006. 刺槐花营养功能成分及其开发利用[J]. 食品科学, (2): 274-276. |
王萍, 吴颖, 杨武杰, 等. 2002. 大豆未成熟子叶体细胞胚胎发生及其相关因子的分析[J]. 中国油料作物学报, 24(1): 29-32. |
王睿辉, 陈耀锋, 梁虹, 等. 2002. 胚龄和基因型对小麦幼胚体细胞胚性无性系的诱导[J]. 西北农林科技大学学报:自然科学版, 30(4): 17-20. |
王树芝, 田砚亭, 罗晓芳. 1999. 刺槐的离体培养研究进展[J]. 河北林果研究, 14(4): 365-373. |
王晓春, 师尚礼, 梁慧敏, 等. 2010. 2, 4-D和BA组合配比对金达苜蓿愈伤组织诱导与分化的影响[J]. 草地学报, 18(2): 219-222. DOI:10.11733/j.issn.1007-0435.2010.02.014 |
薛仁镐, 刘淑兰, 韩碧文. 1995. 大豆未成熟子叶诱导胚状体发生再生植株[J]. 延边农学院学报, 17(3): 148-152. |
张江涛, 允超, 朱延林. 2009. 浅议国内刺槐研究∥中国林学会. 第二届中国林业学术大会—S2功能基因组时代的林木遗传与改良论文集. 南宁: 中国林学会, 661-664.
|
张立刚. 2005. 人工刺槐林平茬综合技术[J]. 河北林业科技, 10(5): 54. |
张涛, 芸芥. 2007. 体细胞胚胎发生的组织细胞学研究[J]. 园艺学报, 34(1): 131-134. |
中国林木志编委会. 1978. 中国主要树种造林技术[M]. 北京: 农业出版社.
|
Arrillaga I, Tobolski J J, Merkle S A. 1994. Advances in somatic embryogenesis and plant production of black locust(Robinia pseudoacacia L.)[J]. Plant Cell Rep, 13(3): 171-175. |
Dumet D, Engelmann F, Chabrillange N, et al. 1992. Cryopreservationof oil palm(Elaeis guineensis Jacq.)[J]. somatic embryos involving a desiccation step.Plant Cell Rep, 12(6): 352-355. |
Evans D A, Sharp W R, Flick C E. 1981. Plant Tissue Culture―Methods and Applications in Agriculture[M]. New York: Academic Press.
|
Garg L, Bhandari N N, Rani V, et al. 1995. Somatic embryogenesis and regeneration of triploid plants in endosperm cultures of Acacia nilotica[J]. Plant Cell Rep, 15(11): 855-858. |
Gupta P K, Pullman G, Timmis R, et al. 1993. Forestry in the 21st century:the biotechnology of somatic embryogenesis[J]. Nature Biotechnology, 11(4): 454-459. DOI:10.1038/nbt0493-454 |
Laine E, Bade P, David A. 1992. Recovery of plants from cryopreserved embryogenic cell suspensions of Pinus caribaea[J]. Plant Cell Rep, 11(5): 295-298. |
Merkle S A, Wiecko A T. 1989. Regeneration of Robinia pseudoacacia via somatic embryogenesis[J]. Can J For Res, 19(2): 285-288. DOI:10.1139/x89-043 |
Rout G R, Samantaray S, Das P. 1995. Somatic embryogenesis and plant regeneration from callus culture of Acacia catechu—a multipurpose leguminous tree[J]. Plant Cell, Tissue and Organ Culture, 42(3): 283-285. DOI:10.1007/BF00030000 |
Vikrant, Rashid A. 2002. Somatic embryogenesis from immature and mature embryos of a minor millet Paspalum scrobiculatum L[J]. Plant Cell, Tissue and Organ Culture, 69(1): 71-77. DOI:10.1023/A:1015048529095 |
von Arnold S, Sabala I, Bozhkov P, et al. 2002. Developmental pathways of somatic embryogenesis[J]. Plant Cell, Tissue and Organ Culture, 69(3): 233-249. DOI:10.1023/A:1015673200621 |
Woo J H.1994.Utilization and tissue culture of Robinia pseudoacacia L.in Korea.Kyungpook National University, Daegu, Korea. https://link.springer.com/chapter/10.1007/978-94-011-4774-3_10
|
Zimmerman J, Lyn N. 1993. Somatic embryogenesis:a model for early development in higher plants[J]. Plant Cell, 5(10): 1411-1423. DOI:10.1105/tpc.5.10.1411 |
 2012, Vol. 48
2012, Vol. 48