文章信息
- 张晔, 李昌晓
- Zhang Ye, Li Changxiao
- 水淹与干旱交替胁迫对湿地松幼苗光合与生长的影响
- Effects of Submergence and Drought Alternation on Photosynthesis and Growth of Pinus elliottii Seedlings
- 林业科学, 2011, 47(12): 158-164.
- Scientia Silvae Sinicae, 2011, 47(12): 158-164.
-
文章历史
- 收稿日期:2011-08-22
- 修回日期:2011-09-16
-
作者相关文章
三峡水库“冬蓄夏排”的反季节水位调度管理方式,使得三峡库区在每年的6—9月份处于145 m低水位状态运行,与最高蓄水位175 m相差30 m。自7月份开始进入高温天气以来,三峡库区暴雨洪水增多,水位变化频率加快。在此过程中,库岸带植物因水位上升出现短期水淹,又因接踵而来的放水调节至低水位暴露于夏季高温中而出现短时间干旱,由此形成水淹-干旱交替胁迫现象,这将很可能打乱库岸带植物的生理节律,影响这些库岸植物的光合作用与生长发育。
湿地松(Pinus elliottii)原产北美东南部亚热带低海拔的潮湿地带,为我国长江流域及其以南各省的主要造林绿化树种之一(张太平等,1999)。作为优良的造林绿化树种与经济树种,近年来已在三峡库区库岸带栽种,但也受到库岸带水淹-干旱交替胁迫的影响。
该树种不仅能抗旱耐涝,还能耐瘠薄,适应性和抗逆力强,生长迅速。国内外学者对湿地松已开展大量研究,包括生物学特征(张太平等,1999)、生理生态(曾小平等,1999; 童方平等,2006a; 李丽文等,2007; Ford et al., 2002)、光合特性(龚伟等,2005; 童方平等,2006b; 2007)、耐旱特征(陈由强等,1999; 周席华等,2005)、遗传变异(吴际友等,2000)等方面,但有关该树种应对水淹-干旱交替胁迫的生理生态机制还未见报道。本研究的笔者假设湿地松幼苗在周期性水淹-干旱交替胁迫条件下,与连续水淹组相比,其光合与生长并无显著差异; 与对照组相比,不论是水淹-干旱交替胁迫还是连续水淹胁迫,均不会显著影响湿地松幼苗的光合与生长。旨在从生理生态的角度深入了解湿地松幼苗对周期性水淹-干旱交替胁迫的适应性机理。
1 材料与方法 1.1 试验材料选择湿地松当年实生幼苗作为研究对象。2010年5月初将生长基本一致的90株幼苗带土盆栽(土壤为紫色土),每盆1株。盆中央内径18 cm,盆高20 cm。将所有盆栽试验用苗置于西南大学三峡库区生态环境教育部重点实验室实验基地大棚下(海拔249 m,透明顶棚,四周开敞)进行相同土壤基质、光照和水分驯化适应,于2010年7月23日开展试验[此时株高为(9.38±0.21)cm]。
1.2 试验设计将试验用苗随机分为3组,每组30盆,包括对照组(CK)、连续性水淹组(CF)和周期性水淹-干旱组(PF)。对照组CK即为常规生长组,土壤含水量为田间持水量的60%~63%(土壤含水量采用称重法确定)。连续性水淹组CF在本试验中为苗木根部土壤全部淹没,水淹超过土壤表面5 cm。水淹处理时,将苗盆放入直径68 cm、高28 cm的大塑料盆内,然后向盆内注水,直到盆内水面超过土壤表面5 cm。在参考已有研究(Anderson et al., 2001; Li et al.,2004; 2005;Browna et al., 2007)的基础上,经过预备试验,确定12天为1个水淹-干旱周期,即6天水淹处理,水淹超过土壤表面5 cm,随后将盆钵中的水放干,并持续6天。在PF组,放水后2天即可达到轻度干旱胁迫状态(清晨叶水势 < -0.5MPa), 这主要是由于试验期间的高温所致(35~40 ℃)。
从试验处理之日算起, 每隔12天为1个处理周期,对光合作用以及生长各项指标进行连续测定,即分别在试验处理后的12,24,36,48和60天共开展5次测定,每个处理每次测定5个重复。同时还对土壤氧化还原电位(soil redox potential)和清晨叶水势(predawn leaf water potential)进行补充测定,以确保试验设计的正确性与试验处理的可靠性。
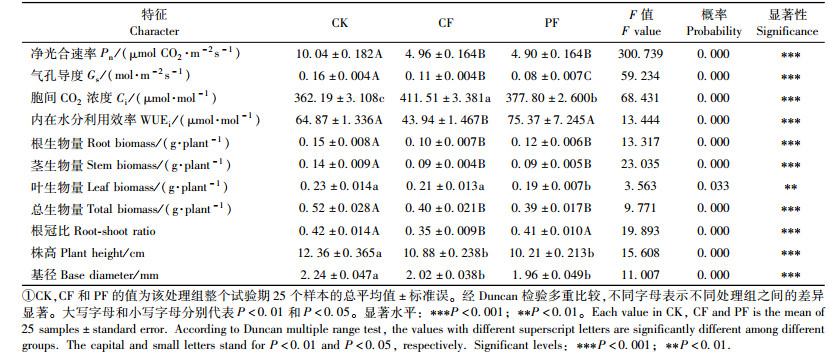
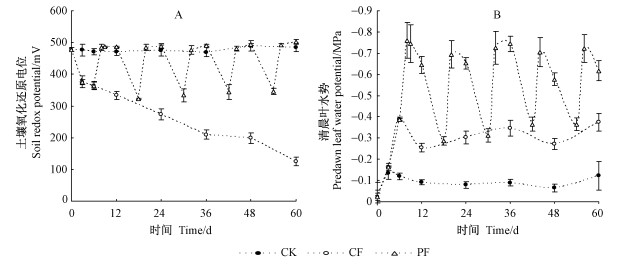
1.3 试验方法1) 土壤氧化还原电位和叶水势的测定 土壤氧化还原电位用DW-1氧化还原电位计(由江苏江分电分析仪器有限公司生产)测定。将DW-1氧化还原电位计探头插入离土壤表面10 cm位置处,待平衡后进行读数,测定结果见图 1A。对照组CK土壤氧化还原电位在整个试验阶段始终保持在470 mV以上,说明土壤处于有氧状态,通气性好(DeLaune et al., 1991)。连续性水淹组CF的土壤氧化还原电位,在水淹后不久便降至350 mV以下,并呈现出持续下降趋势,表明该处理条件下土壤氧气匮乏(DeLaune et al., 1991)。周期性水淹-干旱组PF的土壤氧化还原电位介于300~500 mV之间变化,在水淹阶段土壤氧化还原电位小于350 mV(第1次处理除外),而放水干旱阶段土壤氧化还原电位大于470 mV。
|
图 1 湿地松幼苗在不同水分处理下土壤氧化还原电位和清晨叶水势的变化 Figure 1 Changes in soil redox potential (Eh) and P. elliottii seedlings' predawn leaf water potential under different water treatments |
清晨叶水势采用Psypro露点水势仪(美国Wescor公司生产)测定,在清晨5:00—7:00时,选取湿地松幼苗上部充分发育、成熟的叶片进行测定,每处理重复3次,测定结果见图 1B。在CK组,湿地松幼苗的清晨叶水势始终维持在-0.1 MPa左右。CF组的清晨叶水势从-0.1 MPa逐步下降到-0.3~-0.4 MPa。而PF组清晨叶水势在水淹阶段介于-0.3~-0.4 MPa之间,放水干旱阶段介于-0.5~-0.8 MPa之间变化。
2) 光合作用的测定 叶片光合参数的测定采用Li-Cor 6400便携式光合分析系统(Li-Cor 6400,Li-Cor Inc,USA)测定。在预备试验的基础上,测定时间选择晴天9:00—12:00,控制CO2浓度400 μmol·mol-1,饱和光强为1 200 μmol·m-2s-1,叶室温度为25 ℃。测定指标为叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)等。并用公式计算叶片内在水分利用效率(WUEi=Pn/Gs)(Li et al., 2009)。
3) 生长与生物量的测定采用卷尺测量株高,用游标卡尺测定基径。将各植株的根、茎、叶分开取样,并置于80 ℃烘箱内烘干至恒质量后分别称量。
1.4 数据处理根据测定的各项指标,将水分处理作为独立因素,用一元方差分析(one-way ANOVA)揭示水分处理对湿地松幼苗光合与生长的影响(GLM程序,SPSS 13.0版),并用Duncan检验法进行多重比较,检验每个指标在处理间的差异显著性。
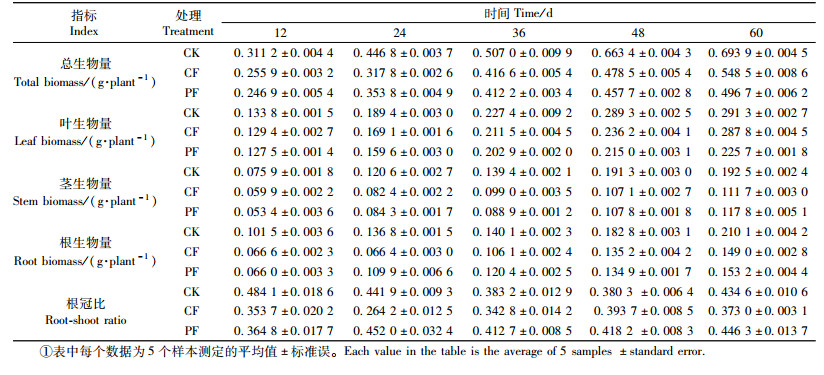
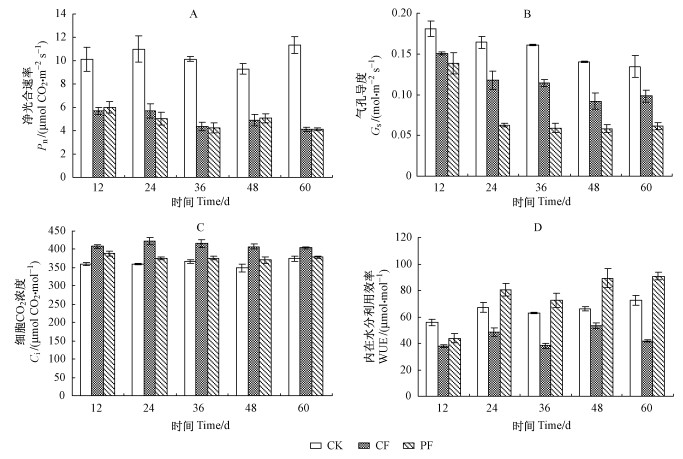
2 结果与分析 2.1 水分处理对湿地松幼苗光合生理的影响1) 水分处理对湿地松幼苗净光合速率的影响 通过方差分析可知:不同水分胁迫能极其显著地影响湿地松幼苗的净光合速率Pn(表 1)。湿地松幼苗在CF组和PF组的净光合速率呈现出下降的趋势,与CK组净光合速率保持相对稳定形成鲜明对比。试验第12天,CF组和PF组净光合速率明显下降,分别比CK组降低49.74%和47.17%。随着处理时间的延长,CF组和PF组净光合速率进一步下降,直至第36天后基本趋于平稳(在CF与PF各自组内,在36,48,60天的Pn测定值分别无显著差异,P >0.05)(图 2A)。就整个试验期的总平均值而言,湿地松幼苗CF组和PF组Pn显著低于CK组,降低幅度分别达50.60%(P < 0.001)和51.20%(P < 0.001),而CF组和PF组之间无显著差异(P = 0.818>0.05)(表 1)。
|
图 2 湿地松幼苗在不同水分处理下净光合速率、气孔导度、胞间CO2浓度和内在水分利用效率的变化 Figure 2 Changes of Pn, Gs, Ci and WUEi of P. elliottii seedlings under different water treatments |
|
|
2) 水分处理对湿地松幼苗气孔导度的影响 不同水分胁迫也能极其显著地影响湿地松幼苗的气孔导度Gs(表 1)。湿地松幼苗的气孔导度Gs在CK组呈现出缓慢下降的趋势,与CF和PF组先下降而后趋于平稳的变化有所不同(图 2B)。试验12天时,CF组和PF组气孔导度分别比CK组下降16.57%和23.20%。在试验48天时,CF组气孔导度基本趋于稳定(第48与60天的Gs值没有显著差异,P= 0.15>0.05),PF组气孔导度则在试验24天后开始保持稳定(PF组24,36,48,60天的测定值均没有显著差异,P = 0.956>0.05)。就整个试验期的总平均值而言,湿地松幼苗CF组(P < 0.001)和PF组(P < 0.001)的Gs均显著小于CK组, 并且CF组大于PF组(P < 0.001)(表 1)。
3) 水分处理对湿地松幼苗胞间CO2浓度的影响 不同水分胁迫也极其显著地影响湿地松幼苗的胞间CO2浓度Ci(表 1)。在整个试验期间,湿地松幼苗CF组和PF组胞间CO2浓度始终高于CK组。在试验12天时,CF组和PF组胞间CO2浓度分别比CK组上升13.30%和7.76%。试验24天后,CF组与PF组胞间CO2浓度趋于平稳(图 2C)。就整个试验期的总平均值而言,CF组和PF组胞间CO2浓度与CK组相比分别增加13.62% (P < 0.001)和4.31%(P < 0.05),并且CF组和PF组之间也存在着显著差异(P < 0.001)(表 1)。
4) 水分处理对湿地松幼苗内在水分利用效率的影响 湿地松幼苗的内在水分利用效率WUEi仍然受到不同水分胁迫的显著影响(表 1)。湿地松幼苗内在水分利用效率在CF与PF组均分别呈现出上升下降交替变化的趋势,与CK组基本趋于稳定的变化方式有所不同(图 2D)。PF组的内在水分利用效率在整个试验期的总均值与CK组相比无显著差异(P>0.05),CF组在整个试验期的内在水分利用效率总均值比CK组和PF组分别低32.26% (P < 0.001)和41.70%(P < 0.01)(表 1)。
2.2 水分处理对湿地松幼苗生物量的影响不同水分胁迫能显著地影响湿地松幼苗的根生物量、茎生物量、叶生物量和总生物量(表 1)。在整个试验期,随着处理时间的延长,湿地松幼苗在各处理组的根生物量、茎生物量、叶生物量和总生物量总体上均不断增加(表 2)。CF组和PF组的根生物量在整个试验期的总平均值分别比CK组低33.33%(P < 0.001)和20.00%(P < 0.001),茎生物量分别比CK组低35.71%(P < 0.001)和35.71%(P < 0.001),叶生物量分别比对照组低8.70%(P>0.05)和17.39%(P < 0.01),总生物量分别比对照组低23.08%(P < 0.001)和25.00%(P < 0.001)(表 1)。
|
|
不同水分胁迫还显著影响湿地松幼苗的根冠比(表 1)。在整个试验期间,湿地松幼苗根冠比在3个处理组之间的变化趋势存在差异。CF的根冠比在试验处理36天后趋于平稳,PF根冠比在24天后趋于平稳,而与CK组从一开始就保持其根冠比大致平稳的趋势有所差异(表 2)。CK,CF和PF组的根冠比在整个试验期的总平均值分别是0.42,0.35和0.41,CK组与CF组(P < 0.001)、CF组与PF组(P < 0.001)分别存在显著差异,CK组与PF组(P>0.05)差异不显著(表 1)。
2.3 水分处理对湿地松幼苗株高和基径的影响湿地松幼苗的株高和基径也受到不同水分胁迫的显著影响(表 1)。在整个试验期,随着处理时间的延长,湿地松幼苗CK,CF和PF组株高(图 3A)和基径(图 3B)均不断增加。CF组和PF组的株高在整个试验期的总平均值分别比CK组低11.97%(P < 0.05)和17.39%(P < 0.001)。与此同时,CF组和PF组的基径分别比CK组低9.82%(P < 0.05)和12.50%(P < 0.01)(表 1)。
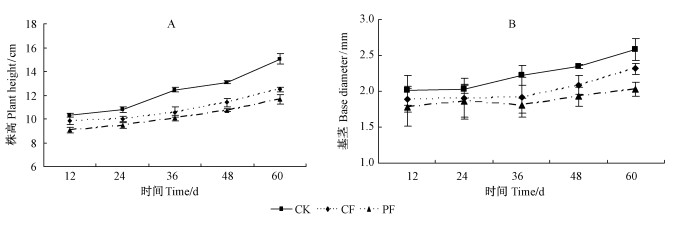
|
图 3 湿地松幼苗在不同水分处理条件下株高(a)和基径(b)的变化 Figure 3 Changes in plant height (a) and base diameter (b) of P. elliottii seedlings under different water treatments |
相关性分析发现:湿地松幼苗的净光合速率Pn与清晨叶水势及土壤氧化还原电位表现出极显著的正相关性。气孔导度Gs仅与清晨叶水势表现出极显著的正相关性,与土壤氧化还原电位却没有相关性。同时还发现,湿地松幼苗的内在水分利用效率WUEi与土壤氧化还原电位表现出极显著的正相关性,但与清晨叶水势并未表现出显著相关性(表 3)。
|
|
在不同水分胁迫条件下,净光合速率可以作为检验应试树种对水分逆境条件光合生理生态响应能力的一个重要的核心表征因子(李昌晓等,2005a; 2005b;2007)。在本试验中,就湿地松幼苗在整个试验阶段的净光合速率而言,连续性水淹胁迫(CF)和水淹-干旱交替胁迫(PF)均显著低于对照组(CK),由此说明笔者的关于“水淹-干旱交替胁迫与连续性水淹胁迫均不会显著影响湿地松幼苗的光合作用”的假设并不成立。相反,湿地松幼苗在CF与PF 2组的净光合速率没有显著差异,部分证实笔者的关于“水淹-干旱交替胁迫与连续性水淹对湿地松幼苗的光合作用影响无显著差异”。另一假设Pezeshki等(2007)认为:耐淹能力较强的树种在水淹初期净光合速率会有所下降,后期将逐步趋于稳定。在本试验中,受到淹水胁迫的湿地松幼苗在试验初期的净光合速率出现急剧下降,下降幅度甚至超过一半,此后逐步趋于稳定状态。这也与衣英华等(2006)对枫杨(Pterocarya stenoptera)幼苗进行的水分胁迫研究结果相类似。由此可见,湿地松幼苗对水淹胁迫以及水淹-干旱交替胁迫均具有一定的适应性。
一般认为,导致净光合速率降低的因素包括气孔限制和非气孔限制2个方面。Farquhar等(1982)认为,气孔限制引起的净光合速率降低是因为气孔导度下降,阻止了CO2的供应; 而非气孔限制则是因为叶肉细胞光合能力下降,导致叶肉细胞利用CO2的能力降低,进而使胞间CO2浓度升高所致。本试验发现:在整个试验期,湿地松幼苗CK组的气孔导度逐步下降的现象,很可能是因为本试验期正处于重庆7—9月份的高温炎热天气。湿地松幼苗CF组的气孔导度下降且胞间CO2浓度(大于设定的供应浓度400 μmol·mol-1)上升,极有可能是气孔限制因素与非气孔限制因素在共同起作用,从而导致该处理组的净光合速率显著降低。与CF组有所不同,湿地松幼苗PF组的气孔导度下降幅度最大,甚至比CF组还要低27%,其胞间CO2浓度比CK组虽有所上升,但仍然小于设定的供应浓度400 μmol· mol-1,因此极有可能是气孔限制因素导致该处理组的净光合速率显著降低。这说明笔者的关于“水淹-干旱交替胁迫与连续性水淹对湿地松幼苗的光合作用影响无显著差异”的不能完全成立。同时还进一步说明第2项假设也并不完全成立。
已有研究表明; 植物和土壤之间的水力导度下降将与根系缺氧一样,引起植物净光合速率和气孔导度降低(陈静等,2009; 李灵玉等,2009)。至于在本试验中,受到水淹或水淹-干旱交替胁迫的湿地松幼苗根系与土壤之间的水力导度是否下降,还有待于进一步的验证。在整个试验过程中,湿地松幼苗在经历一段时间的水分胁迫后,净光合速率、气孔导度和胞间CO2浓度等指标均能维持在较为稳定的状态,说明该树种具有一定的耐受水淹或水淹-干旱交替胁迫的能力(Schaffer et al., 1992; Nickuma et al., 2010)。湿地松幼苗PF组的气孔导度显著低于CF组,表明水淹-干旱交替胁迫的干旱处理对气孔导度的影响较为突出,湿地松幼苗在干旱处理阶段保持水分的特征十分明显。内在水分利用效率WUEi更进一步地说明了湿地松幼苗在干旱处理阶段保持水分。湿地松幼苗CF组WUEi显著低于CK与PF组,然而PF组WUEi与CK组却无显著差异性。由此表明:周期性水淹-干旱胁迫导致湿地松幼苗气孔导度和净光合速率均减小,这样可以有效维持其内在水分利用效率,积极应对水分逆境胁迫所带来的不良环境影响。
植物的生物量、株高和基径与其生长发育、营养物质的形成密切相关,对其所处的生长环境的综合表征作用明显(靖元孝等,2001; 杨静等,2008; Tang et al., 1983)。湿地松幼苗CF与PF组在根生物量、茎生物量、总生物量、株高和基径方面均无显著差异,但是在叶生物量方面却差异显著。另外CF组根冠比显著小于CK组,而PF组根冠比与CK组却无显著差异。由此说明“水淹-干旱交替胁迫与连续性水淹对湿地松幼苗的生长影响无显著差异”假设不成立。湿地松幼苗CF与PF组的根、茎、叶生物量(CF除外)、总生物量、株高和基径均显著低于对照组CK,说明连续性水淹与水淹-干旱交替胁迫已经明显影响到湿地松幼苗的生长与生物量积累,“水淹-干旱交替胁迫与连续性水淹胁迫均不会显著影响湿地松幼苗的生长”也不成立。
相关关系研究表明:清晨叶水势和土壤氧化还原电位越高,湿地松幼苗的净光合速率将有所提高,从而将有助于CO2的同化与光合产物的积累。清晨叶水势高,表明植物受到的水分胁迫程度较轻; 土壤氧化还原电位高,表明土壤的通透性好,对植物根系的氧气供应相对充足,这些相对良好的适生条件无疑将有助于湿地松幼苗的光合作用。气孔导度Gs与清晨叶水势表现出显著的正相关性,也进一步说明植物叶片的水分含量将直接关系到其气孔的导度大小。气孔导度Gs与土壤氧化还原电位却没有直接的相关性,这充分说明植物叶片气孔导度的大小与反映土壤通气性好坏标志的氧化还原电位可能只是间接的表征关系。
水淹-干旱交替胁迫与连续性水淹胁迫均能显著影响湿地松幼苗的光合与生长,并且两者的影响程度存在差异。因此,三峡库区库岸带水位变化引起的水淹-干旱交替胁迫和连续性水淹胁迫均能显著影响湿地松幼苗的光合与生长(表 1)。湿地松幼苗虽然在一定程度上受到水淹-干旱交替胁迫和连续性水淹胁迫的显著影响,但是该树种对水分胁迫仍然表现出一定的耐受能力及可塑性,仍可考虑将该树种列为三峡库区库岸带防护林体系建设树种之一,但应当特别注意加强田间土壤水分管理。
陈静, 秦景, 贺康宁, 等. 2009. 水分胁迫对银水牛果生长及光合气体交换参数的影响[J]. 西北植物学报, 29(8): 1649-1655. |
陈由强, 叶冰莹, 朱锦含. 1999. PV曲线技术比较三种木本植物的水分状况[J]. 福建师范大学学报, 15(4): 71-75. |
龚伟, 龚渊波, 胡庭兴, 等. 2005. CO2浓度升高对湿地松针叶蒸腾特性和水分利用效率的影响[J]. 水土保持学报, 19(5): 178-182. |
李昌晓, 钟章成, 刘芸. 2005a. 模拟三峡库区消落带土壤水分变化对落羽杉幼苗光合特征的影响[J]. 生态学报, 25(8): 1953-1959. |
李昌晓, 钟章成. 2005b. 三峡库区消落带土壤水分变化条件下池杉幼苗光合生理响应的模拟研究[J]. 水生生物学报, 29(6): 712-716. |
李昌晓, 钟章成. 2007. 模拟三峡库区消落带土壤水分变化条件下水松幼苗的光合生理响应[J]. 北京林业大学学报, 29(3): 23-28. |
李灵玉, 朱帆, 王俊刚, 等. 2009. 水分胁迫下臭柏光合特性和色素组成的季节变化[J]. 生态学报, 29(8): 4346-4351. |
李丽文, 杜超群, 张维, 等. 2007. 湿地松不同造林密度试验研究[J]. 湖北林业科技, (6): 16-19. |
靖元孝, 程惠青, 彭建宗, 等. 2001. 水翁幼苗对淹水的反应初报[J]. 生态学报, 21(5): 810-813. |
童方平, 方伟, 马履一, 等. 2006a. 湿地松优良半同胞家系蛋白质及糖类对水分胁迫的生理响应[J]. 中国农学通报, 22(12): 459-464. |
童方平, 方伟, 马履一, 等. 2006b. 水分胁迫下湿地松优良半同胞家系光合色素的响应[J]. 中国农学通报, 22(11): 97-102. |
童方平, 方伟, 马履一, 等. 2007. 水分胁迫下湿地松优良半同胞家系的光合特性响应研究[J]. 南京林业大学学报, 31(2): 32-36. |
吴际友, 龙应忠, 胡蝶梦, 等. 2000. 湿地松半同胞家系主要经济性状的遗传变异及其综合选择[J]. 林业科学, 36(4): 89-92. |
杨静, 何开跃, 李晓储, 等. 2008. 淹水胁迫对两种栎树生长的影响[J]. 林业科技开发, 22(4): 34-37. |
衣英华, 樊大勇, 谢宗强, 等. 2006. 模拟淹水对枫杨和栓皮栎气体交换、叶绿素荧光和水势的影响[J]. 植物生态学报, 30(6): 960-968. |
张太平, 任海, 彭少麟, 等. 1999. 湿地松(Pinus elliottii Engelm)的生态生物学特征[J]. 生态科学, 18(2): 8-12. |
周席华, 刘学全, 胡兴宜, 等. 2005. 鄂西北主要造林树种耐旱生理特性分析[J]. 南京林业大学学报, 29(1): 67-70. |
曾小平, 赵平, 彭少麟, 等. 1999. 三种松树的生理生态学特性研究[J]. 应用生态学报, 10(3): 275-278. |
Anderson P H, Pezeshki S R. 2001. Effects of flood pre-conditioning on responses of three bottomland tree species to soil waterlogging[J]. Journal of Plant Physiology, 158(2): 227-233. DOI:10.1078/0176-1617-00267 |
Browna C E, Pezeshki S R. 2007. Threshhold for recovery in the marsh halophyte Spartina alterniora grown under the combined effects of salinity and soil drying[J]. Journal of Plant Physiology, 164(3): 274-282. DOI:10.1016/j.jplph.2006.01.002 |
DeLaune R D, Pezeshki S R. 1991. Role of soil chemistry in vegetative ecology of wetlands[J]. Trends Soil Science, 1: 101-113. |
Farquhar G D, Skarkey T D. 1982. Stomatal conductance and photo synthesis[J]. Annual Review of Plant Physiology, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
Ford C R, Brooks J R. 2002. Detecting forest stress and decline in response to increasing river flow in southwest Florida, USA[J]. Forest Ecology and Management, 160(11): 45-64. |
Li S, Martin L T, Pezeshki S R. 2005. Responses of black willow (Salix nigra) cuttings to simulated herbivory and flooding[J]. Acta Oecologica, 28(2): 173-180. DOI:10.1016/j.actao.2005.03.009 |
Li S, Pezeshki S R, Goodwin S. 2004. Effects of soil moisture regimes on photosynthesis and growth in cattail (Typha latifolia)[J]. Acta Oecologica, 25(1-2): 17-22. DOI:10.1016/j.actao.2003.10.004 |
Li C, Wei H, Geng Y, et al. 2010. Effects of submergence on photosynthesis and growth of Pterocarya stenoptera(Chinese wingnut)seedlings in the recently-created Three Gorges Reservoir region of China[J]. Wetlands Ecology Management, 18(4): 485-494. DOI:10.1007/s11273-010-9181-3 |
Nickuma M T, Crane J H, Schaffer B. 2010. Reponses of mamey sapote trees to continuous and cyclical flooding in calcareous soil[J]. Scientia Horticulturae, 123(3): 402-411. DOI:10.1016/j.scienta.2009.09.021 |
Pezeshki S R, Li S, Shields F D, et al. 2007. Factors governing survival of black willow (Salix nigra) cuttings in a streambank restoration project[J]. Ecological Engineering, 29(1): 56-65. DOI:10.1016/j.ecoleng.2006.07.014 |
Schaffer B, Andersen P C, Ploetz R C. 1992. Responses of fruit crops to flooding[J]. Horticultural Reviews, 13: 257-313. |
Tang Z C, Kozlowski T T. 1983. Responses of Pinus banksiana and Pinus resinosa seedlings to flooding[J]. Canadian Journal of Forest Research, 13(4): 633-639. DOI:10.1139/x83-091 |
 2011, Vol. 47
2011, Vol. 47