文章信息
- 陈利, 刘金梁, 谷加存, 王政权
- Chen Li, Liu Jinliang, Gu Jiacun, Wang Zhengquan
- 水曲柳和落叶松人工林土壤线虫密度的季节动态
- Seasonal Dynamics of Soil Nematodes in Fraxinus mandshurica and Larix gmelinii Plantations
- 林业科学, 2011, 47(12): 69-77.
- Scientia Silvae Sinicae, 2011, 47(12): 69-77.
-
文章历史
- 收稿日期:2011-01-13
- 修回日期:2011-06-02
-
作者相关文章
土壤线虫个体虽小,但数量庞大,作为土壤动物重要组分之一其功能不可忽视(Coleman et al., 2005;邵元虎等, 2007)。食根线虫可刺激根分泌物增加(Poll et al., 2007),提高土壤微生物的活性(Tu et al., 2003);食微生物线虫可促进养分矿化(Ferris et al., 1998; 毛小芳等, 2005),影响碳和养分循环速率(Yeates et al., 1979;梁文举等,2001;吴纪华等,2007);捕食和杂食性线虫作为线虫类群中的高级营养类群,在控制食根线虫和食微生物线虫方面起着重要调节作用(Khan et al., 2007)。大量研究表明:土壤线虫直接或间接影响植物生长和生产力(Bardgett et al., 1999, 梁文举等,2000;Yeates, 2007)。Verschoor等(2002)研究荷兰草原发现:土壤线虫增加后根系生物量平均降低19%,地上生物量降低17%;Scott等(1979)研究表明:土壤线虫消耗的草原净初级生产力占7%~15%。因此,土壤线虫在陆地生态系统碳和养分循环过程中发挥着重要作用(Stevens et al., 2002)。
森林是陆地生态系统中线虫最丰富的场所,凋落物和土壤中每平方米线虫数量高达1千万条,种类超过400种(Yeates et al., 1999;邵元虎等, 2007)。通过土壤线虫的数量和种类丰富程度可以评价土壤肥力和健康状况(Yeates,2007)。但是,对森林土壤线虫的研究远落后于其他生态系统,如农田(Avendaño et al., 2004;梁文举等,2006)、草地(Bardgett et al., 1999;Verschoor et al., 2002)、灌丛(Jiang et al., 2007;吴建波等,2008)和果园(Forge et al., 2008)等。多项研究显示:土壤线虫密度和种类受土壤有机质(Matlack, 2001)、温度(Verschoor et al., 2001)、湿度(Görres et al. 1998)和pH值(Räty et al., 2003)等影响,因此,研究土壤线虫密度与环境因子之间的关系成为了解和预测土壤线虫动态及其与植被联系的重要基础(Verschoor et al., 2001;Berg et al., 2007)。与国外相比,我国森林土壤线虫研究内容主要关注其多样性变化,研究地点集中在热带和亚热带森林中,而北方森林内的研究较少(李辉信等,2002;邓晓保等,2003;张瑞清等,2007;王超军等,2007;2008)。北方森林土壤特征季节性变化明显,土壤线虫密度也必然随季节发生变化,但是,关于我国北方森林中尤其是针叶林和阔叶林中土壤线虫密度的季节格局和影响因子,所知甚少,这阻碍了对土壤线虫生态学功能的准确评价和预测。为此,本文以东北地区21年生水曲柳(Fraxinus mandshurica)和落叶松(Larix gmelinii)人工纯林为研究对象,通过2年取样分析,探讨不同营养类群的土壤线虫时间和空间动态,及其与环境因子之间的关系。主要目的是:1)比较相同立地条件下各营养类群线虫密度在2林分中的差异;2)分析线虫密度在季节和土层间的变化;3)探讨线虫密度时空动态与土壤温度、湿度和pH值的关系。
1 试验地概况研究地点位于东北林业大学帽儿山实验林场尖砬沟森林培育实验站(127°30′—127°34′E,45°21′—45°25′N)。属温带大陆性季风气候区,年平均气温2.8 ℃,1月平均温度-19.6 ℃,7月平均温度20.9 ℃。年平均降水量723 mm,年平均蒸发量1 094 mm。无霜期120~140天,≥10 ℃的积温2 526 ℃。
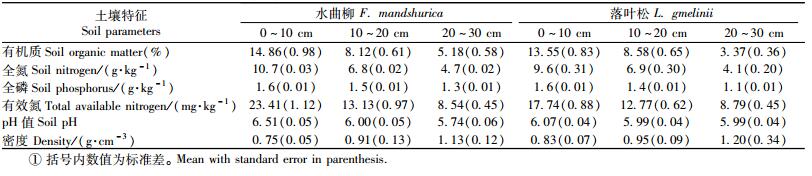
研究林分为1986年营造的水曲柳和落叶松(2年苗)人工林,株行距1.5 m×2.0 m。2002年春季分别在水曲柳和落叶松林分设置3块样地(20 m×30 m),样地位置在山坡中上部,海拔高度400~500 m左右,坡度为10°~15°,2个树种林分立地条件相对一致。2006年调查时,水曲柳树高和胸径分别为(12.35±0.41) m和(9.83±0.74) cm,落叶松分别为(13.80±0.53) m和(12.26±0.15)cm。林地土壤为暗棕壤,土层平均厚度40~45 cm,腐殖质层厚度为10~15 cm,土壤比较肥沃(表 1)。
|
|
2007年和2008年分别于5月中旬(春)、7月中旬(夏)和10月上旬(秋)在水曲柳和落叶松样地内,采用内径为2.8 cm的土壤钻进行取样。每块样地随机选取5个取样点,分3层(0~10 cm、10~20 cm和20~30 cm)采集土壤样品(约100 g),装入事先编号的封口袋,放入2~4 ℃的保温箱中,运回实验室后4 ℃低温保存。2007年5月中旬由于林地未完全融化,取样深度仅到20 cm。2年共取土壤样品402个。
在实验室采用淘洗-过筛-蔗糖离心法分离提取土壤线虫,整个线虫分离工作在10天内完成。分离的具体步骤:1)样品(鲜土)过2 mm筛(混匀);2)称取40 g左右土样放入小盆内;3)加水充分搅拌,静止20 s;4)将悬浮液过40目和400目2个筛;5)重复步骤3), 4)3~6次;6)然后用洗瓶冲洗400目筛上的线虫-土粒混合物于100 mL离心管中;7)在2 000 r·min-1离心5 min;8)小心倒掉离心管中上清液,加入1 mol·L-1蔗糖液(40~50 mL),用玻璃棒充分搅拌线虫-土壤液,2 000 r·min-1离心1 min;9)小心倒出离心管上清液过400目筛;10)用洗瓶小心冲洗筛上的线虫于50 mL离心管内(加入等体积2倍FG固定液)保存。
在显微镜(CK40, OLYMPUS Inc. Japan)下查数各食性线虫个数。根据Yeates等(1993)的分类方法将土壤线虫划分为植食线虫(plant-feeding nematodes,简称PF)、食细菌线虫(bacterivores,简称BF)、食真菌线虫(fungivores,简称FF)、杂食-捕食线虫(omnivores-Predators,简称OM-PR)4大类。
2.2 土壤环境因子测定在取样的同时测定各个土层的温度(JM624数字温度计,天津今明仪器有限公司)、土壤湿度(TDR300, Spectrum Technologies Inc. Illinois, USA)和土壤pH值(土壤原位pH计,IQ150,Spectrum Technologies Inc. Illinois, USA),每个采样点重复测定3次。同时采集土壤样品,在实验室测定土壤有机质(重铬酸钾氧化-外加热法)、全氮(半微量凯式定氮法)和全磷(硫酸-高氯酸消煮-钼锑抗比色法)(鲍士旦, 2000)。
2.3 数据处理依据土壤湿度,将土壤线虫密度折算成每100 g干土含有线虫的条数,计算不同树种、不同土层各个采样时间上线虫密度平均值和标准误差。不同树种之间、不同土层和不同季节之间线虫密度的差异采用方差分析(SPSS 13.0 for Windows,SPSS Inc. Illinois, USA),平均值之间显著性水平用LSD法检测,显著性水平设置在α=0.05水平上。在此基础上采用回归分析方法,分析土壤温度、湿度和pH值与线虫密度的相关性,显著性水平设置在α=0.05水平上。最后采用Sigmaplot 10.0(Systat software Inc. California, USA)软件进行相关指标的绘图。
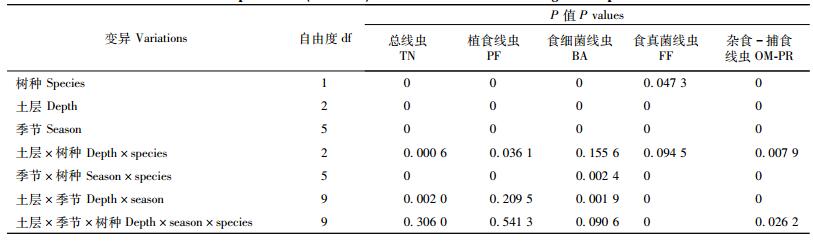
3 结果与分析 3.1 土壤线虫密度土壤线虫总密度(TN)和各营养类群线虫密度在2个林分中具有显著差异(表 2)。从2年数据的平均值来看,水曲柳林地总线虫密度(1 079条·100 g-1干土)明显高于落叶松林地(393条·100 g-1干土)。各营养类群线虫占的比例不同,其中,植食线虫(PF)占82%(水曲柳)和74%(落叶松),食细菌线虫(BA)占11%(水曲柳)和17%(落叶松),杂食-捕食线虫(OM-PR)占5%(水曲柳)和7%(落叶松),食真菌线虫(FF)占1%(水曲柳)和2%(落叶松)。
|
|
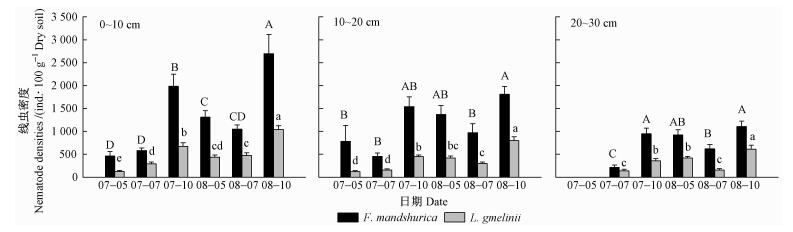
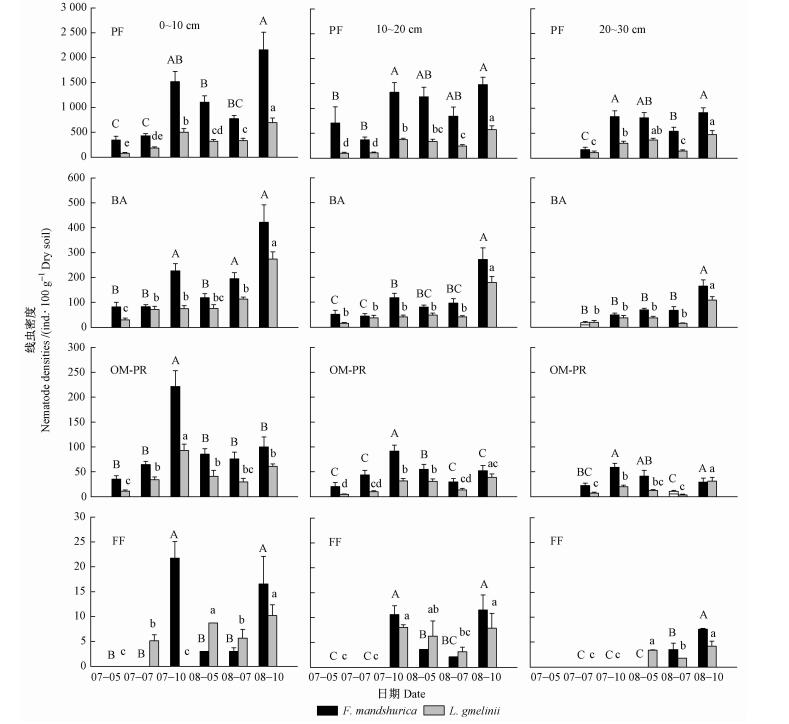
2个林分不同土层之间总线虫密度也具有显著差异(表 2),表层(0~10 cm)密度最高,水曲柳为1 346条·100 g-1干土(占41%),落叶松为507条·100 g-1干土(占35%);底层(20~30 cm)密度最低,水曲柳为760条·100 g-1干土(占23%),落叶松为336条·100 g-1干土(占23%)(图 1)。这种随土层深度增加密度下降的格局在各营养群类线虫(PF,BA,OM-PR和FF)中均存在(表 2,图 2)。
|
图 1 水曲柳和落叶松人工林2007—2008年生长季内土壤总线虫密度季节动态和土层变化 Figure 1 Seasonal dynamics and vertical distributions of total nematodes density in F. mandshurica and L. gmelinii plantations 同一树种不同字母表示在0.05水平上差异显著。 Different letters within a species indicate significant differences at α=0.05 level. |
|
图 2 水曲柳和落叶松人工林2007—2008年生长季内土壤各营养类群线虫密度季节动态和土层变化 Figure 2 Seasonal dynamics and vertical distributions of different trophic groups of nematodes in F. mandshurica and L. gmelinii plantations 同一树种不同字母表示在0.05水平上差异显著Different letters within a species indicate significant differences at α=0.05 level。PF:植食线虫Plant feeding nematodes;BA:食细菌线虫Bacterivores;FF:食真菌线虫Fungivores;OM-PR:杂食线虫-捕食线虫Omnivores-Predators. |
不同季节土壤线虫总密度和各营养类群线虫密度具有显著差异(表 2,图 1,2)。对于土壤总线虫密度,无论表层(0~10 cm)、亚表层(10~20 cm)还是底层(20~30 cm),秋季(10月)线虫密度最高(占42%~66%),夏季(7月)密度最低(占13%~28%,2007年表层除外)(图 1)。树种、土层、季节的方差分析表明:两者之间具有明显的交互作用,但是,其3者之间的交互作用(除了OM-PR线虫外)不显著(表 2)。在总线虫密度季节变化中,LSD检验发现秋季线虫密度与夏季或春季具有显著差异;而夏季和春季之间在水曲柳林地中不显著,但是在落叶松林地表层(2007)和底层(2008)差异显著(图 1)。
与总线虫密度季节性格局相似,各营养类群线虫密度也具有明显的季节性变化(图 2)。对于植食线虫(PF)2007年和2008年秋季线虫密度最高,除2007年表层(0~10 cm)外,均表现出秋季(10月)>春季(5月)>夏季(7月)的格局(图 2)。秋季与夏季或春季线虫密度有显著差异,但是夏季和春季之间差异不显著(图 2)。对于食细菌线虫(BA),在水曲柳林地3个土壤层次上,线虫密度从春季到秋季逐渐增加,秋季达到最大值,并且与夏季或春季有显著差异;落叶松林地除表层(0~10 cm)与水曲柳季节格局相似外,而亚表层(10~20 cm)和底层(20~30 cm)在夏季密度相对较低(图 2)。杂食-捕食线虫(OM-PR)其密度季节性变化在林分间主要差别是水曲柳亚表层和底层2008年春高于秋季,但差异不显著(图 2)。食真菌线虫(FF),在2个林分3个土壤层次上均表现为秋季线虫密度最高(图 2)。总体上,2个树种林地各营养类群线虫季节性格局基本一致。
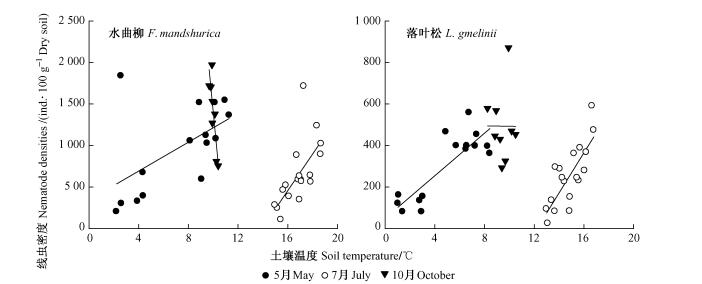
3.3 土壤线虫密度与土壤温度、水分和pH的相关性水曲柳和落叶松林地土壤线虫密度与土壤水分和pH在呈显著负相关(图 3)。在2个林分中,随着土壤水分和pH增加,土壤线虫总密度降低,土壤水分可以解释线虫总密度变异的44%(水曲柳)和37%(落叶松),土壤pH可以解释变异的58%(水曲柳)和32%(落叶松)。与土壤水分和pH不同,线虫总密度与土壤温度在整个生长季内不相关(图 4)。但是考虑不同季节时发现,在春季(水曲柳R2=0.31,P < 0.05;落叶松R2=0.71, P < 0.01)和夏季(水曲柳R2=0.42,P < 0.05;落叶松R2=0.61, P < 0.01)具有显著正相关,秋季相关性较弱(图 4)。多元线性回归分析表明:土壤温度、水分和pH综合作用可以解释线虫总密度变异的46%(水曲柳)和49%(落叶松)。

|
图 3 水曲柳和落叶松人工林2007—2008年生长季内土壤线虫总密度与土壤水分和pH关系 Figure 3 Correlations between soil nematode densities with soil moisture and pH in F. mandshurica and L. gmelinii plantations |
|
图 4 水曲柳和落叶松人工林2007—2008年生长季内土壤线虫总密度与土壤温度关系 Figure 4 Correlations between soil nematode density and soil temperature in F. mandshurica and L. gmelinii plantations |
多项研究表明:在陆地生态系统中森林土壤线虫最为丰富,这主要是由于森林具有多样的植物种类、庞大的根系、丰富的凋落物和有机质以及相对稳定的土壤环境(Brown et al., 1990)。一般认为,温带阔叶森林土壤线虫密度明显高于温带针叶林(邵元虎等,2007),这与本研究结果一致。在立地条件和林分年龄相同条件下,经过2年的研究发现:水曲柳林地土壤线虫密度明显高出落叶松174%。王邵军等(2007)对我国福建针叶林和阔叶林土壤线虫研究发现,阔叶林土壤线虫密度是针叶林的2倍;Háněl(2008)对欧洲橡树(Quercus robur)林、欧洲桤木(Alnus glutinosa)林和欧洲落叶松(Larix decidua)林土壤线虫密度的研究也得到同样规律。产生这种差异可能有3个方面原因:首先,针叶林和阔叶林凋落物组成不同,前者凋落物往往形成粗腐殖质,C:N比高,后者一般形成软腐殖质,C:N比低,而土壤腐殖质品质影响线虫数量多少。例如,Yeates(1996)研究表明: C:N等于13.8时,土壤线虫密度4 224×103·m-2,当C:N升高到18.3时,土壤线虫密度则降低到2 133×103·m-2。其次,根系分泌物量多少影响土壤线虫密度。根系分泌物对线虫具有吸引作用(冯志新,2001),分泌物多少与树种类型有密切关系(Brown et al., 1990)。吴保国等(1997)对水曲柳和落叶松苗木根系分泌物定量分析发现:水曲柳根分泌物中游离氨基酸(130 mg·L-1)是落叶松(28 mg·L-1)的4.5倍,分泌物中可溶性糖(10~11 mg·L-1)也高于落叶松(8.5~9.0 mg·L-1)。这些分泌物为土壤线虫,尤其是根际线虫提供大量营养物质(Brown et al., 1990)。此外,除分泌物外,土壤线虫还利用微生物中的碳和氮(陈小云等,2007),这可能是影响土壤线虫密度的另一个原因。贾淑霞等(2009)研究表明:水曲柳林地中微生物碳和氮分别比落叶松林地高16%和22%,而且细菌、真菌和放线菌数量也明显高于落叶松林。因此树种类型引起的腐殖质、根系分泌物和微生物碳氮的不同是导致水曲柳和落叶松林地土壤线虫密度差异的重要因素。
在各营养类群线虫中,植食线虫占比例最高(水曲柳为82%,落叶松为74%),其次是食细菌线虫(水曲柳为11%,落叶松为17%),杂食-捕食线虫(水曲柳为5%,落叶松为7%)和食真菌线虫(水曲柳为1%,落叶松为2%)占的比例较低。这种比例关系可能在植物生态系统中具有普遍性。周际海等(2008)研究农田玉米(Zea mays)土壤表明:植食线虫占60%,杂食-捕食线虫占1%;王邵军等(2008)研究日本柳杉(Cryptomeria japonica)纯林和混交林土壤线虫发现,植食线虫占48%~57%;阮维斌等(2007)同样在内蒙古大针茅草原得到类似的规律(植食线虫比例69%~81%,食真菌线虫比例0.9%~2.4%)。这种现象在欧洲橡树林和新西兰辐射松(Pinus radiata)林的研究(Yeates,1996;Lazarova et al., 2004)中同样得到证实。导致植食线虫明显高于其他营养类群线虫主要原因可能是根系的多少。土壤植食线虫生存的场所主要是根际,它们以新鲜细根为食物,或寄生在根的皮层细胞内(Brown et al., 1990),它们依赖根系生存。植物群落(如森林)中生长着大量根系,这些根系(包括分泌物)为植食性线虫提供能量和营养物质。如果根系死亡,对植食线虫生存会产生重要影响。例如,Háněl(2004)对欧洲云杉(Picea abies)林研究发现:在皆伐后2年的迹地上,土壤植食线虫密度很低,而食细菌线虫占绝对优势。此外,如果植被稀疏,植食线虫占的比例也很低(吴建波等,2008)。
土壤温度、水分和pH是影响线虫密度的重要因子,因为这些因子影响线虫的繁殖和生长(冯志新,2001)。线虫的繁殖和生长不但需要水分,还需要O2,土壤水分过多降低了土壤中O2的浓度。本研究表明:土壤水分与线虫密度紧密负相关(图 3),可以解释线虫密度变异的44%(水曲柳)和37%(落叶松)。2个林分中土壤pH值从5.0增加到7.0,线虫密度显著下降(图 3),说明土壤线虫适宜生长在微酸性环境中(冯志新,2001;Räty et al., 2003)。温度是影响线虫繁殖的关键因素(Verschoor et al., 2001),多数线虫完成一代需要3~4周时间,最短接近1周(冯志新,2001),因此每一季节内的土壤温度变化对线虫密度的影响可能显得更重要。本研究表明:虽然温度在整个生长季内对线虫密度没有影响,但是春季和夏季土壤温度与线虫密度紧密正相关(图 4),这可能是线虫有较短的繁殖周期,而在这繁殖周期内温度对卵的孵化和幼虫发育有重要影响。准确了解这些土壤环境因子对线虫密度的影响机制还需要将线虫密度的变化与其生活史联系起来。
森林土壤最大特点是随着土壤深度增加养分和水分减少和温度降低,这必然影响土壤线虫密度的垂直分布特征。在水曲柳和落叶松林地中,生长季节从表层(0~10 cm)到底层(20~30 cm)土壤线虫总密度分别减少了44%(水曲柳)和34%(落叶松)(图 1)。Sohlenius等(2001)认为土壤资源有效性的垂直分布影响了线虫种群密度。在本研究的林分中,从表层到底层随着土壤深度增加,土壤有机质含量、养分含量、水分等显著下降(表 1)。除了上述因子外,根系密度的垂直减少也是一个重要因素。已往研究表明:水曲柳和落叶松林地50%~60%的细根分布在表层(0~10 cm),底层(20~30 cm)不到20%(梅莉等,2006;程云环等,2005)。在森林土壤中,由于绝大多数土壤线虫生活在根际范围内,因此,根系(主要是细根)和土壤资源垂直分布是影响土壤线虫密度垂直分布的主要原因(Ou et al., 2005; Berg et al., 2007)。
土壤线虫密度变化的另一特点是季节动态。无论在热带森林干湿季节还是温带或北方森林四季变化,线虫种群密度变化都与季节有关(Berg et al., 2007)。主要原因是这些季节变化影响土壤线虫生殖和发育以及食物资源(Sohlenius et al., 2001)。本研究中水曲柳和落叶松林地土壤线虫总密度秋季达到最高(图 1)。在各营养类群线虫中,植食线虫密度季节变化格局与总线虫密度格局相似(图 2),食细菌线虫和杂食-捕食线虫在表层不同年份之间略有差异,秋季土壤线虫密度最高。导致秋季密度最高的原因可能有3个方面原因:第一,线虫密度秋季升高与细根生物量关系密切。Verschoor等(2001)和Van der Stoel等(2006)对荷兰草地研究表明,土壤线虫密度(主要是植食线虫)与细根生物量相关(R2=0.74);王邵军等(2007)对我国福建森林研究发现,细根生物量可以解释59%的线虫密度的变异。在本研究的林分中,无论水曲柳还是落叶松1级根(根尖)生物量在秋季(9月)最高(水曲柳为52.1 g·m-2, 落叶松为37.1 g·m-2),其次是春季(5月)(水曲柳为43.3 g·m-2, 落叶松为15.5 g·m-2),夏季(7月)最低(水曲柳为37.5 g·m-2, 落叶松为14.7 g·m-2)(Wang et al., 2006)。细根生物量季节变化与线虫密度季节变化基本吻合。第二,线虫密度秋季升高可能与细根非结构碳水化合物浓度有关。作为占绝大多数的植食线虫,主要食物来源是细根中的碳和其他营养物质。为了越冬和下年春季生长,根系中的碳水化合物在秋季显著增加(Teixeira et al., 2007; Regier et al., 2010)。Norton(1978)认为,在季节变化过程中,食物的供应往往比温度显得更重要。秋季细根碳和营养物质增加为线虫提供了充足食物,促进线虫短期内繁殖。第三,秋季林地凋落物大量增加,导致土壤可溶性物质含量提高,促进了土壤微生物生物量(碳和氮)积累,这可能是导致线虫密度增加的原因之一。Maxwell等(1995)在美国Coweeta实验站研究表明:当土壤微生物碳从79.5 g·m-2(6月)增加到88.7 g·m-2(10月)时,土壤线虫密度从10.5×105 m-2增加到12.8×105 m-2。Ou等(2005)对辽宁杨树(Populus canadensis)林研究发现:线虫数量与土壤总有机碳(TOC)相关性为R2=0.56,在水田和旱田则高达R2=0.86和R2=0.71。这些解释虽然有其合理性,但还是不能了解秋季线虫密度增加的机制,这可能需要从线虫生存策略以及环境适应性方面去深入研究。
5 结论1) 林分类型、土层和季节对总线虫和各营养类群线虫密度有显著影响。水曲柳林地土壤线虫密度显著高于落叶松,2林分均为表层显著高于底层,秋季显著高于夏季和春季;2)在各营养类群线虫中,植食线虫占比例最高,其次是食细菌线虫,杂食-捕食线虫和食真菌线虫占比例最低;3)土壤水分和pH与线虫总密度显著负相关,春季和夏季土壤温度与线虫密度显著正相关,这3个因子的综合作用可以解释线虫总密度变异的46%(水曲柳)和49%(落叶松)。
鲍士旦. 2000. 土壤农化分析[M]. 2版. 北京: 中国农业出版社.
|
陈小云, 刘满强, 胡锋, 等. 2007. 根际微型土壤动物——原生动物和线虫的生态功能[J]. 生态学报, 27(8): 3132-3143. |
程云环, 韩有志, 王庆成, 等. 2005. 落叶松人工林细根动态与土壤资源有效性关系研究[J]. 植物生态学报, 29(3): 403-410. DOI:10.17521/cjpe.2005.0053 |
邓晓保, 邹寿青, 付先惠, 等. 2003. 西双版纳热带雨林不同土地利用方式对土壤动物个体数量的影响[J]. 生态学报, 23(1): 130-138. |
冯志新. 2001. 植物线虫学[M]. 北京: 中国农业出版社.
|
贾淑霞, 赵妍丽, 孙玥, 等. 2009. 施肥对落叶松和水曲柳人工林土壤微生物生物量碳和氮季节变化的影响[J]. 应用生态学报, 20(9): 2063-2071. |
李辉信, 刘满强, 胡锋, 等. 2002. 不同植被恢复方式下红壤线虫数量特征[J]. 生态学报, 22(11): 1882-1889. DOI:10.3321/j.issn:1000-0933.2002.11.012 |
梁文举, 姜勇, 李琪. 2006. 定位试验地耕层土壤植物寄生线虫空间分布特征[J]. 生态学报, 26(1): 33-39. |
梁文举, 史奕, SteinbergerY. 2000. 农业生态系统线虫多样性研究进展[J]. 应用生态学报, 11(sup): 113-116. |
梁文举, 闻大中. 2001. 土壤生物及其对土壤生态学发展的影响[J]. 应用生态学报, 12(1): 137-140. |
毛小芳, 李辉信, 龙梅, 等. 2005. 不同食细菌线虫取食密度下线虫对细菌数量、活性及土壤氮素矿化的影响[J]. 应用生态学报, 16(6): 1112-1116. |
梅莉, 王政权, 韩有志, 等. 2006. 水曲柳根系生物量、比根长和根长密度的分布格局[J]. 应用生态学报, 17(1): 1-4. |
阮维斌, 吴建波, 张欣, 等. 2007. 内蒙古中东部大针茅群落土壤线虫多样性研究[J]. 应用与环境生物学报, 13(3): 333-337. |
邵元虎, 傅声雷. 2007. 试论土壤线虫多样性在生态系统中的作用[J]. 生物多样性, 15(2): 116-123. |
王邵军, 蔡秋锦, 阮宏华. 2007. 土壤线虫群落对闽北森林植被恢复的响应[J]. 生物多样性, 15(4): 356-364. |
王邵军, 蔡秋锦, 阮宏华. 2008. 不同生境柳杉根际线虫群落的生态特征[J]. 生态学杂志, 27(4): 583-590. |
吴保国, 王晓水, 刘广平. 1997. 落叶松水曲柳混交林挥发物和根分泌物的作用//沈国舫, 翟明普.混交林研究[M]. 北京: 中国林业出版社: 159-163.
|
吴纪华, 宋慈玉, 陈家宽. 2007. 食微线虫对植物生长及土壤养分循环的影响[J]. 生物多样性, 15(2): 124-133. |
吴建波, 阮维斌, 谢凤行, 等. 2008. 毛乌素沙地三种植物根际土壤线虫群落和多样性分析[J]. 生物多样性, 16(6): 547-554. |
张瑞清, 孙振钧, 王冲, 等. 2007. 西双版纳热带雨林凋落叶分解过程Ⅱ.微生物与线虫的群落动态[J]. 生态学报, 27(2): 640-649. |
周际海, 陶军, 陈小云, 等. 2008. 安徽农药厂厂区及周边农田土壤线虫数量特征[J]. 生物多样性, 16(6): 613-617. |
Avendaño F, Ierce F J P, Melakeberhan H. 2004. The relationship between soybean cyst nematode seasonal population dynamics and soil texture[J]. Nematology, 6(4): 511-525. DOI:10.1163/1568541042665214 |
Bardgett R D, Cook R, Yeates G W, et al. 1999. The influence of nematodes on below-ground processes in grassland ecosystems[J]. Plant and Soil, 212(1): 23-33. DOI:10.1023/A:1004642218792 |
Berg M P, Bengtsson J. 2007. Temporal and spatial variability in soil food web structure[J]. Oikos, 116(1): 1789-1804. |
Brown V K, Gange A C. 1990. Insect herbivory below ground[J]. Advances in Ecological Research, 20: 1-58. DOI:10.1016/S0065-2504(08)60052-5 |
Coleman D C, Whitman W B. 2005. Linking species richness, biodiversity and ecosystem function in soil systems[J]. Pedobiologia, 49(6): 479-497. DOI:10.1016/j.pedobi.2005.05.006 |
Ferris H, Venette R C, Van der Meulen H R, et al. 1998. Nitrogen mineralization by bacterial-feeding nematodes: verification and measurement[J]. Plant and Soil, 203(2): 159-171. DOI:10.1023/A:1004318318307 |
Forge T A, Hogue E J, Neilsen G, et al. 2008. Organic mulches alter nematode communities, root growth and fluxes of phosphorus in the root zone of apple[J]. Applied Soil Ecology, 39(1): 15-22. DOI:10.1016/j.apsoil.2007.11.004 |
Görres J H, Dichiaro M J, Lyons J B, et al. 1998. Spatial and temporal patterns of soil biological activity in a forest and an old field[J]. Soil Biology & Biochemistry, 30(2): 219-230. |
Háněl L. 2004. Response of soil nematodes inhabiting spruce forests in the Šumava Mountains to disturbance by bark beetles and clear-cutting[J]. Forest Ecology and Management, 202(1-3): 209-225. DOI:10.1016/j.foreco.2004.07.027 |
Háněl L. 2008. Nematode assemblages indicate soil restoration on colliery spoils afforested by planting different tree species and by natural succession[J]. Applied Soil Ecology, 40(1): 86-99. DOI:10.1016/j.apsoil.2008.03.007 |
Jiang D M, Li Q, Liu F M, et al. 2007. Vertical distribution of soil nematodes in an age sequence of Caragana microphylla plantations in the Horqin Sandy Land, Northeast China[J]. Ecological Research, 22(1): 49-56. DOI:10.1007/s11284-006-0187-5 |
Khan Z, Kim Y H. 2007. A review on the role of predatory soil nematodes in the biological control of plant parasitic nematodes[J]. Applied Soil Ecology, 35(2): 370-379. DOI:10.1016/j.apsoil.2006.07.007 |
Lazarova S S, de Goede R G M, Peneva V K, et al. 2004. Spatial patterns of variation in the composition and structure of nematode communities in relation to different microhabitats: a case study of Quercus dalechampii Ten forest[J]. Soil Biology & Biochemistry, 36(4): 701-712. |
Matlack G R. 2001. Factors determining the distribution of soil nematodes in a commercial forest landscape[J]. Forest Ecology and Management, 146(1-3): 129-143. DOI:10.1016/S0378-1127(00)00454-0 |
Maxwell R A, Coleman D C. 1995. Seasonal dynamics of nematodes and microbial biomass in soils of riparian-zone forests of the Southern Appalachians[J]. Soil Biology & Biochemistry, 27(1): 79-84. |
Norton D C. 1978. Ecology of plant-parasitic nematodes[J]. New York: John Wiley & Son, 82. |
Ou W, Liang W J, Jiang Y, et al. 2005. Vertical distribution of soil nematodes under different land use types in an aquic brown soil[J]. Pedobiologia, 49(2): 139-148. DOI:10.1016/j.pedobi.2004.10.001 |
Poll J, Marhan S, Haase S, et al. 2007. Low amounts of herbivory by root-knot nematodes affect microbial community dynamics and carbon allocation in the rhizosphere[J]. Federation of European Microbiological Societies (FEMS) Microbiology Ecology, 62(3): 268-279. DOI:10.1111/fem.2007.62.issue-3 |
Räty M, Huhta V. 2003. Earthworms and pH affect communities of nematodes and enchytraeids in forest soil[J]. Biology and Fertility of Soils, 38(1): 52-58. DOI:10.1007/s00374-003-0614-5 |
Regier N, Streb S, Zeeman S C, et al. 2010. Seasonal changes in starch and sugar content of poplar (Populus deltoides × nigra cv.Dorskamp) and the impact of stem girdling on carbohydrate allocation to roots[J]. Tree Physiology, 30(8): 979-987. |
Scott J A, French N R, Leethan J W. 1979. Patterns of consumption in grasslands // French N R. Perspectives in grassland ecology. Ecological Studies, 32: 89-105.
|
Sohlenius B, Boström S. 2001. Annual and long-term fluctuations of the nematode fauna in a Swedish Scots pine forest soil[J]. Pedobiologia, 45(5): 408-429. DOI:10.1078/0031-4056-00096 |
Stevens G N, Jones R H, Mitchell R J. 2002. Rapid fine root disappearance in a pine woodland: A substantial carbon flux[J]. Canadian Journal of Forest Research, 32(12): 2225-2230. DOI:10.1139/x02-135 |
Teixeira E I, Motta D J, Mickelbar M V. 2007. Seasonal patterns of root C and N reserves of lucerne crops (Medicago sativa) grown in a temperate climate were affected by defoliation regime[J]. European Journal of Agronomy, 26(1): 10-20. DOI:10.1016/j.eja.2006.08.010 |
Tu C, Koenning S R, Hu S. 2003. Root-parasitic nematodes enhance soil microbial activities and nitrogen mineralization[J]. Microbial Ecology, 46(1): 134-144. DOI:10.1007/s00248-002-1068-2 |
Van der Stoel C D, Duyts H, Van der Putten W H. 2006. Population dynamics of a host-specific root-feeding cyst nematode and resource quantity in the root zone of a clonal grass[J]. Oikos, 112(3): 651-659. DOI:10.1111/oik.2006.112.issue-3 |
Verschoor B C, de Goede R G M, de Hoop J W, et al. 2001. Seasonal dynamics and vertical distribution of plant-feeding nematode communities in grasslands[J]. Pedobiologia, 45(3): 213-233. DOI:10.1078/0031-4056-00081 |
Verschoor B C. 2002. Carbon and nitrogen budgets of plant-feeding nematodes in grasslands of different productivity[J]. Applied Soil Ecology, 20: 15-25. DOI:10.1016/S0929-1393(02)00010-0 |
Wang Z Q, Guo D L, Wang X R, et al. 2006. Fine root architecture, morphology and biomass of different branch orders of two Chinese temperate tree species[J]. Plant and Soil, 288(1/2): 155-171. |
Yeates G W, Bird A. 1979. Soil nematodes in terrestrial ecosystems[J]. Journal of Nematology, 11(3): 213-229. |
Yeates G W, bongers T, De Goeds R G M, et al. 1993. Feeding habits in soil nematode families and genera—An outline for soil ecologists[J]. Journal of Nematology, 25(3): 315-331. |
Yeates G W, Bongers T. 1999. Nematode diversity in agroecosystems[J]. Agriculture, Ecosystems and Environment, 74(1-3): 113-135. DOI:10.1016/S0167-8809(99)00033-X |
Yeates G W. 1996. Diversity of nematode faunae under three vegetation types on a pallic soil in Otago, New Zealand[J]. New Zealand Journal of Zoology, 23(4): 401-407. DOI:10.1080/03014223.1996.9518099 |
Yeates G W. 2007. Abundance, diversity and resilience of nematode assemblages in forest soils[J]. Canadian Journal of Forest Research, 37(2): 216-225. DOI:10.1139/x06-172 |
 2011, Vol. 47
2011, Vol. 47