文章信息
- 姜福星, 刘凤栾, 赵梁军
- Jiang Fuxing, Liu Fengluan, Zhao Liangjun
- 狗蔷薇RaWUS基因的超量表达诱导转基因烟草根尖形成不定芽
- Overexpression of RaWUS Gene of Rosa canina Inducing Shoot Regeneration from Root Tip of Transgenic Tobacco
- 林业科学, 2011, 47(12): 43-52.
- Scientia Silvae Sinicae, 2011, 47(12): 43-52.
-
文章历史
- 收稿日期:2011-06-27
- 修回日期:2011-09-28
-
作者相关文章
2. 四川农业大学(成都校区)风景园林学院 成都 611130
2. College of Landscape Architecture, Sichuan Agricultural University Chengdu 611130
狗蔷薇(Rosa canina)是蔷薇科(Rosaceae)蔷薇属(Rosa)的一种落叶灌木,其花朵美丽,具有较高的观赏价值,在园林中应用广泛(杨倩等, 2003), 而且可作为培育树形月季(Rosa chinensis)的优良砧木和研究蔷薇属植物系统发育、进行种质资源创新的重要材料(梁艳华等,2002;Lim et al., 2005);同时在食品、医药、化工等领域也有较高的研究开发价值(Khodzhaeva et al., 1998; Gürses et al., 2006; Orhan et al., 2009)。但是狗蔷薇存在着利用常规方法繁殖困难、再生效率低等问题,而且不同程度地遭受黑斑病、蚜虫等病虫害侵扰,因此亟需采用基因工程技术对其进行遗传改良。建立高效再生和遗传转化体系是对其进行研究、开发和利用的基础和前提条件(杨倩等, 2003)。
植物体细胞胚多为单细胞起源,具两极性、高度敏感性、高效再生性等特点,是最理想的遗传转化受体;并可作为良种快繁、种质资源保存、原生质体培养、细胞工程育种、人工种子以及植物发育生物学研究的良好材料(王关林等, 2004)。作者所在研究室的Tian等(2008)在狗蔷薇上建立了具有体细胞胚胎性质的类原球茎(protocorm-like body, PLB)高效再生系统,其过程为:叶片外植体—毛状不定根—类原球茎—再生植株;并且研究证明,狗蔷薇的类原球茎是胚胎发生与器官发育的整合体(体细胞胚胎被茎尖分生组织所包裹),具有与兰花(Cymbidium)的类原球茎相似的性质和功能,在科学研究和实际生产中具有广泛的应用(Tian et al., 2008; 姜福星等, 2010)。因此对狗蔷薇类原球茎进行研究,特别是阐明其形成的分子机制具有重要的价值和意义。
植物干细胞是器官形成的源泉(Scheres, 2007),而WUSCHEL(WUS)基因编码一种新亚型的同源异型盒转录因子,被认为是植物干细胞命运的决定基因,是茎尖分生组织中可塑性干细胞的主要调控者(徐云远等, 2005; 王占军等, 2011; Mayer et al., 1998; Schoof et al., 2000; Kieffer et al., 2006; Yadav et al., 2010);WUS基因的表达是茎尖分生组织、胚胎和器官建立和形成的先决条件,与干细胞的形成和器官的发生密切相关(Zhao et al., 2008; Chen et al., 2009; Su et al., 2009; Mantegazza et al., 2009; Ikeda et al., 2009; Cheng et al., 2010)。但是WUS基因的持续表达会使转基因植株出现不理想的性状,如表型异常、生长缓慢, 甚至死亡等(Li et al., 2004)。Zuo等(2000)建立了可有效调控目的基因表达的LexA-VP16-ER(XVE)嵌合型的化学调控系统的质粒PER8(10),其由细菌的抑制子LexA(X)的DNA结合区域的编码区、VP16(V)的转录激活区域和人类雌二醇受体羧基端编码区(estradiol receptor, ER)所融合而成。该系统仅受化学诱导剂(β-雌二醇, β-estradiol)严格而特定的诱导和调控,对植物无毒害和生理影响, 并且在加入雌二醇后,其目的启动子的活性可达到普通35S启动子活性的4~8倍,是比较理想的操纵基因表达和研究基因功能的化学调控系统(Zuo et al., 2000)。
应用XVE化学调控系统的质粒PER8(10),Zuo等(2002)在拟南芥(Arabidopsis thaliana)中研究证明,WUS基因的过量表达可诱导拟南芥的根尖形成体细胞胚胎并发育成苗;Rashid等(2009)的研究认为烟草(Nicotiana tabacum)的WUS基因同源表达可在离体条件下诱导烟草的根尖形成不定芽并形成植株。并且研究证明,WUS基因的功能及其参与的干细胞调控网络在被子植物中是比较保守的,利用该系统操纵拟南芥的WUS基因在其他植物中异源表达也表现出明显的功能,能诱导体细胞胚胎和不定芽等器官的异位发生:Rashid等(2007)从转拟南芥WUS基因的烟草的根尖诱导出不定芽进而形成可育的种苗和植株,认为仅仅通过操纵单一的WUS基因表达就能使植物以根芽的方式实现有效再生,为解决顽拗型植物的高效再生问题提供了新的途径;Arroyo-Herrera等(2008)利用该系统在转基因可可(Coffea canephora)中建立体细胞胚胎的重复发生和生产体系,并从可可的子叶中诱导产生异源分生组织;Soliset等(2009)利用该系统对再生困难的辣椒(Capsicum chinensis)进行遗传转化后,从转基因辣椒的茎段上诱导产生球形胚。采用其他研究系统也得出了相似的结论:Gallois等(2004)在拟南芥中采用Cre -lox P为基础的物理热激表达系统的研究证明:WUS基因的存在让根尖细胞启动多潜能性,这些多潜能性细胞根据周围环境的差异向着不同的方向分化而形成茎尖、叶片、体细胞胚胎和花芽等不同的器官;Ikeda等(2009)采用定点突变技术在拟南芥中进一步研究证明,WUS基因是一个植物中既能抑制干细胞的分化又能促进花芽分生组织形成的非常少见的双功能的转录因子,其过量表达可诱导拟南芥的根尖形成茎尖分生组织和(或)体细胞胚胎。
上述研究结果表明,WUS基因是启动体细胞胚胎和器官的发生、提高植物再生能力的有价值的目的基因,可用于对顽拗型植物进行遗传改良解决其再生困难的问题,也是调控植物生长发育的重要功能基因,参与了多种植物器官的形成和发育过程(Zuo et al., 2000; Gallois et al., 2004; Arroyo-Herrera et al., 2008; Rashid et al., 2009; Solis et al., 2009; Ikeda et al., 2009)。研究木本植物WUS基因,有助于探讨林木生长发育和木材形成过程的分子机制,进而提高林木的产量和品质(杨晓慧等, 2009; 王占军等, 2011),甚至能够延长其寿命并且最大限度发挥其作用和效益(Scheres, 2007)。
从狗蔷薇的不定根尖上形成类原球茎的现象,与从拟南芥和烟草等植物的根上形成体细胞胚胎和不定芽很相似,根据前人的研究结果,推测可能是WUS在狗蔷薇中同源基因的超量表达促使根尖形成了类原球茎。为了获得有价值的目的基因并探讨狗蔷薇类原球茎形成的分子机制,本研究从狗蔷薇的类原球茎中分离WUS的同源基因并对其进行功能分析。
1 材料与方法 1.1 植物材料、菌株、表达载体和试剂所用的植物材料狗蔷薇和红花烟草(Nicotiana tabacum)的组培苗、所用的根瘤农杆菌(Agrobacterium tumefaciens)菌株LBA4402均为中国农业大学植物发育分子生物学实验室培养和保存,植物表达载体PER8购买于美国Rockefeller大学Chua Nam-Hai教授,Taq DNA聚合酶、反转录酶、高保真酶Primer Star、限制性内切酶为TaKaRa产品;琼脂糖凝胶回收试剂盒、质粒提取试剂盒、壮观霉素(spectinomycin, Spe)、羧苄青霉素(carbencillin, Carb)、潮霉素(hygromycin, Hyg)、链霉素(streptomycin, SM)等试剂购自北京中科瑞泰生物公司;DNA Marker、RNA提取试剂(RNAPLANT)购自天根生化科技(北京)有限公司;pEASY -T1载体和Trans 1-T1感受态细胞购自北京全式金生物技术公司, 引物合成和测序均由上海生物工程技术公司完成。
1.2 方法 1.2.1 类原球茎的培养参照Tian等(2008)的方法,选取狗蔷薇组培苗茎段的中上部叶片为试验材料进行毛状不定根和类原球茎的诱导。
1.2.2 RNA的提取及反转录反应在狗蔷薇的类原球茎刚刚形成的时候(不定根的根尖刚刚开始变绿),将其切下来,采用RNAplant试剂盒提取总RNA,并进行电泳检测,然后以其为模板,用AP作为反转录引物(表 1),在反转录酶M-MLV的作用下合成cDNA第1链,制备类原球茎cDNA为模板。
|
|
与已报导的矮牵牛(Petunia hybrida)(AF481951)、金鱼草(Antirrhinum majus)(AY162209)、甜橙(Citrus sinensis)(EU032533)、番茄(Lycopersicon esculentum) (AJ538329) 等物种的WUS同源基因进行序列比对,在较为保守的区域设计2条简并引物WUS265F和WUS630R(表 1),然后以类原球茎cDNA为模板,进行PCR扩增。采用25 μL反应体系:10 ×buffer 2.5 μL, cDNA 1.0 μL, 2.5 mmol ·L-1 dNTP 2.0 μL, 10 mmol ·L-1的上下游引物各1.0 μL,Taq酶0.2 μL,ddH2O 17.3 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。PCR产物以1%琼脂糖凝胶电泳检测和分离,用DNA纯化试剂盒纯化后连接到pEASY -T1载体中,转化Trans 1-T1化学感受态细胞。挑取单菌落放大培养,提取质粒做酶切鉴定,挑选阳性克隆送上海生工进行序列测定后,在NCBI上进行序列比对,确认为目的基因中间片段序列。参照英俊公司的3’RACE说明书,根据已经获得的中间序列,设计2条基因特异的正向引物3 WUSF1和3 WUSF2与AUAP(表 1)引物进行巢式扩增,对其3’端进行扩增,反应体系和方法基本同上,只是退火温度改为60 ℃。然后再设计2条基因特异的反向引物5 WUSR1和5 WUSR2(表 1), 采用Takara公司的5’RACE试剂盒(北京六合通公司),进行5’扩增。将获得的中间片段、3’RACE和5’RACE进行序列拼接后,采用NCBI数据库和DNAMAN软件确定该基因的开放阅读框架(open reading frame, ORF)并分别在开放阅读框架前后设计2条引物RaWUSF和RaWUSR(表 1),用高保真酶PrimerStar进行扩增。反应体系和程序基本同上,只是退火温度为58 ℃,时间为15 s, 循环数为30个。将PCR产物电泳凝胶回收后,进行加“A”尾巴处理,然后再连接到pEASY-T1载体中,转化Trans1-T1化学感受态细胞中挑选阳性克隆进行测序,经过对多个单克隆进行校正比对,挑选出原始克隆并进行扩繁和提取质粒,获得含有目的基因ORF编码区的标准质粒。
1.2.4 RaWUS基因的序列比对及系统发育分析采用NCBI数据库、DNAMAN和CLUSTALW软件对目的基因的核苷酸及其编码的蛋白质进行序列分析,用MEGA4.0软件进行亲缘关系和系统发育树的构建。
1.2.5 RaWUS基因在狗蔷薇不同器官中的表达分析参照1.2.2的方法分别提取狗蔷薇茎尖、茎段、花、叶片、类原球茎、根不同部位的RNA并且反转录成为cDNA模板,设计2条基因特异的引物RaWUS1和RaWUS2(表 1),并以甘油醛-3-磷酸脱氢酶GAPDH基因(内参)的序列分别设计2条引物GAPDHF和GAPDHR为内参对照(表 1),对上述器官cDNA模板进行扩增,分析RaWUS基因在狗蔷薇中的表达情况。
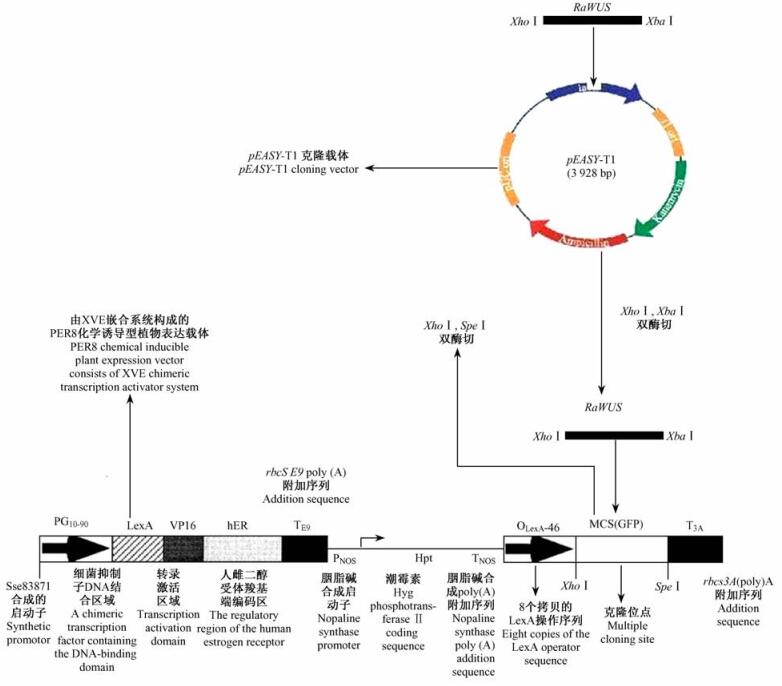
1.2.6 RaWUS基因的PER8诱导型表达载体的构建Xho Ⅰ和Spe Ⅰ是质粒PER8常用的酶切位点,但是采用Primer5.0对RaWUS基因进行序列分析发现,该基因内部有Spe Ⅰ的酶切位点,所以不能用Spe Ⅰ对该基因进行酶切和构建表达载体。根据Spe Ⅰ和Xba Ⅰ是同尾酶的原理,用带有Xho Ⅰ和Xba Ⅰ酶切位点的基因特异的引物XhWUS F和XbWUS R(表 1)扩增RaWUS基因的标准质粒,将PCR产物连接到pEASY -T1载体中,转化Trans 1-T1化学感受态细胞,然后涂平板培养,筛选阳性克隆,提取质粒DNA,采用双酶切(Xho Ⅰ和Xba Ⅰ)和PCR扩增鉴定筛选,对筛选出的已插入目标基因的pEASY-T1载体的阳性单克隆进行扩繁并提取质粒。再用Xho Ⅰ和Xba Ⅰ将目标基因片段RaWUS从pEASY -T1载体中切下来,电泳回收后用T4DNA连接酶连接至已经过Xho Ⅰ和Spe Ⅰ双酶切质粒PER8上,转化Trans 1-T1化学感受态细胞;然后涂平板培养,筛选阳性克隆,提取质粒DNA,采用Xho Ⅰ和Bam HⅠ双酶切和PCR扩增鉴定。最后把已经过鉴定的质粒送上海生工用PER8测序引物(PER8-S)(表 1)和构建表达载体的基因特异的引物XhWUS F和XbWUS R(表 1)分别进行序列测定,以确认表达载体是否构建成功。
1.2.7 RaWUS基因对烟草的遗传转化将已经构建好的质粒采用冻融法导入根瘤农杆菌LBA4404中,在含有壮观霉素(Spe) 100 μg ·mL-1和链霉素(SM)100 μg ·mL-1的YEB培养基上涂板,挑选单克隆并摇菌。参照Rashid等(2007)的方法,对烟草进行叶盘法转化和含有羧苄青霉素(Carb) 200 mg ·L-1的MS培养基上脱菌处理后,再将转基因烟草放在含有潮霉素(Hyg)50 mg ·L-1的MS培养基上进行筛选,筛选出抗性不定芽后,采用前述的方法提取其中的RNA,并反转录为cDNA,用基因特异的引物RaWUS1和RaWUS2(表 1)进行检测,反应条件为:94 ℃ 5 min, 94 ℃30 s, 51 ℃ 30 s, 72 ℃45 s, 32个循环, 72 ℃延伸10 min。将经过检测的阳性芽转移到烟草的生根培养基上进行不定根的诱导,然后将不定根和茎段均转接到含有1 μmol ·L-1雌二醇和1.5 mg ·L-1 6-BA的培养基上分析基因的表达对不定根和叶片的影响。
1.2.8 转基因烟草的表型分析及显微观察选择变绿的不定根用松下DMC-ZS7数码相机进行拍照。进一步分析根系解剖结构的变化:将未变绿及已变绿的不定根直接用恒温箱式冰冻切片机制成冷冻切片,然后显微照相分析,再制作成石蜡切片进行显微观察。具体方法如下:将其浸泡在用70%乙醇配制的卡诺氏固定液[无水乙醇:冰醋酸=3 :1 (V/V)],室温下固定24~48 h, 先用70%乙醇冲洗2次,再以70%,80%,90%,100%酒精梯度脱水,石蜡包埋,切片厚约12 μm,采用番红-固绿双重染色法,中性树胶封片,用日本Olympus光学显微镜观察照相。
2 结果与分析 2.1 类原球茎的诱导、RNA的提取及反转录反应将从叶片的愈伤组织上形成的毛状不定根转移到含有TDZ的1/2MS (无机盐减半)培养基上放在光照处培养,1个月后,根尖变绿,这标志着类原球茎已开始发生;这时将类原球茎从不定根上切下来,进行RNA提取并电泳检测后,反转录成为cDNA模板,用于下一步试验。
2.2 RaWUS基因全长cDNA的克隆用简并引物对类原球茎的cDNA模板扩增后获得约300 bp中间片段后,在NCBI和DNAMAN软件上进行序列比对,发现其与同源基因较相似,为目的基因的片段;然后再分别在正、反向设计2条基因特异的引物,进行3’RACE和5’RACE的巢式扩增得到了约600 bp 3’端和750 bp 5’端。进行序列拼接后得到了全长为1 507 bp基因, 用DNAMAN软件和在NCBI数据库上进行开放阅读框架分析,发现其编码区为876 bp,编译292个氨基酸,并包括425 bp的5’端非翻译区和206 bp的3’端非翻译区。
2.3 RaWUS基因的序列比对及系统发育分析用DNAMAN和CLUSTALW软件对目的基因和其他物种的同源基因进行序列比对,发现其包括高度保守同源盒(homeobox)区域、酸性结构域、WUS盒(TLPLFPMH区域)和EAR-like位点(ASLELXLN结构)等典型的WUS基因的保守区域(Mayer et al., 1998; Tan et al., 2000; Ohta et al., 2001; Kieffer et al., 2006; Mantegazza et al., 2009; Ikeda et al., 2009),这表明已经克隆得到了WUS基因在狗蔷薇中的同源序列,将其命名为RaWUS基因(图 1和图 2),提交GeneBank进行基因登录,登录号为JN981165。除此之外,本研究还发现WUS同源基因在MEKSFRDCSIS及其附近的区域也较相似和保守,这是否可以看作WUS基因的一个新保守区域,有待于进一步研究确定(图 1)。

|
图 1 RaWUS基因与其他物种WUS基因的同源序列比对 Figure 1 Homology comparison of amino acid sequence aligment of RaWUS and other plants |
系统发育与亲缘关系分析表明,RaWUS基因与苜蓿(Medicago truncatula)、矮牵牛的同源基因亲缘关系最近,其次为金鱼草和扭果花(Streptocarpus rexii),与拟南芥、银杏(Ginkgo biloba)的同源基因亲缘关系最远(图 2)。

|
图 2 RaWUS基因的系统发育树 Figure 2 Phylogenetic tree of RaWUS |
RaWUS基因在狗蔷薇的茎尖、茎干、类原球茎、花和叶片中均有表达,说明其广泛参与了上述器官的形成和发育过程,并且在上述器官发育过程中可能起着重要作用;而在根系中没有表达(图 3)。

|
图 3 RaWUS基因在狗蔷薇不同部位中的表达模式 Figure 3 Expression pattern of RaWUS in various tissues of R. canina 1.茎尖Shoot apical meristem; 2.茎段Stem; 3.类原球茎Protocorm-like body; 4.叶片Leaf; 5.花Flower; 6.根Root. |
将带有Xho Ⅰ和Xba Ⅰ酶切位点的RaWUS基因的PCR产物连接到pEASY -T1载体中, 筛选出阳性单克隆并扩繁提取质粒后,再采用限制性内切酶Xho Ⅰ和Xba Ⅰ从已经插入的pEASY -T1载体的质粒中切下含有该酶切位点的目标基因片段,电泳回收后,用T4DNA连接酶连接至已进行Xho Ⅰ和Spe Ⅰ双酶切的质粒PER8(图 4),然后涂到含有壮观霉素100 μg ·mL-1的筛选培养平板上;再挑选阳性单菌落摇菌,经PCR鉴定出阳性克隆后,提取质粒再用XhoⅠ和BamHⅠ酶切,切下大约560 bp目的条带(同尾酶连接后,不可能再从连接处切开,只能在基因内部选择可用的BamHⅠ酶)(图 5);最后把已经过酶切鉴定的质粒送上海生工分别用带有酶切位点的目的基因特异的引物(XhWUS F和XbWUS R)和PER8载体测序引物(PER8-Sequence)进行序列测定和分析,获得了目的基因的序列和部分载体序列(数据未列出)。以上结果均说明,植物表达载体已经构建成功,命名为RaWUS -PER8。
|
图 4 RaWUS -PER8诱导型表达载体的构建 Figure 4 Construction of RaWUS -PER8 inducible expression vector |

|
图 5 RaWUS -PER8诱导型表达载体的酶切检测 Figure 5 Detection of RaWUS -PER8 by enzyme digestion |
转基因烟草分子检测的RT-PCR结果显示,均扩增出了清晰的大小一致的目的条带,而对照则无条带,表明RaWUS基因已经转入烟草中(图 6)。

|
图 6 转基因烟草的分子检测分析 Figure 6 Detection of transgenic tobacco by RT-PCR 1.对照Wild type; 2-6:烟草的转基因株系 Lines of transgenic tobacco. |
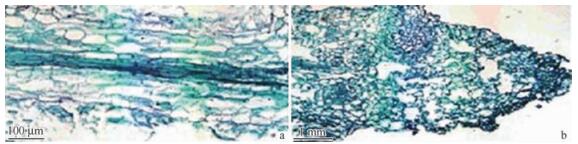
转基因烟草的不定根和茎段均转接到含有1 μmol ·L-1雌二醇和1.5 mg ·L-16-BA的培养基上20天后,可以明显地看到,转基因烟草的不定根根尖甚至整个根系都逐渐变绿膨大进而形成不定芽,而对照(野生型和转基因烟草未加诱导剂)则无明显变化(图 7; 图 8),这说明是化学诱导剂(β-雌二醇, β-estradiol)调控RaWUS基因表达产生的结果。与根尖变绿相对应的是,内部的解剖结构也发生了明显的变化。石蜡切片和冰冻切片的显微观察结果均表明:已经变绿的根尖的皮层中有圆球形或椭圆形分生组织细胞团的产生,这些细胞具有体积小、排列紧密、颜色较深(细胞核大而细胞质浓密)等特点,具有明显的分生组织细胞的特点,与其周围排列疏松、细胞间隙明显、体积较大、颜色较浅的薄壁细胞形成明显的对比(图 9; 图 10)。

|
图 7 从转基因烟草的不定根上诱导出不定芽直至发育成为完整的植株 Figure 7 Adventitious shoot induced from root of transgenic tobacco regenerating and developing into fertile plants a:未加入诱导剂;b:将转基因烟草转移到含有诱导剂的培养基上后根尖开始变绿;c:根尖上的绿点发育并膨大; d:根上形成不定芽; e:转接到无诱导剂的生根培养基上; f:形成种苗。 a: Transgenic tobacco on non-inductive medium; b:The root tip region began to green by transferring transgenic tobacco from non-inductive onto an inductive medium; c: The green point developed and became swollen; d: Adventitious shoot from root; e: Shoot was transferred to rooting medium without induction; f: Plants grown on the soil in glass pots. |
狗蔷薇的毛状不定根根尖形成类原球茎与根上形成不定芽(根芽)和根上形成胚胎等现象很相似,根芽现象不论在自然条件下还是组培条件下都可以普遍发生,根上形成体细胞胚胎和类原球茎则只能在组培条件下诱导产生;根上形成不定芽、体细胞胚胎和类原球茎,不但是植物进行繁殖和再生的有效方式,也是非常有趣的现象和进行植物发育生物学研究的理想材料(陈惠, 2001; 郑湘如等,2007; 李燕等,2008; Salm et al., 1996;Fambrini et al., 2003; Rashid et al., 2007; Kim et al., 2009)。
从根尖上形成不定芽和胚胎的现象,在蔷薇属植物中也有过报道:Salm等(1996)研究了从杂种月季(Rosa hybrida)品种‘Moneyway’的不定根上形成体细胞和不定芽进而形成完整的小植株的再生过程,但是时间和周期较长;Kim等(2009)则发现,杂种月季的另一个品种‘Charming’可从根系产生的胚性愈伤组织上以体细胞胚胎发生与器官发育相结合的方式进行高效再生,并且将根上产生的胚性愈伤组织进行扩繁和继代培养后,其芽的再生能力可以保持相当长的时间,认为这是对商品月季品种进行遗传改良的有效再生体系。上述研究说明,从根尖上诱导出不定芽或体细胞胚胎甚至类原球茎可作为蔷薇属植物高效再生和遗传转化的有效方式。Rashid等(2007)就认为拟南芥WUS基因在提高植物再生能力上具有潜在的应用价值,可通过对顽拗型植物转入该基因的方法,从植物的根部诱导产生不定芽进而实现高效再生。本文研究表明,RaWUS基因可能对于提高包括蔷薇属植物在内的植物再生能力具有潜在的应用价值。
Gallois等(2004)通过拟南芥研究认为,在生长素的作用下,WUS基因诱导根尖产生胚胎;Gordon等(2007)则认为在细胞分裂素的作用下,WUS基因诱导根尖产生不定芽。TDZ被认为是一种不但具有细胞分裂素和生长素双重性质,而且可以对植物产生逆境、赤霉素、乙烯等多种生物学效应的高效的植物生长调节剂(徐晓峰等, 2003)。是否可以认为TDZ对狗蔷薇的毛状不定根产生了生长素和细胞分裂素的双重作用,诱导RaWUS基因的表达使狗蔷薇的根尖上同时形成了体细胞胚胎和不定芽,而不定芽将体胚包裹起来从而形成了类原球茎?当RaWUS基因转入蔷薇属植物后,诱导其表达会从其不定根上产生不定芽、体细胞胚胎还是类原球茎,分别需要什么样的外界条件,有待于进一步研究证明。笔者也曾用生长素和TDZ调控RaWUS基因表达对转基因烟草的不定根进行诱导,发现与细胞分裂素的作用基本一致,仅有不定芽的生成(图 7;图 8)。这可能也与不同植物的遗传特性、生理生化和解剖结构等方面的差异有关。

|
图 8 离体根上形成不定芽或叶片的过程 Figure 8 Formation of adventitious shoot, leaf or bulbous tissue from root |
|
图 9 烟草不定根解剖结构的显微观察(RaWUS基因的表达前后) Figure 9 Microobservation on anatomy of root in transgenic tobacco by paraffin a.对照薄壁细胞;b.表明皮层中有分生组织细胞团产生。 a. Parenchymatous cells as CK; b. Suggesting meristematic stem cell mass induced in cortex of root in transgenic tobacco. |

|
图 10 转基因烟草根的冰冻切片显微观察(RaWUS基因的表达前后) Figure 10 Microobservation on root in transgenic tobacco by frozen section a.对照,根系皮层中均为薄壁细胞;b-d. RaWUS基因表达后,转基因烟草的根系皮层中有分生组织干细胞团的产生。 a. Parenchymatous cells as CK; b-d. Meristematic stem cell mass induced in cortex of root in transgenic tobacco. |
笔者也构建了RaWUS基因的35S组成型表达载体对烟草进行遗传转化,但未发现转基因烟草上出现根尖长芽的现象(尚未发表),这可能是因为从根尖上形成不定芽或体细胞胚胎,薄壁细胞转变成为分生组织干细胞或胚性干细胞,是细胞的性质和状态的根本性改变,涉及到剧烈、复杂的物质和能量的变化;35S组成型表达不能满足这样的要求,而XVE系统加入雌二醇后,其目的启动子的活性可达到普通35S启动子活性的4~8倍(Zuo et al., 2000),产生的“爆发力”满足了实现这一转变对物质和能量的需求;在移除化学诱导剂后,植物又恢复了正常生长(图 7 e, f)。所以XVE化学调控系统不但是通过操纵关键基因的表达对体细胞胚胎发生和器官发育进行人工调控进而实现从体细胞胚胎诱导到形成种苗的一系列生产过程的严格而有效的化学调控系统,而且是深入研究目的基因的功能的有效工具。
本研究证明RaWUS基因在XVE系统下具有能够促使薄壁细胞转变为分生组织干细胞及调节干细胞活性的功能。这与Rashid等(2007)得到的拟南芥WUS基因促使转基因烟草根尖形成根芽,及Yadav等(2010)在拟南芥中研究认为WUS基因通过调节干细胞的数量、细胞分裂的模式和干细胞前体的分化来控制干细胞的动态平衡的结论很相似,证明RaWUS基因与其在拟南芥中的同源基因具有相似的功能。但是同源基因的功能也存在差异,如本研究则发现RaWUS基因直接作用于皮层中的薄壁细胞使其转变成为球形的分生组织干细胞团(图 9;图 10),这与Rashid等(2007)得到的拟南芥WUS基因激活转基因烟草根的中柱鞘薄壁细胞的研究结果有显著不同;中柱鞘薄壁细胞被认为是延展的分生组织,一般来说比皮层中的薄壁细胞更活跃(郑湘如等, 2007; Atta et al., 2009)。这说明RaWUS基因与拟南芥的WUS基因的不同点在于其激活了转基因烟草根系中的皮层的薄壁细胞而不是中柱鞘薄壁细胞。那么是否可以认为蔷薇、杨树等木本植物因为高度杂合、世代周期较长、进行次生生长等原因,比草本植物的同源基因功能更为强大(杨晓慧等, 2009),有待于进一步研究。
虽然WUS基因的功能及其参与的干细胞调控途径在被子植物中是比较保守的,但是在进化过程中也会产生明显的差异(Nardmann et al., 2006; 2009);木本植物因为其生长发育的特殊性和长期进化的作用,所以林木的WUS基因可能与其在拟南芥等草本植物中的同源基因存在一定的差异(杨晓慧等, 2009; Nardmann et al., 2009; 王占军等, 2011)。但是迄今为止,分离出的木本植物WUS基因还很少,对其功能的研究鲜见报道,仅见Tan等(2000)分离甜橙CsWUS基因并构建组成型的表达载体导入相应的拟南芥突变体(wus-1)后能恢复拟南芥突变体茎尖分生组织的大部分功能,及Nardmann等(2009)发现银杏的GgWUS基因能促进拟南芥茎尖干细胞的发育和花器官数量增多。本文仅仅对狗蔷薇的RaWUS基因进行了初步功能分析,发现其具有调控干细胞活性的功能,RaWUS基因在狗蔷薇其他器官形成和发育中的作用及其他木本植物中WUS同源基因的功能还有待于深入研究。
陈惠. 2001. 栝楼不定根尖分化不定芽过程中的细胞组织学研究[J]. 云南植物研究, 23(4): 488-492. |
姜福星, 田传卫, 张建甫, 等. 2010. 狗蔷薇类原球茎发育过程的显微观察[J]. 植物生理学通讯, 46(6): 589-596. |
李燕, 张惠英, 王欣欣, 等. 2008. 秦艽发根系体细胞胚的诱导和植株再生[J]. 兰州大学学报:自然科学版, 44(4): 81-85. |
梁艳华, 彭春生. 2002. 树状月季砧木的选择[J]. 北方园艺, (4): 38-39. |
王关林, 方宏筠. 2004. 植物基因工程[M]. 2版.北京: 科学出版社: 344-355.
|
王占军, 陈金慧, 施季森. 2011. 植物干细胞中WUS / CLV反馈调控机制的研究进展[J]. 林业科学, 47(4): 159-164. DOI:10.11707/j.1001-7488.20110425 |
徐晓峰, 黄学林. 2003. TDZ:一种有效的植物生长调节剂[J]. 植物学通报, 20(2): 227-237. |
徐云远, 种康. 2005. 植物干细胞决定基因WUS的研究进展[J]. 植物生理与分子生物学学报, 31(5): 461-468. |
杨倩, 彭春生. 2003. 树月季砧木的驯化和快速繁殖[J]. 北京林业大学学报, 25(2): 85-93. |
杨晓慧, 张有慧, 张志毅, 等. 2009. 毛白杨干细胞决定基因WUSCHEL的克隆及其单核苷酸多态性分析[J]. 林业科学, 45(1): 43-49. DOI:10.11707/j.1001-7488.20090108 |
郑湘如, 王丽. 2007. 植物学[M]. 2版.北京: 中国农业大学出版社: 97.
|
Atta R, Laurens L, Boucheron-Dubuisson E, et al. 2009. Pluripotency of Arabidopsis xylem pericycle underlies shoot regeneration from root and hypocotyl explants grown in vitro[J]. Plant J, 57(4): 626-644. DOI:10.1111/tpj.2009.57.issue-4 |
Arroyo-Herrera A, Gonzalez A K, Moo R C, et al. 2008. Expression of WUSCHEL in Coffea canephora causes ectopic morphogenesis and increase somatic embryogenesis[J]. Plant Cell Tiss Organ Cult, 94(2): 171-180. DOI:10.1007/s11240-008-9401-1 |
Cheng Z J, Zhu S S, Gao X Q, et al. 2010. Cytokinin and auxin regulates WUS induction and inflorescence regeneration in vitro in Arabidopsis[J]. Plant Cell Rep, 29(8): 927-933. DOI:10.1007/s00299-010-0879-8 |
Chen S K, Kurdyukov S, Kereszt A, et al. 2009. The association of homeobox gene expression with stem cell formation and morphogenesis in cultured Medicago truncatula[J]. Planta, 230(4): 827-840. DOI:10.1007/s00425-009-0988-1 |
Fambrini M, Cionini G, Conti A, et al. 2003. Origin and development in vitro of shoot buds and somatic embryos from intact roots of Helianthus annuus × H[J]. tuberosus. Annals of Botanny, 92(1): 145-151. DOI:10.1093/aob/mcg116 |
Gallois J L, Nora F R, Mizukami Y, et al. 2004. WUSCHEL induces shoot stem cell activity and developmental plasticity in the root meristem[J]. Genes Dev, 18(4): 375-380. DOI:10.1101/gad.291204 |
Gürses A, Dogar C, Karaca S, et al. 2006. Production of granular activated carbon from waste Rosa canina sp. seeds and its adsorption characteristics for dye[J]. Journal of Hazardous Materials B, 131(1-3): 254-259. |
Gordon S P, Heisler M G, Reddy G V, et al. 2007. Pattern formation during de novo assembly of the Arabidopsis shoot meristem[J]. Development, 134(19): 3539-3548. DOI:10.1242/dev.010298 |
Ikeda M, Mitsuda N, Ohme-Takagi M. 2009. Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patterning[J]. Plant Cell, 21(11): 3493-3505. DOI:10.1105/tpc.109.069997 |
Kieffer M, Stern Y, Cook H, et al. 2006. Analysis of the transcription factor WUSCHEL and its functional homologue in Antirrhinum reveals a potential mechanism for their roles in meristem maintenance[J]. Plant Cell, 18(3): 560-573. DOI:10.1105/tpc.105.039107 |
Kim S W, Oh M J, Liu J R. 2009. Plant regeneration from the root-derived embryonic tissues of Rosa hybrida L. cv. Charming via a combined pathway of somatic embryogenesis and organogenesis[J]. Plant Biotechnol Rep, 3(4): 341-345. |
Khodzhaeva M A, Sagdullaev B T, Turakhozhaev M T, et al. 1998. Carbohydrates of the fruit of Rosa canina[J]. Chemistry of Natural Compounds, 34(6): 736-737. DOI:10.1007/BF02336105 |
Li Junhua, Xu Yunyuan, Chong Kang, et al. 2004. Analysis of transgenic tobacco with overexpression of Arabidopsis WUSCHEL gene[J]. Acta Botanica Sinica, 46(2): 224-229. |
Lim K, Werlemark G, Matyasek R, et al. 2005. Evolutionary implications of permanent odd polyploidy in the stable sexual pentaploid of Rosa canina L[J]. Heredity, 94(5): 501-506. DOI:10.1038/sj.hdy.6800648 |
Mantegazza R, Tononi P, Möller M, et al. 2009. WUS and STM homologs are linked to the expression of lateral dominance in the acaulescent Streptocarpus rexii (Gesneriaceae)[J]. Planta, 230(3): 529-542. DOI:10.1007/s00425-009-0965-8 |
Mayer K F, Schoof H, Haecker A, et al. 1998. Role of WUSCHEL regulating stem cell fate in the Arabidopsis shoot meristem[J]. Cell, 95(6): 805-815. DOI:10.1016/S0092-8674(00)81703-1 |
Nardmann J, Werr W. 2006. The shoot stem cell niche in angiosperms: Expression patterns of WUS orthologues in rice and maize imply major modifications in the course of mono-and dicot evolution[J]. Mol Biol Evol, 23(12): 2492-2504. DOI:10.1093/molbev/msl125 |
Nardmann J, Reisewitz P, Werr W. 2009. Discrete shoot and root stem cell-promoting WUS / WOX 5 functions are an evolutionary innovation of angiosperms[J]. Mol Biol Evol, 26(8): 1745-1755. DOI:10.1093/molbev/msp084 |
Orhan N, Aslan M, Hosbas S, et al. 2009. Antidiabetic effect and antioxidant potential of Rosa canina fruits[J]. Pharmacognosy Magazine, 5(20): 309-315. DOI:10.4103/0973-1296.58151 |
Ohta M, Matsui K, Hiratsu K, et al. 2001. Repression domains of class II ERF transcriptional repressors share an essential motif for active repression[J]. Plant Cell, 13(8): 1959-1968. DOI:10.1105/tpc.13.8.1959 |
Rashid S Z, Yamaji N, Kyo M. 2007. Shoot formation from root tip region: a developmental alteration by WUS in transgenic tobacco[J]. Plant Cell Rep, 26(9): 1449-1455. DOI:10.1007/s00299-007-0342-7 |
Rashid S Z, Kyo M. 2009. In vivo function assay of WUS ortholog in tobacco[J]. Acta Hortic, 829: 161-166. |
Salm T P M, Toorn C J G, Hänisch C H, et al. 1996. Somatic embryogenesis and shoot regeneration from excised adventitious roots of the rootstock Rosa hybrida L. 'Moneyway'[J]. Plant Cell Rep, 15(7): 522-526. DOI:10.1007/BF00232986 |
Scheres B. 2007. Stem-cell niches: nursery rhymes across kingdoms[J]. Nature Reviews Molecular Cell Biology, 8(5): 345-354. DOI:10.1038/nrm2164 |
Schoof H, Lenhard M, Haecker A, et al. 2000. The stem cell population of Arabidopsis shoot meristem in maintained by a regulatory loop between the CLAVATA and WUSCHEL gene[J]. Cell, 100(6): 635-644. DOI:10.1016/S0092-8674(00)80700-X |
Su Y H, Zhao X Y, Liu Y B, et al. 2009. Auxin-induced WUS expression is essential for embryonic stem cell renewal during somatic embryogenesis in Arabidopsis[J]. Plant J, 59(3): 448-460. DOI:10.1111/tpj.2009.59.issue-3 |
Solis L Y, Gonzalez-Estrada R T, Nahuath-Dzib S, et al. 2009. Overexpression of WUSCHEL in C. chinensis cause ectopic morphogenesis[J]. Plant Cell Tiss Organ Cult, 96(3): 279-287. DOI:10.1007/s11240-008-9485-7 |
Tan F C, Swain S M. 2000. Functional characterization of AP3, SOC1 and WUS homologues from citrus (Citrus sinensis)[J]. Physiologia Plantarum, 131(3): 481-495. |
Tian Chuanwei, Chen Ying, Zhao Xiaolan, et al. 2008. Plant regeneration through protocorm-like bodies induced from rhizoids using leaf explants of Rosa spp[J]. Plant Cell Rep, 27(5): 823-831. DOI:10.1007/s00299-007-0504-7 |
Yadav R K, Tavakkoli M, Reddy G V. 2010. WUSCHEL mediates stem cell homeostasis by regulating stem cell number and patterns of cell division and differentiation of stem cell[J]. Development, 137(21): 3581-3589. DOI:10.1242/dev.054973 |
Zhao X Y, Su Y H, Cheng Z J, et al. 2008. Cell fate switch during in vitro plant organogenesis[J]. Journal of Intergrative Plant Biology, 50(7): 814-822. |
Zuo J, Niu Q W, Chua N H. 2000. An estrogen receptor-based transactivator XVE medias highly inducible gene expression in transgenic plants[J]. Plant J, 24(2): 265-273. DOI:10.1046/j.1365-313x.2000.00868.x |
Zuo J, Niu Q W, Chua N H. 2002. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis[J]. Plant J, 30(3): 349-359. DOI:10.1046/j.1365-313X.2002.01289.x |
 2011, Vol. 47
2011, Vol. 47


