文章信息
- 杨海峰, 王敏杰, 赵树堂, 唐芳, 卢孟柱
- Yang Haifeng, Wang Minjie, Zhao Shutang, Tang Fang, Lu Mengzhu
- 利用拟南芥基因芯片和突变体对木材形成相关基因的初步分析
- Preliminary Analysis of Genes Involved in Wood Formation Using Arabidopsis thaliana Microarray and Mutants
- 林业科学, 2011, 47(12): 36-42.
- Scientia Silvae Sinicae, 2011, 47(12): 36-42.
-
文章历史
- 收稿日期:2011-03-28
- 修回日期:2011-07-05
-
作者相关文章
2. 内蒙古农业大学林学院 呼和浩特 010019
2. College of Forestry, Inner Mongolia Agricultural University Hohhot 010019
木材是由形成层活动产生大量次生维管系统而形成,该过程涉及一系列重要生物学过程,包括形成层发育、分化、次生壁形成、细胞程序性死亡(PCD)等一系列重要生物学事件,其中每个过程均由多基因参与且呈网络调控(Plomion et al., 2001)。近年来,基因组学方法已成为研究木材形成的重要方法。Whetten等(2001)结合EST技术和基因芯片分析技术获得了一组与火炬松(Pinus taeda)次生木质部发育相关的基因;一些学者分别分析了次生维管系统不同发育阶段的基因表达谱(Du et al., 2006; Prassinos et al., 2005; van Raemdonck et al., 2005; Wang et al., 2009);Schrader等(2004)更进一步获得了杨树形成层区域的组织特异性转录图谱。上述研究均发现大量在特定维管组织中表达的基因,为维管发育相关基因的进一步功能验证奠定了基础。
拟南芥(Arabidopsis thaliana)作为模式植物,植株小、生活周期短、全基因组序列已知,有丰富的突变体资源(Alonso et al., 2003; Yamada et al., 2003),为研究参与调控植物维管系统发育的基因功能提供了便利。通过拟南芥突变体分析发现KANADI基因家族的KAN1,KAN2,KAN3与HD-Zip III基因家族的PHB (PHABULOSA), PHV (PHAVOLUTA), REV (REVOLUTA)之间的相互调控影响维管组织的极性分化(Carlsbecker et al., 2005;Emery et al., 2003; Juarez et al., 2004; McConnell et al., 2001; McHale et al., 2004; Zhong et al., 2004), 以及hca (Pineau et al., 2005)等基因参与调控维管束的不对称发育,apl基因对于韧皮部的发育是必需的(Bonke et al., 2003)。上述研究表明,拟南芥在植物维管发育研究中具有重要地位。充分利用拟南芥模式植物所具备的研究资源,可简化研究体系,快速解析所获得的大量维管系统相关基因功能。
本研究利用已建立的毛白杨次生维管再生系统(Du et al., 2006),利用拟南芥全基因组芯片分析了该系统所模拟的次生维管系统发育过程中不同时期的基因表达谱。对表达水平显著变化的一批候选基因的拟南芥突变体进行次生诱导培养,获得了表型变化明显的突变体,为解析这些候选基因的功能奠定了基础。
1 材料与方法 1.1 试验材料所用的植物材料为4年生易县毛白杨(Populus tomentosa),取自河北任丘。挑选来自同一个无性系的生长良好、干形均匀的毛白杨20株。
拟南芥突变体种子,来自Nottingham Arabidopsis Stock Centre (NASC,拟南芥突变体资源中心)(Scholl et al., 2000);野生型拟南芥种子(Columbia生态型)由中国林业科学研究院国家林业局林木培育重点实验室保存。
1.2 研究方法 1.2.1 毛白杨次生维管系统再生系统选取4年生河北省毛白杨无性系,按照Li等(1988)所采用的创伤方法进行树干剥皮,选定毛白杨植株,距基部约1 m处开始,向上环剥1 m。刮取剥皮后第6,10,12,14,16,18,22天树干表面新出现的组织,液氮保存。同时,取同一株树的组织样品,进行3 μm半薄切片观察,根据形成层再生及韧皮部和木质部的分化阶段,分析再生过程中关键时期,去除形态差异不显著时期,确定后续基因芯片分析时期。
1.2.2 RNA的提取及拟南芥表达谱芯片分析根据QIAGen RNeasy植物样品总RNA提取试剂盒(QIAGen,USA)提取剥皮后不同天数样品的总RNA,取20 μg总RNA,按照Invitrogen cDNA合成试剂盒(Invitrogen,USA)提供的流程合成双链cDNA;采用Phase Lock Gel(Eppendorf,Germany)-苯酚/氯仿法纯化cDNA;按照Enzo RNA转录标记试剂盒(Affymetrix,USA)将纯化的cDNA通过转录掺入法标记上生物素,将生物素标记的cRNA用RNeasy试剂盒(QIAGen,USA)纯化,并作进一步的片断化处理。拟南芥ATH1-121501全基因组芯片购自美国Affymetrix公司。芯片的杂交、显色和洗涤根据Affymetrix的真核生物杂交流程进行。芯片杂交试验设2次重复。Affymetrix公司G2500A型基因芯片扫描仪扫描。数据的分析和处理通过Affymetrix® Microarray Suite Version 5.0。
1.2.3 拟南芥突变体的获得根据上述拟南芥ATH1基因芯片对毛白杨次生维管系统再生过程中的基因表达分析结果,以置信度P < 0.05、差异表达为2倍以上、每个基因参与比较的有效点ratio值(Cy5和Cy3荧光信号强度的比值)的数量≥4为筛选标准,筛选出再生过程中表达差异显著的基因(信号对数值的绝对值大于1)。根据相应的拟南芥基因登录号,在SIGnAL,GABI,RIKEN国际拟南芥突变体库中搜索相应基因的拟南芥突变体,获得拟南芥突变体种子。
1.2.4 拟南芥的春化处理及次生生长诱导取拟南芥突变体和野生型拟南芥种子(Columbia-0) 置于湿润滤纸上,4 ℃保温保湿春化处理5天,播种于培养钵,每个突变体播种约30粒种子,应用短光照、长黑暗,即8 h光照、16 h黑暗培养箱中培养,在23 ℃条件下培养约4~5个月。利用该方法,对照野生型拟南芥的发芽率、存活率均在90%以上。
1.2.5 发芽率及出芽后存活率的观察统计拟南芥播种后第7天统计出芽率,第30天统计出芽后存活率;该发芽试验重复进行1次。在拟南芥突变体生长过程中,每隔7天观察记录突变体表型变化、生理发育周期变化。
1.2.6 突变体的取材、切片及光学显微镜观察次生生长诱导的拟南芥突变体和野生型拟南芥,培养4个月后,经充分次生生长,茎基部较粗。取次生诱导后的拟南芥下胚轴和茎基部,经FAA固定液固定,由50%乙醇开始,经乙醇/叔丁醇系列脱水后石蜡包埋,徕卡RM2135石蜡切片机切片,切片厚度8 μm,粘片,脱蜡,80%甘油封片,奥林巴斯BX51显微镜拍照。
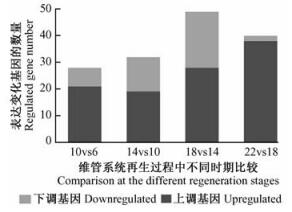
2 结果与分析 2.1 毛白杨次生维管系统再生过程中拟南芥基因芯片对不同时期样品的比较分析利用拟南芥全基因组芯片分析毛白杨次生维管系统再生过程中第6, 10, 14, 18, 22天前后2次连续样品间基因表达差异。研究发现,共有149个基因在该过程中表达呈现显著差异,其中106个基因的表达量增加,43个基因的表达量下降(图 1)。该结果表明毛白杨次生维管系统再生过程有大量而复杂的基因表达及调控过程。
|
图 1 毛白杨维管系统再生过程中相邻不同时期差异表达基因的数量 Figure 1 Number of genes with differences in transcript levels between adjacent stages of secondary vascular system (SVS) regeneration |
对上述基因功能初步分类(图 2):再生第6天到第10天表达发生变化的28个基因中,功能未知的基因12个,信号转导相关的基因和转录因子基因各2个;再生第10天到第14天表达发生变化的32个基因中,功能未知的基因15个,信号转导相关的基因4个,转录因子基因2个;再生第14天到第18天表达发生变化的49个基因中,功能未知的基因21个,信号转导相关的基因和转录因子基因各5个;再生第18天到第22天表达发生变化的40个基因中,功能未知的基因16个,信号转导相关的基因和转录因子基因各2个。功能已知的基因编码包括生长素诱导蛋白,蛋白激酶、G蛋白等信号转导相关蛋白,MYB、AP2、锌指结构域等转录和调控因子,也包括纤维素、果胶及其他细胞壁多糖生物合成酶及扩张蛋白、伸展蛋白、富含羟脯氨酸糖蛋白等细胞壁蛋白。

|
图 2 维管再生过程中不同时期差异表达基因的功能分类 Figure 2 Functional classification based on putative function of the genes expressed during regeneration period |
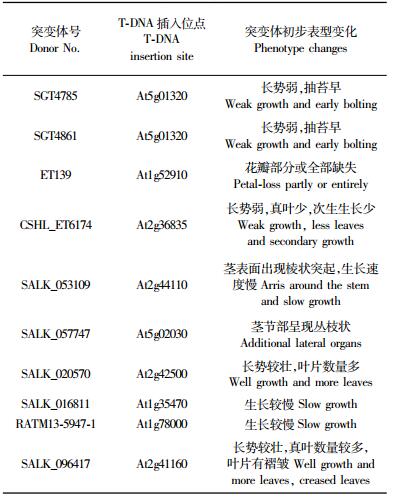
根据拟南芥ATH1基因芯片对毛白杨次生维管系统再生过程中的基因表达分析结果,按照方法中所述的条件,由再生过程中差异表达显著的149个基因中筛选出89个作为候选基因,利用相应拟南芥基因登录号,由SIGnAL,GABI,RIKEN等国际拟南芥突变体库搜索,得到相应基因的拟南芥突变体。分析突变体的T-DNA插入位点,遴选目的基因有可能被破坏的突变体,每个基因选择1~2个突变系,最终由欧洲拟南芥资源中心(NASC)收集到151个拟南芥突变体种子。
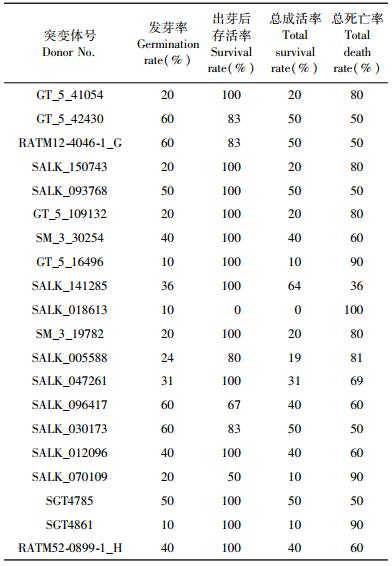
2.3 拟南芥突变体的发芽率及成活率统计对于获得的151个拟南芥突变体,进行发芽率及幼苗成活率统计,研究初步发现20个突变体发芽率或存活率较低(表 1),发芽率介于10%~60%,其中2个突变体(SALK_018613,SALK_070109) 发芽后存活率分别为0%和50%。
|
|
上述突变体的发芽率及存活率较低,推测T-DNA破坏的基因对拟南芥种子发育形成、种子萌发乃至木材发育具有重要影响。如SGT4861突变体对应的缺失基因是植物正常生理代谢所需的一种酶,该基因缺失造成植物体内正常生理代谢受到干扰,造成发芽或存活率较低。其他突变体的突变基因还包含信号转导及转录因子等基因,但大多基因功能未知。此外,该突变基因由拟南芥全基因组芯片分析木材发育的研究结果获知,推测该同源基因不仅在种子萌发过程中具有重要作用,在木材发育过程中也具有某种重要影响,需进一步利用木本模式植物开展目标基因在木材发育中的功能研究。
2.4 拟南芥突变体的表型及解剖结构变化将野生型拟南芥与151个拟南芥突变体共同进行次生生长诱导培育。野生型拟南芥在培育约3个月抽苔,莲座叶片数量可达40余片,植株整体生长旺盛,约4个月时,茎高达30 cm,长势较壮(图 3A),茎基部和下胚轴部位较粗,直径可达约2~3 mm。荧光显微镜下观察下胚轴部位(图 3C),木质部发育较充分,存在大量次生木质部结构,木质部导管数量较多,出现Chaffey等(2002)研究中所提及的拟南芥下胚轴次生生长结构的Ⅰ, Ⅱ阶段。
对151个拟南芥突变体同期进行次生诱导生长,观察其表型变化及解剖结构变化,初步发现10个拟南芥突变体发生表型变化(表 2),主要为3类。第1类突变体表现在次生生长发育受到影响。如图 3B所示突变体,在次生生长条件下,该突变体长势较弱,生长约1个月即开始抽苔开花,下胚轴和茎较细,约0.5~1 mm。下胚轴横切解剖研究发现(图 3D),木质部和韧皮部次生生长不充分,木质部中管状分子数量较少,但木质部的导管孔径较大。该表型变化表明该突变体次生维管系统发育受到影响,导致该突变体未能经历充分次生生长而出现该表型变化。第2类突变体表现在生长速度显著落后于野生型拟南芥。图 3E中所示为同期种植的拟南芥突变体与野生型拟南芥,该突变体播种后,由真叶出现至随后整个生长阶段,突变体生长均落后于野生型。至野生型拟南芥抽苔开花约30 cm高时,该突变体则刚刚抽苔。推测,该类突变可能是由于激素调控相关基因受影响而导致生长节律减缓。第3类突变体主要表现在表型出现显著变化。图 3F所示突变体显著的表型变化为茎表面出现数条棱状突起(图 3F箭头所示),沿茎基部纵向生长,终止于茎上叶柄部位,而野生型拟南芥表面则没有棱状突起(图 3A,G)。研究发现棱状突起在突变体茎原基发育过程中出现,棱状突起结构内部存在能够产生自发荧光的细胞(图 3H),推测其为次生壁加厚的管状分子。在突变体茎早期发育过程中,推测其维管发育模式受到影响,导致茎上叶片或侧芽发育形成过程中,某些维管组织异常出现在表皮内部的皮层中,导致形成图 3H所示在茎表面出现的棱状结构。
|
|

|
图 3 拟南芥突变体的表型变化 Figure 3 Phenotype changes of Arabidopsis thaliana mutants WT:野生型Wild-type;Mu:突变体Mutants. A.野生型拟南芥茎基部,茎基部发育较壮; B.拟南芥突变体,开花抽苔早,长势较弱,茎基部较细; C.野生型拟南芥下胚轴部位横切面的解剖结构; D.拟南芥突变体下胚轴部位横切面解剖结构,几乎无次生生长; E.突变体发育比野生型拟南芥生长较慢,右侧野生型拟南芥已开花结种,左侧拟南芥突变体刚抽苔; F.拟南芥突变体在茎的侧面出现数条棱状突起,沿茎向上生长; G.野生型拟南芥的茎横切解剖结构;H.拟南芥突变体茎横切解剖结构, 在茎上出现棱状突起结构。 A. Stem's basal part of Arabidopsis wild-type; B. Arabidopsis mutants, earlier flowering period, showing a weaker growth; C. Arabidopsis hypocotyl cross section of wild-type; D. Hypocotyl cross section of Arabidopsis mutants, there are not almost typical secondary growth; E. Slower growth of Arabidopsis mutants; F. Arris around the stem of Arabidopsis mutants; G. Stem cross section of wild-type; H. Stem cross section of Arabidopsis mutant, there are arrises' structure around stem. |
目前利用拟南芥研究维管系统发育已取得了许多重要进展,Beers等(2001)获得与拟南芥维管组织分化相关的特异表达的EST片段,Ko等(2006;2004a; 2004b)通过基因芯片获得茎初生生长与次生生长转换过程中的差异表达基因,Zhong等(2008)和Zhou等(2009)利用拟南芥研究证明了影响次生细胞壁的数个转录因子。但上述研究主要集中在拟南芥维管系统发育研究,未与木材发育相关基因的功能研究相结合。本研究利用拟南芥全基因组芯片分析毛白杨次生维管再生过程,共有149个基因在该过程中表达呈现差异变化,主要有转录因子、信号转导相关蛋白、细胞壁相关蛋白,以及代谢相关蛋白、其他功能蛋白基因等,其中大部分基因功能未知。结合已有切片观察结果(Du et al., 2006),可初步推断各个阶段所表达基因分别与毛白杨剥皮后各个阶段的维管发育相关:10天比较6天的差异表达基因可能与维管形成层的形成相关,主要有一些功能未知的基因、信号转导相关基因及转录因子;14天比较10天的差异表达基因可能与维管形成层的形成相关,多为一些功能未知基因及信号转导相关基因、转录因子基因;18天比较14天的差异表达基因可能与形成层的发育以及韧皮部细胞的分化相关,发现的差异表达基因多于前2个时期,多数为功能未知基因及信号转导相关基因、转录因子基因;22天比较18天的差异表达基因可能与木质部的分化相关,包括一些功能未知基因,生长素诱导蛋白、蛋白激酶、G蛋白等信号转导相关基因,MYB、AP2、锌指结构域等转录因子和调控因子基因,也包括纤维素、果胶及其他细胞壁多糖生物合成相关基因以及扩张蛋白、伸展蛋白、富含羟脯氨酸糖蛋白等细胞壁蛋白基因。Chaffey等(2002)也曾比较欧美杂种山杨(Populus tremula × P. tremuloides)次生木质部与次生诱导的拟南芥下胚轴结构及组分,研究表明二者具有较高相似性,因此认为木材发育与拟南芥次生维管系统发育可能具有相似的调控发育模式。本研究通过拟南芥芯片分析获得的基因表达谱,进一步验证了拟南芥的次生维管发育及其分子调控具有与木本植物如杨树类似的模式。上述这些差异表达基因在维管系统发育过程中,尤其对于次生维管系统或木材的发育很可能具有重要作用,为进一步研究木材维管系统发育提供了重要的研究基础。
本研究利用基因芯片获知差异表达基因,通过拟南芥突变体分析其功能。研究中发现20个拟南芥突变体的发芽率或存活率较低,10个拟南芥突变体出现表型变化。表型变化主要表现在维管系统次生生长发育受到抑制、生长速度减慢、次生生长结构发生变化等。如SALK_053109突变体表现在茎上出现了棱状突起、生长速度减慢、次生结构较发达,分析发现内部维管束发育分化有了一定变化。SALK_057747突变体茎上节部位出现多个分枝。上述突变体研究结果说明T-DNA插入造成基因功能缺失,导致突变体维管系统发育不正常,推断这些缺失基因可能参与调控拟南芥的维管系统发育,尤其在次生维管系统的发育中具有某些重要作用。因此,深入研究其基因功能,对于阐明木本植物的次生维管系统发育具有重要意义。
然而,在突变体缺失基因研究中,应关注T-DNA拷贝数影响。来源于国际拟南芥突变体库的突变体,几乎半数突变体基因组内有多个T-DNA插入位点,但获得拟南芥突变体时仅获知1个T-DNA插入基因位点,因此,研究中需明确表型变化与该目标基因的一致性,若该基因位点并不是造成表型变化的原因,需要寻找其他T-DNA插入基因位点。如突变体SALK_053109,所获知T-DNA插入基因位点为At2g44110(表 2),但深入研究发现该基因缺失并不能造成突变表型,进一步研究发现尚有其他T-DNA拷贝。因此,对于突变体研究,首先分析内部T-DNA拷贝数及突变基因,确认基因缺失与表型变化的一致性,才可深入开展目标基因功能研究。
目前以林木研究模式植物——杨树作为研究材料已做了大量研究工作,其基因组测序已经完成(Tuskan et al., 2006),为杨树的功能基因组学研究奠定了基础。但由于林木遗传背景复杂,世代长,无法利用突变体快速分析和验证相关基因的功能。本研究利用拟南芥突变体,结合基因芯片技术分析获得的毛白杨次生维管系统再生过程中的调控基因,对其进行了初步的功能分析,进一步缩小了木材形成相关候选基因范围,克服了木本植物的研究局限,为木材发育的基因功能研究探索一条新途径。
Alonso J M, Stepanova A N, Leisse T J, et al. 2003. Genome-wide insertional mutagenesis of Arabidopsis thaliana[J]. Science, 301: 653-657. DOI:10.1126/science.1086391 |
Beers E P, Zhao C S. 2001. Arabidopsis as a model for investigating gene activity and function in vascular tissues//Morohoshi N, Komamine A. Molecular Breeding of Woody Plants. New York: Elsevier Science BV, 43-52.
|
Bonke M, Thitamadee S, Mahonen A P, et al. 2003. APL regulates vascular tissue identity in Arabidopsis[J]. Nature, 426: 181-186. DOI:10.1038/nature02100 |
Carlsbecker A, Helariutta Y. 2005. Phloem and xylem specification: pieces of the puzzle emerge[J]. Current Opinion in Plant Biology, 8(5): 512-517. DOI:10.1016/j.pbi.2005.07.001 |
Chaffey N, Cholewa E, Regan S, et al. 2002. Secondary xylem development in Arabidopsis : a model for wood formation[J]. Physiologia Plantarum, 114(4): 594-600. DOI:10.1034/j.1399-3054.2002.1140413.x |
Du Juan, Xie Hongli, Zhang Deqiang, et al. 2006. Regeneration of the secondary vascular system in poplar as a novel system to investigate gene expression by a proteomic approach[J]. Proteomics, 6(3): 881-895. DOI:10.1002/(ISSN)1615-9861 |
Emery J F, Floyd S K, Alvarez J, et al. 2003. Radial patterning of Arabidopsis shoots by class III HD-ZIP and KANADI genes[J]. Current Biology, 13(20): 1768-1774. DOI:10.1016/j.cub.2003.09.035 |
Juarez M, Kui J, Thomas J, et al. 2004. MicroRNA-mediated repression of rolled leaf1 specifies maize leaf polarity[J]. Nature Biotechnology, 428: 84-88. |
Ko J H, Beers E P, Han K H. 2006. Global comparative transcriptome analysis identifies gene network regulating secondary xylem development in Arabidopsis thaliana[J]. Mol Gen Genomics, 276(6): 517-531. DOI:10.1007/s00438-006-0157-1 |
Ko J H, Han K H. 2004a. Arabidopsis whole-transcriptome profiling defines the features of coordinated regulations that occur during secondary growth[J]. Plant Molecular Biology, 55(3): 433-453. DOI:10.1007/s11103-004-1051-z |
Ko J H, Han K H, Park S, et al. 2004b. Plant body weight-induced secondary growth in Arabidopsis and its transcription phenotype revealed by whole-transcriptome profiling[J]. Plant Physiology, 135(2): 1069-1083. DOI:10.1104/pp.104.038844 |
Li Zhengli, Cui Keming. 1988. Differentiation of secondary xylem after girdling[J]. IAWA Bulletin, 9: 375-383. DOI:10.1163/22941932-90001099 |
McConnell J R, Emery J, Eshed Y, et al. 2001. Role of PHABULOSA and PHAVOLUTA in determining radial patterning in shoots[J]. Nature Biotechnology, 411: 709-713. |
McHale N A, Koning R E. 2004. MicroRNA-directed cleavage of Nicotiana sylvestris PHAVOLUTA mRNA regulates the vascular cambium and structure of apical meristems[J]. Plant Cell, 16(7): 1730-1740. DOI:10.1105/tpc.021816 |
Pineau C, Freydier A, Ranocha P, et al. 2005. hca: an Arabidopsis mutant exhibiting unusual cambial activity and altered vascular patterning[J]. The Plant Journal, 44(2): 271-289. DOI:10.1111/j.1365-313X.2005.02526.x |
Plomion C, Leprovost G, Stokes A. 2001. Wood formation in trees[J]. Plant Physiology, 127(4): 1513-1523. DOI:10.1104/pp.010816 |
Prassinos C, Ko J H, Yang J, et al. 2005. Transcriptome profiling of vertical stem segments provides insights into the genetic regulation of secondary growth in hybrid aspen trees[J]. Plant and Cell Physiology, 46(8): 1213-1225. DOI:10.1093/pcp/pci130 |
Raemdonck D V, Pesquet E, Cloquet S, et al. 2005. Molecular changes associated with the setting up of secondary growth in aspen[J]. Journal of Experimental Botany, 56(418): 2211-2227. DOI:10.1093/jxb/eri221 |
Scholl R, May S, Ware D. 2000. Seed and molecular resources for Arabidopsis[J]. Plant Physiology, 124(4): 1477-1480. DOI:10.1104/pp.124.4.1477 |
Schrader J, Nilsson J, Mellerowicz E, et al. 2004. A high-resolution transcript profile across the wood-forming meristem of poplar identifies potential regulators of cambial stem cell identity[J]. The Plant Cell, 16(9): 2278-2292. DOI:10.1105/tpc.104.024190 |
Tuskan G A, DiFazio S, Jansson S, et al. 2006. The genome of Black Cottonwood, Populus trichocarpa (Torr & Gray)[J]. Science, 313(5793): 1596-1604. DOI:10.1126/science.1128691 |
Wang Minjie, Qi Xiaoli, Zhao Shutang, et al. 2009. Dynamic changes in transcripts during regeneration of the secondary vascular system in Populus tomentosa Carr[J]. revealed by cDNA microarrays. BMC Genomics, 10(1): 215-222. |
Whetten R, Sun Y H, Zhang Y, et al. 2001. Functional genomics and cell wall biosynthesis in loblolly pine[J]. Plant Molecular Biology, 47(1): 275-291. |
Yamada K, Lim J, Dale J M, et al. 2003. Empirical analysis of transcriptional activity in the Arabidopsis genome[J]. Science, 302(5646): 842-846. DOI:10.1126/science.1088305 |
Zhong Ruiqin, Lee Chanhui, Zhou Jianli, et al. 2008. A battery of transcription factors involved in the regulation of secondary cell wall biosynthesis in Arabidopsis[J]. Plant Cell, 20(10): 2763-2782. DOI:10.1105/tpc.108.061325 |
Zhong Ruiqin, Ye Zhenghua. 2004. amphivasal vascular bundle 1, a gain-of-function mutation of the IFL1/REV gene, is associated with alterations in the polarity of leaves, stems and carpels[J]. Plant Cell Physiology, 45(4): 369-385. DOI:10.1093/pcp/pch051 |
Zhou Jianli, Lee Chanhui, Zhong Ruiqin, et al. 2009. MYB58 and MYB63 are transcriptional activators of the lignin biosynthetic pathway during secondary cell wall formation in Arabidopsis[J]. Plant Cell, 21(1): 248-266. DOI:10.1105/tpc.108.063321 |
 2011, Vol. 47
2011, Vol. 47