文章信息
- 张露婷, 吴江, 梅丽, 吴家胜
- Zhang Luting, Wu Jiang, Mei Li, Wu Jiasheng
- 喜树种源耐盐能力评价及耐盐指标筛选
- Saline tolerance of Camptotheca acuminata provenances and the index selection for saline tolerance
- 林业科学, 2011, 47(11): 66-72.
- Scientia Silvae Sinicae, 2011, 47(11): 66-72.
-
文章历史
- 收稿日期:2010-11-26
- 修回日期:2011-03-28
-
作者相关文章
2. 黄岩林业特产局 黄岩 318020
2. Huangyan Bureau of Special Forest Products Huangyan 318020
我国盐渍化和次生盐渍化土地有4 000万hm2以上, 占现有耕地的四分之一,而且盐渍化日趋严重,影响到我国农林业的生产(赵可夫等,1999)。目前,盐碱地综合治理主要靠生物措施,发掘更多的耐盐植物是当前抗盐性研究的重要内容, 尤其是具有经济效益的耐盐植物(柯裕州等,2009)。在盐胁迫下,植物细胞内自由基产生与清除的平衡遭到破坏,膜脂过氧化作用增强,破坏膜结构和功能,导致膜透性增大和丙二醛含量上升,离子平衡失调、代谢紊乱,同时胁迫使植物出现水分亏损,植物会通过积累一些离子和有机物质来降低渗透势,以促进植物吸水(黄鹏,2006; Sreenivasulu et al., 2000; Mittova et al., 2003; Navrot et al., 2007; 周滈等,2007),当盐分浓度超过植物叶片耐盐阀值或达到叶片致死盐量时,植物常表现出萎蔫或枯死状态(汪贵斌等, 2003)。
喜树(Camptotheca acuminata)为珙桐科(Nyssaceae)落叶乔木,是我国特有的树种,生长迅速,树干高大,枝叶茂盛,萌芽能力强,病虫害少,是造林的优良树种,也是优良的庭院树和行道树(张显强等,2006),在一些沿海区域作为行道树零星栽培,生长良好。喜树还是重要的抗癌药用植物,其全身各器官含有喜树碱,尤其是幼嫩的叶片含量较高(Liu et al., 1996),而且叶片喜树碱含量随树体年龄的增长迅速下降。我国长江以南一些地方营建了大面积的喜树采叶园作为提取喜树碱的原料。本文拟通过盐胁迫下不同种源喜树的生理生化特性研究,对喜树种源耐盐能力进行鉴定,旨在为喜树耐盐良种的选育、耐盐机制研究、耐盐评价指标体系建立以及沿海区域采叶园的扩大栽培等提供理论基础。
1 材料与方法 1.1 试验材料以喜树自然分布区内收集的云南昆明(KM)、湖南邵阳(SY)、湖南浏阳(LY)、浙江龙泉(LQ)、浙江长兴(CX)、江苏南京(NJ)、贵州贵阳(GY)、江西南昌(NC)、广西桂林(GL)、安徽黄山(HS)10个种源为试验对象。于2008年11月份采种,按一般种源试验要求进行,种子采集后经晾干保存。2009年3月将不同种源的喜树种子播种到浙江农林大学大棚内的苗床上,常规管理,待长到芽苗阶段,将生长基本一致的喜树选出,移栽于营养钵中,用珍珠岩:蛭石:泥炭土=1:2:2(含缓释肥)作为栽培基质,每个营养钵栽1株喜树幼苗,下面套塑料托盆,以防止水肥的流失。8月份,选择生长基本一致的喜树幼苗(苗高平均为79.0 cm,地径平均为9.46 mm)进行NaCl胁迫试验。
1.2 试验方法于8月2日进行NaCl胁迫试验,NaCl处理按NaCl占土壤干质量的百分比设3个水平, 即0(CK),0.2%(S1),0.6%(S2),采用称重法使土壤含水量控制在田间持水量的75%。每个处理设置3次重复,每个重复6株苗,共18株。盐胁迫处理11天后开始采样测定生理生化指标,采样于8:00进行,取从上往下的第2~3轮功能叶片,为确保材料的代表性,每个处理取6株植株的叶子作为混合样,生长指标、K+和Na+含量测定时间为盐胁迫处理21天,每个指标重复测定3次。
生物量采用收获法测定; 叶片相对含水量采用称质量法测定; 超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定; 过氧化物酶(POD)活性采用愈创木酚法测定; 可溶性糖含量采用蒽酮比色法测定; 可溶性蛋白含量采用考马斯亮蓝法测定; 丙二醛(MDA)含量采用硫代巴比妥酸比色法测定; 细胞膜相对透性采用电导仪法(汤章城,1999)测定,K+和Na+含量采用火焰光度计法(王宝山等,1995)测定。
2 结果与分析 2.1 NaCl胁迫对不同喜树种源苗木生长的影响盐胁迫影响植物体多个方面的生理代谢,Levitt(1980)则认为, 生物量是植物对盐胁迫响应的综合体现, 是评价植物耐盐性最具代表性的可靠指标,也是树木抗盐育种的重要选择指标(杨敏生等,2006)。从表 1可以看出:随着NaCl浓度增加,10个喜树种源苗高、地径和生物量均呈下降趋势,而根冠比呈上升趋势,不同处理间差异达到显著水平。根据S2处理下各种源的总生物量大小,10个种源耐盐能力从强到弱依次为LY>NC>GL>HS>SY>GY>KM>NJ>LQ>CX。
|
|
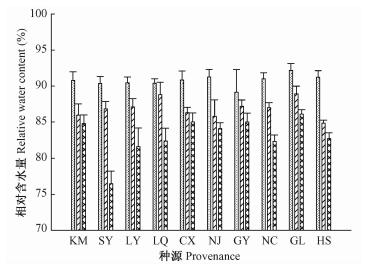
Levitt(1990)认为不同环境胁迫作用于植物时能对植物造成水分胁迫,植物会出现水分亏缺现象,植物叶片相对含水量的大小可部分反映植物抗逆性的能力。从图 1可知:NaCl浓度处理下, 10个种源的喜树幼苗叶片相对含水量均随NaCl胁迫的加剧而呈现下降的趋势,但不同种源下降幅度不一致。方差分析表明,NaCl处理、种源对喜树幼苗叶片相对含水量的影响均达到极显著水平(P<0.01)(表 2)。
|
图 1 NaCL胁迫对喜树幼苗叶片相对含水量的影响 Figure 1 Effects of NaCl stress on RWC in the leaf of Camptotheca acuminata seedlings |
|
|
NaCl胁迫下,10个喜树种源的SOD和POD活性变化趋势如图 2所示。SOD活性基本随着盐胁迫的加剧呈现上升的趋势; POD活性基本随着盐胁迫的加剧呈现先上升后下降的趋势。方差分析表明(表 2),NaCl处理、种源对喜树苗木叶片SOD和POD活性的影响均达到极显著的水平(P<0.01)。
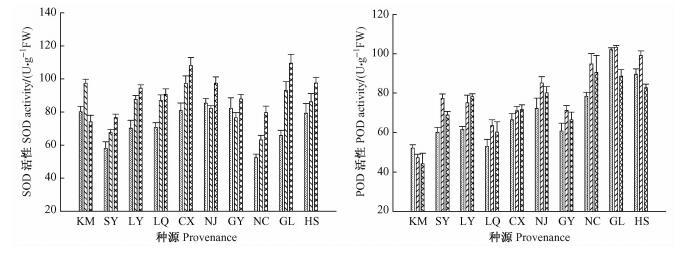
|
图 2 NaCl胁迫对喜树幼苗SOD和POD活性的影响 Figure 2 Effects of NaCl stress on SOD and POD activities in the leaf of C. acuminata seedlings |
从图 3可知: 10个种源的喜树幼苗可溶性糖和可溶性蛋白含量均随着NaCl胁迫的加剧而呈现上升的趋势。方差分析表明: NaCl处理、种源对喜树苗木叶片可溶性糖含量和可溶性蛋白含量的影响均达到极显著的水平(表 2)。
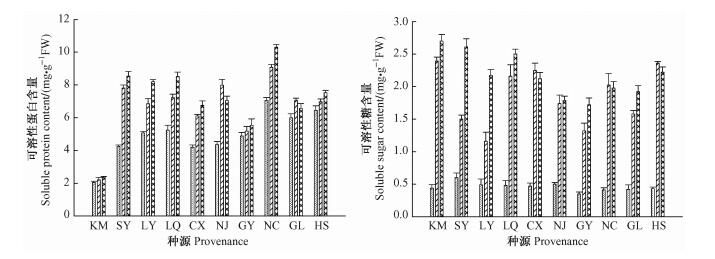
|
图 3 NaCl胁迫对喜树幼苗叶片可溶性糖和可溶性蛋白含量的影响 Figure 3 Effects of NaCl stress on soluble sugar and protein contents in the leaf of C. acuminata seedlings |
NaCl胁迫下,10个喜树种源的细胞膜透性和MDA含量变化趋势如图 4所示。10个种源的喜树苗木叶片细胞膜透性和MDA含量均随着NaCl胁迫的加剧而呈现上升的趋势,表明NaCl胁迫程度越强,喜树苗木叶片受到的伤害越大,但各个种源受到的伤害程度有所差异。方差分析表明: NaCl处理、种源对喜树苗木细胞膜透性和MDA含量均有极显著的影响(表 2)。
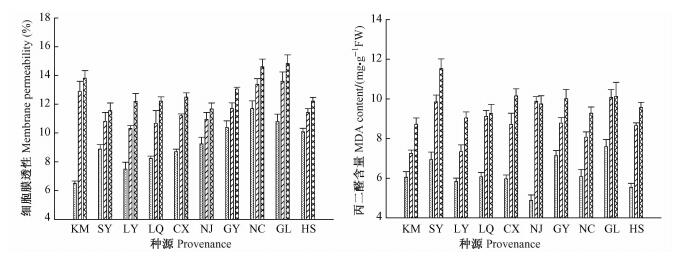
|
图 4 NaCl胁迫对喜树幼苗叶片细胞膜透性和MDA含量的影响 Figure 4 Effects of NaCl stress on membrane permeability and MDA content in the leaf of C. acuminata seedlings |
从表 3可知: 10个喜树种源叶片中Na+浓度和Na+/K+比值随盐胁迫强度的增强而明显上升。随着NaCl浓度的增高, 叶片中K+浓度先上升后下降, 表明在低盐浓度胁迫下, 根系不仅增加对Na+的吸收, 而且也增强了对K+的吸收, 但NaCl浓度较高时, 则明显抑制各种源对K+的吸收。方差分析表明:NaCl处理、种源对喜树苗木叶片Na+/K+比值的影响均达到极显著的水平(表 2)。
|
|
以叶片相对含水量(X1)、叶片SOD活性(X2)、叶片POD活性(X3)、叶片可溶性蛋白(X4)、叶片可溶性糖(X5)、叶片细胞膜透性(X6)、叶片MDA含量(X7)、叶片Na+/K+比值(X8)为自变量, 以总生物量为因变量(Y), 采用逐步剔除、逐个选入和逐步回归等分析方法对得到的数据进行分析。3种分析方法同时表明:在所有的自变量中, 叶片可溶性糖(X5)、叶片MDA含量(X7)、叶片Na+/K+比(X8)对总生物量(Y)均有显著影响,其他指标对总生物量的影响均不显著,叶片可溶性糖(X5)对总生物量的影响最大。回归方程为Y=114.032 7-12.004 6 X5-3.764 9 X7-6.799 0 X8,达到极显著水平(P < 0.000 1, F=86.83)。
相关分析表明:叶片相对含水量(X1)、叶片SOD活性(X2)、叶片可溶性蛋白(X4)、叶片可溶性糖(X5)、叶片细胞膜透性(X6)、叶片MDA含量(X7)、叶片Na+/K+比(X8)与喜树各种源总生物量之间相关系数分别为0.851, -0.564, -0.433 8, -0.892, -0.738, -0.889和-0.698,相关关系均达到极显著水平(P < 0.01)。综合以上分析:叶片可溶性糖、叶片MDA含量和叶片Na+/K+比可以作为评价喜树种源耐盐能力的重要参考指标, 而叶片相对含水量、叶片SOD活性、叶片可溶性蛋白、叶片细胞膜透性这4项指标与喜树生物量有显著的相关关系,也可作为评价喜树耐盐能力的辅助指标。
3 结论与讨论盐分胁迫不是单一的某种伤害,而是综合反应,盐胁迫对植物造成的危害主要是离子毒害,渗透胁迫和营养不均衡3个方面(Xiong et al., 2002)。这些危害进一步引起植物生理生化变化, 主要表现为盐胁迫破坏植物体内自由基代谢平衡,植物通过激活各类自由基代谢酶的活性来消除自由基的毒害,同时盐胁迫会影响植物体内渗透势,植物通过积累各类离子和有机物质来降低渗透势,以防止植物水分外渗(赵可夫等,1999)。本研究中可溶性糖和可溶性蛋白含量的大量升高是为了降低细胞的渗透势,这与陈健妙等(2010)的研究结果相一致。植物细胞在盐胁迫下可通过多种途径产生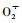
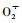
植物细胞内SOD, POD等抗氧化酶可以在一定程度上抵御各种环境因子造成的氧化胁迫。其中SOD是保护植物细胞免受自由基伤害的第一道防线(Hernández et al., 2001),主要调控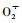
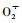
盐离子的吸收对植物造成的另外一个危害就是植物营养的不均衡。K+是与耐盐性相关的重要离子之一, 具有调控离子平衡、蛋白质合成、渗透调节等多项生理功能。然而由于Na+和K+具有相近的离子半径和水合能,Na+竞争K+的吸收位点及活性位点,导致依赖K+的酶活性及代谢过程受抑制(Shinozaki et al., 2003)。试验表明:较低浓度的NaCl处理下,喜树各种源叶片中Na+,K+浓度同时升高, 表明根系不仅增加对Na+的吸收, 而且也增强了对K+的吸收; 较高浓度的NaCl处理下,Na+在叶片中累积速度明显高于K+在叶片中的累积速度,抑制了根系对K+的吸收,因而导致了Na+/ K+比值与对照相比明显增大,这与Silva等(2008)在酸枣(Choerospondios axillans)上和孙景波等(2009)在桑树(Morus alba)上的研究结果一致。数据分析结果表明:喜树叶片中叶片可溶性糖、MDA含量、Na+/K+比值对喜树苗木总生物量有显著影响, 说明可以用可溶性糖, MDA, Na+/K+比作为评价喜树苗期耐盐能力的指标。汪贵斌等(2001)研究了5个品种银杏(Gingko biloba)的耐盐能力, 也发现银杏叶片中Na+/K+比值与树种的耐盐能力有很大关系。张子学等(2004)研究10个棉花(Gossypium hirsutum)品种的耐盐能力,发现叶片中可溶性糖和可溶性蛋白质含量可作为棉花品种耐盐能力的指标。费伟等(2005)研究了盐胁迫对番茄(Lycopersicon esculentum)幼苗生理特性的影响,认为丙二醛含量的高低可以作为鉴定番茄幼苗耐盐性的生理指标。
生物量是植物对盐胁迫响应的综合体现。根据S2处理下各种源的总生物量大小,参试的10个种源耐盐能力从强到弱依次为LY>NC>GL>HS>SY>GY>KM>NJ>LQ>CX。分析表明:可溶性糖、MDA、Na+/K+比等指标也可作为评价喜树苗期耐盐能力的参考指标。但由于植物耐盐性的机制十分复杂,用单个耐盐参考指标难以客观地反映出植物的耐盐能力,如何提出综合性的耐盐参考生理指标有待于进一步研究。另外,喜树的耐盐表现是否随不同生长发育阶段而变化也需要进一步的研究。
陈健妙, 郑青松, 刘兆普, 等. 2010. 两种麻疯树苗对盐胁迫的生理生态响应[J]. 生态学报, 30(4): 933-940. |
费伟, 陈火, 曹忠, 等. 2005. 盐胁迫对番茄幼苗生理特性的影响[J]. 上海交通大学学报:农业科学版, 23(1): 5-9. |
黄鹏. 2006. 盐分胁迫对香椿幼苗生长的影响[J]. 甘肃农业大学学报, 41(4): 60-63. |
柯裕州, 周金星, 张旭东, 等. 2009. 盐胁迫对桑树幼苗光合生理生态特性的影响[J]. 林业科学, 45(8): 61-66. DOI:10.11707/j.1001-7488.20090811 |
刘祖祺, 张石城. 1994. 植物抗性生理学[M]. 北京: 中国农业出版社.
|
孙景波, 孙广玉, 刘晓东, 等. 2009. 盐胁迫对桑树幼苗生长、叶片水分状况和离子分布的影响[J]. 应用生态学报, 20(3): 543-548. |
汤章城. 1999. 现代植物生理学实验指南[M]. 北京: 科学出版社.
|
王宝山, 赵可夫. 1995. 小麦叶片中K、Na提取方法比较[J]. 植物生理学通讯, 31(1): 50-52. |
汪贵斌, 曹福亮, 游庆方, 等. 2001. 盐胁迫对4树种叶片中K+和Na+的影响及耐盐能力的评价[J]. 植物资源与环境学报, 10(1): 30-34. |
汪贵斌, 曹福亮, 张往祥. 2003. 银杏品种耐盐能力的研究[J]. 林业科学, 39(5): 168-172. DOI:10.11707/j.1001-7488.20030527 |
汪月霞, 孙国荣, 王建波, 等. 2006. NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J]. 生态学报, 26(1): 122-129. |
吴强盛, 刘琴. 2010. 毛桃对盐胁迫的光合、抗氧化和离子响应[J]. 江西农业大学学报, 32(2): 303-307. |
杨敏生, 李艳华, 梁海永, 等. 2006. 白杨派杂种无性系及其亲本光合和生长对盐胁迫的反应[J]. 林业科学, 42(4): 19-26. |
杨淑萍, 危常州, 梁永超. 2010. 盐胁迫对海岛棉不同基因型幼苗生长及生理生态特征的影响[J]. 生态学报, 30(9): 2322-2331. |
张显强, 唐金刚, 乙引. 2004. 中国喜树资源及可持续开发对策[J]. 贵州师范大学学报:自然科学版, 22(1): 36-39. |
张子学, 王正鹏, 凌中鑫, 等. 2004. 不同棉花品种NaCl胁迫的生理表现及其耐盐性筛选指标分析[J]. 中国棉花, 31(8): 8-10. |
赵可夫, 李法曾. 1999. 中国盐生植物[M]. 北京: 科学出版社.
|
周滈, 卓丽环, 张荻, 等. 2007. NaCl胁迫对偃伏梾木幼苗生理影响[J]. 东北林业大学学报, 35(1): 13-16. |
Amor N B, Jiménez A, Megdiche W, et al. 2006. Response of antioxidant systems to NaCl stress in the halophyte Cakile maritime[J]. Physiologia Plantarum, 126(3): 446-457. DOI:10.1111/ppl.2006.126.issue-3 |
Bowler C, Montagu M V, Inze D. 1992. Superoxide dismutase and stress tolerance[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 43: 83-116. DOI:10.1146/annurev.pp.43.060192.000503 |
Chaparzadeh N, D'Amico M L, Khavari-Nejad R A, et al. 2004. Antioxidative responses of Calendula officinalis under salinity conditions[J]. Plant Physiology and Biochemistry, 42(9): 695-701. DOI:10.1016/j.plaphy.2004.07.001 |
Hernández J A, Ferrer M A, Jiménez A, et al. 2001. Antioxidant systems and O2—[]·/H2O2 production in the apoplast of pea leaves: its relation with salt-induced necrotic lesions in minor veins[J]. Plant Physiology, 127(3): 817-831. DOI:10.1104/pp.010188 |
Levitt J. 1980. Response of plants to environmental stress[M]. New York: Academic Press.
|
Liu Z, John Adams. 1996. Camptothecin yield and distribution within Camptotheca acuminata trees cultivated in Louisiana[J]. Can J Bot, 74(3): 360-365. DOI:10.1139/b96-045 |
Mittova V, Tal M, Volokita M, et al. 2002. Salt stress induces up-regulation of an efficient chloroplast antioxidant system in the salt-tolerant wild tomato species Lycopersion pennellii but not in the cultivated species[J]. Physiol Plant, 115: 393-400. DOI:10.1034/j.1399-3054.2002.1150309.x |
Navrot N, Rouhier N, Gelhaye E, et al. 2007. Reactive oxygen species generation and antioxidant systems in plant mitochondria[J]. Physiologia Plantarum, 129: 185-195. DOI:10.1111/ppl.2007.129.issue-1 |
Scandalios J G. 1993. Oxygen stress and superoxide dismutases[J]. Plant Physiology, 101: 7-12. DOI:10.1104/pp.101.1.7 |
Shinozaki K, Dennis E S. 2003. Regulation of ion homeostasis under salt stress[J]. Current Opinion in Plant Biology, 6(5): 441-445. DOI:10.1016/S1369-5266(03)00085-2 |
Silva E C, NogueiraR J, Araujo F P, et al. 2008. Physiological responses to salt stress in young umbu plants[J]. Environmental and Experimental Botany, 63(1/3): 147-157. |
Sreenivasulu N, Grimm B, Wobus U, et al. 2000. Differential response of antioxidant compounds to salinity stress in salt-tolerant and salt-sensitive seedlings of foxtail millet(Setaria italica)[J]. Physiologia Plantarum, 109(4): 435-442. DOI:10.1034/j.1399-3054.2000.100410.x |
Xiong L, Zhu J K. 2002. Molecular and genetic aspects of plant response to osmotic stress[J]. Plant and Cell Environment, 25(2): 131-139. DOI:10.1046/j.1365-3040.2002.00782.x |
 2011, Vol. 47
2011, Vol. 47