文章信息
- 吕文华, 刘杏娥, 刘君良
- Lü Wenhua, Liu Xing'e, Liu Junliang
- 黄藤材的真菌变色
- Fungal Staining of Daemonorops margaritae Canes
- 林业科学, 2011, 47(8): 196-200.
- Scientia Silvae Sinicae, 2011, 47(8): 196-200.
-
文章历史
- 收稿日期:2009-09-21
- 修回日期:2010-03-30
-
作者相关文章
2. 国际竹藤网络中心 北京 100102
2. International Centre for Bamboo and Rattan Beijing 100102
黄藤(Daemonorops margaritae),是我国热带和南亚热带森林中的主要伴生植物,是我国的优良商品棕榈藤种,为中国特有种(许煌灿等,1994a)。天然分布以海南岛为中心,延伸至23°30' N以南的广东和广西南部地区。黄藤萌蘖多、生长快、产量高,可广泛栽培于海南、广东、广西、云南和福建等省区,目前已在我国华南地区广为推广栽培(许煌灿等,1994b;1999)。棕榈藤的藤茎或藤条是著名的非木质林产品,富含纤维,质地柔韧,抗拉、抗弯强度大,是编织和家具制作的优良材料(蔡则谟等,2003)。黄藤具有良好的工艺特性,嫩茎还可作为蔬菜食用,具较高经济价值和开发前景。
藤条原色多为乳白色或米黄色,多数藤家具的颜色都以自然清新的原色为主。但黄藤伐后颜色变化很快,呈黄色、红黄色或棕黄色;在运输、存放、加工和使用等过程中,黄藤还容易发生蓝变、褐变、红变或黑斑等变色现象,降低价值,影响其销售和利用。有些变色严重的黄藤弯曲强度降低,不能用于家具制造,常被制成藤篮等低值品,甚至用作燃料。对黄藤材的变色成分和变色机制进行研究,探索如何防止和消除黄藤变色,可以提高藤材的利用率和藤材制品的价值,既增加藤材经济效益,也在一定程度上保护或节约棕榈藤资源。
本研究首先用化学药剂初步判定黄藤变色材的微生物与非微生物变色类型(Wilcox, 1964),再通过电镜显微观察验证;对微生物变色试样进行化学成分分析和变色菌的分离鉴定;最后,将分离纯化后的菌株接种到黄藤正常材上,检验其变色性状,考察分析各变色菌对黄藤材的颜色和质量等材质的影响。
1 材料与方法 1.1 材料黄藤采自广东省肇庆市金鸡坑林场,攀生在杉木(Cunninghamia lanceolata)上,约15年生。藤条直径10 ~ 20 mm, 长15 ~ 25 m, 节间长度15 ~25 cm。选取典型的黄藤气干变色材进行变色类型的确定和变色真菌的分离。用于接种变色菌的黄藤试材为藤全长1 /3 ~ 2 /3中部的非节部健全藤材(无虫蛀、无蓝变、无霉斑),试样尺寸为50 mm × D mm ×2 mm(50 mm为顺纹长度,D为藤条直径)。
1.2 显微观察首先,用饱和乙二酸水溶液和15%的过氧化氢水溶液涂刷变色材表面,初步判断黄藤材的微生物与非微生物变色(Wilcox, 1964);其次,对变色试样通过光学电镜和扫描电镜(SEM)进行微观考察。SEM分析采用日本JEOL生产的JSM-5500LV型扫描电子显微镜,10 mm × 10 mm × 1mm试样,喷金处理,白金厚度为8 nm, 加速电压15 kV。
1.3 化学成分分析按照造纸原料的国家标准GB / T 2677. 2 ~ 10—93 ~ 95测试黄藤正常材及其变色材的灰分、冷水抽提物、热水抽提物、1%氢氧化钠抽提物、苯醇抽提物、酸不溶木质素、综纤维素和聚戊糖等各项基本化学成分。pH值的测定按照木材pH值测定方法(GB / T 6043—1999)进行。
1.4 变色菌的分离鉴定和接种首先将变色材表面用75%的酒精消毒,再用无菌水漂洗2 ~ 3次,用解剖刀轻轻刮去表层,切取小块变色材,放在PDA平板培养基上,在温度26 ~ 28 ℃、相对湿度75%的培养箱中培养;当试件周围明显长出菌丝后,采用尖端菌丝挑取法挑取形态不同的菌落,转到PDA培养基上,进行纯化培养;最后,将分离纯化的单纯菌种转接到PDA斜面培养基上,制成试管菌种,放于4℃冰箱中备用。通过形态学方法和DNA测序的分子生物学方法进行菌种鉴定(吕文华等,2009)。
将分离变色菌株分别接种到PDA培养基上培养,待菌落基本长满培养皿后,在平板内加入2 ~ 3mL无菌水,用玻璃棒轻轻搅动,得到含变色菌孢子和菌丝片段的混合溶液即菌悬液,用无菌移液管将其移到无菌试管中备用。将正常的黄藤材藤片在103 ℃下烘干、称重并测色;然后用湿纱布包好,在121 ℃条件下湿热灭菌30 min。将2根无菌小木棍平行放置于空白平板中的无菌滤纸上,再将2片灭菌后的藤片横放在小木棍上,涂布菌悬液,放入培养箱中培养,定期观察。分别在接种2和4周后,用毛刷轻轻清除藤片表面的菌丝和孢子,烘干、称重并测色。每次每菌各取样3个求平均值。
1.5 材色测定采用国际照明委员会CIE L* a* b* (1976)表色系统表色和计算色差(段新芳,2002)。采用日本MINLTA生产的CR-300台式测色仪、D65标准光源、O / d(垂直照明/漫反射),测得色度学参数L* (亮度)、a* (蓝绿指数)和b* (黄红指数),计算色差ΔL*,Δa*,Δb*和总色差ΔE* (ΔE* = [(ΔL*)2 +(Δa*)2 + (Δb*)2]1 /2)。各片试样分别测取3个点求平均值。
2 结果与分析 2.1 黄藤材的变色特征新伐黄藤的去皮藤茎,多为光泽的黄白色或米黄色,在空气中自然放置,尤其在日光照射下,颜色变化很快,呈黄色、红黄色或棕黄色。黄藤产地气候温暖湿润,尤其是在春夏高温多雨季节,黄藤材在运输、存放、加工以及使用过程中,容易由于保管不善而出现蓝变、褐变、红变或黑斑等现象。黄藤颜色从正常的黄白色变为浅蓝黑色,严重者甚至变成铁灰色或暗褐色,变色范围可局限于藤材表皮及至整个藤材横截面。黄藤材在不同环境条件下可能发生各种变色;但在实际生产和使用中,黄变、蓝变、褐变是造成黄藤降等、影响黄藤使用、造成经济损失的主要变色。
2.2 黄藤材变色类型的初步判定研究表明:黄藤材主要存在黄变、蓝变、褐变和红变等变色情况。Wilcox(1964)认为用饱和乙二酸水溶液和过氧化氢水溶液处理变色材,可以明确区分木材微生物与非微生物变色类型:用饱和乙二酸水溶液涂刷变色材表面做脱色处理后,木材色斑能够消除,则为非微生物变色;而用过氧化氢脱色处理后,色斑能够消除,则为微生物变色。将各种黄藤变色材分别用饱和乙二酸水溶液和15%的过氧化氢水溶液进行涂刷处理,20 min后,观察试材颜色的变化。结果表明:用饱和乙二酸水溶液处理后,蓝变材、褐变材及红变材的颜色变化不大;黄变材则发生明显的漂白脱色现象,变化明显。用过氧化氢水溶液处理后,蓝变材、褐变材及红变材都发生了一定程度的漂白现象,变色有所消除。据此,认为黄藤蓝变材、褐变材及红变材的变色属于微生物引起的变色;而黄变材的变色则是由非微生物引起的化学或者光变色。
2.3 扫描电镜观察扫描电镜观察表明:黄藤黄变材的微观组织结构与正常材一样,没有菌丝或孢子,说明黄藤材的黄变不是由于微生物侵染所致。对黄藤的蓝变材、褐变材和红变材的显微观察(图 1)表明:各变色材的导管和和基本薄壁组织细胞中充满了真菌菌丝体,各种变色菌的菌丝首先进入藤材的大导管中,再从导管入侵旁边的薄壁细胞,菌丝或孢子主要存在于藤材导管和基本薄壁组织细胞中。
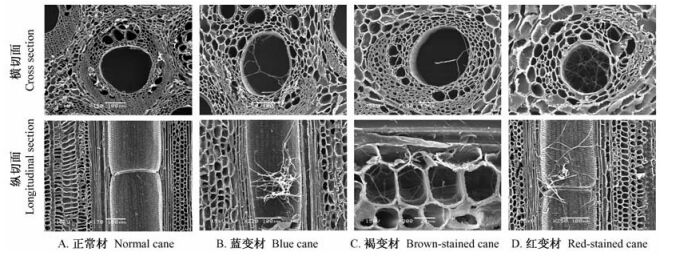
|
图 1 变色黄藤材的扫描电镜观察 Figure 1 The SEM observation of the normal and stained D. margaritae canes |
变色菌在藤材组织内的延伸主要通过纹孔进行。一般情况下,变色菌的穿孔都是机械性的。变色菌的菌丝较粗,但藤材细胞壁无溶蚀现象,菌丝主要通过细胞壁的纹孔,从一个细胞进入另一个细胞。黄藤导管上的纹孔较大,菌丝通过导管细胞壁上的纹孔时,其菌丝大小的变化不明显。
2.4 化学成分分析无论是微生物引起的还是非微生物引起的变色,都会导致藤材组分的相应变化。黄藤正常材和微生物变色材的各项化学成分的分析测试结果见表 1。由表 1可知:黄藤材与木材的化学组成相近,主要由纤维素、半纤维素和木质素组成;但含有比木材更多的水溶物和弱碱液溶解物等抽提物。因此,藤在运输、存放、加工和使用等过程中容易受菌虫等生物或微生物败坏而降低价值(李坚,1999;2002)。
|
|
由表 1可知:黄藤真菌变色材各项抽提物(冷水、热水、1%氢氧化钠和苯醇抽提物)的含量都低于正常材。能溶于热水、冷水的主要藤材成分包括单糖、低聚糖、部分淀粉、果胶、糖醇类和可溶性无机盐等,冷水抽提物含量减少说明变色材的可溶性矿物成分及其他某些糖类的含量减少;热水抽提物含量降低表明变色材中的淀粉和果胶质等含量较少。在稀碱溶液中除了可溶出能被热水、冷水抽提的化合物之外,还有蛋白质、氨基酸等以及部分聚合度较低、支链较多、耐碱性较弱的半纤维素被降解溶出。1% NaOH抽提物含量较低,表明变色材中的蛋白质、氨基酸、半纤维素等物质的含量较正常材少;苯醇抽提物含量降低,表明变色材中的脂肪酸、脂肪烃和萜类化合物等含量减少。综纤维素是指植物纤维原料中纤维素和半纤维素的全部,也即糖类总量。由于变色菌对综纤维素和灰分没有分解或降解作用或作用小,内含物的大量减少使得综纤维素和灰分的相对含量有所增加;同理,变色材的藤芯木质素比正常材高,表明变色菌对藤芯木质素无分解或降解作用或作用小。藤皮的酸不溶木质素有少量减少。在真菌侵染过程中,真菌分泌的酶可能在较小程度上会溶蚀细胞壁的少量多糖类物质,从而使得多戊糖含量有较小程度的增加(吕文华等,2002)。一般认为,变色菌主要是侵蚀细胞的内含物,不会对细胞壁组织造成损害(吕文华等,2002),但真菌变色前后的黄藤材的化学成分分析表明:变色菌在适宜条件下,对藤材细胞壁也存在一定的溶蚀作用。黄藤材受真菌侵染后,各种抽提物大量减少,主成分相对增加,说明变色菌主要侵蚀细胞的内含物,对细胞壁的损害较小。
霉菌和变色菌生长的最适pH值一般都在5 ~ 6左右,微生物可以通过糖类和脂肪代谢产酸、蛋白质代谢产碱以及其他物质代谢产生酸碱,从而改变环境酸碱度,使之更适合微生物生存(张文治,2005)。由于黄藤材材性偏酸,pH值较小(藤芯4.18,藤皮4.32),为了更有利于变色菌生长,变色菌侵染使得藤材pH值增加,变色藤芯增至4.97,变色藤皮增至5.04;同理,真菌的生长需要水分,真菌的菌丝体有一定的保水作用,因而在相同的环境条件下,受真菌侵染的藤材的含水率会比正常材的含水率高。
受真菌侵染后,藤芯各项化学成分的变化比藤皮的相应变化大,说明藤芯受变色菌的影响更大。
2.5 变色菌的分离鉴定和接种从黄藤红变材中分离出了4种变色菌株。黄藤蓝变材与褐变材的分离情况大致相同,各分离出了13种变色菌株;各变色材共计分离得到了15种变色菌株,分别编号为F1 ~ F15。通过形态观测和DNA测序(吕文华等,2009),12种菌株分别鉴定到属或种: F1,F7和F13属曲霉菌(Aspergillus sp.),其中F1为日本曲霉(A.japonicus);F2,F11和F12属青霉菌(Penicillium sp.);F5属毛壳菌(Chaetomium sp.);F6和F9都为可可球色二孢(L. theobromae);F8为长枝木霉(T.longibrachiatum);F15属镰刀菌(Fusarium sp.),其余4种菌株未能明确界定。将15种变色菌株分别接种到健全黄藤材上,定期观测藤片试材的颜色和质量变化,分析结果见表 2。
|
|
对于CIEL* a* b* (1976)系统,色差ΔE* = 1时称为1个NBS色差单位。一个NBS单位(ΔE* = 1)大约相当于视觉色差识别阈值的5倍。NBS单位的色差感觉一般分为6档: 0 ~ 0.5痕迹,0.5 ~ 1.5轻微,1.5 ~ 3.0可察觉,3.0 ~ 6.0可识别,6.0 ~ l2大,12以上非常大(段新芳,2002)。正常材接种各种变色菌株仅仅2周时间,各接种材的总色差值都达到了3个NBS以上,即发生了感觉明显的颜色变化,其中,有6个菌株使藤材的色差达到感觉强烈的6个NBS以上,最大总色差值达19.75个NBS。当正常材接种变色菌4周后,有8个菌株使藤色变化感觉强烈,最大总色差值达28.64个NBS。可见15种变色菌株都使黄藤材发生了明显的颜色变化。接种材的变色与分离变色菌的变色材颜色一致。结合变色菌的分离和培养性状认为:黄藤材的蓝变、褐变及红变等真菌变色主要是由真菌菌丝体的颜色和其所分泌的色素被藤材组分吸收所致。由表 2可知:各变色菌都使黄藤材质量有一定程度减少,但变化量较小。接种4周后,黄藤材质量损失率最大为2.47%,最小仅为0.77%。接种材的质量变化和颜色变化没有明显的相关性。质量损失主要发生于接种变色菌后的2周内,说明变色菌的侵染较快,对藤材主成分的分解或降解能力较弱。
3 结论化学药剂分析和扫描电镜观察结果表明:黄藤材的蓝变、褐变和红变属于由微生物引起的变色,变色材的导管和基本薄壁组织细胞中存在大量菌丝或孢子。
基本化学成分分析结果表明:与正常材相比,黄藤微生物变色材的各项抽提物的含量都较低,含水率、聚戊糖、综纤维素、灰分和pH值则较高;变色菌主要侵蚀细胞内含物,对藤材细胞壁存在较小溶蚀作用;变色材芯部的化学成分变化较皮部的更大,说明藤芯受变色菌的影响比藤皮大。
从黄藤变色材中共计分离得到了15种变色菌株。黄藤正常材接种这些真菌后,质量损失主要发生在2周内,质量损失率较小;但颜色变化较快,变色明显,在2周内造成了感觉明显的色差。接种材变色在一定程度上都与分离相应菌种的变色材颜色相一致。根据变色菌的培养性状,黄藤材的蓝变、褐变和红变等色变主要是由变色菌的菌丝体的颜色和其所分泌的色素引起。
蔡则谟, 许煌灿, 尹光天, 等. 2003. 棕榈藤利用的研究与进展[J]. 林业科学研究, 16(4): 479-487. |
段新芳. 2002. 木材颜色调控技术[M]. 北京: 中国建材工业出版社: 21-25.
|
李坚. 1999. 木材保护学[M]. 哈尔滨: 东北林业大学出版社: 25-38.
|
李坚. 2002. 木材科学[M]. 北京: 高等教育出版社: 322-325.
|
吕文华, 肖绍琼, 木乔英. 2002. 西南桦木材变色的主要原因[J]. 北京林业大学学报, 24(4): 107-110. |
吕文华, 刘君良, 吴玉章, 等. 2009. 黄藤材变色菌的分离和鉴定. 中国林学会木材工业分会木材保护研究会成立25周年庆祝大会暨第七届木材保护学术研讨会论文集, 77 -82 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=xblx201505037&dbname=CJFD&dbcode=CJFQ
|
许煌灿, 尹光天, 曾炳山, 等. 1994a. 黄藤生态生物学特性的研究[J]. 林业科学研究, 7(1): 20-26. |
许煌灿, 尹光天, 曾炳山, 等. 1994b. 黄藤栽塔技术的研究[J]. 林业科学研究, 7(3): 239-246. |
许煌灿, 吴金坤, 尹光天. 1999. 棕榈藤的研究和发展[J]. 世界林业研究, 12(5): 37-42. |
张文治. 2005. 微生物学[M]. 北京: 高等教育出版社: 122-130.
|
Wilcox W W. 1964. Some methods used in studying microbiological deterioration of wood[J]. Forest Service Research Note, 17(2): 63. |
 2011, Vol. 47
2011, Vol. 47


