文章信息
- 冯春富, 严善春, 鲁艺芳, 胡晓
- Feng Chunfu, Yan Shanchun, Lu Yifang, Hu Xiao
- 兴安落叶松诱导抗性对舞毒蛾幼虫解毒酶活性的影响
- Effects of Induced Resistance of Larix gmelinii on the Activities of Detoxifying Enzymes in Lymantria dispar
- 林业科学, 2011, 47(8): 102-107.
- Scientia Silvae Sinicae, 2011, 47(8): 102-107.
-
文章历史
- 收稿日期:2009-12-21
- 修回日期:2010-11-08
-
作者相关文章
植物的诱导抗性是指植物在遭受外界物理、化学以及生物干扰后所表现出来的一种抗性(娄永根等,2000)。利用外源信号化合物和昆虫取食均能够诱导植物产生对害虫有毒、抗营养和抗消化的次生代谢物质,进而影响害虫的生长发育(邓文红等,2009; 桂连友等,2004; 吴莹莹等,2008; 尹姣等,2005; 王立春等,2008)。然而在长期的演化过程中,昆虫与植物之间存在着一种协同进化机制,当植物产生诱导防御物质时,昆虫能够利用自身的解毒系统对摄入体内的有毒物质进行解毒和排毒,这大大降低了诱导抗性在害虫防治过程中的作用强度(王琛柱等,2007)。因此,在研究植物诱导防御与害虫之间作用的关系时,对害虫本身的生理防御机制的研究是必不可少的。目前,对于落叶松诱导抗性与其重要害虫间关系的研究,局限于对害虫产卵选择及趋避行为反应的测定(刘英胜等,2009),而对其生理解毒机制的研究尚未见报道。磷酸酯酶(phosphatase)、羧酸酯酶(carboxylesterase,CarE)、谷胱甘肽S-转移酶(glutathione S-transferases,GSTs)是昆虫体内重要的解毒代谢酶类,参与各种外源毒物的代谢,如水解、氧化、还原、轭合等,从而起解毒作用(Yang et al., 2001),近年来随着植物诱导抗性和有害生物综合防治研究的不断深入,昆虫体内的解毒酶也逐渐受到重视。
兴安落叶松(Larix gmelinii)是我国主要的造林树种之一。为进一步了解不同外源因子对落叶松化学防御的诱导作用,以及对昆虫生长发育的影响,本研究以兴安落叶松及其重要害虫之一舞毒蛾(Lymantria dispar)为研究对象,测定取食不同的外源因子诱导的落叶松后,舞毒蛾幼虫中肠内酸性磷酸酯酶ACP(acid phosphatase)、碱性磷酸酯酶AKP(alkaline phosphatase)、CarE和GSTs 4种解毒酶活性的变化,从生理生化角度了解植物诱导抗性对昆虫生长发育的干扰,以及幼虫的解毒机制,为综合应用植物诱导抗性防御害虫危害提供一定的理论依据。
1 材料与方法 1.1 供试材料选用2年生兴安落叶松苗移植于盆中,恢复生长2个月后备用。舞毒蛾卵块采自东北林业大学哈尔滨实验林场,在温度(25±1)℃、相对湿度(80±1)%、光周期16L: 8D的室内孵化。孵化的舞毒蛾幼虫以兴安落叶松新鲜幼嫩针叶饲喂至3龄备用。
1.2 处理方法 1.2.1 植物材料处理7月末,选用健康、长势一致的落叶松苗,分别进行喷施外源诱导剂及幼虫取食处理。喷施药剂处理:参照Birkett等(2000)和Thaler等(2001)方法,分别配制1 mmol·L-1茉莉酸甲酯和茉莉酮的丙酮水溶液(8 L蒸馏水中含1 mL丙酮),将2种药剂分别喷施在不同的落叶松苗上,每株喷施100 mL。不同化合物处理的落叶松苗以塑料布遮罩,异地放置,防止不同化合物对落叶松产生交互作用,24 h后用于试验。幼虫取食处理:将新蜕皮的落叶松毛虫(Dendrolimus superans)和舞毒蛾3龄幼虫,分别放于不同的落叶松苗上,每株松苗放置5头同种幼虫,外罩纱网,取食24 h后取下幼虫。在所有诱导处理后的松苗上立即接上舞毒蛾饥饿幼虫,用于试虫解毒酶活性测定试验。每种处理各选试验松苗10株,对照松苗不做任何处理。
1.2.2 供试幼虫处理及收集选取新蜕皮的舞毒蛾3龄幼虫,饥饿24 h后移置诱导处理过的落叶松苗枝条上,每株10头舞毒蛾幼虫。选取取食1,3和5天的幼虫,将虫取下,每次取虫25头,置于-80 ℃冰箱备用,以测定舞毒蛾幼虫体内的解毒酶活性。
1.3 供试药品考马斯亮蓝G-250、牛血清白蛋白(BSA)、均为Amresco产品; 还原型谷胱甘肽(GST)、1-氯-2,4-二硝基苯(CDNB)、毒扁豆碱(eserine)、固蓝B盐(Fast blue B salt)均为Sigma公司产品; α-乙酸萘酯(α-NA)、硝基苯基磷酸二钠、SDS(十二烷基硫酸钠)、巴比妥钠,均购自国药集团化学试剂有限公司。
1.4 解毒酶活性测定磷酸酯酶、羧酸酯酶和谷胱甘肽S转移酶的酶源制备和活性测定分别参照Bessey等(1946)、王光峰等(2003)、曹挥等(2003)的方法并略作修改,分别将3种原酶液稀释50,50和200倍,酶活性测定时酶液加入量分别为0.1,0.1和0.2 mL。重复测定3次。
1.5 酶源蛋白质含量测定采用考马斯亮蓝G-250染色法,测定方法参照Bradford(1976)。每种测定重复3次。
1.6 数据统计分析使用SPSS 11.5软件统计酶活性的平均值和标准误,采用one-way ANOVA进行差异显著性分析,以LSD(最小显著法)在0.05和0.01水平下检验与对照之间的差异显著性。
2 结果与分析舞毒蛾幼虫取食不同外源因子诱导的兴安落叶松后,其体内解毒酶活性均受到抑制。但不同因子诱导的落叶松对酶活力的抑制作用存在差异; 相同因子处理落叶松时,幼虫体内不同解毒酶活性随时间的变化趋势也不完全相同。
2.1 不同因子处理的落叶松对舞毒蛾中肠磷酸酯酶活性的影响 2.1.1 酸性磷酸酯酶活性变化舞毒蛾幼虫取食不同因子处理落叶松1~5天后,结果如图 1所示:中肠酸性磷酸酯酶活性均低于对照,差异极显著(P<0.01)。这说明几种因子诱导处理的落叶松对舞毒蛾幼虫体内酸性磷酸酯酶活性均有抑制作用,其中舞毒蛾幼虫取食诱导的松苗对试虫体内酸性磷酸酯酶活性的抑制作用强于其他处理,且与落叶松毛虫及茉莉酸甲酯诱导处理的结果差异极显著(P<0.01);松毛虫幼虫取食诱导的松苗对试虫体内酸性磷酸酯酶活性的抑制作用最弱,舞毒蛾表现出同种不同个体之间具激烈的生存竞争,且其种内竞争大于种间竞争。取食不同因子处理松苗的幼虫体内酸性磷酸酯酶的活性随时间的变化逐渐降低,3天时降低的幅度最大,分别降低了54.54%,35.93%,68.33%,57.31%。在5天时,茉莉酸甲酯的诱导作用对试虫体内酶活性的抑制作用最强,说明其对植物抗性的诱导作用比虫害诱导的速度慢。
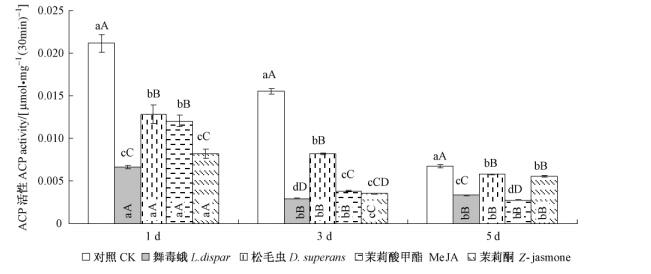
|
图 1 不同因子诱导的落叶松对舞毒蛾幼虫体内酸性磷酸酯酶活性的影响 Figure 1 Impact of ACP activity of L. dispar larva induced by different factors in L. gmelinii 图中数据为平均值±标准误。柱顶部字母表示同一时间段不同处理落叶松对舞毒蛾幼虫体内解毒酶活性影响的差异显著性; 柱底部字母表示试虫取食同种因子处理的落叶松后,体内解毒酶随时间变化的差异(小写字母表示P<0. 05,大写字母表示P<0. 01)。下同。 Columns are mean ± SE. Top letters means significant difference of larva detoxification enzyme which fed larch seedlings subjected to different treatments in the same time. Bottom letters means significant difference of larva detoxification enzyme in different time which fed larch seedlings subjected to the same treatment (small letters: P < 0. 05; capital letters: P < 0. 01). The same below. |
不同因子处理后的落叶松,对舞毒蛾幼虫体内碱性磷酸酯酶活性的影响较为复杂(图 2)。1天时,取食舞毒蛾处理松苗试虫的酶活性被显著诱导增加(P<0.01),其他处理与对照差异不显著; 3天时,试虫体内碱性磷酸酯酶活性均显著低于对照(P<0.01),其中以取食茉莉酸甲酯处理的试虫酶活性最低,与其他处理差异极显著(P<0.01);5天时,除取食松毛虫处理的试虫体内酶活性被诱导增加高于对照外,其他处理的试虫体内酶活性依然显著低于对照,茉莉酸甲酯对试虫体内酶活性依然表现出最强的抑制作用。说明不同因子处理后的落叶松苗,对试虫体内碱性磷酸酯酶的活性表现出较强的抑制作用,但碱性磷酸酯酶的应答速率较酸性磷酸酯酶慢,其中经茉莉酸甲酯处理的松苗对试虫体内酶活性的抑制作用最强。取食不同因子处理松苗的幼虫体内酶活性随时序变化而降低,3天时受抑制明显,分别降低了28.8%,3.38%,50.21%和32.25%,且外源化合物诱导植物抗性对碱性磷酸酯酶活性的抑制作用强于昆虫取食诱导。
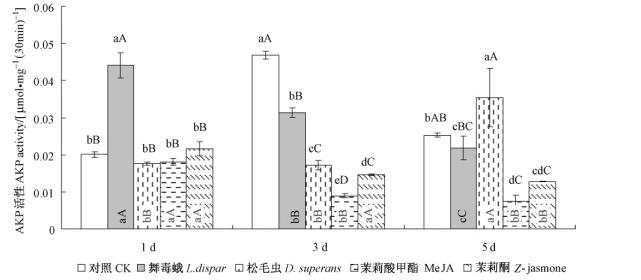
|
图 2 不同因子诱导的落叶松对舞毒蛾幼虫体内碱性磷酸酯酶活性的影响 Figure 2 Impact of AKP activity of L. dispar larva induced by different factors in L. gmelinii |
试虫取食不同处理落叶松苗后,其体内羧酸酯酶活性均受到不同程度的抑制,与对照相比差异极显著(P<0.01)。其中取食舞毒蛾幼虫诱导处理落叶松的试虫,羧酸酯酶活性低于其他处理(图 3); 茉莉酮处理对试虫体内羧酸酯酶活性抑制作用最弱。随着时间的推移,除茉莉酮处理显著下降外,其他处理的幼虫体内羧酸酯酶的活性逐渐升高,但变化不显著,说明舞毒蛾不同个体间相互抑制,有强烈的生存竞争作用,茉莉酮对植物抗性的诱导作用较其他因子诱导速度慢。
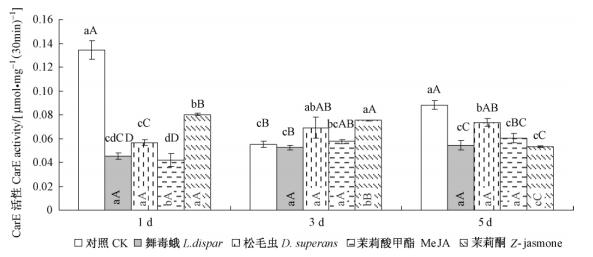
|
图 3 不同因子诱导的落叶松对舞毒蛾幼虫体内羧酸酯酶活性的影响 Figure 3 Impact of CarE activity of L. dispar larva induced by different factors in L. gmelinii |
试虫取食不同因子处理落叶松后,其中肠谷胱甘肽S-转移酶活性变化见图 4。在1天时,除茉莉酸甲酯处理的试虫体内酶活性显著低于对照、松毛虫处理的试虫体内酶活性与对照相近外(P<0.01),其他2种处理的试虫酶活性显著高于对照(P<0.05或0.01)。在3~5天时,茉莉酸甲酯和舞毒蛾取食处理的试虫体内酶活性显著低于对照(P<0.01),另外2种处理的试虫体内酶活性显著高于对照(P<0.05或0.01)。经茉莉酸甲酯处理的试虫体内酶活性显著低于其他处理(P<0.05或0.01)。说明茉莉酸甲酯和舞毒蛾取食处理能够抑制试虫体内谷胱甘肽转移酶的活性。随着处理时间的延长,各处理试虫体内的酶活性都显著增加,其中茉莉酮对试虫酶活性的诱导作用最大。说明茉莉酸甲酯和茉莉酮对试虫体内谷胱甘肽S转移酶活性有相反的诱导效果。

|
图 4 不同因子诱导的落叶松对幼虫体内谷胱甘肽S转移酶酶活性的影响 Figure 4 Impact of GSTs activity of L. dispar larva induced by different factors in Larix gmelinii |
利用生物或非生物因子处理植株,通过信号传导途径,最终诱导植物形成茉莉酸类物质,通过激活体内相应的防御基因,使植物产生蛋白酶抑制素、植物保卫素、次生化合物以及释放挥发物等(吴夏华等,2007),从而增强植物对昆虫正常生长发育的干扰或抑制。昆虫取食外源因子处理的植物后,不可避免地将有毒物质摄入体内,它将启动自身的解毒系统进行解毒。已有的研究表明:昆虫体内解毒酶活性的变化已被视为抗虫性的生理指标,转基因植物抗虫的生理作用就主要表现在解毒酶活性受抑制(郭同斌等,2007); 外源毒物能使幼虫体内解毒酶活性受影响,导致昆虫体内毒物积累而死亡(周琳等,2008)。本研究表明:取食不同因子诱导的落叶松后,试虫体内主要的解毒酶活性受到不同程度的抑制,进而影响其对有毒物质的代谢,这是植物诱导抗虫性的重要生理机制,也是发挥落叶松诱导抗虫性的重要途径之一。
磷酸酯酶是昆虫体内重要的代谢酶系,可参与多种生化反应,在昆虫生长发育及对外源毒物的解毒代谢方面均具有重要的作用。磷酸酯酶还参与转磷基作用,其活性受到抑制,能量代谢所需的磷释放量即下降,会影响昆虫正常的生理活动(Nathan et al., 2005)。本研究中,在取食不同因子诱导的落叶松后,试虫体内酸性磷酸酯酶活性受到显著抑制,碱性磷酸酯酶在1天时显著升高,而后降低至显著低于对照。已有研究表明:将脱氧鬼臼毒素加入小麦(Triticum aestivum)叶片,黏虫取食后明显抑制了其体内酸性磷酸酯酶活性,碱性磷酸酯酶则表现为先诱导后抑制的变化过程(马志卿等,2007),本试验结果与其类似。
羧酸酯酶具有广泛的底物专一性和重叠性,能催化水解脂肪族羧酸酯、芳酸酯及相应的硫代酯等多种化合物,在昆虫解毒的过程中也起着重要作用(李会平等,2007)。本试验结果表明:外源因子诱导落叶松后,对舞毒蛾幼虫体内羧酸酯酶的活性产生十分显著的抑制作用,尤以同种昆虫诱导处理对舞毒蛾幼虫体内羧酸酯酶的抑制作用最明显。这是因为不同诱导方式的作用途径不同,且昆虫口腔分泌物在诱导植物的防御反应中发挥一定作用(殷海娣等,2006; Rose et al., 2005)。有研究表明:昆虫偏爱以前被取食过的植物,二点叶瞒(Tetranychus urticae)对以前取食过的西红柿(Lycopersicon esculentum)植株的选择超过对照和蓟马(Frankliniella occidentalis)危害的西红柿(Pallini et al., 1997); 甜菜夜蛾(Spodoptera exigua)口腔分泌物可诱导植物释放挥发物,并称为诱导素(vollicitin),这些也早已得到证实(Alborn et al., 1997); 这可能是昆虫在取食的过程中口腔分泌物作用在损伤部位抑制了植物的一些防御基因的表达之故(Musser et al., 2002)。舞毒蛾诱导落叶松产生的抗性对同种其他个体解毒作用的影响更直接更迅速,抑制强度更大。茉莉酸是昆虫诱导植物防御反应的重要信号物质,而茉莉酸甲酯可以较轻易地转化为茉莉酸(徐伟等,2005)。茉莉酸甲酯从植物防御系统反应的中间步骤直接进入,启动防御系统,省略了多步信号启动过程,因此表现为茉莉酸甲酯诱导作用迅速,与舞毒蛾幼虫取食诱导作用相近,二者导致试虫体内羧酸酯酶的活性在第1天就差异不显著。而茉莉酮转化为茉莉酸的过程更为复杂,所需时间更多,导致其诱导的抗性对羧酸酯酶的抑制作用启动较慢。
谷胱甘肽S-转移酶是广泛分布于生物体内的一种重要解毒酶,其主要功能是催化某些内源性或外来有害物质的亲电子基团与还原型谷胱甘肽的巯基偶联,增加其疏水性使其易于穿越细胞膜,分解后排出体外,从而达到解毒的目的(杨海灵等,2006)。已有研究显示不同的次生物质对昆虫体内谷胱甘肽S转移酶活性影响不同,某些植物次生物质可抑制谷胱甘肽S转移酶的活性,如苦豆子生物碱(罗万春等,2003); 而某些植物次生物质可激活谷胱甘肽S转移酶的活性,如芸香甙等(董向丽等,1998)。本研究结果表明:取食茉莉酸甲酯和舞毒蛾取食处理落叶松的幼虫体内酶活性显著下降,而取食松毛虫和茉莉酮处理松苗的幼虫体内酶活性有所增加。表明不同诱导因子处理后对次生物质诱导存在差异,导致昆虫取食后产生不同的生理生化反应。在研究植物次生物质对烟青虫(Heliothis assulta)和棉铃虫(Helicoverpa armigera)食物利用及中肠解毒酶活性的影响时发现:用含棉酚、烟碱、番茄苷和辣椒素4种植物次生物质的人工饲料饲养烟青虫和棉铃虫5龄幼虫48 h,番茄苷抑制烟青虫的取食和生长,但对幼虫体内谷胱甘肽转移酶活力没有诱导升高,反而有抑制作用(董钧锋等,2002),表明昆虫种类的不同也会导致昆虫生理代谢的复杂性,因此本研究中不同因子诱导落叶松产生的抗性差异还有待进一步研究。
综合以上4种解毒酶随时间的变化趋势可以看出:舞毒蛾进化出完善的种内竞争机制,在其不同个体间表现出明显的前抑制后生存的竞争作用。植物诱导抗性对昆虫的解毒机制有较强的干扰作用,喷施茉莉酸甲酯对舞毒蛾解毒酶有较强的抑制作用,可以作为一种有效的诱导剂,在害虫治理上具潜在价值和应用前景。从碱性磷酸酯酶及谷胱甘肽S-转移酶的活性变化趋势来看,松毛虫取食诱导落叶松产生的防御反应,有可能更适合舞毒蛾的进一步取食,因此,在林间调查时应对此现象予以关注,加强对轻度松毛虫危害的落叶松林的监管与看护,以预防舞毒蛾的进一步危害。
曹挥, 刘素琪, 王鸿雷, 等. 2003. 万寿菊根提取物对山楂叶螨几种酶活性的影响[J]. 林业科学, 39(2): 114-118. DOI:10.11707/j.1001-7488.20030219 |
邓文红, 沈应柏, 陈华君, 等. 2009. 昆虫取食和药剂熏蒸对马尾松针叶脱落酸和茉莉酸含量的影响[J]. 应用生态学报, 20(5): 1166-1170. |
董钧峰, 张继红, 王琛柱. 2002. 植物次生物质对烟青虫和棉铃虫食物利用及中肠解毒酶活性的影响[J]. 昆虫学报, 45(3): 296-300. |
董向丽, 高希武, 郑炳宗. 1998. 植物次生物质对棉铃虫谷胱甘肽S转移酶和乙酰胆碱酯酶的影响[J]. 植物保护学报, 25(1): 72-78. |
桂连友, 刘树生. 2004. 外源茉莉酸和茉莉酸甲酯诱导植物抗虫作用及其机理[J]. 昆虫学报, 47(4): 507-514. |
郭同斌, 嵇保中. 2007. 转基因杨树对杨小舟蛾幼虫解毒酶活性的影响[J]. 林业科学, 43(5): 59-63. |
李会平, 黄大庄, 纪慧芳, 等. 2007. 取食不同杨树对光肩星天牛幼虫体内羧酸酯酶活性的影响[J]. 林业科学, 43(4): 50-53. |
刘英胜, 严善春, 程红, 等. 2009. 落叶松毛虫对兴安落叶松9种挥发性物质的行为反应[J]. 林业科学, 45(4): 72-77. DOI:10.11707/j.1001-7488.20090412 |
娄永根, 程家安. 2000. 虫害诱导的植物挥发物:基本特性、生态学功能及释放机制[J]. 生态学报, 20(6): 1097-1106. |
罗万春, 张强. 2003. 苦豆子生物碱对小菜蛾体内部分杀虫剂代谢酶活性的影响[J]. 昆虫学报, 46(1): 122-125. |
马志卿, 李广泽, 冯俊涛, 等. 2007. 脱氧鬼臼毒素对粘虫几种代谢酶系的影响[J]. 昆虫学报, 50(2): 186-190. DOI:10.7679/j.issn.2095-1353.2007.039 |
王琛柱, 钦俊德. 2007. 昆虫与植物的协同进化:寄主植物-铃夜蛾-寄生蜂相互作用[J]. 昆虫知识, 44(3): 311-319. DOI:10.7679/j.issn.2095-1353.2007.071 |
王光峰, 张友军, 柏连阳, 等. 2003. 多杀菌素对甜菜夜蛾多酚氧化酶和羧酸酯酶的影响[J]. 农药学学报, 5(2): 40-46. |
王立春, 任琴, 许志春. 苿莉酸甲酯对马尾松松针萜烯类挥发物及马尾松毛虫生长发育的影响[J]. 北京林业大学学报, 30(1): 79-84. |
吴夏华, 胡睦荫, 蔡庭付, 等. 2007. 茉莉酸及其甲酯的代谢与生理功能[J]. 安徽农业科学, 35(14): 4109-4125. DOI:10.3969/j.issn.0517-6611.2007.14.014 |
吴莹莹, 黄凤宽, 韦素美, 等. 2008. 茉莉酸甲酯诱导水稻后对褐飞虱的抗性研究[J]. 广西农业科学, 39(4): 474-477. |
徐伟, 严善春. 2005. 茉莉酸在植物诱导防御中的作用[J]. 生态学报, 25(8): 2074-2082. |
杨海灵, 聂力嘉. 2006. 谷胱甘肽硫转移酶结构与功能研究进展[J]. 成都大学学报, 25(1): 19-24. |
殷海娣, 黄翠虹, 王戎疆., 等. 2006. 昆虫唾液成分在昆虫与植物关系中的作用[J]. 昆虫学报, 49(5): 843-849. |
尹姣, 陈巨莲, 曹雅忠, 等. 2005. 外源化合物诱导后小麦对麦长管蚜和粘虫的抗虫性研究[J]. 昆虫学报, 48(5): 718-724. |
周琳, 马志卿, 张兴, 等. 2008. 雷公藤总生物碱对粘虫生长发育及几种代谢酶系的影响[J]. 昆虫学报, 51(11): 1151-1156. DOI:10.3321/j.issn:0454-6296.2008.11.007 |
Alborn H T, Turlings T C J, Jones T H, et al. 1997. An elicitor of plant volatiles from beet armyworm oral secretion[J]. Science, 276(5314): 945-949. DOI:10.1126/science.276.5314.945 |
Bessey O A, Lowry O H, Brock M J. 1946. Rapid coloric method for determination of alcaline phosphatase in five cubic millimeters of serum[J]. J Biol Chem, 164: 321-329. |
Birkett M A, Campbell C A M. 2000. New roles for cis-jasmone as an insect semiochemical and in plant defense[J]. PNAS, 97(16): 9329-9334. DOI:10.1073/pnas.160241697 |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein-dyebinding[J]. Analytical Biochemistry, 72(1/2): 248-254. |
Musser R A, Hum-Musser S, Sue M, et al. 2002. Caterpillar saliva beats plant defences: a new weapon emerges in the evolutionary arms race between plants and herbivores[J]. Nature, 416: 500-600. |
Nathan S S, Kalaivani K, Murugan K, et al. 2005. The toxicityand physiological effect of neem limonoids on Cnaphalocrocis medinalis(Guenée)the rice leaffolder[J]. Pest Biochem Physiol, 84(2): 113-122. |
Pallini A, Janssen A, Sabelis M W. 1997. Odour-mediated responses of phytophagous mites to conspecific and heterospecific competitors[J]. Oecologia, 110(2): 179-185. DOI:10.1007/s004420050147 |
Rose U S R, Tumlinson J H. 2005. Systemic induction of volatile release in cotton : how specific is the signal to herbivory[J]. Planta, 222(2): 3327-3351. |
Thaler J S, Stout M J, Karban R, et al. 2001. Jasmonate-mediated induced plant resistance affects a community of herbivores[J]. Ecological Entomology, 26(3): 312-324. DOI:10.1046/j.1365-2311.2001.00324.x |
Yang X, Margolies D C, Zhu K Y, et al. 2001. Host plant-induced changes in detoxification enzymes and susceptibility to pesticides in the two-spotted spider mite(Acari : Tetranychidae)[J]. J Econ Entomol, 94(2): 381-387. DOI:10.1603/0022-0493-94.2.381 |
 2011, Vol. 47
2011, Vol. 47

