文章信息
- 胡红玲, 张健, 刘洋, 涂利华, 向元彬
- Hu Hongling, Zhang Jian, Liu Yang, Tu Lihua, Xiang Yuanbin
- 模拟氮沉降对华西雨屏区巨桉林凋落叶分解的影响
- Effects of Simulated Nitrogen Deposition on Leaf Litter Decomposition in a Plantation of Eucalyptus grandis, in a Rainy Region of West China
- 林业科学, 2011, 47(8): 25-30.
- Scientia Silvae Sinicae, 2011, 47(8): 25-30.
-
文章历史
- 收稿日期:2010-10-11
- 修回日期:2011-07-05
-
作者相关文章
2. 马边彝族自治县林业局 乐山 614600
2. Forestry Bureau of Mabian Yi Ethnic Autonomous County Leshan 614600
化石燃料燃烧、氮肥的使用、固氮作物的种植, 以及其他人类活动已经改变了全球氮循环, 加速了活性氮的生成和沉降(Vitousek et al., 1997; Galloway et al., 2002, 2003, 2004)。氮沉降强烈影响陆地上其他元素如碳元素的循环(Gruber et al., 2008)。在模拟氮沉降或施氮试验中发现, 活性氮增加对陆地生态系统凋落物分解有促进作用(Hobbie et al., 2000; Allison et al., 2009)、抑制作用(Prescott, 1995; Magill et al., 1998; Hobbie, 2008)或者没有影响(Hobbie et al., 2000; Johnson et al., 2000; Knops et al., 2007)。
巨桉(Eucalyptus grandis)是发展短周期工业纸浆原料林的主要树种之一, 在世界上种植十分广泛(冯茂松等, 2003), 是世界上栽培面积最大的一种桉树(陈小红等, 2000)。我国于20世纪60年代引种巨桉, 四川自1986年引入巨桉, 经过引种试验, 巨桉已成为四川桉树的主要栽培种(胡天宇等, 1999)。虽然国内外有学者对巨桉人工林林地养分平衡和凋落物分解动态等作了相关研究(Turner et al., 1983; Ribeiro et al., 2002; 刘洋等, 2006; Xiang et al., 2007), 但巨桉凋落物分解对大气氮沉降增加的响应尚未见报道。
本研究通过2年的模拟氮沉降和原位分解试验, 探讨氮沉降持续增加对巨桉凋落叶分解和养分释放过程的影响, 及巨桉凋落叶分解过程中是否存在限制值, 为科学经营管理巨桉人工林提供基础数据和理论依据。
1 研究区概况华西雨屏区是四川盆地西部边缘一个狭长形独特的自然地理单元, 是一个大尺度、复合型的生态过渡带, 也是我国西部地区以阴湿为主要特征的罕见气候地理单元(庄平等, 2002)。研究区位于雅安市青衣江流域二级阶地后缘老板山中部的四川农业大学林场试验站内(103°00'E, 30°08'N), 海拔660 m, 属于中亚热带湿润气候, 处于“华西雨屏”的中心地带, 是四川省多雨中心区之一。该区云雾多, 日照时数少, 雨量充沛, 相对湿度大。年均气温16.1 ℃, ≥ 10 ℃年积温5 231 ℃, 年均无霜期298天; 年均降雨量1 772.2 mm, 年均日照时数1 019.9 h, 全年太阳辐射总量3 640.13 MJ·cm-2。2008年该区域N湿沉降量达到了8.24 g·m-2 (涂利华等, 2009)。土壤为黄壤, pH值为4.7, 表土(0 ~ 20 cm)总碳、总氮、碱解氮、有效磷和速效钾含量分别为14.5 g·kg-1、1.25 g · kg-1、81.87 mg · kg-1、86.60 mg·kg-1和68.36 mg·kg-1。巨桉人工林营造于2003年5月, 造林密度为1 333株·hm-2 (株行距为1.5 m × 5 m)。
2 研究方法2007年10月, 用尼龙网铺于地表收集新鲜凋落叶(近1 ~ 2天凋落), 风干, 称取20.0 g风干叶装入20 cm × 20 cm的尼龙网袋(孔径1 mm)。取9袋样品测定初始化学性质及其含水量。2008年1月, 在巨桉林内选择具有代表性的地段作为氮沉降试验样地。在样地中建立12个3 m × 3 m的样方, 样方之间设>3 m的缓冲带。2008年1月21日, 将准备好的凋落袋置于各样方原有凋落物层表面, 使其自然分解, 每样方放置凋落袋数目为36袋。用NH4NO3进行模拟氮沉降处理, 共设4个水平:对照(CK, 0 g N·m-2a-1)、低氮(5 g N·m-2a-1)、中氮(15 g N·m-2a-1)和高氮(30 g N·m-2a-1), 每个水平3个重复。将各样方年氮施用量分成12等份, 从2008年1月开始(放置凋落袋之后), 每月下旬定量施入对应各样方, 将每份NH4NO3溶解至1 L水中, 用喷雾器在该水平样方中均匀喷洒, 对照只喷洒清水。
从2008年3月开始, 以2个月为间隔期收回凋落叶样品, 每次每样方取3袋(即每水平共取回9袋), 总共分12次取回, 分解时间为22个月。凋落袋取回后, 风干, 除去侵入根系和泥土, 于65 ℃温度下烘干至恒质量, 称干质量并记录。将凋落物样品粉碎过2 mm筛后装袋, 供化学分析使用。凋落物木质素、纤维素含量用酸性洗涤纤维法(acid detergent fiber method) (Rowland et al., 1994)测定。由于测定木质素和纤维素所需样品量较大(>3 g), 而凋落叶分解至第2年时部分样品量过少, 故只测定凋落叶分解第1年该2项指标的含量。全氮采用半微量凯氏法测定(LY/T 1228—1999)。全磷待测液和全钾待测液均采用硫酸-高氯酸消煮法制备(LY/T 1271—1999), 全磷采用钼锑抗比色法测定(LY/T 1270—1999), 全钾用TAS-986原子分光光度计测定(普析公司, 北京)。所有化学分析均作3个重复。巨桉凋落叶初始木质素、纤维素、氮、磷和钾含量分别为422.0, 152.0, 11.6, 0.65和4.86 mg·g-1。
每阶段凋落物质量残留率Rm计算方法为: Rm= X1/X0, X1为该阶段凋落物质量(g), X0为初始凋落物质量(g)。每阶段凋落物各成分残留率RL计算方法为:RL = (C1 × M1)/(C0 × M0), C1为该阶段某成分含量(mg·g-1), M1为该阶段凋落物总干质量(g), C0为某成分初始含量(mg·g-1), M0为初始凋落物质量(g)。
利用SPSS15.0软件(SPSS Inc., USA)对凋落物的质量损失进行拟合, 所采用的模型为Olson负指数衰减模型y =ae-kt, y为质量残留率(%), a为拟合参数, k为年分解系数(kg·kg-1a-1), t为时间(a)。凋落物分解50% (T50%)和95% (T95%)所需时间的计算方法为:T50% =-ln (1-0.50)/k; T95% =-ln (1-0.95)/k(Olson, 1963)。
利用SPSS15.0软件Nonlinear过程非线性渐近模型计算分解限制值。模型如下:Lm = m (1 -e-ki/m), Lm为凋落物无灰分质量损失率(%), m为凋落物分解限制值(%), ki为初始分解速率(以第1次取样期间分解速率计算(Berg et al., 1991)。
利用SPSS15.0软件中的One-Way ANOVA过程对每次取样质量残留率、各成分残留率和限制值进行方差分析, 采用Fisher's LSD法进行多重比较。用SigmaPlot 10.0(Systat Software Inc., USA)软件绘图。除明确说明外, 文中统计显著水平均为P<0.05。
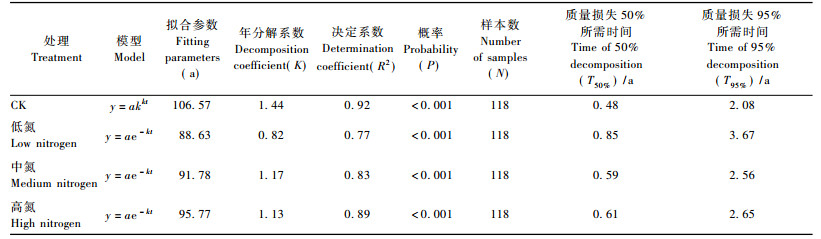
3 结果与分析 3.1 氮沉降对巨桉凋落叶分解的影响对照样方凋落叶的分解代表了巨桉凋落叶的自然分解过程。对照样方巨桉凋落叶质量损失有明显的阶段性(图 1):在分解前8个月, 质量损失达到70%;而在随后的分解过程中, 质量损失率明显降低, 特别是分解至14个月后, 质量损失率接近于零, 分解近乎停止。各氮处理质量损失也呈现出与对照类似的阶段性特点。

|
图 1 凋落叶质量残留率 Figure 1 Mass remaining of leaf litter |
在巨桉凋落叶分解至7个月时, 氮沉降对分解开始表现出显著的抑制作用, 并且一直持续到分解后期。各处理凋落叶质量残留率均呈现出极显著(P<0.01)指数衰减过程(图 2)。利用Olson模型求得的分解系数表现为低氮<高氮<中氮<对照。对照、低氮、中氮和高氮处理的凋落叶质量损失95%所需时间分别为2.08, 3.67, 2.56和2.65年(表 1)。在3个氮处理中, 低氮处理对凋落叶分解的抑制作用最为明显, 分解7个月后所有阶段低氮处理质量残留率均显著高于对照(P<0.05)。分解至22个月时, 对照和低氮处理的质量残留率分别为10.3% ± 1.2%和28.1% ± 9.8%。低氮处理使得凋落叶质量损失95%所需时间增加了1.6年。中氮和高氮处理样方中, 凋落物质量残留率在绝大部分时间段内均高于对照, 并在部分时间段达到显著水平。
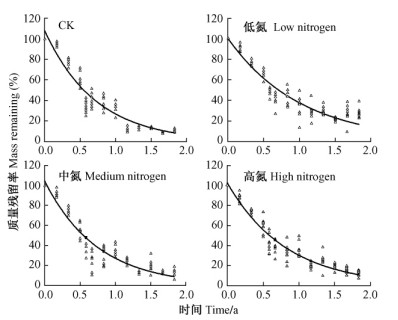
|
图 2 凋落叶质量残留率与时间的指数回归关系(Olson模型) Figure 2 Experimental regression relationships between mass remaining and time(Olson's model) |
|
|
利用非线性渐近模型计算得到对照、低氮、中氮和高氮样方凋落叶分解限制值分别为90.1% ± 2.4%, 72.3% ± 3.1%, 87.2% ± 3.2%和85.6% ± 3.5%, 低氮处理限制值显著低于对照, 其余处理与对照差异不显著。
3.2 氮沉降对巨桉凋落叶木质素和纤维素分解的影响在凋落叶质量快速损失的分解初期(前7个月), 各处理凋落物木质素含量上升, 而这一过程结束后木质素含量缓慢下降(图 3)。与木质素不同, 纤维素含量在前12个月分解过程中, 基本呈稳步减少状态。木质素和纤维素绝对残留率均随着凋落叶质量损失而减少。在前12个月分解过程中, 各处理木质素残留率均大于对照。低氮处理纤维素残留率从分解7个月开始显著大于对照, 分解至第12个月时, 3个氮处理凋落叶纤维素残留量均显著高于对照。木质素和纤维素作为巨桉凋落叶最重要的2种成分, 与凋落叶质量损失模式一致, 氮沉降主要通过抑制2者分解来抑制巨桉凋落叶分解。
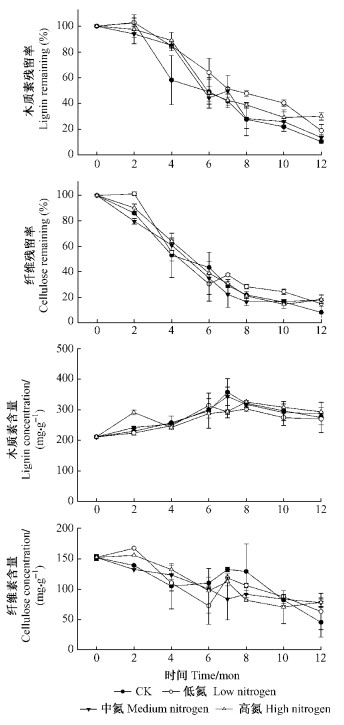
|
图 3 木质素和纤维素质量残留率和含量 Figure 3 Mass remaining and content of lignin and cellulose |
巨桉凋落叶在分解过程中, 全氮含量和全钾含量呈明显的波动状态, 而全磷含量基本保持稳定。3种元素的残留率均随质量残留率减少而减少, 在分解至14个月后, 3种元素的损失速率明显降低。总体来看, 氮沉降对3种元素的释放过程没有显著的影响(图 4)。
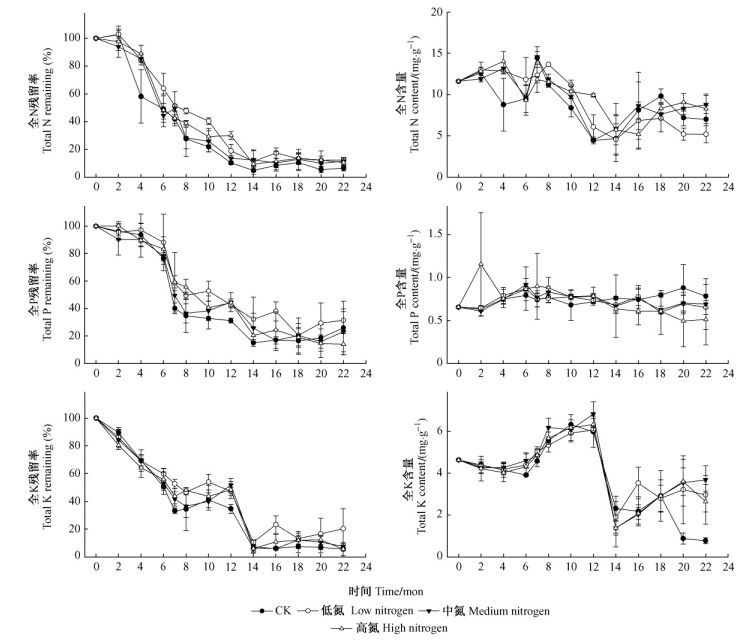
|
图 4 全N, 全P和全K的残留率和含量 Figure 4 Mass remaining and content of tolal N, tolal P, and tolal K |
通常来说, 凋落物分解具有阶段性, 在不同阶段质量损失的主导因素不同。在分解初期有一个质量损失较快的淋溶期, 表现为凋落物中可溶性成分如糖类和氨基酸等的分解, 随着分解进行, 抗分解物质如木质素等的相对含量增加, 凋落物分解速率降低, 甚至停滞(Magill et al., 1998)。在许多长期跨气候区的凋落物分解试验中也发现了凋落物分解的阶段性特点(Parton et al., 2007)。以往研究表明, 巨桉凋落叶分解初期速率较快, 刘洋等(2006)研究发现, 巨桉凋落叶分解第1年质量损失率为36%, Ribeiro等(2002)发现在分解317天后, 巨桉凋落叶质量损失率约35%。本研究发现巨桉凋落叶分解至14个月时质量损失率达70%, 这可能与华西雨屏区降雨量大、空气湿度高、土壤湿度大有关。在随后的分解过程中, 分解速率明显降低, 接近于稳定状态。同样, 氮、磷、钾元素的释放也呈现这一阶段性模式, 在分解的第1年, 3种元素已释放了大部分, 而进入第2年分解过程, 该3种元素的释放变得十分缓慢。
巨桉凋落叶分解可能存在限制值, 在分解14— 22个月时, 各处理凋落叶质量损失极其微弱, 残留的凋落叶在这一阶段处于较稳定状态。自然状态下, 巨桉凋落叶分解限制值大约为90%, 而氮沉降使得这一限制值降低, 并且低氮时可降低至72%左右, 与对照差异显著(P<0.05)。与本研究结果类似, Berg(2000)对苏格兰松(Pinus sylvestris)和挪威云杉(Picea abies)长期施氮试验表明, 施氮显著降低了苏格兰松凋落叶分解限制值。
本研究发现, 氮沉降显著抑制了凋落物分解, 并且低氮处理抑制作用最为明显, 这与以往许多模拟氮沉降或施氮试验研究结果一致(Magill et al., 1998; Fang et al., 2007; Hobbie, 2008; Carreiro et al., 2000), 这些研究发现增加的氮抑制了凋落物后期的分解。Knorr等(2005)分析了全球氮沉降或施氮试验中凋落物分解响应方式, 结果表明凋落物分解对氮增加的响应取决于3个因素:凋落物基质质量(化学特性)、背景氮沉降量和施氮量。通常来说, 低氮沉降背景样地或高质量凋落物(木质素含量低或氮含量高)分解受氮沉降促进(Knorr et al., 2005), 而具有较高背景氮沉降水平的样地(Knorr et al., 2005)或凋落物基质质量较差时(Magill et al., 1998; Waldrop et al., 2004; 2006; Berg et al., 1997; Knorr et al., 2005; Manning et al., 2008), 凋落物分解过程易受氮沉降抑制。本研究发现, 巨桉凋落叶分解受氮沉降抑制的主要原因在于氮抑制了凋落物最主要的2种成分木质素和纤维素的分解。这一现象在许多同类研究中也有发现(Magill et al., 1998; Berg et al., 1997)。这可以解释为在凋落物分解后期, 木质素分解中间产物与无机氮会结合生成抗分解物质(Magill et al., 1998)。本研究中, 巨桉凋落叶木质素含量较高(42%), 因此, 外源无机氮的增加会使得抗分解物质生成的机会增多。凋落物分解后期, 木质素等物质的分解通常需要特定的微生物如担子菌(Basidiomycetes)分泌特定的分解酶才能完成。有研究表明, 无机氮的增加抑制了这类酶的合成(Carreiro et al., 2000; Waldrop et al., 2004; Sinsabaugh, 2010), 从而抑制了木质素的分解。同时, 凋落物中纤维素通常受木质素聚合体的保护(Berg et al., 2006), 因此木质素分解的减慢也会使得纤维素的分解受阻。
本研究发现, 在分解至14个月时, 凋落叶氮、磷、钾释放率分别大于80%, 60%和80%, 在随后的分解过程中对照与处理之间该3种元素残留率基本无显著差异。因此, 氮沉降对巨桉凋落叶分解过程的养分释放并无影响。从新鲜凋落物到腐殖质的转化是一个长期过程, 涉及到很多生物和非生物过程, 因此, 氮沉降对巨桉凋落物分解过程的长期影响有待进一步研究。
陈小红, 胡庭兴, 李贤伟, 等. 2000. 四川省巨桉生长状况调查与发展前景分析[J]. 四川林业科技, 21(4): 23-26. |
冯茂松, 张健. 2003. 巨桉纸浆原料林施肥效应研究[J]. 四川农业大学学报, 21(3): 221-226. |
胡天宇, 李晓清. 1999. 巨桉引种栽培及适生区域研究[J]. 四川林业科技, 1999. |
刘洋, 张健, 冯茂松. 2006. 巨桉人工林凋落物数量、养分归还量及分解动态[J]. 林业科学, 42(7): 1-10. |
涂利华, 胡庭兴, 黄立华, 等. 2009. 华西雨屏区苦竹林土壤呼吸对模拟氮沉降的响应[J]. 植物生态学报, 33(4): 728-738. |
庄平, 高贤明. 2002. 华西雨屏带及其对我国生物多样性保育的意义[J]. 生物多样性, 10(3): 339-344. |
Allison S D, LeBauer D S, Ofrecio M R, et al. 2009. Low levels of nitrogen addition stimulate decomposition by boreal forest fungi[J]. Soil Biology & Biochemistry, 41(2): 293-302. |
Berg B. 2000. Initial rates and limit values for decomposition of Scots pine and Norway spruce needle litter:a synthesis for N-fertilized forest stands[J]. Canadian Journal of Forest Research, 30(1): 122-135. DOI:10.1139/x99-194 |
Berg B, Ekbohm G. 1991. Litter mass loss rates and decomposition patterns in some needle and leaf litter types[J]. Long-term decomposition in a Scots pine forest Ⅶ.Canadian Journal of Botany, 69(7): 1449-1456. |
Berg B, Laskowski R.2006.Litter decomposition:a guide to carbon and nutrient turnover.Burlington, USA:Elsevier Ltd.
|
Berg B, Matzner E. 1997. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems[J]. Environmental Reviews, 5(1): 1-25. DOI:10.1139/a96-017 |
Carreiro M M, Sinsabaugh R L, Repert D A, et al. 2000. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition[J]. Ecology, 81(9): 2359-2365. DOI:10.1890/0012-9658(2000)081[2359:MESELD]2.0.CO;2 |
Fang H, Mo J, Peng S, et al. 2007. Cumulative effects of nitrogen additions on litter decomposition in three tropical forests in southern China[J]. Plant and Soil, 297(1/2): 233-242. |
Galloway J N, Aber J D, Erisman J W, et al. 2003. The nitrogen cascade[J]. Bioscience, 53(4): 341-356. DOI:10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2 |
Galloway J N, Cowling E B. 2002. Reactive nitrogen and the world:200 years of change[J]. Ambio, 31(2): 64-71. DOI:10.1579/0044-7447-31.2.64 |
Galloway J N, Dentener F J, Capone D G, et al. 2004. Nitrogen cycles:past, present, and future[J]. Biogeochemistry, 70(2): 153-226. DOI:10.1007/s10533-004-0370-0 |
Gruber N, Galloway J N. 2008. An earth-system perspective of the global nitrogen cycle[J]. Nature, 451: 293-296. DOI:10.1038/nature06592 |
Hobbie S E. 2008. Nitrogen effects on decomposition:a five-year experiment in eight temperate sites[J]. Ecology, 89(9): 2633-2644. DOI:10.1890/07-1119.1 |
Hobbie S H, Vitousek P M. 2000. Nutrient limitation of decomposition in Hawaiian forests[J]. Ecology, 81(7): 1867-1877. DOI:10.1890/0012-9658(2000)081[1867:NLODIH]2.0.CO;2 |
Johnson D W, Cheng W, Ball J T. 2000. Effects of CO2 and N fertilization on decomposition and N immobilization in ponderosa pine litter[J]. Plant and Soil, 224(1): 115-122. DOI:10.1023/A:1004606901550 |
Knops J M H, Naeem S, Reich P B. 2007. The impact of elevated CO2, increased nitrogen availability and biodiversity on plant tissue quality and decomposition[J]. Global Change Biology, 13(9): 1960-1971. DOI:10.1111/gcb.2007.13.issue-9 |
Knorr M, Frey S D, Curtis P S. 2005. Nitrogen additions and litter decomposition:a meta-analysis[J]. Ecology, 86(12): 3252-3257. DOI:10.1890/05-0150 |
Magill A H, Aber J D. 1998. Long-term effects of experimental nitrogen additions on foliar litter decay and humus formation in forest ecosystems[J]. Plant and Soil, 203(2): 301-311. DOI:10.1023/A:1004367000041 |
Manning P, Saunders M, Bardgett R D, et al. 2008. Direct and indirect effects of nitrogen deposition on litter decomposition[J]. Soil Biology & Biochemistry, 40(3): 688-698. |
Olson J S. 1963. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 44(2): 322-331. DOI:10.2307/1932179 |
Parton W, Silver W L, Burke I C, et al. 2007. Global-scale similarities in nitrogen release patterns during long-term decomposition[J]. Science, 315(5810): 361-364. DOI:10.1126/science.1134853 |
Prescott C E. 1995. Does N availability conrol rates of litter decomposition in forests[J]. Plant and Soil, 168-169(1): 83-88. DOI:10.1007/BF00029316 |
Ribeiro C, Madeira M, Araujo M C. 2002. Decomposition and nutrient release from leaf litter of Eucalyptus globulus grown under different water and nutrient regimes[J]. Forest Ecology and Management, 171(1/2): 31-41. |
Rowland A P, Roberts J D. 1994. Lignin and cellulose fractionation in decomposition studies using acid-detergent fiber methods[J]. Communications in Soil Sciences and Plant Analysis, 25(3/4): 269-277. |
Sinsabaugh R L. 2010. Phenol oxidase, peroxidase and organic matter dynamics of soil[J]. Soil Biology & Biochemistry, 42(3): 391-404. |
Turner J, Lambert M J. 1983. Nutrient cycling within a 27-year-old Eucalyptus grandis plantation in New South Wales[J]. Forest Ecology and Management, 6(2): 155-168. DOI:10.1016/0378-1127(83)90019-1 |
Vitousek P M, Aber J D, Howarth R W, et al. 1997. Human alteration of the global nitrogen cycle:sources and consequences[J]. Ecological Applications, 7(3): 737-750. |
Waldrop M P, Zak D R. 2006. Response of oxidative enzyme activities to nitrogen deposition affects soil concentrations of dissolved organic carbon[J]. Ecosystems, 9(6): 921-933. DOI:10.1007/s10021-004-0149-0 |
Waldrop M P, Zak D R, Sinsabaugh R L, et al. 2004. Nitrogen deposition modifies soil carbon storage through changes in microbial enzymatic activity[J]. Ecological Applications, 14(4): 1172-1177. DOI:10.1890/03-5120 |
Xiang W, Bauhus J. 2007. Does the addition of litter from N-fixing Acacia mearnsii accelerate leaf decomposition of Eucalyptus globulus[J]. Australian Journal of Botany, 55(5): 576-583. DOI:10.1071/BT06083 |
 2011, Vol. 47
2011, Vol. 47