文章信息
- 潘欣, 张健, 朱天辉, 梁洪萍
- Pan Xin, Zhang Jian, Zhu Tianhui, Liang Hongping
- 巨桉林下马勃分子系统发育的关系
- Analysis of Puffballs'Phylogenetic Relationships from Eucalyptus grandis Forest
- 林业科学, 2011, 47(5): 68-75.
- Scientia Silvae Sinicae, 2011, 47(5): 68-75.
-
文章历史
- 收稿日期:2010-05-01
- 修回日期:2010-10-02
-
作者相关文章
2. 成都理工大学地球科学学院 成都 610059
2. College of Earth Science, Chengdu University of Technology Chengdu 610059
马勃种类繁多,为重要的外生菌根菌,对人工林的营造具有重要意义(黄勇等,2008; 赵会珍等,2007; 郑来友,2003)。朱天辉等(2001a)报道桉树(Eucalyptus spp.)林下外生菌根主要有多根硬皮马勃(Scleroderma polyrhizum)、光硬皮马勃(S. cepa sp)、大孢硬皮马勃(S. bovista)、黄梗硬皮马勃(S.citrinum)及大秃马勃(Calvatia gigantea)等。人工接种马勃类真菌能使桉树幼苗形成菌根,可有效促进桉树生长(黄勇等,2008; 郑来友,2003)。马勃幼时可以食用,其天然产物种类丰富,某些代谢产物具有很高的应用研究价值,同时亦是一类常见的用于消肿、解毒、止血及抗癌等功用的药用真菌。Kawahara等(1995)从Calvatia sp.中分离得到2种甾类化合物胆固醇A和B。Nedelcheva等(2007)利用TLC及GC-MS技术从Bovista plumbea,Calvatia utriformis,Lycoperdon perlatum和L. pyriforme等马勃中检测到了27种脂肪酸,首次发现了3种异构同质的十六碳烯酸。国内学者也对此进行了研究,陈丽等(2005)从橙黄硬皮马勃子实体提取物中得到一种具有抑菌活性的非蛋白氨基酸,通过波谱分析鉴定为N,N-二甲基苯丙氨酸(N,Ndimethyl-phenylalanine)。龚先玲等(2005)从多根硬皮马勃子实体中分离出3个含氮化合物,根据化学和光谱数据,结构分别确定为: N,N-dimethylphenylalanine(1),2-N,N,N-trimethyl-phenylalanine(2),2-trimethyl-ammonio-3-(3-indolyl)propionate(3)。综上可见,马勃不仅发挥着重要的生态学意义,亦具有广阔的应用开发前景。
四川省内巨桉(Eucalyptus grandis)人工林下马勃种类丰富,且多数能与巨桉形成外生菌根,对于维护巨桉人工林生态系统的稳定发挥了积极的作用,但目前国内对其在人工林地中的生态学价值及其开发利用还缺乏较为系统的研究。本试验采集了四川省不同地区巨桉林下马勃类子实体,培养其菌丝体,克隆其rDNA-ITS区序列并测序,首次构建了马勃的系统发育树,从而为研究巨桉林生态系统稳定及外生菌根的开发利用奠定基础。
1 材料与方法 1.1 野外采集及鉴定马勃样品采集时间为每年5—9月份,采集地为四川省眉山、乐山、宜宾、泸州、彭山及雅安等地巨桉林下,采集时记录马勃子实体形态、大小、颜色、聚生情况及生境特征等,样品采集后用冰袋封存,6 h内送实验室鉴定及培养。
1.2 鉴定及培养室内对采集回来的子实体及孢子形态进行观测和镜检,结合野外调查记录和分类参考资料初步确定马勃种类(卯晓岚,2000;袁明生等,2000)。马勃菌丝体培养采取如下步骤:选取新鲜的马勃子实体,去掉表面泥土,用无菌水及75%乙醇进行表面消毒,主要选取植物根部菌丝束、子实体内部组织及孢子分离培养,组织可剪成约0.5 cm×0.5 cm×0.5 cm见方的小菌块,用1 g·L-1浓度的升汞溶液消毒2 min,75%乙醇溶液中浸泡1 min,无菌水冲洗数次后,移入含链霉素的PDA培养基,置培养箱内分别于25 ℃条件下恒温培养,纯化后保存。纯培养物接种于100 mL PDA液体培养基,25 ℃条件下160 r·min-110~15天为外生菌根培养液,在巨桉幼苗移栽时接种,方法为在每株幼苗根部周围以浇灌方式施入,其他管理按常规方式进行。
1.3 总DNA提取分别提取子实体及菌丝体DNA,采用改良二次沉淀法(潘欣,2004)。马勃子实体先用灭菌蒸馏水洗净,再用75%无水乙醇冲洗2~3次,灭菌蒸馏水除去残余乙醇后备用。菌丝体样品可10 000 r·min-1离心5 min收集,用灭菌双蒸水冲洗2~3次,尽量吸干水分,剩余样品可保存于-20 ℃。
1.4 ITS区PCR扩增、克隆及测序采用真菌通用引物ITS4和ITS5,其序列如下:ITS4(5'—3'): TCCTCCGCTTATTGATATGC,ITS5(5'—3'): GGAAGTAAAAGTCGTAACAAG。PCR扩增体系50 μL,包括超纯水40.5 μL,10×Buffer5.0 μL,10 mmol·L-1 dNTP 1.0 μL,ITS4和ITS5各1.0 μL,模板DNA 1.0 μL,Taq plus DNA聚合酶0.5 μL。每个反应为30个循环,每个循环包括95 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,首次循环先在95 ℃预变性3 min,最后一次循环后在72 ℃延伸7 min,扩增产物经1%琼脂糖凝胶电泳后用凝胶成相系统(BIO-RAD)观察并保存。用天根生化科技(北京)有限公司小量胶回收试剂盒及连接试剂盒,完成回收纯化及连接。氯化钙法制备新鲜的大肠杆菌感受态细胞,将重组质粒DNA转入感受态细胞JM109,取适量菌液涂布于Amp(100μg·mL-1)抗性平板上,37 ℃培养16~24 h。进行菌落PCR鉴定,反应体系与条件同前。筛选阳性菌落于37 ℃穿刺培养16~18 h后,将样品送上海生工生物工程技术服务有限公司测序,并利用BLAST(basic local alignment search tool)软件(http://www.ncbi.nlm.nih.gov/BLAST/)进行比对分析。
1.5 马勃ITS区序列分析及系统发育将测序ITS区序列在GenBank中BLAST比对,选取GenBank中相关序列,利用DNAstar软件分析ITS区序列特征,用Clustal X(ftp://ftp-igbmc.ustrasbg.fr/pub/ClustalX/)对ITS区序列不同基因片段进行比对对齐,ITS区序列结构见图 1。以MEGA 4(http://www.megasoftware.net/)分析序列的碱基组成及计算遗传距离等,构建Neighbor-joining树,Kimura双参数法计算核酸距离,bootstrap=1 000。
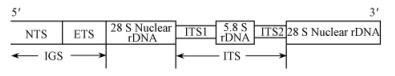
|
图 1 ITS区示意 Figure 1 The sketch map of ITS region |
根据形态特征及ITS序列结果鉴定马勃种类主要有以下几种:大秃马勃、白刺马勃(Lycoperdonwrighti)、草地横隔膜马勃(Vascellum pretense)、橙黄硬皮马勃(Scleroderma citrinum)、金黄硬皮马勃(S.aurantium)、大孢硬皮马勃(S. bovista)、多根硬皮马勃及3个待定种硬皮马勃Scleroderma sp. 11-1、Scleroderma sp. 2-2和Scleroderma sp. 5-2(编号为菌株号,下同)。其中白刺马勃、草地横隔膜马勃及金黄硬皮马勃为巨桉林下国内首次发现并报道,部分种类见图 2。

|
图 2 部分马勃种类 Figure 2 The partial species of puffballs a:大秃马勃C. gigantea; b:橙黄硬皮马勃S. citrinum; c:大孢硬皮马勃S. bovista; d:白刺马勃L. wrightii; e:豆包菌P. tinctorius; f:草地横膜马勃V. pratens. |
根据菌丝培养特性,比较子实体与菌丝ITS区序列,橙黄硬皮马勃等6种马勃菌丝体培养成功,其余菌丝体均被证明不是原子实体所属物种,因此马勃的培养条件仍需摸索。显微镜下观察橙黄硬皮马勃菌丝无隔,无色,多分枝,孢子球形,直径8 ~13 μm; 白刺马勃菌丝有隔,无色,分枝少,未观测到孢子; Scleroderma sp. 11-1菌丝有隔,较粗,无色,分枝少,未观测到孢子; 多根硬皮马勃菌丝无隔,无色,分枝少,孢子椭圆形,直径6~10 μm; Scleroderma sp. 2-2菌丝有隔,无色,分枝少,未观测到孢子。由此可见,不同种马勃菌丝特征不一。培养橙黄硬皮马勃9-3B、多根硬皮马勃11-3及3个待定种硬皮马勃Scleroderma sp. 11-1、Scleroderma sp.2-2和Scleroderma sp. 5-2菌液接种巨桉幼苗后,均可产生外生菌根(图 3)。
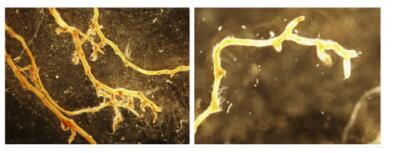
|
图 3 接种外生菌根后巨桉根部的菌丝形态(以Scleroderma sp. 2-2为例) Figure 3 The ectomycorrhizae after inoculated cultivatedmycelium(Scleroderma sp. 2-2 as an example) |
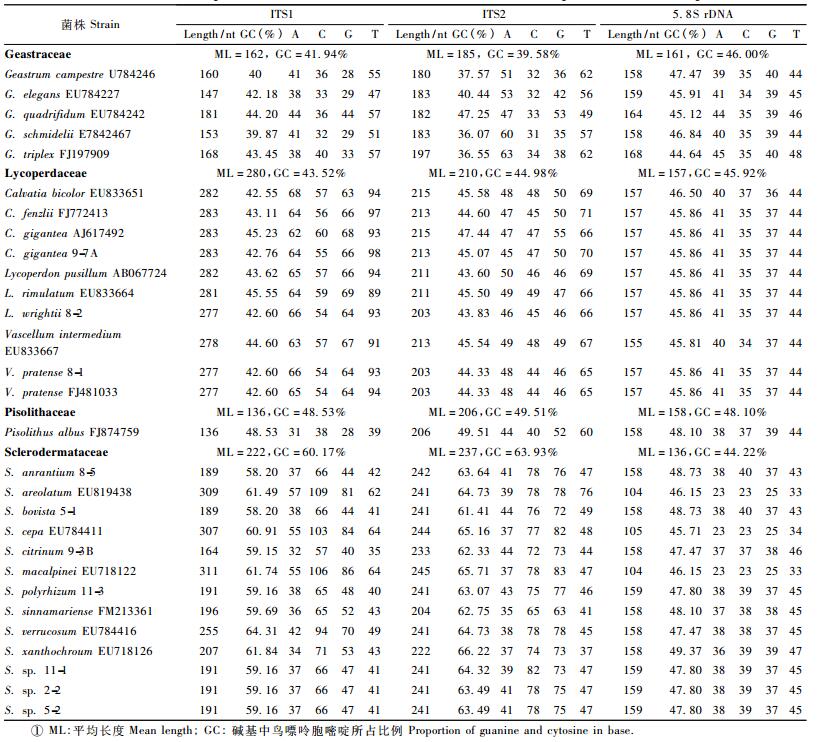
使用通用ITS引物对马勃总DNA进行扩增,在600~750 bp附近得到明亮而清晰的条带,测序后分析其序列特征。将序列在GenBank中注册,序列号如下:大秃马勃HM237179、白刺马勃HM237177、草地横隔膜马勃HM237178、橙黄硬皮马勃HM237176、金黄硬皮马勃HM237174、大孢硬皮马勃HM237175、多根硬皮马勃HM237173及3个待定种硬皮马勃Scleroderma sp. 11-1 HM237170,Scleroderma sp. 2-2 HM237171和Scleroderma sp.5-2 HM237172。GenBank(http://www.ncbi.nlm.nih.gov/)中下载马勃ITS区序列,与本研究种类比较,结果表明不同种类马勃ITS区长度不等,秃马勃属(Calvatia)766 bp,其中大秃马勃766 bp; 地星属(Geastrum)607~610 bp; 马勃属(Lycoperdon)750 ~763 bp,其中白刺马勃750 bp; 硬皮马勃属(Scleroderma)668~704 bp,其中橙黄硬皮马勃668 bp、金黄硬皮马勃701 bp、大孢硬皮马勃700bp、多根硬皮马勃703 bp、待定种硬皮马勃Scleroderma sp. 11-1 703 bp、Scleroderma sp. 2-2703 bp和Scleroderma sp. 5-2 704 bp; 横膜马勃属(Vascellum)750 bp,其中草地横隔膜马勃750 bp。
ITS1区差异较大,平均长度在136~280 bp之间,秃马勃属、马勃属及横膜马勃属平均最长,且相对一致(277~283 bp),豆包菌最短,其中硬皮马勃属ITS1长度变化较大,在164~331 bp之间。硬皮马勃属GC含量最高,达到60.17%,地星属、秃马勃属及马勃属差异较小,在41%左右。
ITS2区平均长度在185~237 bp之间,硬皮马勃属平均最长,秃马勃属、马勃属及横膜马勃属其次,豆包菌最短,各属内长度变化不大。硬皮马勃属GC含量依旧较高,达到64.93%,秃马勃属、马勃属及横膜马勃属其次,平均为44.98%。
5.8 S区相对保守,长度在158 bp左右,仅S. cepa EU784411,S. macalpinei EU718122较短,长度为104bp,各属平均GC含量较为一致,在44.22%~48.10%之间。ITS区不同区域长度、GC含量等见表 1。
|
|
生物信息学软件分析表明,马勃种类多样性及差异主要体现在18S rDNA的5'端与28S rDNA的3'端之间的ITS(ITS1、ITS2)中度保守区域,在比对结果(图 4)ITS1的方框区域硬皮马勃属序列缺失,ITS2的方框区域秃马勃属、马勃属及横膜马勃属序列缺失,因此可设计引物进行马勃不同属间的PCR鉴定。

|
图 4 培养马勃rDNA-ITS区序列 Figure 4 The sequences of the puffballs rDNA-ITS regions |
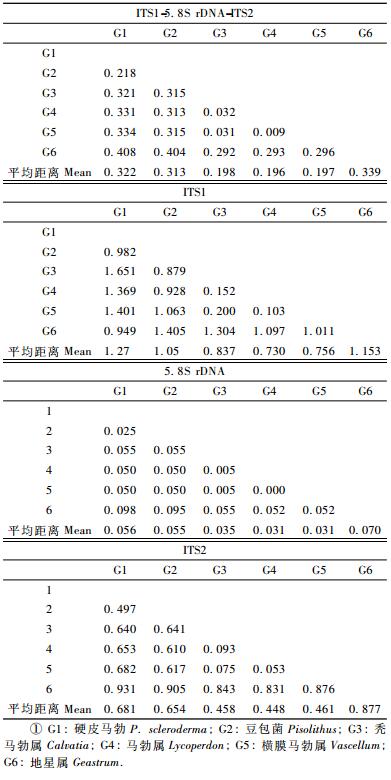
用Mega进行遗传距离计算(表 2),马勃ITS1-5.8S rDNA-ITS2,ITS1,5.8S rDNA及ITS2序列平均遗传距离以地星属最大,硬皮马勃属、豆包菌其次,秃马勃属、马勃属及横膜马勃属之间的遗传距离最小(除了ITS1硬皮马勃属的1.27略大于地星属的1.153)。
|
|
基于ITS1-5.8S rDNA-ITS2区全序列构建的系统发育树表明,马勃形成2个进化组(图 5A),硬皮马勃属、豆包菌聚为1组,形成2个分支,其中硬皮马勃属聚成1支,bootstrap值达99%,豆包菌单独一支; 地星属、秃马勃属、马勃属、横膜马勃属聚为1组,形成2个分支,其中地星属以99%支持度聚在一起,秃马勃属、马勃属与横膜马勃属以100%支持度聚在一起,属间bootstrap值支持率高。
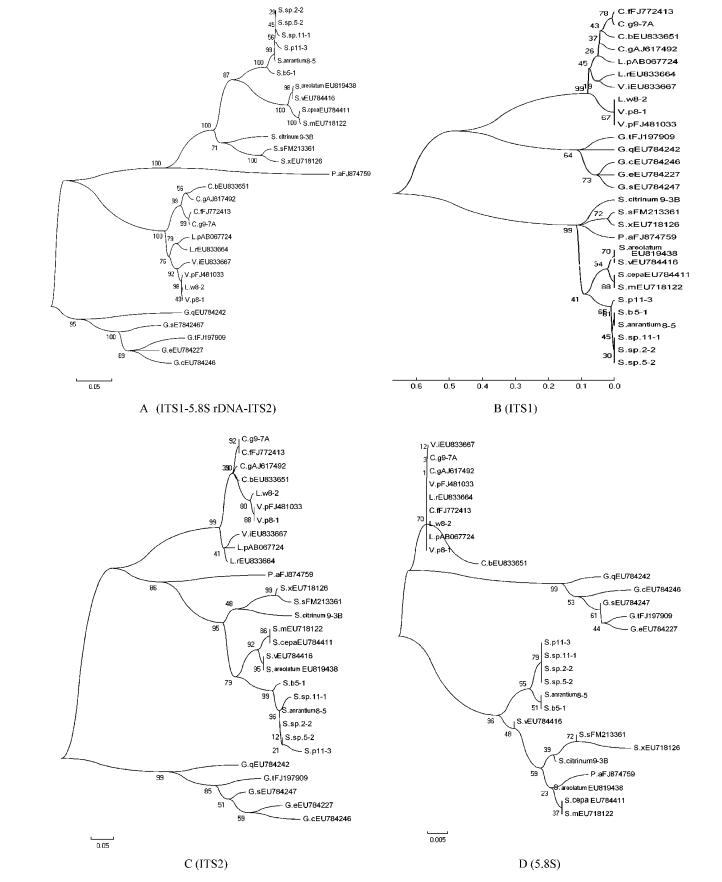
|
图 5 基于rDNA-ITS不同区域的系统发育树 Figure 5 The phylogenetic tree based on sequence of rDNA-ITS regions |
基于ITS1序列构建的系统发育树表明,马勃形成2个进化组(图 5B),硬皮马勃属、豆包菌聚为1组; 另1组中,地星属单独分支,bootstrap值仅为64%,秃马勃属、马勃属、横膜马勃属单独分支,单分支中(属内)bootstrap值支持率不高。
基于ITS2序列构建的系统发育树表明,马勃形成2个进化组(图 5C),地星属聚为1组; 另1组中,豆包菌单独一支,硬皮马勃属单独一支,秃马勃属、马勃属、横膜马勃属单独一支,各属内种之间具有较好的分化且bootstrap值支持率高。
基于5.8S序列构建的系统发育树表明,马勃形成2个进化组(图 5D),其具体分支情况同图 9B,硬皮马勃属,秃马勃属、马勃属、横膜马勃属属内bootstrap值支持率均不高。
综上所述,硬皮马勃属、豆包菌亲缘关系较近,秃马勃属、马勃属、横膜马勃属之间亲缘关系近; 3个待定种硬皮马勃Scleroderma sp.11-1、Scleroderma sp.2-2和Scleroderma sp.5-2与金黄硬皮马勃在同一分支中。利用ITS1-5.8S rDNA-ITS2标记建立属间发育树支持度较高,ITS2区信息可用于分析属内差异。
3 结论与讨论马勃类真菌为重要的林木外生菌根真菌,对于人工林的营造及其维护人工林生态系统的稳定具有重要意义。本研究用真菌鉴定的常规方法进行子实体形态特征观察和显微鉴定,依据卯晓岚(2000)、袁明生等(2007)分类描述,鉴定出大秃马勃等10种马勃子实体,其中白刺马勃、草地横隔膜马勃及金黄硬皮马勃为巨桉林下国内首次发现报道。多根硬皮马勃、金黄硬皮马勃、大孢硬皮马勃、大秃马勃及橙黄硬皮马勃等曾报道为林木外生菌根菌(卯晓岚,2000; 朱天辉等,2001b)。我国马勃资源丰富,除橙黄硬皮马勃、金黄硬皮马勃报道有微毒外,其余幼时均可食用,所有种成熟后均可药用,具有消肿、止血及消炎等功效(魏景超,1979; 卯晓岚,2000),因此马勃具有重要的科研及应用开发价值。
马勃种类研究及鉴定尚缺乏系统资料,传统的真菌种类鉴定主要是依据子实体的特征,菌丝体较少能直接用于种类鉴定。利用通用引物对rDNA基因的ITS区段进行PCR扩增并进行序列分析目前已经广泛用于真菌的分类鉴定(林晓民,2004; 刘先宝等,2008; 潘欣等,2008)。本研究将子实体与菌丝体ITS区序列进行比较,结果显示本研究成功培养出橙黄硬皮马勃等6种马勃类纯培养物,为下一步的开发和利用奠定了基础,也表明这种分子鉴定方法是切实可行的,而依靠菌丝体鉴定往往会出现失误(林晓民,2004)。
rDNA基因是一种高度重复的串联序列单位,串联排列在染色体上,由于rDNA不同区段所受的选择压力不同,从而使各区段的保守程度有明显的差异,18S,5. 8S,28S和5S rDNA基因区的DNA序列保守,表 1、图 8显示马勃5. 8S rDNA区域序列相对保守,但在硬皮马勃属与其他属仍表现出一定的差异,可见亦可利用5. 8S rDNA进行系统分析,ITSrDNA不同区段(ITS1,ITS2及5.8S)序列均可用于系统进化分析(He et al., 2005; 李自慧等,2008)。本研究中硬皮马勃属ITS1,ITS2区GC含量较其他属高,在60.17%~64.93%之间,而其余属在41%~ 44.98%。研究表明ITS区的GC含量与它的序列长度和亚重复单位的数目有一定关系,表 2中可以看出表明硬皮马勃属与其余属间均具有较大的遗传距离,可见GC含量分析能够提供系统发育信息(Kan et al., 2005)。
首次建立基于ITS1-5.8S rDNA-ITS2,ITS1,ITS2及5.8S ITS区不同区段建立马勃分子系统发育树,其中ITS1-5.8S rDNA-ITS2属间系统发育树支持度高,可用于建立马勃类真菌属间系统发育树。ITS2区属内系统发育树支持度高,可显示属内(种)差异并用于建立属内(种)系统发育树。国外学者也研究表明利用ITS1-5.8S rDNA-ITS2标记可建立Lycoperdaceae不同属间发育(Larsson et al., 2008),ITS2可用于真核生物属种水平进化分析(Miao et al., 2008; Sun et al., 2010)。依靠ITS-rDNA区系统发育还可用于马勃种类的鉴定,Kruger等(2003)依靠ITS-rDNA进化分析成功将L. pyriforme最终鉴定为摩根菌属(Morganella). Bates(2004)建立了基于ITS-rDNA的美国亚利桑那州腹菌类(含29种马勃)系统发育树,结果亦表明原定种L. pyriforme属于摩根菌属。本研究选择了27种马勃ITS区序列并分析,进化结果表明3个待定种硬皮马勃Scleroderma sp. 11-1,Scleroderma sp. 2-2和Scleroderma sp. 5-2与金黄硬皮马勃出于同一分支,结合形态学分析,此3待定种为金黄硬皮马勃的可能性较大。
从巨桉林下采集获得马勃子实体,并成功培养出橙黄硬皮马勃、草地横隔膜马勃、白刺马勃、多根硬皮马勃、硬皮马勃Scleroderma sp. 11-1及Scleroderma sp. 2-2等菌丝体,提取了马勃总DNA,并克隆其ITS区序列,与子实体ITS区进行比较分析。研究发现,马勃类真菌ITS区长度在607~766bp之间,不同属长度不一,在分子水平上揭示了马勃的遗传多样性,构建了基于rDNA-ITS区不同区段的系统发育树,首次提出了ITS1-5.8S rDNA-ITS2,ITS2区分别作为马勃类真菌属间与属内进化标记,为马勃类真菌系统学研究及其进一步利用提供了参考标准,并为巨桉人工林下外生菌根的作用机制研究奠定了基础。
陈丽, 李晓明, 张鞍灵, 等. 2006. 黄硬皮马勃提取物抑菌活性初步研究[J]. 西北农业学报, 15(3): 87-90. |
龚先玲, 曾任森, 骆世明, 等. 2005. 多根硬皮马勃中子实体的化学成分[J]. 天然产物研究与开发, 17(4): 431-433. |
黄勇, 黄宝灵, 吕成群, 等. 2008. 马勃类真菌对桉树苗木生长效应的研究[J]. 四川林业科技, 29(5): 34-38. |
李自慧, 冯宪敏, 卢思奇, 等. 2008. 以ITS1-5[J]. 8S rDNA-ITS2序列为标记的肺孢子菌分子系统发育研究.中国科学(C辑):生命科学, 38(4): 377-385. |
林晓民. 2004. 大型真菌的生态多样性及分子鉴定[J]. 西北农林科技大学林学院博士学位论文. |
刘先宝, 高宏华, 蔡吉苗, 等. 2008. 橡胶树白粉病菌rDNA-ITS序列及其系统发育分析[J]. 热带作物学报, 29(2): 215-219. |
卯晓岚. 2000. 中国大型真菌[M]. 郑州: 河南科学技术出版社.
|
潘欣, 邹立扣, 彭培好, 等. 2008. 杜鹃褐斑病病原菌的分离与鉴定[J]. 北方园艺, (6): 198-200. |
魏景超. 1979. 真菌鉴定手册[M]. 上海: 上海科学技术出版社.
|
袁明生, 孙佩琼. 2007. 中国蕈菌原色图集[M]. 成都: 四川科学技术出版社.
|
赵会珍, 胥艳艳, 付晓燕, 等. 2007. 马勃的食药用价值及其研究进展[J]. 微生物通报, 34(2): 367-369. |
郑来友, 李文钿, 成小飞, 等. 2003. 彩色豆马勃与松树形成内外生菌根的研究[J]. 林业科学研究, 16(3): 262-268. |
朱天辉, 张健, 胡庭兴, 等. 2001a. 四川桉树外生菌根真菌的研究[J]. 四川农业大学学报, 19(2): 137-140. |
朱天辉, 张健, 胡庭兴, 等. 2001b. 四川桉树菌根类型及林分密度对菌根真菌的影响[J]. 四川农业大学学报, 19(3): 222-224. |
Bates S T. 2004. Arizona members of the Geastraceae and Lycoperdaceae(Basidiomycota, Fungi)[J]. PhD thesis, Arizona State University. |
He M X, Huang L M, Shi J H, et al. 2005. Variability of ribosomal DNA ITS-2 and its utility in detecting genetic relatedness of pearl oyster mar[J]. Biotechnol, 7(1): 40-45. |
Kan Xianzhao, Wang Shanshan, Ding Xin, et al. 2007. Structural evolution of nrDNA ITS in Pinaceae and its phylogenetic implications[J]. Molecular Phylogenetics and Evolution, 44: 765-777. DOI:10.1016/j.ympev.2007.05.004 |
Kawahara N, Sekita S, Satake M. 1995. Two steroids from Calvatia cytthiformis[J]. Phytochemistry, 38(4): 947-950. DOI:10.1016/0031-9422(94)00740-K |
Kruger D, Kreisel H. 2003. Proposing Morganella subg.Apioperdon subg.nov.for the puffball Lycoperdon pyriform[J]. Mycotaxon, 86: 169-177. |
Larsson E, Jeppson M. 2008. Phylogenetic relationships among species and genera of Lycoperdaceae based on ITS and LSU sequence data fr om north European taxa[J]. Mycological Research, 112(1): 4-22. DOI:10.1016/j.mycres.2007.10.018 |
Miao M, Warrenb A, Song W, et al. 2008. Analysis of the internal transcribed spacer 2(ITS2)region of scuticociliates and related taxa(Ciliophora, Oligohymenophorea)to infer their evolution and phylogeny[J]. Protist, 159(4): 519-533. DOI:10.1016/j.protis.2008.05.002 |
Nedelcheva D, Antonova D, Tsvetkova S, et al. 2007. TLC and GC-MS probes into the fatty acid composition of some Lycoperdaceae mushrooms[J]. Journal of Liquid Chromatography & Related Technologies, 30(18): 2717-2727. |
Sun P, Clamp J C, Xu D. 2010. Analysis of the secondary structure of ITS transcripts in peritrich ciliates(Ciliophora, Oligohymenophorea): Implications for structural evolution and phylogenetic reconstruction[J]. Molecular phylogenetics and Evolution, 56(1): 242-251. DOI:10.1016/j.ympev.2010.02.030 |
 2011, Vol. 47
2011, Vol. 47