文章信息
- 姜金仲, 李云, 贺佳玉, 郝晨, 王淑琴, 温富贵
- Jiang Jinzhong, Li Yun, He Jiayu, Hao Chen, Wang Shuqin, Wen Fugui
- 四倍体刺槐胚珠败育及其机制
- Ovule Abortion and Its Mechanism for Tetraploid Robinia pseudoacacia
- 林业科学, 2011, 47(5): 40-45.
- Scientia Silvae Sinicae, 2011, 47(5): 40-45.
-
文章历史
- 收稿日期:2011-01-10
- 修回日期:2011-03-06
-
作者相关文章
2. 贵州师范学院森林植物研究所 贵阳 550018;
3. 北京市延庆县园林绿化局 北京 102100
2. Forest Plant Research Institute, Guizhou Normal College Guiyang 550018;
3. Landscape Bureau of Yanqing County, Beijing Beijing 102100
刺槐(Robinia pseudoacacia)四倍体(4x)是人工诱导二倍体(2x)体细胞加倍而育成的刺槐优良类型(属同源四倍体)(Kim-C,1975)。李云等(2006)、张国君等(2007)、姜金仲等(2009)研究证明,其叶片大而肥厚、营养丰富、作为饲料的适口性好,适应性强,生物质产量高,是一优良的饲用无性系。郝晨等(2006)对四倍体刺槐大小孢子发育时期与花器形态的相关性进行了研究。姜金仲等(2008a; 2008)对四倍体刺槐种子促萌措施、花器原基分化及其成熟表型变异的研究表明:四倍体刺槐有大量的畸形败育花粉粒,种子大部分是败育的、萌发率平均只有5%。但尚无关于四倍体刺槐种子败育原因的研究报道。
种子是胚珠发育的结果,探索种子败育的原因首先应从胚珠发育过程着手。本文通过对四倍体刺槐胚珠发育过程连续切片观察及该过程中内源激素含量变化的测定,初步探讨了四倍体刺槐胚珠败育现象及其发生原因,为进一步研究四倍体刺槐种子高度不育现象提供基础。
1 材料与方法 1.1 试验材料北京林业大学同源四倍体刺槐和二倍体刺槐试验林基地位于北京郊区,地势平坦,黄棕壤,暖温带亚湿润气候区,年平均气温11.5 ℃,年平均降雨量568.9 mm,冬春两季多干旱。试验材料采自该基地已连续开花4年的6年生纯林。林中四倍体刺槐原种系北京林业大学于1997年从韩国引进。2005年5月中旬,林木处于盛花期时,从具有典型四倍体刺槐特征的代表性单株上采集试验所用的材料。
1.2 胚珠败育率及败育胚珠有胚率花冠展开后当天对要观测的花朵进行挂牌标记,按照试验设计时段(花冠展开后5,15,30,50,70,100天)分别在不同时段摘取尚留存的豆荚,用剪子顺荚果纵轴剪开,用镊子剥出胚珠,描述内部胚珠发育和败育情况。从解剖所得胚珠中每次随机抽取30粒为一样本,重复抽取3次,统计每次的败育率,3次的平均数作为该时期败育率的估值。在取豆荚的同时,统计该时段豆荚的留存率,并设立二倍体刺槐作对照,重复3次。
豆荚留存率(%)=尚留存的豆荚总数/挂牌观测豆荚总数×100%;胚珠败育率(%)=败育胚珠总数/观察胚珠总数×100%;胚珠有胚率(%)=有胚败育胚珠总数/解剖败育胚珠总数×100%。
1.3 胚珠生长发育的切片观察取花冠展开后不同时期(5,15,30,50,70,100天)尚留存的豆荚,从中剥出发育正常胚珠,立即进行FAA固定液固定; 固定24 h后,转入70%乙醇保存,乙醇系列脱水,二甲苯透明,石蜡浸透和包埋,制成8 μm的石蜡切片; 铁矾苏木精单染(叶兴国等,1997),Olympus BX51光学显微镜下观察,摄像系统DP70照相。
1.4 胚珠发育和败育过程中内源激素测定胚珠中IAA,GA3,ABA含量测定方法采用高效液相色谱法(HPLC)。不同发育时期的四倍体刺槐胚珠分析材料抽样方法与败育率统计时的抽样方法相同,参考Kurepin等(2007)的方法进行试验材料内源激素测定,每份材料的测定重复3次。
2 结果与分析 2.1 四倍体刺槐胚珠的败育形态及败育率按照胚珠的败育形态(图版Ⅰ),四倍体刺槐胚珠败育可以分为3个时期。初期败育(图版Ⅰ-7,8):败育胚珠体积较小,胚珠表现为轻度至深度枯黄色; 正常胚珠表现为嫩绿剔透; 发生在花冠展开5~30天之间。中期败育(图版Ⅰ-9,10):败育胚珠体积较小,部分表面表现出枯黄色,且胚珠周围有黄色透明液体,具明显的坏死特征; 正常胚珠表现为黄绿圆润; 发生在花冠展开30~50天之间。后期败育(图版Ⅰ-11,12):败育胚珠干瘪、较小,正常胚珠圆润饱满; 发生在花冠展开50天之后。
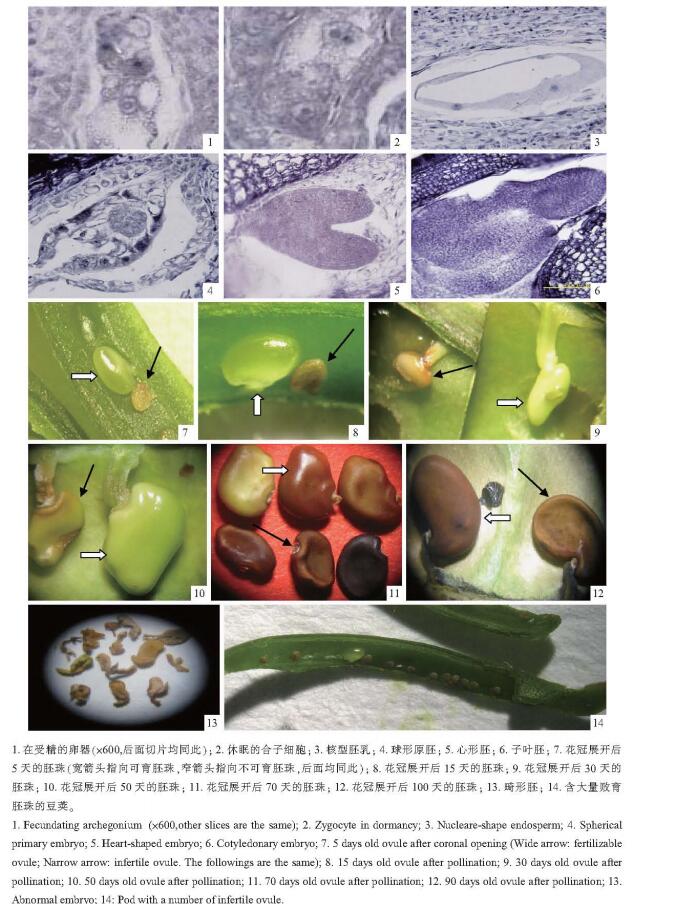
|
图版Ⅰ PlateI |
从各时期的胚珠败育率及变化趋势(图 1)可以看出:胚珠的败育率呈现出初期高、中间低、后期又高的趋势; 初期平均败育率为51.9%(54.6%±2.3%,49.2%±2.1%); 中期平均败育率为30.3%(27.3%±1.5%,33.3%±1.7%),此时胚珠已有明显的珠柄,败育胚珠内流出黄色透明液体、然后逐渐干枯死亡,这种败育形式可以从中期一直持续到后期; 后期平均败育率为72.6%(70.2%±2.9%,75.0%±3.4%),是中期败育继续发展的结果。
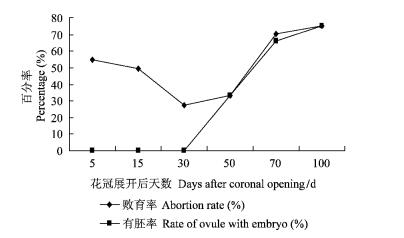
|
图 1 胚珠败育率及有胚率变化趋势 Figure 1 Change trend of ovule abortion rate and the rate of ovule with embryo |
为了探索四倍体刺槐胚珠败育与幼胚发育的关系,对四倍体刺槐胚珠生长发育过程进行分期切片观察。花冠展开后5天时,胚珠切片中观察到胚囊的体积迅速增大,珠心的内壁细胞不断分裂、体积增大,具进行受精作用时的卵器(图版Ⅰ-1)。花冠展开后约15天时,观察到胚囊内处于休眠状态的合子细胞(图版Ⅰ-2); 但胚乳核己经分裂多次,形成分布于靠近胚囊内壁的多核胚乳(图版Ⅰ-3)。花冠展开后30天时,观察到合子细胞开始第1次横向分裂,形成1个顶细胞和1个基细胞,顶细胞体积较大,细胞质较浓,染色较深,基细胞体积较小,细胞质染色较浅; 顶细胞不断地向各方向分裂,形成由多个细胞构成的球形原胚(图版Ⅰ-4)。花冠展开后50天时,前面看到的球形原胚继续分裂,体积增大,在其两侧以后形成子叶的位置上,细胞分裂速度加快,逐渐形成心形胚(图版Ⅰ-5)。花冠展开后70天时,随着心形幼胚的不断生长,内珠被的最内层细胞开始沿胚囊壁伸长,然后逐渐解体,除在珠孔端还有少数外,大部分内珠被细胞已经解体,心形胚逐步发育成子叶形胚(图版Ⅰ-6)。
综上所述可以看出,初期败育阶段的切片特征是合子细胞处于休眠状态、尚未进行分裂生长,中期败育阶段的切片特征是球形原胚、心形胚已经形成,后期败育阶段的切片特征是子叶胚已经形成。
2.3 四倍体刺槐胚珠初期败育与生理落果四倍体刺槐胚珠初期败育阶段合子细胞尚无分裂生长,无论是败育胚还是正常胚中均没有成形的胚,说明此时的胚珠败育与成形幼胚无关(当然,不排除与受精卵的存在与否有关),因此,较高的胚珠初期败育率可能是生理落果所造成。
按照果实生长发育的一般特征,果实生长发育早期,坐果量大的果树品种均存在生理落果现象,四倍体刺槐可能也存在这种现象,观察到的豆荚脱落情况(图 2)支持这种看法。由图 2可以看出,花冠展开后30天之内,豆荚大批脱落,到了30天时,豆荚保留率仅有5.7%(也就是94.3%的早期豆荚此时已经脱落); 此后,保留率缓慢降低,二倍体刺槐也表现出了相同的趋势(图 2)。这种现象与常见的果实生理落果现象基本相同,说明果实发育的生理落果在刺槐中是存在的。
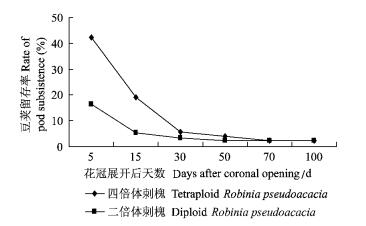
|
图 2 豆荚留存率 Figure 2 Percentage of pod subsistence |
四倍体刺槐的生理落果可能是导致胚珠初期大量败育的原因,即四倍体刺槐的生理落果可能是源于豆荚内胚珠败育,当豆荚内胚珠败育达到一定比例时,整个豆荚就会脱落,从而实现生理落果。从早期脱落的四倍体刺槐豆荚中存在大量的败育胚珠(图版Ⅰ-14)也可说明这点,至于引起四倍体刺槐生理落果的原因尚需进一步研究。
2.4 四倍体刺槐胚珠中、后期败育与败育胚珠的有胚率为了探索四倍体刺槐胚珠中、后期败育与胚珠内幼胚发育状态的关系,对不同时期的败育胚珠进行了解剖。不同时期败育胚珠的有胚率(图 1)为:花冠展开后30天内,败育胚珠中未看到常规解剖镜下能看到的有形胚,因此,败育胚珠的有胚率均为零; 花冠展开30天后,败育胚珠的有胚率逐渐提高,100天时达到最高(72.2%)。上述结果与胚珠切片观察的结果具有一致性。花冠展开后30天内,合子尚无分裂生长,胚珠内还没有成形的胚,所以败育胚珠的有胚率为零; 花冠展开30天后,合子开始发育,逐渐形成了有形胚,随着无胚败育阶段(初期败育或生理落果)的结束,有胚败育逐渐占据优势,因而败育胚珠解剖的有胚率逐渐提高。
由此可见,四倍体刺槐的中、后期胚珠败育是有胚胚珠和无胚胚珠共同存在的败育。中期败育处在合子细胞解除休眠开始发育的时期,此时,幼胚结构相对简单,对合子细胞内遗传信息的完整程度要求还不太严格,有些未来才败育的胚此时靠不完整的合子细胞遗传信息仍能存活,而大批因生理落果败育的胚珠此时已经脱落,所以,此期的胚珠败育率相对较低; 后期败育处在幼胚逐渐成形时期,由心形胚逐渐发育成子叶胚,随着幼胚逐渐发育完整,其结构及功能也逐渐复杂,其所需要的遗传信息完整性也越来越高,那些靠不完整遗传信息暂时存活下来的畸形幼胚(图版Ⅰ-13)就会死亡,继而引发后期胚珠败育,到花冠展开100天时,胚珠败育率达到75.2%,此时的败育胚珠有胚率为72.2%,所以,此时的胚珠败育是以有胚胚珠败育为主。
四倍体刺槐后期的高有胚胚珠败育率说明,大多数四倍体刺槐合子细胞所获得的遗传信息是不正常的,原因可能是四倍体刺槐减数分裂不正常导致雌雄配子遗传信息不正常引起的,也可能是只有特定的刺槐同源四倍体染色体组合才能提供幼胚正常生长发育所需要的完整遗传信息(也就是说,大多数的染色体同源加倍细胞是不能成活的,只有染色体完成了同源加倍、同时又有部分基因发生了改变,使加倍与基因改变偶然组合到一起,构成了能够使幼胚继续生长下去的完整遗传信息),也可能二者同时存在,尚需进一步研究。
2.5 四倍体刺槐胚珠败育与内源激素的变化为了进一步探索引起四倍体胚珠败育的原因,对四倍体刺槐不同时期败育胚珠进行了内源激素测定。
2.5.1 胚珠败育过程中GA3和IAA含量的变化趋势GA3和IAA是胚胎生长发育的促进剂(李宗霆等,1996)。由图 3A和B可以看出,四倍体刺槐正常胚和败育胚的2种内源激素含量的变化趋势都可以分为3个阶段:初期快速下降,中期上升,后期下降。虽然3个阶段中败育胚珠和正常胚珠的内源激素表现出了相似的变化趋势,但败育胚珠的曲线始终运行在正常胚珠曲线下方,说明,败育胚珠的生长促进类内源激素含量始终低于正常胚珠,所以,这种促进剂含量相对较低可能是导致胚珠败育的原因之一; 但相关分析表明,内源激素含量的变化趋势与胚珠败育率的变化趋势之间没有显著的相关性(P<0.05),说明胚珠败育除了受促进剂含量低的影响外,还有其他因素的作用。
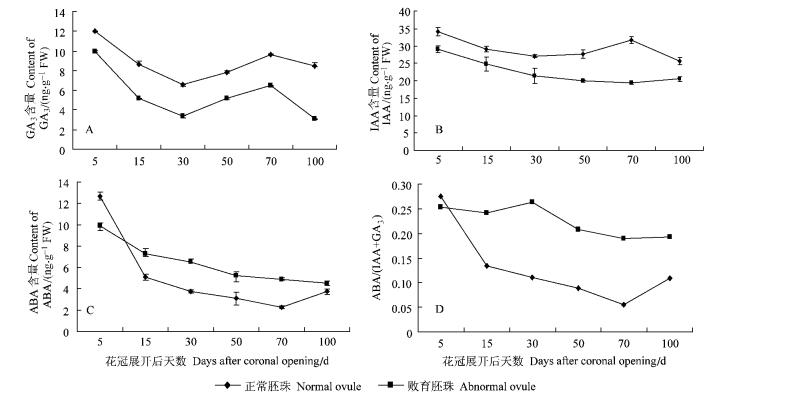
|
图 3 胚珠内源激素变化趋势 Figure 3 Change trend of endogenous phytohormones in ovule |
由图 3C可以看出,正常胚珠ABA含量变化趋势可分为3个阶段:初期快速下降,中期缓慢下降和后期快速上升,与胚珠切片发育阶段比较,初期和中期下降反映抑制物质含量的降低有利于胚珠和胚的生长发育,后期的快速上升则反映胚珠已经成熟,要停止生长。而败育胚珠中的含量则呈一直缓慢下降趋势,且相对于正常胚,下降的幅度要小得多,说明败育胚珠中的生长抑制类内源激素含量始终高于正常胚珠。由胚珠败育过程中ABA/(IAA+GA3)的变化趋势(图 3D)可以看出:正常胚珠ABA/(IAA+GA3)比值的变化趋势和ABA含量变化趋势一样,也分为3个阶段,且每阶段的趋势也是相同的; 但是,败育胚珠则表现为2个阶段,花冠展开后5~30天的上升阶段和此后的下降阶段。与胚珠切片发育阶段比较,此趋势的意义可以理解为: 5~30天之间,合子休眠期(生理落果期)胚珠败育30天时已逐渐结束,因此,抑制物质相对含量达到了最大值; 此后,随着合子休眠期败育胚珠的大批死亡和伴随的大批豆荚脱落,原胚-心形胚期(中期败育)开始,由于此期的胚珠败育是畸形胚逐渐死亡引起的,所以,ABA/(IAA+GA3)比值又恢复到15天以前的下降趋势中,只是与正常胚珠的下降趋势相比,其下降幅度小得多,其生长抑制物质明显高于同期正常胚珠的水平。
3 结论与讨论1) 四倍体刺槐胚珠败育分为3个阶段。初期败育:合子处于休眠状态,花冠展开后5~30天之间,平均败育率为51.9%,败育胚珠体积较小、轻度至深度枯黄色,败育胚珠的有胚率为0;中期败育:球形原胚、心形胚已逐渐形成,花冠展开后30~50天之间,平均败育率为30.3%,败育胚珠体较积小、部分表面枯黄色、周围有黄色透明液体,败育胚珠的有胚率为33.2%;后期败育:子叶胚已逐渐形成,花冠展开50天后,败育率为72.6%,败育胚珠干瘪、较小、棕黄色,败育胚珠的平均有胚率为70.8%。
四倍体刺槐中期败育胚珠普遍流出黄色液体是其不同于其他时期败育胚珠的特征,这种现象在其他植物上未见报道; 败育胚珠表现出了一种病态,而不是初期败育所表现出来的自然干瘪死亡。产生病态的原因可能与胚珠内幼胚遗传信息异常有关,造成这种遗传信息异常的原因可能是染色体同源加倍后染色体减数分裂异常所致。
四倍体刺槐部分后期败育胚珠中不含胚,且败育胚珠除了表现为空瘪外,其轮廓大小与可育胚珠非常近似(图版Ⅰ-11,12),这种现象说明,部分不含幼胚的胚珠也能继续生长,直至长成成熟的胚珠空壳。
2) 四倍体刺槐胚珠初期、中期及后期败育的原因有所不同。初期败育属无胚胚珠败育,其发生原因与果实生理落果有关; 中、后期败育属有胚、无胚胚珠同时存在的胚珠败育,但有胚胚珠占多数(70.8%),其发生的原因主要是幼胚畸形死亡。
关于二倍体植物胚珠败育的原因目前主要有以下几种观点:授粉与受精失败(Burd,1994),幼胚营养资源竞争败育(Gómez et al., 2003),位置效应,即(二倍体刺槐的)胚珠在子房内的位置(Susko,2006),近交(Wiens et al., 1989),胚囊不能发育、胚乳败育及合子细胞死亡(Mogensen,1975),胚珠内胼胝质的沉积模式(Calviño et al., 2009)等。这些原因在四倍体刺槐早期败育阶段中均有存在的理由,其中特别是近交,四倍体刺槐表现尤为明显,据观察,四倍体刺槐几乎是完全自交的(另文发表),但此自交是否就是四倍体刺槐胚珠早期败育的主要原因尚待进一步研究。由此可见,四倍体刺槐胚珠早期败育的原因很复杂,受多种因素影响,除了与生理落果有关外,还可能与上述诸种导致胚珠败育的因素有关。
关于多倍体植物胚珠败育原因的研究较少。Sato等(1984)对苹果(Malus pumila)三倍体品种‘Mutsu’的研究表明,胚珠败育率为50%,败育原因部分是因为没有受精,但主要的原因是合子和初期胚乳核的败育; Schneider(1953)认为,在苹果三倍体中,由于减数分裂异常会形成非整倍体的雌雄配子,非整倍体的雌雄配子结合又会形成非整倍性的受精卵及胚乳核,从而使受精卵及胚乳核遗传性失去平衡,失衡的遗传性是早期幼胚及胚乳败育的原因,幼胚及胚乳的早期败育是胚珠早期败育的原因。从四倍体刺槐胚珠败育的情况看,其胚珠中、后期败育的原因与上述三倍体苹果早期幼胚及胚乳败育的原因相同,但苹果三倍体仅研究了胚珠的早期败育。
从四倍体刺槐胚珠中、后期败育率逐渐提高的情况分析,其幼胚及胚乳的败育时间是不一样的,遗传性失衡较重的幼胚败育相对较早,遗传性失衡较轻的幼胚败育较晚; 四倍体刺槐后期败育率迅速提高,说明花冠展开50天后,幼胚对遗传失衡进入敏感期,其原因是幼胚结构及功能逐渐复杂,对遗传信息的正确性要求越来越高,遗传信息的细小改变就可能使其失去生命,进而引起胚珠败育,因此认为畸形幼胚逐渐死亡是四倍体刺槐胚珠中、后期(特别是后期)败育的主要原因,而畸形幼胚死亡的原因与三倍体苹果幼胚死亡的原因(Schneider,1953)有相同之处。
3) 花冠展开15天之后的四倍体刺槐胚珠发育期间,败育胚珠生长促进类内源激素(GA3,IAA)水平总是低于发育正常胚珠,生长抑制类内源激素(ABA)水平及ABA/(IAA+GA3)的比值总是明显高于发育正常胚珠,这种现象提示,四倍体刺槐胚珠败育与胚珠内源激素异常有关。这与前人的研究结果有相似之处: Leopold等(1984)认为,植物器官形成和发育不仅与内源激素的绝对量有关,而且与生长促进激素及生长抑制激素间的平衡有关,管花木犀(Osmanthus delavayi)球形原胚发育后期胚珠开始败育时,IAA,GA3含量急剧下降; ABA是一种生长抑制型内源激素,其绝对含量或相对含量过高都可能引起胚珠败育(Reed et al., 1986)。
4) 四倍体刺槐胚珠败育现象是源自于二倍体刺槐染色体的同源加倍,因此,研究四倍体刺槐胚珠败育的发生规律及机制,对于认识染色体同源加倍对植物育性的影响具有一定意义。
郝晨, 李云, 姜金仲, 等. 2006. 四倍体刺槐大小孢子发育时期与花器形态的相关性[J]. 核农学报, 20(4): 292-295. |
姜金仲, 贺佳玉, 李云, 等. 2009. 四倍体刺槐种子胚变异及生活力分析[J]. 核农学报, 23(3): 405-412. |
姜金仲, 李云, 贺佳玉, 等. 2008a. 刺槐同源四倍体种子促萌技术研究[J]. 北京林业大学学报, 30(5): 104-108. |
姜金仲, 郝晨, 李云, 等. 2008b. 四倍体刺槐花器原基分化及其成熟表型变异[J]. 林业科学, 44(6): 34-38. |
李云, 张国君, 路超, 等. 2006. 四倍体刺槐不同生长时期和部位的叶片的饲料营养价值分析[J]. 林业科学研究, 19(5): 580-584. |
李宗霆, 周燮. 1996. 植物激素免疫检测技术[J]. 南京:江苏科学技术出版社.. |
叶兴国, 王边铮. 1997. 大豆花药愈伤组织的分化及其内源激素分析[J]. 作物学报, 23(5): 555-561. |
张国君, 李云, 姜金仲, 等. 2007. 饲料型四倍体刺槐叶粉营养价值的比较研究[J]. 草业科学, 24(1): 26-30. |
Burd M. 1994. Bateman's principle and plant reproduction: the role of pollen limitation in fruit and seed set[J]. Bot Rev, 60(1): 83-139. DOI:10.1007/BF02856594 |
Calviño A, Carrizo García C. 2009. Distinctive patterns of callose deposition provide an early sign of ovule abortion in the andromonoecious shrub Caesalpinia gilliesii[J]. Bol Soc Argent Bot, 44(1/2): 49-55. |
Gómez J M, Zamora R. 2003. Factors affecting intrafruit pattern of ovule abortion and seed production in Hormathophylla spinosa(Cruciferae)[J]. Plant Syst Evol, 239(3/4): 215-229. |
Kim-C S. 1975. Studies on the colchitetraploids of Robinia pseudoacacia L.Research Report of the Institute of Forest Genetics[J]. Korea, No.12: 108. |
Kurepin L V, Emery R J, Pharis R P, et al. 2007. Uncoupling light quality from light irradiance effects in Helianthus annuus shoots: putative roles for plant hormones in leaf and internode growth[J]. Journal of Experimental Botany, 58(8): 2145-2157. DOI:10.1093/jxb/erm068 |
Leopold A C, Nooden L O. 1984. Hormonal regulatory system in plants ∥ Scott T K.Hormonal Regulation of Development Ⅱ[J]. Berlin: Springer-Verla: 10-11. |
Mogensen H L. 1975. Ovules abortion in Quercus(Fagaceae)[J]. Amer J Bot, 62(2): 160-165. DOI:10.2307/2441590 |
Reed A J, Singletary G W. 1989. Roles of carbohydrate supply and phyto-hormones in maize kernel abortion[J]. Plant Physiol, 91(3): 986-992. DOI:10.1104/pp.91.3.986 |
Sato M, Kanbe K. 1984. Studies on the ovule abortion of the triploid apple cultivar'Mutsu'[J]. Bull Akita Pref Coll Agr, (10): 33-42. |
Schneider G W. 1953. Megagametogenesis and embryology in a diploid and an aneuploid apple[J]. Amer J Bot, 40(3): 196-203. DOI:10.2307/2438778 |
Susko D J. 2006. Effect of ovule position on patterns of seed maturation and abortion in Robinia pseudoacacia(Fabaceae)[J]. Canadian Journal of Botany, 84(8): 1259-1265. DOI:10.1139/b06-094 |
Wiens D, Nickrent D L, Davern C I, et al. 1989. Developmental failure and loss of reproductive capacity in the rare palaeoendemic shrub Dedeckera eurekensis[J]. Nature, 338(6210): 65-67. DOI:10.1038/338065a0 |
 2011, Vol. 47
2011, Vol. 47

