文章信息
- 张欣, 冯颖, 丁伟峰, 马涛, 刘荣, 马艳
- Zhang Xin, Feng Ying, Ding Weifeng, Ma Tao, Liu Rong, Ma Yan
- 常用农药对5种昆虫细胞系的毒力测定及分析
- Measurement and Analysis of Cytotoxicity of 5 Insect Cell Lines Induced by Some Pesticides
- 林业科学, 2011, 47(4): 182-189.
- Scientia Silvae Sinicae, 2011, 47(4): 182-189.
-
文章历史
- 收稿日期:2009-10-22
- 修回日期:2010-08-18
-
作者相关文章
2. 国家林业局资源昆虫培育与利用重点实验室 昆明 650224
2. Key Laboratory of Cultivating and Utilization of Resource Insects of State Forestry Administration Kunming 650224
自20世纪60年代Grace建立了第一个能够稳定传代的昆虫细胞系以来(Grace,1962),经过几十年的研究和发展,昆虫细胞培养已在细胞系建立、培养技术和方法、昆虫细胞培养技术的利用等方面取得了很大的进展,昆虫细胞被广泛地应用于医学、农学及生物学的各个领域(宋德伟等,2004; 张佑红等,2006; Maramorosch et al., 1992)。目前,全世界已有500多株昆虫细胞系得以建立(Lynn,2001),100多种昆虫细胞被应用于生物学和医学的研究(程东美等,2002),利用昆虫细胞检测化学药物及生物活性物质毒力的立体毒力测试体系也逐步发展起来。从20世纪60年代开始就有学者进行了昆虫细胞离体条件下农药的毒力检测(Mitsuhashi et al., 1970; 杨红等, 1996), Waterhouse(1965)首次研究了DDT对天蚕蛾传代细胞系的影响; Yoshida(1979)研究了有机合成的杀虫剂对离体细胞正常呼吸代谢及生物大分子合成的影响; Stipanovic等(1990)首次采用了MTT法测定了棉酚系列天然产物对烟芽夜蛾(Heliothis viresecn)细胞系的毒力; Rahiouid等(2007)、Salehzadeh等(2002)报道了蛋白及农药等对草地夜蛾(Spodoptera frugiperda)细胞系Sf-9的细胞毒性; 另外,Das等(2006)也利用农药对人体外周血淋巴细胞系的毒力来检测农药对人体的影响。国内在这方面的研究开始得较晚,且大多数集中于利用MTT法检测,毛黎娟等(2005)测定了杀虫剂对家蚕细胞的毒力; 钟国华等(2008a)研究报道了9种植物源物质对斜纹夜蛾(Prodenia litura)细胞系SL-1细胞凋亡小体的影响; 周青春等(1997a; 1997b)用改进的MTT法检测了丙酮、乙酸乙酯、二甲苯等有机溶剂杀虫剂对菜粉蝶(Pieris rapae)细胞系和棉铃虫(Helicoverpa amigera)细胞系的毒力; 杨红等(1996)利用菜青虫(菜粉蝶)细胞检测二甲基砜、丙酮、乙酸乙酯及二甲苯等的毒力。
农药的活体生物检测周期长,费时费力,且昆虫对药剂的敏感性受季节、温度、昆虫品系等因素的影响较大,而利用昆虫细胞进行杀虫剂的筛选和毒力测定则具有耗药量少、灵敏、简便、周期短、适宜于快速筛选、试验条件易于控制、节约人工等优点,弥补了传统生物测定方法的不足(程东美等,2002; 周青春等,1996)。本研究利用Blackman细胞活力分析仪测定了4种常用农药及二甲苯在不同含量水平上对来源于双翅目和鳞翅目的5种昆虫细胞系的毒力,并探讨不同农药对昆虫细胞的作用机制,为利用昆虫细胞系进行农药活性筛选奠定基础。
1 材料与方法 1.1 供试细胞系及培养供试细胞系3个来源于双翅目、2个来源于鳞翅目(表 1),均为本研究所昆虫细胞库保存,各培养基均添加10%FBS(fetal bovine serum),调节pH值为6.3,5种细胞系均在28 ℃下密闭培养,5~7天传代1次。
|
|
农药:25 g·L-1氯氟氰菊酯(山东德乐化工有限公司)、10%高氯·灭乳油(聊城市景阳岗农药有限公司)、45%马拉硫磷(辽宁凌云集团农药化工有限公司)、0.3%印楝素(云南中科生物产业有限公司)。有机溶剂:二甲苯,国产分析纯试剂。
4种农药及二甲苯经0.22 μm有机溶剂针头过滤器过滤,无菌水制备稀释成100倍的工作液。
1.3 毒力测定及分析方法将同一种细胞系培养液混合,每培养瓶(25 cm2)分装10 mL。在预试验的基础上,将农药及二甲苯工作液分别取100, 200, 300 μL混匀于10 mL培养液中,使其终含量为0.1, 0.2, 0.3 μL·mL-1,设空白对照一组。处理前及加入农药及二甲苯5, 24, 48, 72 h后,经Blackman细胞活力分析仪测定其活力及细胞形态,计数活细胞和死细胞数,每个样品测定100次,仪器软件自动计算细胞活力的平均数,仪器系统误差为±6%。本研究取各处理细胞活力并根据以下公式计算各处理在不同时间的致死率。
致死率(%)=(处理前细胞活力-处理后细胞活力)/处理前细胞活力×100%
利用SPSS软件Duncan多重比较法对处理类型及细胞种类进行多重比较。
1.4 形态学观察处理后5, 24, 48, 72 h分别在Nikon ECLIPSE TS100倒置生物显微镜及其拍照系统下观察细胞形态及动态,并拍片记录细胞形态学变化。
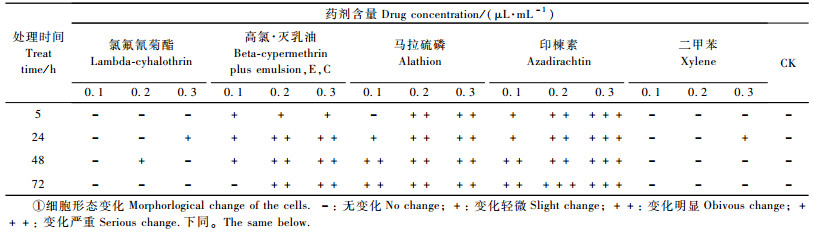
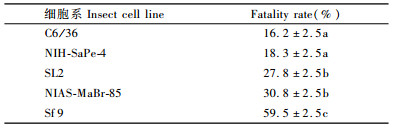
2 结果与分析 2.1 4种农药及二甲苯对SL2细胞的毒力4种农药对SL2细胞的生长均产生不同程度的影响,随农药终含量和处理时间的增加,致死率增大,其中毒力最大的是印楝素,印楝素0.3 μL·mL-1处理24 h,致死率达87.22%。其次分别为高氯·灭乳油、马拉硫磷及氯氟氰菊酯。二甲苯在处理后5, 24 h对细胞生长有轻微影响,其余时间均对细胞生长无影响。对照组细胞除由于混匀操作有轻微影响到细胞生长外,48 h以后均出现增长(图 1)。
|
图 1 不同处理对SL2细胞的毒力 Figure 1 Cytotoxicity induced by different treatment on the SL2 |
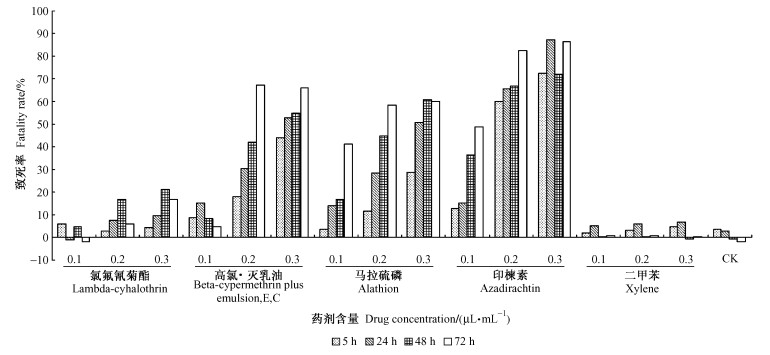
显微镜观察处理前SL2细胞呈贴壁生长,形态多为圆形,大小均一。二甲苯及氯氟氰菊酯各处理的细胞形态变化不明显,其余3种农药各处理细胞形态均有变化(表 2),体现为细胞皱缩,比例减小,碎片增多, 贴壁松散。0.1 μL·mL-1马拉硫磷处理24 h后及0.2, 0.3 μL·mL-1处理5 h后培养瓶壁出现大量不明结晶物质; 0.3 μL·mL-1印楝素处理的细胞致死率较高,24 h后基本无贴壁细胞存在,只有大量细胞碎片及个别悬浮细胞(图版Ⅰ-1—6)。
|
|
|
图版Ⅰ Plate1 图版说明见正文末 See explanation at the end of text |
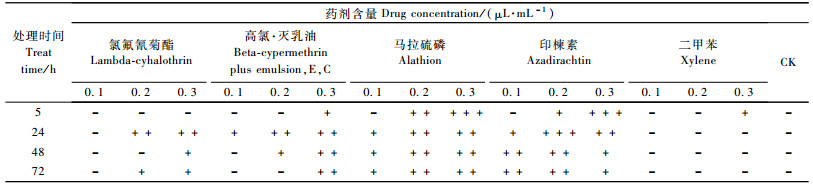
4种农药对C6/36细胞的生长均产生一定的影响,农药含量及处理时间与细胞的致死率之间不存在明显的线性关系,但主要表现为高含量短时间条件下高致死率。毒力最大的是印楝素,印楝素0.3 μL·mL-1、5 h处理致死率达80.85%。其次分别为马拉硫磷、氯氟氰菊酯及高氯·灭乳油。二甲苯在高含量处理5 h时对细胞生长有轻微影响,其余处理均未对细胞生长产生影响; 对照组细胞正常增长(图 2)。
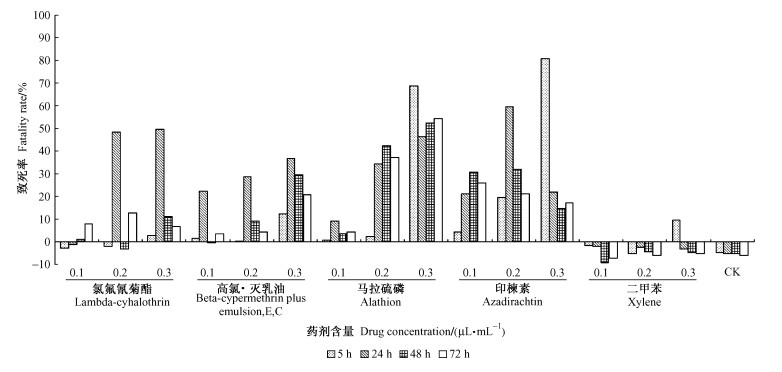
|
图 2 不同处理对C6/36细胞的毒力 Figure 2 Cytotoxicity induced by different treatment on the C6/36 |
显微镜观察处理前C6/36细胞呈半贴壁生长,形态为多角形、梭形,部分悬浮生长的细胞为近圆形。二甲苯处理后的细胞形态与对照基本一致,其余各处理细胞形态均出现变化(表 3),主要表现为细胞形态成圆形,细胞界限不清晰,细胞核不明显,出现空包结构,碎片增多。其中马拉硫磷0.2, 0.3 μL·mL-1处理5 h后均有大量结晶物质出现的现象(图版Ⅰ-7—12)。
|
|
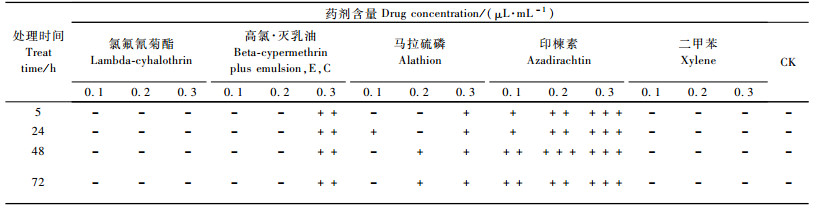
印楝素、高氯·灭乳油、马拉硫磷对NIH-SaPe-4细胞的生长均产生不同程度的影响,呈现出随农药终含量的增加致死率增大的趋势,但处理时间与致死率之间无明显线性关系。其中毒力最大的是印楝素,印楝素0.3 μL·mL-1、5 h,致死率高达92.75%。其次分别为高氯·灭乳油、马拉硫磷。氯氟氰菊酯及二甲苯对细胞生长基本无影响,对照组细胞生长正常(图 3)。
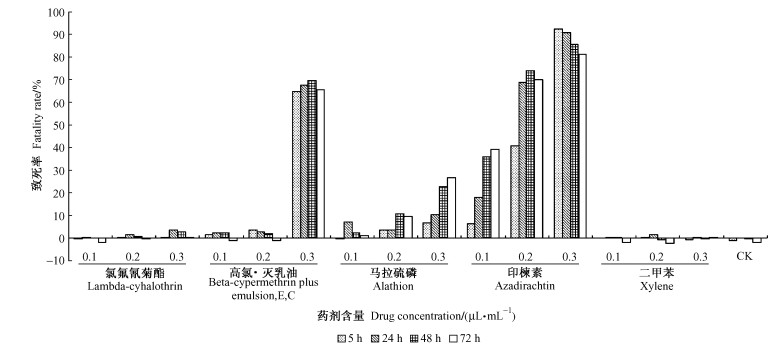
|
图 3 不同处理对NIH-SaPe-4细胞的毒力 Figure 3 Cytotoxicity induced by different treatment on the NIH-SaPe-4 |
显微镜观察处理前NIH-SaPe-4细胞呈悬浮生长,形态为圆形、椭圆形和少部分梭形。氯氟氰菊酯、二甲苯各处理后的细胞形态与对照基本一致,印楝素、高氯·灭乳油各处理细胞形态均出现变化(表 4),主要表现为细胞皱缩,细胞核不明显,细胞内空包结构,并出现细胞堆现象,碎片增多。马拉硫磷各处理对细胞形态影响不明显的同时也没有出现大量结晶物质(图版Ⅰ-13—15, Ⅱ-1—3)。

|
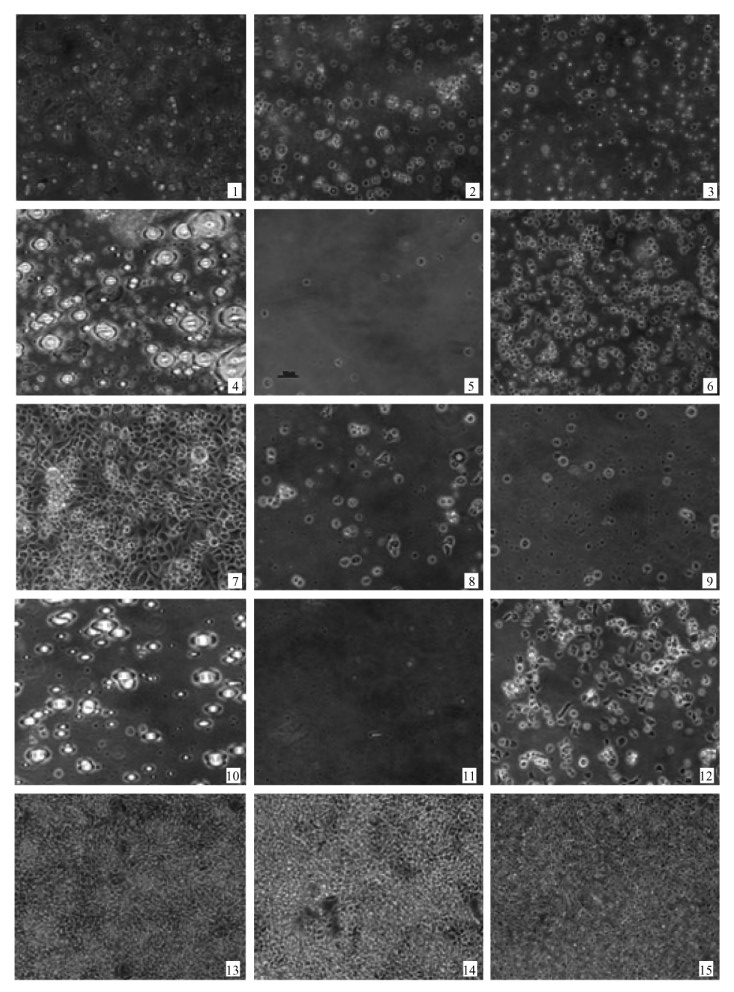
图版Ⅱ Plate2 图版说明见正文末 See explanation at the end of text |
|
|
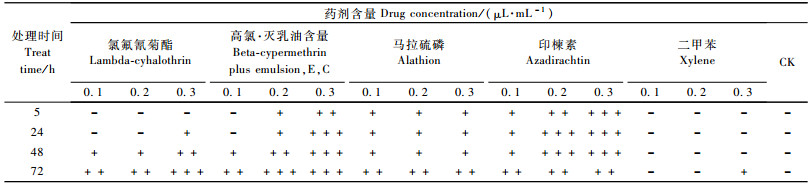
4种农药对NIAS-MaBr-85细胞的生长均产生了影响,随农药终含量和处理时间的增加致死率随之增大,其中对NIAS-MaBr-85细胞毒力最大的是高氯·灭乳油的高含量长时间处理,0.3 μL·mL-1含量处理72 h,致死率达88.93%。其次分别为印楝素、氯氟氰菊酯及马拉硫磷。二甲苯在高含量长时间下对细胞生长有轻微影响,对照组细胞生长正常(图 4)。
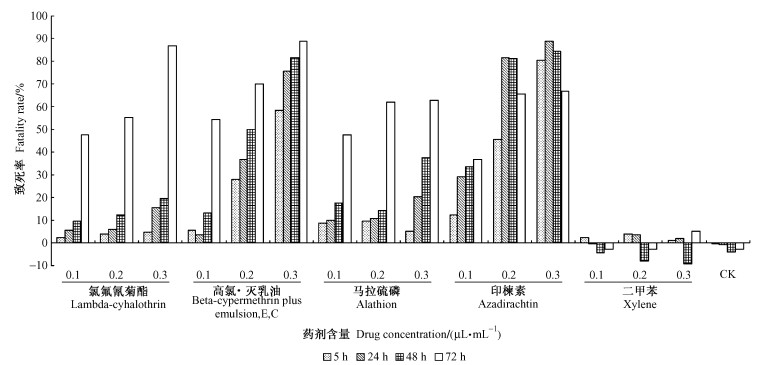
|
图 4 不同处理对NIAS-MaBr-85细胞的毒力 Figure 4 Cytotoxicity induced by different treatment on the NIAS-MaBr-85 |
显微镜观察处理前NIAS-MaBr-85细胞呈轻微贴壁生长,形态为圆形、椭圆形和少部分梭形。氯氟氰菊酯低浓度短时间、二甲苯各处理后的细胞形态变化不明显; 其余各处理均出现不同程度变化(表 5),主要为细胞悬浮生长,圆形细胞减少,梭形细胞增多,细胞皱缩,细胞内空包结构,碎片增多等不同程度的变化(图版Ⅱ-4—9)。
|
|
各药剂对Sf 9细胞的生长均产生了影响,随农药终含量和处理时间的增加致死率随之增大,其中最大的是印楝素,在中、高含量下均达到了100%的致死率。其次分别为高氯·灭乳油、马拉硫磷及氯氟氰菊酯。二甲苯各处理短时间内对细胞生长均产生影响, 随着培养时间的增长有逐渐恢复的趋势; 对照组细胞生长正常(图 5)。
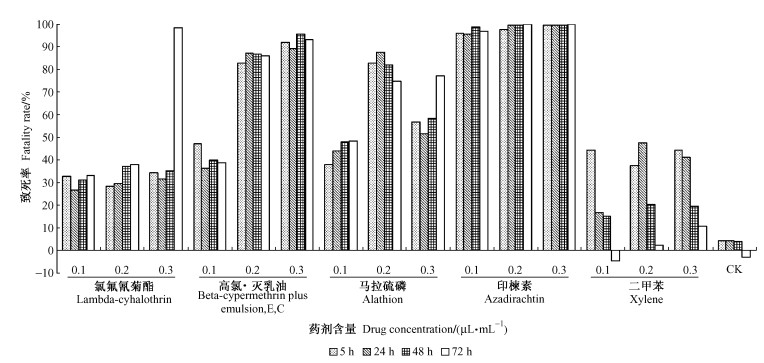
|
图 5 不同处理对Sf 9细胞的毒力 Figure 5 Cytotoxicity induced by different treatment on the Sf 9 |
显微镜观察处理前Sf 9细胞呈半贴壁生长,悬浮生长细胞形态多为圆形, 贴壁生长细胞为多角形及梭形,细胞大小均一,形态饱满。4种农药及二甲苯处理后细胞形态均发生改变(表 6),大部分表现为细胞悬浮生长,细胞皱缩,细胞内空包结构,碎片增多等不同程度的变化。由于印楝素各处理致死率都很高,所以基本观察不到细胞存在,均为细胞碎片; 马拉硫磷0.2, 0.3 μL·mL-1处理在5 h后均贴壁出现大量结晶物质(图版Ⅱ-10—15)。
|
|
在试验基础上对试验结果采用SPSS软件Duncan多重比较法, 对药剂及细胞种类进行了多重比较,结果见表 7、表 8。
|
|
|
|
通过对不同药剂类型之间及其与对照间的致死率多重比较发现,氯氟氰菊酯、马拉硫磷、高氯·灭乳油及印楝素与二甲苯之间均差异显著。从细胞致死率水平上来看,印楝素对5种细胞毒力效果最显著,高氯·灭乳油及马拉硫磷其次, 并与氯氟氰菊酯之间差异显著, 而二甲苯对5种细胞的毒力不明显,对5种昆虫细胞毒力效果最显著的是印楝素,其次是高氯·灭乳油、马拉硫磷及氯氟氰菊酯。5种昆虫细胞系致死率多重比较结果显示各药剂处理后Sf 9的细胞死亡率与其他细胞间差异显著,其次是SL2、NIAS-MaBr-85与C6/36、NIH-SaPe-4之间差异显著; 结果表明在同种药剂相同含量及时间处理下,Sf 9细胞的反应最为敏感,其次是NIAS-MaBr-85、SL2、NIH-SaPe-4及C6-36。
3 讨论本文研究结果显示,4种常用农药对离体培养的昆虫细胞均有不同程度的毒力作用,离体昆虫细胞对农药的敏感性与农药的作用机制一致,昆虫细胞对作用范围较大的广谱性农药较敏感; 而在同一药剂同一浓度处理下,不同细胞系的反应不同,敏感性差异明显; 研究结果表明昆虫细胞系用于农药的毒力测定及研究是可行的。
本研究发现同种昆虫细胞系对不同的农药类型的耐受量是有差异的,这与药剂对昆虫细胞系的毒力及作用机制相关(毛黎娟等,2005)。本文采用的4种农药对昆虫的作用机制不同,印楝素可直接作用于昆虫的神经系统、血淋巴、遗传物质、内分泌系统、表皮等(程东美等,2007),能对200多种昆虫具有拒食、忌避、生长发育调节等作用(钟国华等,2008b); 高氯·灭乳油由1.2%的氯氟菊酯和8.8%灭多威组成,主要具有触杀和胃毒作用,击倒作用强,杀虫速度快(颜桂军等,2005); 马拉硫磷一种具有神经毒性的有机磷杀虫剂,也具有触杀和胃毒作用,杀虫谱广(周炳等,2007); 氯氟氰菊酯为神经毒剂,主要为触杀作用,杀虫谱广、作用快、持效期长,具有杀虫、杀螨双重活性(黄建忠等,2008)。本试验5种细胞系对印楝素处理的反应最显著,其次是高氯·灭乳油、马拉硫磷、氯氟氰菊酯。试验结果说明采用离体测试的方法与药剂的作用方式存在很大的相关性,5种细胞对印楝素均产生高致死率说明离体测试的结果对于能影响细胞代谢能力的毒杀性试剂具有较高的灵敏性,而对于神经毒类的杀虫剂,由于在细胞系中找不到靶作位点而使其对细胞的毒力相对于活体降低(郑炳莲等,2000),因此本试验中马拉硫磷和氯氟氰菊酯对细胞致死率较低; 但若是直接来源于昆虫神经系统的细胞系,可能就对神经毒剂的药剂较为敏感。在以往的报道中(周青春等,1997a; 1996;杨红等,1996),二甲苯在1%至4%的含量下较其他有机溶剂,如丙酮、乙酸乙酯、乙醇、二甲亚砜等对昆虫细胞的毒力强,所以本试验采用毒力较强的二甲苯作为有机溶剂对照,试验结果显示二甲苯对5种昆虫细胞毒力效果不明显,可能是由于在本研究中为了与供试农药终含量保持一致,二甲苯终含量仅为0.01%至0.03%。较低的终含量使得二甲苯毒力效果不明显。所以在利用昆虫细胞系进行药剂的毒力检测时,针对不同药剂类型选择合适的细胞系至关重要。
在大部分研究报告中,进行农药或有机溶剂毒力检测的细胞多为鳞翅目的草地夜蛾Sf 9、粉纹夜蛾Hi-5、家蚕细胞、棉铃虫细胞等。本文共采用了鳞翅目细胞系Sf 9及NIAS-MaBr-85、双翅目细胞系SL2、NIH-SaPe-4及C6-36等5种细胞系进行研究,除Sf 9常见于毒力检测的报道以外,还未见其他4种细胞系用于毒力检测的报道。在本试验中,在处理条件一致的情况下Sf 9具有较显著的反应,其次是NIAS-MaBr-85、SL2、NIH-SaPe-4及C6-36,试验采用的4种农药中氯氟氰菊酯、马拉硫磷、印楝素均属于广谱性杀虫剂; 说明鳞翅目细胞较双翅目细胞更适宜于用于毒力检测,而Sf 9表现出的高敏感性也说明成熟的工程细胞系较其他细胞系灵敏。
利用昆虫细胞进行杀虫剂的毒力检测及作用机制研究作为一种新的检测手段相对于传统的生物测定方法来说具有简便、快捷、经济等优点,还能在细胞水平、分子水平上研究昆虫病毒与宿主的相互关系,为杀虫剂的作用机制及抗性的研究提供理想的体系。但由于细胞的类型以及药剂的作用机制的不同,其结果有可能与常规的生物测定有一定差距。所以,利用离体测定时与昆虫活体测定相结合并选择合适的药剂类型和供试细胞对离体毒力检测的效果能起到事半功倍的效果。
图版说明 Explanation of plate
5种细胞系在各药剂处理下致死率最高时的细胞形态。
1-6:细胞系为SL2。1.CK; 2.氯氟氰菊酯0.3 μL·mL-1, 48 h; 3.高氯·灭乳油0.2 μL·mL-1, 72 h; 4.马拉硫磷0.3 μL·mL-1, 48 h; 5.印楝素0.3μL·mL-1, 72 h; 6.二甲苯0.3 μL·mL-1, 24 h。
7-12:细胞系为C6/36。7.CK; 8.氯氟氰菊酯0.3 μL·mL-1, 24 h; 9.高氯·灭乳油0.3 μL·mL-1, 48 h; 10.马拉硫磷0.3 μL·mL-1, 5 h; 11.印楝素0.3 μL·mL-1, 5 h; 12.二甲苯0.3 μL·mL-1, 5 h.
13-18:细胞系为NIH-SaPe-4。13.CK; 14.氯氟氰菊酯0.3 μL·mL-1, 24 h; 15.高氯·灭乳油0.3 μL·mL-1, 48 h; 16.马拉硫磷0.3 μL·mL-1, 72 h; 17.印楝素0.3 μL·mL-1, 5 h; 18.二甲苯0.2 μL·mL-1, 24 h;
19-24:细胞系为NIAS-MaBr-85。19. CK; 20.氯氟氰菊酯0.3 μL·mL-1, 72 h; 21.高氯·灭乳油0.3 μL·mL-1, 72 h; 22.马拉硫磷0.3 μL·mL-1, 72 h; 23.印楝素0.3 μL·mL-1, 24 h; 24.二甲苯0.3 μL·mL-1, 72 h。
25-30:细胞系为Sf 9。25.CK; 26.氯氟氰菊酯0.3 μL·mL-1, 72 h; 27.高氯·灭乳油0.3 μL·mL-1, 48 h; 28.马拉硫磷0.2 μL·mL-1, 24 h; 29.印楝素0.3 μL·mL-1, 72 h; 30.二甲苯0.2 μL·mL-1, 48 h
Mmorphological changes of the 5 cells lines at the highest death rate of different treatment.
1-6: The cell line is SL2. 1.CK; 2. Lambda-cyhalothrin 0.3 μL·mL-1, 48 h; 3. Beta-cypermethrin plus emulsion, E, C 0.2 μL·mL-1, 72 h; 4. Alathion 0.3 μL·mL-1, 48 h; 5. Azadirachtin 0.3 μL·mL-1, 72 h; 6. Xylene 0.3 μL·mL-1, 24 h.
7-12: The cell line is C6/36. 7.CK; 8. Lambda-cyhalothrin 0.3 μL·mL-1, 24 h; 9. Beta-cypermethrin plus emulsion, E, C 0.3 μL·mL-1, 48 h; 10. Alathion 0.3 μL·mL-1, 5 h; 11. Azadirachtin 0.3 μL·mL-1, 5 h; 12. Xylene 0.3 μL·mL-1, 5 h.
13-18: The cell line is NIH-SaPe-4.13.CK; 14. Lambda-cyhalothrin 0.3 μL·mL-1, 24 h; 15. Beta-cypermethrin plus emulsion, E, C 0.3 μL·mL-1, 48 h; 16. Alathion 0.3 μL·mL-1, 72 h; 17. Azadirachtin 0.3 μL·mL-1, 5 h; 18. Xylene 0.2 μL·mL-1, 24 h.
19-24: The cell line is NIAS-MaBr-85.19.CK; 20.Lambda-cyhalothrin 0.3 μL·mL-1, 72 h; 21. Beta-cypermethrin plus emulsion, E, C 0.3 μL·mL-1, 72 h; 22. Alathion 0.3 μL·mL-1, 72 h; 23. Azadirachtin 0.3 μL·mL-1, 24 h; 24. Xylene 0.3 μL·mL-1, 72 h.
25-30: The cell line is Sf 9. 25. CK; 26. Lambda-cyhalothrin 0.3 μL·mL-1, 72 h; 27. Beta-cypermethrin plus emulsion, E, C 0.3 μL·mL-1, 48 h; 28.Alathion 0.2 μL·mL-1, 24 h; 29. Azadirachtin 0.3 μL·mL-1, 72 h; 30. Xylene 0.2 μL·mL-1, 48 h
程东美, 张志祥, 胡美英, 等. 2002. 昆虫细胞在杀虫剂研究上的应用[J]. 世界农药, 24(4): 28-30. |
程东美, 张志祥, 田永清, 等. 2007. 印楝杀虫作用机理[J]. 植物保护, 33(4): 11-15. |
黄建忠, 李学锋, 胡涛, 等. 2008. 2.5%高效氯氟氰菊酯WP防治十字花科蔬菜蚜虫的田间药效试验.[J]. 农药, 47(5): 378-377. |
毛黎娟, 魏芳林, 朱国念. 2005. 利用MTT法测定杀虫剂对家蚕细胞的毒力[J]. 农药学学报, 7(1): 45-48. |
宋德伟, 马艳, 冯颖, 等. 2004. 昆虫细胞工程进展[J]. 林业科学研究, 17(1): 116-124. |
颜桂军, 荣凤芝, 王勃, 等. 2005. 4%啶虫脒·高氯微乳剂配方的研究与室内毒力测定[J]. 农药, 44(11): 514-515. DOI:10.3969/j.issn.1006-0413.2005.11.010 |
杨红, 周青春, 王家坤, 等. 1996. 利用菜青虫细胞检测几种有机溶剂和有机磷农药的毒力[J]. 植物保护学报, 23(1): 79-83. |
张佑红, 朱雄伟, 陈燕. 2006. 昆虫细胞培养及其应用进展[J]. 武汉化工学院学报, 28(3): 20-24. |
郑丙莲, 杨红, 洪华珠, 等. 2000. 八种昆虫细胞系对灭多威农药的敏感性研究[J]. 生物技术通报, 5: 30-32. DOI:10.3969/j.issn.1002-5464.2000.05.008 |
钟国华, 水克娟, 黄劲飞, 等. 2008a. 植物源物质诱导的斜纹夜蛾细胞凋亡[J]. 昆虫学报, 51(4): 449-453. |
钟国华, 水克娟, 吕朝军, 等. 2008b. 印楝素对SL-1的细胞凋亡诱导作用[J]. 昆虫学报, 51(6): 618-627. |
周炳, 赵美蓉, 张安平, 等. 2007. 马拉硫磷对映体对人成神经细胞瘤细胞生长影响的选择性差异[J]. 农药学学报, 9(3): 263-268. |
周青春, 汪虹, 洪华珠., 等. 1997a. 农药生物制定新方法的研究Ⅰ:几种有机溶剂对中国棉铃虫(Heliothis armiger)细胞生长的影响[J]. 华中师范大学学报:自然科学版, 31(1): 92-95. |
周青春, 杨红, 汪虹, 等. 1997b. 农药生物测定新方法的研究Ⅱ:杀虫剂细胞生测体系的的建立及改进[J]. 华中师范大学学报:自然科学版, 31(4): 456-458. |
周青春, 万树青, 刘钊杰, 等. 1996. 利用MTT法测定杀虫剂对细胞的毒力[J]. 植物保护学报, 23(4): 343-348. |
Das G P, Shaik A P, Jamil K. 2006. Cytotoxicity and genotoxicity induced by the pesticide profenofos on cultured human peripheral blood lymphocytes[J]. Drug and Chemical Toxicology, 29: 313-322. DOI:10.1080/01480540600653093 |
Grace T D C. 1962. Establishment of four strains of cells from insect tissues grown in vitro[J]. Nature, 195(4843): 780-789. DOI:10.1038/195780a0 |
MaramoroschK, 罗曦霞. 1992. 昆虫细胞系的发展:历史回顾[J]. 武汉大学学报, (4): 115-120. |
Lynn D E. 2001. Novel techniques to establish new insect cell lines[J]. In Vitro Cell Dev Biol-Animal, 37(6): 319-321. DOI:10.1007/BF02577564 |
Mitsuhashi J, Grace T D C, Waterhouse D F. 1970. Effects of insecticides on cultures of insect cells[J]. Entomol Exp Appl, (13): 327-331. |
Rahiouid I, Laugier C, Balmand S, et al. 2007. Toxicity, binding an d internalization of the pea-Alb entomotoxin in Sf 9 cells[J]. Biochimie, 89(9): 1-5. |
Salehzadeh A, Jabbar A, Jennens L, et al. 2002. The effects of phytochemical pesticides on the growth of cultured invertebrate and vertebrate cells[J]. Pest Management Science, 58: 268-276. DOI:10.1002/(ISSN)1526-4998 |
Stipanovic R D, Elissalde M H, Altman D W, et al. 1990. Cell culture bioassay to evaluate allelochemicat toxicity to Heliothis viresecn(Lepidopterera: Noctuideal)[J]. J Eoon Entomol, 83: 737-741. DOI:10.1093/jee/83.3.737 |
Waterhouse D F. 1965. Some aspects of Australian entomological research[J]. Proc XII Congr Ent, London, 46: 46-50. |
Yoshida M. 1979. Inhibitory effects of pesticides on growth and respiration of cultured cells[J]. Pesticides Biochemistry and Physiology, 10: 313-321. DOI:10.1016/0048-3575(79)90037-3 |
 2011, Vol. 47
2011, Vol. 47