文章信息
- 郭琦, 王保垒, 王博文, 李百炼, 张德强
- Guo Qi, Wang Baolei, Wang Bowen, Li Bailian, Zhang Deqiang
- 毛白杨PtDREB2A基因的克隆、表达及单核苷酸多态性分析
- Isolation, Expression and Single Nucleotide Polymorphisms Analysis of PtDREB2A in Populus tomentosa
- 林业科学, 2011, 47(4): 49-56.
- Scientia Silvae Sinicae, 2011, 47(4): 49-56.
-
文章历史
- 收稿日期:2010-12-08
- 修回日期:2011-01-22
-
作者相关文章
干旱、高盐及极端温度胁迫是影响森林生产力和限制林业生产的主要非生物胁迫因素, 而生物工程已成为改良植物适应非生物胁迫最为理想和最有前途的方法, 受到世界各国政府的高度重视。国内外研究表明, 植物的抗旱、耐极端温度、耐盐碱等抗逆性状是由多基因控制的数量性状, 是多方面、多层次和多途径协同作用的结果, 有着非常复杂的调控机制(Zhang et al., 2004; Yue et al., 2006)。先前的研究主要涉及干旱、高盐及极端温度胁迫下, 植物在蛋白激酶、水通道调节、渗透调节物质合成、光合作用调节、胚胎发育晚期丰富蛋白等方面发生的变化以及相关基因的克隆和转化, 这些研究成果大大推动了植物抗干旱、耐极端温度、耐盐碱方面的遗传改良进程(Chaves et al., 2004; Rashotte et al., 2006)。迄今, 已克隆了数十个与干旱、极端温度和盐胁迫诱导表达相关的基因, 证实了渗透调节物质如甘露醇、甘氨酰甜菜碱、海藻糖和果聚糖等在高等植物抗干旱、耐极端温度、耐盐碱方面有渗透保护与调节作用, 但这些物质单独对抗逆性状的作用并不显著(Matsukura et al., 2010)。
然而, 最近的研究表明, 植物各种诱导型基因的表达主要受特定转录因子在转录水平上的调控(Agarwal et al., 2006)。而编码脱水响应元件结合蛋白(dehydration responsive element binding protein, DREB)的转录因子基因, 是一种DRE顺式作用元件, 普遍存在于干旱、高盐或低温胁迫应答基因的启动子中, 对在这些胁迫条件下的基因诱导表达起调控作用(Agarwal et al., 2006; Matsukura et al., 2010)。通过将DREB基因分别转入模式植物如拟南芥(Arabidopsis thaliana)以及主要农作物如水稻(Oryza sativa)、玉米(Zea mays)和小麦(Triticum aestivum)等的大量研究充分证明了DREB的过量表达可有效激活并影响靶基因的表达水平, 并能显著提高转化植株对干旱、盐碱及高低温环境的忍耐程度, 从而增强植物对多种逆境的抵抗和适应能力, 为植物抗逆性状的分子育种奠定了重要的基础(Matsukura et al., 2010; Qin et al., 2007; Sakuma et al., 2006b; Xu et al., 2008)。
因此, 在林木, 特别是在用材树种中分离DREB基因家族成员以及深入研究它们对干旱、高盐及极端温度胁迫的分子遗传学调控机制, 从而为选育抗旱、耐盐和能够在极端温度下迅速生长的抗逆树种提供分子基础。特别是最近产生的基于候选基因内单核苷酸(single nucleotide polymorphisms, SNPs)的联合遗传学研究非常有助于林木育种方案的制定(Thumma et al., 2005)。而毛白杨(Populus tomentosa)是我国特有的杨属白杨派(Sect.Leuce)树种, 分布在我国黄淮海流域约100万km2的范围内, 在我国北方, 尤其在黄河流域林业生产和生态环境建设中占有重要地位。在长期进化过程中, 毛白杨种内形成了许多变异类型, 而这种积累的变异能被用来研究控制目标性状的分子遗传学基础(Zhang et al., 2007)。鉴于毛白杨野生性强、遗传变异丰富、进化史较长等特点, 可能很适合用于开展林木数量性状相关基因的SNP发现和联合遗传学研究。为此, 本研究从毛白杨经干旱胁迫后构建的cDNA中分离得到一DREB2A基因的cDNA序列, 并对其进行了组织特异性, 及非生物胁迫、植物激素及糖诱导的差异表达分析。在此基础上, 检测了该基因在毛白杨自然群体中的SNP多样性、单体型(haplotype, Hap)和连锁不平衡(linkage disequilibrium, LD)结构分析。本研究为分离其他树种DREB2A成员以及进行该基因的连锁不平衡作图和基因辅助树木育种提供了重要的依据。
1 材料与方法 1.1 植物材料用于PtDREB2A基因内SNP多样性分析的材料取自全国毛白杨基因库中能够最大程度地反映毛白杨天然分布范围的45株基因型个体(徐煲铧等, 2009); 而用于RNA提取的材料取自1年生毛白杨无性系。
1.2 杨树苗木胁迫处理及植物激素诱导在前期大量预试验的基础上, 确定了较为合理的非生物胁迫及激素诱导试验系统, 即, 对于非生物胁迫处理, 每一处理均将经过无性系化的毛白杨1年生盆栽苗3株, 分别经过高温(42 ℃, 6 h)、低温(4 ℃, 6 h)、干旱(1天)、盐(250 mmol·L-1, 5 h)及水淹(1天); 而对于激素诱导则分别将配制浓度为10 mg·L-1, 100 mg·L-1, 1 μmol·L-1与50 mg·L-1的脱落酸(abscissic acid, ABA)、萘乙酸(naphthaleneacetic acid, NAA)、吲哚乙酸(indole-3-acetic acid, IAA)及赤霉素(gibberellin, GA3)溶液喷施后6 h进行叶片采集。将上述所有处理后采集的叶片组织置于液氮中冻存备用。
1.3 总DNA的提取总DNA的提取按DNeasy Plant Mini Kits (Qiagen, Inc., Valencia, CA, USA)描述的方法进行。
1.4 RNA提取和cDNA的合成将经胁迫处理与植物激素诱导的材料, 及毛白杨根部组织、韧皮部、形成层、未成熟木质部、成熟木质部、嫩叶和成熟叶片材料总RNA的提取和cDNA的合成按Zhang等(2010a)描述的方法进行。
1.5 PtDREB2A基因检测为了分离毛白杨干旱胁迫差异表达的基因, 作者所在课题组构建了毛白杨干旱诱导的cDNA文库, 并对ESTs克隆进行了随机测序与比对, 检测到了一全长DREB2A基因的cDNA序列。
1.6 引物设计和PCR扩增根据所得的PtDREB2A cDNA序列, 在其可能的开放阅读框两端设计1对寡聚核苷酸引物:
PtDREB2AF:5′-TTGGGTCCTGAGATCGAGAA -3′;
PtDREB2AR:5′-GAGCCTTCAATCAGCCTAGAA -3′。
应用25 μL DNA聚合酶链式反应(PCR)体系, 以毛白杨成熟木质部cDNA为模板, 加入2.5 μL 10×buffer, 1.8 μL 25 mmol·L-1 MgCl2, 1 μL 10 mmol·L-1 dNTP, Taq DNA聚合酶1.0 U(以上试剂购自Promega公司), 10 μmol·L-1正向和反向引物各1 μL, 加适量双蒸水至25 μL。于94 ℃ 3 min →(93℃ 30 s →65 ℃ 30 s→ 72℃ 1 min) 40个循环→72 ℃ 5 min热循环条件下, 扩增出长约2 700 bp的cDNA片段。
1.7 PCR产物的克隆、测序及计算机分析将PCR扩增得到的目的基因片段回收后连接于pGEM-T上。连接产物转化大肠杆菌DH5α, 筛选阳性克隆, 送公司测序。应用DNAMAN6.0软件和CLUSTALX软件包程序推导出氨基酸序列并进行NCBI检索分析, 然后分别估算和预测推导蛋白质的分子量和等电点。
1.8 Realtime PCR检测PtDREB2A基因的组织器官及调控表达模式采用ABI Primer Express 3.0软件在PtDREB2A基因内设计能够扩增长度约为63 bp cDNA片段的Realtime PCR引物, 其序列如下:PtDREB2ARTF:5′-AAAGGTAAAGGAGGGCCAGA GA -3′; PtDREB2ARTR:5′-ACTTCCCCCATGTCCTC TGTCT -3′。
以肌动蛋白基因Actin作为内参, 引物序列为ActF:5′-CTCCATCATGAAATGCGATG -3′; ActR:5′-TTGGGGCTAGTGCTGAGATT -3′。定量PCR反应按照Zhang等(2010b)描述的方法进行, 最后用该基因在待测样品中的扩增量与内参Actin基因扩增量的比值, 即相对表达量分析其表达模式。
1.9 PtDREB2A基因的SNP多样性分析依据已克隆的PtDREB2A基因的核苷酸序列设计基因特异的引物, 以选取的45株个体的总DNA为模板进行PCR扩增; 将PCR扩增产物进行琼脂糖凝胶电泳分离, 回收、纯化目的片段后与PGEM-T载体连接, 转化后挑取阳性单克隆进行序列测定。每一阳性克隆重复3次测序, 从而获得准确的测序结果。在此基础上, 组合利用MEGA4.0和DnaSP4.50.4软件对每一基因的45个序列进行分析, 标出SNP位点、计算SNP频率及多样性指数; 分析同义突变、错义突变和无义突变情况。
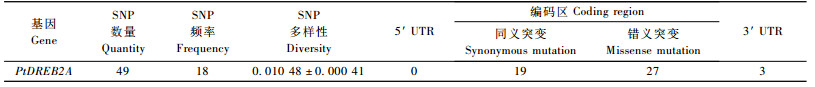
2 结果与讨论 2.1 毛白杨DREB2A同源cDNA的克隆及序列分析在对毛白杨经干旱胁迫后构建的cDNA文库的ESTs克隆随机测序的基础上, 检测到了一DREB2A基因的cDNA序列。在此基础上设计基因特异的引物, 以该文库的cDNA为模板进行PCR扩增后与pGEM-T载体连接后克隆测序。结果表明, 克隆的这一PtDREB2A cDNA总长为946 bp, 分别包含长度为21 bp与61 bp的5′ UTR及3′ UTR(基因注册号为HQ665006);在PtDREB2A序列中, 基因内部含有完整的开放阅读框架, 大小为864 bp, 可编码长度为287个氨基酸残基的蛋白质。运用DNAMAN6.0软件估算推导的该蛋白质的分子量约为31.6 ku, 其等电点为5.22。比较PtDREB2A的cDNA与基因组DNA序列显示, 该基因的编码区域不存在内含子序列。
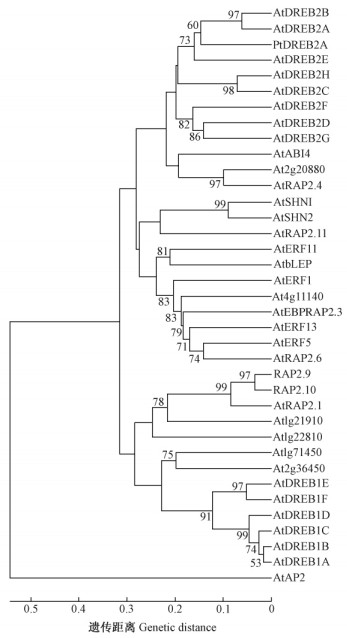
鉴于植物ERF(ethylene-responsive factor)是一很大的基因家族, 模式植物拟南芥及水稻全基因组分别含有122及139个ERF成员, 且分属于12及15个亚家族(Nakano et al., 2006)。为了获知克隆的毛白杨PtDREB2A属于何种类型的ERF成员, 作者由拟南芥每一亚家族中选取1~2个ERF成员及已验证功能的所有ERF基因共35个成员, 与毛白杨PtDREB2A蛋白进行了同源性进化分析(图 1)。由图 1可见, 以拟南芥AtAP2为类外群, 所有的ERF成员聚在一起, 而毛白杨PtDREB2A与拟南芥亚家族Iva中AtDREB2类型的ERF成员属于同一亚家族, 且与拟南芥AtDREB2A的亲缘关系最近, 故将其命名为毛白杨PtDREB2A是合理的。通过Internet进入NCBI, 将PtDREB2A基因序列进行NCBI检索, 结果初步表明PtDREB2A是毛白杨中首次克隆的DREB2类型的转录因子基因。
|
图 1 PtDREB2A与拟南芥ERFs蛋白的系统进化关系 Figure 1 The phylogenetic relationship between PtDREB2A and ERFs from Arabidopsis thaliana |
为了分析PtDREB2A蛋白质的一级结构特征, 将PtDREB2A cDNA推导的氨基酸序列与拟南芥AtDREB2A及水稻OsDREB2A蛋白质序列进行了同源比较和结构分析(图 2)。PtDREB2A氨基酸序列与拟南芥AtDREB2A及水稻OsDREB2A中的AP2/ERF domain序列高度同源, 同源性分别为80.3%和83.3%。由图 2显示的蛋白质一级结构可见, 与模式植物的DREB2A相似, PtDREB2含有植物DREB2A所具有的一切保守结构域, 如在PtDREB2氨基酸序列的中部第78—138氨基酸残基位置含有与抗逆基因启动子区域顺式作用元件CRT/DRE相结合的AP2/ERF结构域(Liu et al., 1998); 除了高度保守的AP2/ERF结构域外, 在N端存在相对保守的核定位信号如KKRK(位于氨基酸序列的19—56), 在C端酸性区域含有转录激活域(位于252—287), 其主要功能被认为是在植物胁迫条件下, 能够驱逐AP2/ERF结构域与DNA的CRT/DRE相结合, 从而激活下游基因的诱导表达(Sakuma et al., 2006a)。
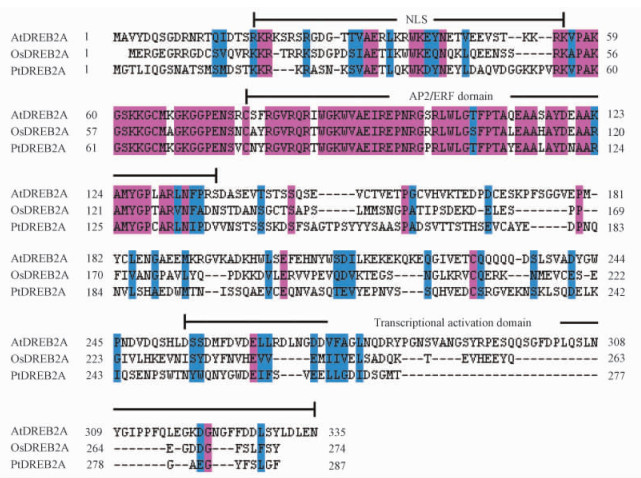
|
图 2 PtDREB2A与拟南芥AtDREB2A及水稻DREB2A蛋白质一级结构比较 Figure 2 Comparison of the primary structure of DREB2A between P.tomentosa and A.thaliana and O.sativa |
为了检测PtDREB2A基因在杨树不同组织与器官中的表达模式, 依据该基因的mRNA序列, 设计1对能够扩增出63 bp的cDNA片段的引物, 以逆转录合成的cDNA第1链为模板, 以Actin基因的扩增量作为内参, 进行Realtime-PCR扩增。PtDREB2A基因在不同组织和器官中的扩增量与内参Actin基因扩增量的比值, 即相对表达量如图 3所示。由图 3可见, PtDREB2A基因在杨树根、茎、叶片和顶端分生组织中均有表达, 但其表达模式却不同:PtDREB2A在叶片中表达丰度最高(4.62), 而在树干皮层及根部组织表达量中等, 在顶端分生组织及主干韧皮部、形成层与木质部表达丰度最低。在逆境状态下, 叶片是感知极端温度、脱水及高盐等抗逆信号较为敏感的器官, 而根部则是在非生物胁迫下直接遭受逆境伤害的组织, 因此由该基因在杨树叶片与根部组织的高丰度表达可推测PtDREB2A可能与逆境胁迫有关。
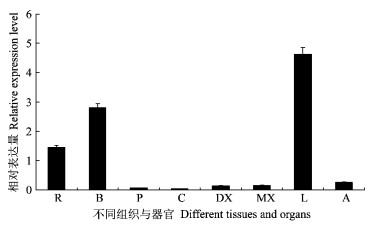
|
图 3 PtDREB2A基因的组织表达谱分析 Figure 3 Relative transcript abundance of PtDREB2A in root, phloem, cambium, xylem, leaf and apex tissues R:根Root; B:树皮Bark; P:树干韧皮部Phloem of stem; C:树干形成层Cambium of stem; DX:树干正在发育的木质部Developing xylem of stem; MX:树干成熟木质部Mature xylem of stem; L:叶片Leaf; A:顶端分生组织Apex. |
虽然克隆的PtDREB2A基因在蛋白质一级结构上具备了植物DREB2A类型的一切结构特征, 但不同物种在进化过程中形成了其特异的抗逆机制, 特别是多年生树木与1年生草本植物可能具有不同的基因调控机制。因此, 很有必要在转录水平上检测PtDREB2A基因对各种非生物胁迫是否具有调控表达作用。为此, 利用定量Realtime-PCR技术检测了毛白杨PtDREB2A基因在不同逆境条件及激素处理诱导下的RNA转录水平, 并计算PtDREB2A基因的扩增量与内参Actin基因扩增量的比值, 即相对表达量(图 4)。由图 4A可见, 除处于水淹状态下, 在其他逆境如高温、干旱、低温及高盐条件下, PtDREB2A基因在转录水平均有不同程度的上调表达。与对照相比, 表达量分别提高了1.8 ~48.8倍, 其中该基因对高温胁迫的响应最为明显。因此, Realtime-PCR检测结果显示, 所分离的PtDREB2A是受极端温度、干旱及高盐(NaCl)胁迫诱导表达的基因。
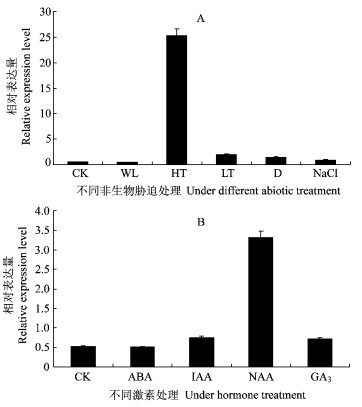
|
图 4 PtDREB2A的非生物胁迫及激素诱导差异表达分析 Figure 4 Regulation of PtDREB2A expression induced by abiotic stress and hormone treatment WL:水淹Water logging; HT:高温High temperature; LT:低温Low temperature; D:干旱Drought. |
植物激素, 如脱落酸(ABA)、吲哚乙酸(IAA)、萘乙酸(NAA)与赤霉素(GA3)等是植物生长发育及抵御逆境胁迫的重要调节剂, 可能参与调控抗逆基因的表达。而本文克隆的PtDREB2A基因是否受外源激素影响呢, 及究竟何种激素对该基因的诱导具有重要调控作用?为了回答这一问题, 作者在毛白杨叶片上喷施了外源激素如ABA, IAA, NAA及GA3, 同样采用Realtime-PCR技术检测了该基因的mRNA转录水平(图 4B)。由图 4B显示的结果可见, 外源激素如生长素IAA, NAA及赤霉素GA3的施加均显著提高了PtDREB2A基因的表达, 而PtDREB2A与脱落酸ABA的诱导无关。
先前已在模式植物如拟南芥及主要农作物如水稻、小麦与玉米中对DREB2A类型的基因进行了较为详尽的非生物胁迫诱导表达模式研究, 证明了该类基因在不依赖于ABA的胁迫信号转导途径中, 通过与DREB的相互作用, 激活下游基因RD29A的表达来实现其抗逆功能。如Liu等(1998)在利用酵母单杂交技术分离出AtDREB2A基因的基础上, 诱导表达结果显示, 拟南芥AtDREB2A受脱水及高盐(250 mmol·L-1 NaCl)胁迫诱导, 但与寒冷及ABA的诱导无关。在拟南芥中正反义表达DREB2A不仅会引起干旱和盐响应基因的表达, 还引起了热激相关基因的表达, 正义表达DREB2A显著增加了转基因植株的耐热性, 而反义表达的植株则降低了耐热性(Sakuma et al., 2006b)。在水稻中共检测到6个DREB2类型的基因成员, 对其中5个进行了诱导表达分析后显示, 与毛白杨同源性最高的OsDREB2A的表达受干旱和高盐的诱导, 而与寒冷及ABA的诱导无关(Matsukura et al., 2010)。不像拟南芥与水稻中的DREB2A基因, 小麦与玉米中DREB2A的表达不仅受干旱与高盐诱导, 且与寒冷的诱导相关(Qin et al., 2007; Xu et al., 2008)。因此, 不同物种DREB2A类型基因的表达机制可能与该物种在长期演化过程中形成的适应性进化有关, 而本文研究结果初步表明PtDREB2A基因的表达不仅受到高温、低温、干旱及高盐等非生物胁迫因素的影响, 还与植物激素如NAA, IAA及GA3诱导有关。
2.3 PtDREB2A基因内SNP的多样性分析基因的遗传多样性是伴随物种长期进化过程中形成的种内核苷酸位点的微小变异, 而研究基因内SNP的多样性是对该基因进行群体遗传学和“基于候选基因内SNP连锁不平衡作图”的基础。为此, 在分析PtDREB2A cDNA序列的基础上, 以取自毛白杨自然分布区中3个群体, 包含9个省、市、自治区, 能够最大范围覆盖毛白杨生长区域的45株基因型个体为材料, 对包含21 bp的5′ UTR, 864 bp的编码区和61 bp的3′ UTR等共946 bp的核苷酸序列进行了单核苷酸多态性分析(表 1)。由表 1可见, 在毛白杨物种演化过程中PtDREB2A基因内分别发生了1次插入、1次缺失及49个单核苷酸突变。其中, 插入和缺失均发生在编码区, 长度分别为3 bp与33 bp, 由此可看出, 在该基因内发生的插入与缺失均未导致移码突变。因此, 对于PtDREB2A基因, 在长度为864 bp的区域内SNP发生的频率为1/18 bp, SNP多样性, 即, 任意两序列之间核苷酸差异的平均数πT=0.010 48±0.000 41。在此基础上, 分析了SNPs在群体中的频率, 结果显示, 在检测到的49个SNPs中, 有14个属于常见SNPs, 即其出现频率超过10%, 而34个属于罕见SNPs。与人类相比(Suha et al., 2005), 在毛白杨中SNP发生的频率较高, 这主要由于树木野生性强、高度杂合, 在其物种长期演化过程中, 为了适应自然界多变的高温、寒冷、干旱等非生物胁迫和抵御病虫等生物胁迫, 在自然选择的作用下形成了许多变异类型。
|
|
为了检测PtDREB2A基因编码区内核苷酸位点的改变是否影响了其编码的氨基酸序列, 在分析SNP多态性位点的基础上进行了氨基酸的多样性分析。对PtDREB2A基因编码区内的46个SNPs进行了同义突变、错义突变和无义突变分析, 结果如表 1所示。由表 1可见, 在PtDREB2A编码区内的46个SNPs中, 有19个属于同义突变, 它们均位于密码子的第3个核苷酸上, 而27个属于错义突变, 没有检测到无义突变。鉴于错义突变中常见SNP对于候选基因内SNP连锁不平衡作图的重要性, 需要对错义突变中的常见SNP进行详细分析。在27个错义突变中, 有7个属于常见SNPs。其中, 有2, 4与1个分别位于密码子的第1, 2及3个核苷酸位置上。如, 在编码区的第52及第757位置上分别发生了第1位密码子的突变, 由原来的ACT < GCT与TAT < GAT, 从而分别导致其编码的氨基酸由苏氨酸(Thr) < 丙氨酸(Ala)与酪氨酸(Tyr) < 天门冬氨酸(Asp)。在编码区中, 同义突变与错义突变的核苷酸多样性分别为πsyn=0.014 95, πnonsyn=0.008 90, 非同义突变与同义突变的比率为0.60。因此, 对于PtDREB2A基因, 由其编码区内部发生的非同义突变与同义突变的比率0.60 < 1, 显示了在毛白杨物种演化过程中, 是纯化选择, 而不是自然选择对PtDREB2A基因内同义SNP位点起了主要的进化驱动力。
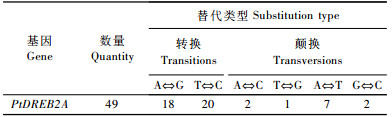
为了分析毛白杨PtDREB2A基因内核苷酸突变的替代类型, 对检测到的49个SNPs进行变异类型统计(表 2)。由表 2可见, 在这些SNPs中, 有38个属于转换类型, 分别包含18个G⇔A和20个C⇔T。对于颠换替代类型, 共检测到11个, 分别包括2个C⇔A, 3个G⇔T, 4个A⇔T和2个C⇔G。因此, 转换/颠换为3.45>2.0, 造成这一结果可能是, SNP在CG序列上出现最为频繁, 而且多是C→T, 原因是CG中C即胞嘧啶常为甲基化的、自发地脱氨后即成为胸腺嘧啶(Suha et al., 2005)。
|
|
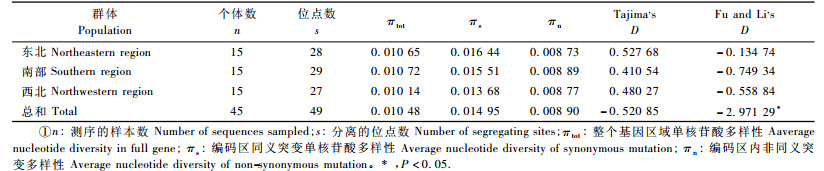
毛白杨属我国的乡土树种, 在长期的物种演化过程中, 形成了3个相对独立的气候与地理区域, 很有必要利用基因内SNP遗传多样性来研究区域内及区域间的遗传分化程度。为此, 作者对其分别进行了单核苷酸多样性、Tajima's D(Tajima, 1989)和Fu and Li's D (Fu et al., 1993)的中性检验(表 3)。由表 3可见, 对于检测的SNP多样性指数如πtot, πs和πn在3个群体间虽有不同但显示了相似的结果, 表明在毛白杨进化过程中3个区域受到了相似的选择压。总体上看, 利用Tajima's D和Fu and Li's D进行的中性检验结果表明, D*均为负值, 这显示了在整个群体内, PtDREB2A在进化过程中存在过剩的罕见SNP, 且多数是有害变异, 造成的这些变异由于受到负选择作用而在种群中保持比较低的比例。例如, 在毛白杨整个自然分布区及3个相对独立的分布区, 罕见SNP的比例均多于65%。对于3个群体来说, 均为πn < πs, 即非同义突变与同义突变的比率 < 1, 因此, 在毛白杨3个相对独立的分布区内, 纯化选择是对该基因内同义SNP位点的主要选择压。
|
|
1) 利用RT-PCR方法, 首次由毛白杨受干旱胁迫后构建的cDNA文库中扩增获得一PtDREB2A cDNA克隆, 并进行了测序和序列分析, 结果表明克隆的PtDREB2A基因内部含有完整的开放阅读框架, 大小为864 bp, 可编码长度为287个氨基酸残基的蛋白质。推导的蛋白质一级结构显示, PtDREB2A含有植物DREB2A所具有的一切保守结构域, 即在其氨基酸序列的中部第78—138氨基酸残基位置含有与抗逆基因启动子区域顺式作用元件CRT/DRE相结合的AP2/ERF结构域, 而在N端存在相对保守的核定位信号如KKRK(位于氨基酸序列的19—56), 以及在C端酸性区域含有转录激活域(位于252—287)。
2) PtDREB2A基因的组织器官及调控表达分析表明, 该基因在杨树叶片中表达丰度最高, 在树干皮层及根部组织表达量中等, 而在顶端分生组织及主干韧皮部、形成层与木质部表达丰度最低。在逆境包括高温、干旱、低温及高盐条件下, PtDREB2A基因在转录水平上均有不同程度的上调表达, 表达量分别提高了1.8~48.8倍, 其中对高温胁迫的响应最为明显。植物激素诱导表达显示, 外源激素如生长素IAA, NAA及赤霉素GA3的施加显著提高了PtDREB2A基因的表达, 而PtDREB2A与脱落酸ABA的诱导无关。
3) 在毛白杨自然群体内, PtDREB2A基因内存在丰富的SNP变异, 多样性水平π高达0.010 48±0.000 41, SNP频率为1/18 bp; 对于编码区域, 在毛白杨整个群体及3个相对独立的分布区内, 均为非同义突变与同义突变的比率<1, 推测纯化选择是毛白杨自然群体内PtDREB2A基因内同义SNP位点的主要选择压。
徐煲铧, 杨晓慧, 李百炼, 等. 2009. 毛白杨纤维素合酶基因PtCesA4的克隆、表达及单核苷酸多态性分析[J]. 林业科学, 45(5): 1-10. DOI:10.11707/j.1001-7488.20090501 |
Agarwal P K, Agarwal P, Reddy M K, et al. 2006. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants[J]. Plant Cell Reports, 25(12): 1263-1274. DOI:10.1007/s00299-006-0204-8 |
Chaves M M, Oliveira M M. 2004. Mechanisms underlying plant resilience to water deficits:prospects for water-saving agriculture[J]. Journal of Experimental Botany, 55(407): 2365-2384. DOI:10.1093/jxb/erh269 |
Fu Yunxin, Li Wenhsiung. 1993. Statistical tests of neutrality of mutatons[J]. Genetics, 133(3): 693-709. |
Liu Qiang, Kasuga M, Sakuma Y, et al. 1998. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression, respectively, in Arabidopsis[J]. The Plant Cell, 10(8): 1391-1406. DOI:10.1105/tpc.10.8.1391 |
Matsukura S, Mizoi J, Yoshida T, et al. 2010. Comprehensive analysis of rice DREB2-type genes that encode transcription factors involved in the expression of abiotic stress-responsive genes[J]. Mol Genet Genomics, 283(2): 185-196. DOI:10.1007/s00438-009-0506-y |
Nakano T, Suzuki K, Fujimura T, et al. 2006. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiol, 140(2): 411-432. DOI:10.1104/pp.105.073783 |
Qin F, Kakimoto M, Sakuma Y, et al. 2007. Regulation and functional analysis of ZmDREB2A in response to drought and heat stresses in Zea mays L[J]. Plant J, 50(1): 54-69. DOI:10.1111/j.1365-313X.2007.03034.x |
Rashotte A M, Mason M G, Hutchison C E, et al. 2006. A subset of Arabidopsis AP2 transcription factors mediates cytokinin responses in concert with a two-component pathway[J]. Proc Natl Acad Sci USA, 103(29): 11081-11085. DOI:10.1073/pnas.0602038103 |
Sakuma Y, Maruyama K, Osakabe Y, et al. 2006a. Functional analysis of an Arabidopsis transcription factor, DREB2A, involved in drought-responsive gene expression[J]. The Plant Cell, 18(5): 1292-1309. DOI:10.1105/tpc.105.035881 |
Sakuma Y, Maruyama K, Qin F, et al. 2006b. Colloquium paper:dual function of an Arabidopsis transcription factor DREB2A in water-stress-responsive and heat-stress-responsive gene expression[J]. Proc Natl Acad Sci USA, 103(49): 18822-18827. DOI:10.1073/pnas.0605639103 |
Suha Y, Vijg J. 2005. SNP discovery in associating genetic variation with human disease phenotypes[J]. Mutation Research, 573(1/2): 41-53. |
Tajima F. 1989. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics, 123(3): 585-595. |
Thumma B R, Nolan M F, Evans R, et al. 2005. Polymorphisms in Cinnamoyl CoA reductase (CCR) are associated with variation in microfibril angle in Eucalyptus spp[J]. Genetics, 171(3): 1257-1265. DOI:10.1534/genetics.105.042028 |
Xu Z S, Ni Z Y, Liu L, et al. 2008. Characterization of the TaAIDFa gene encoding a CRT/DRE-binding factor responsive to drought, high-salt, and cold stress in wheat[J]. Mol Genet Genomics, 280(6): 497-508. DOI:10.1007/s00438-008-0382-x |
Yue B, Xue W Y, Xiong L Z, et al. 2006. Genetic basis of drought resistance at reproductive stage in rice:separation of drought tolerance from drought avoidance[J]. Genetics, 172(2): 1213-1228. |
Zhang Deqiang, Du Qingzhang, Xu Baohua, et al. 2010a. The actin multigene family in Populus:organization, expression and phylogenetic analysis[J]. Mol Genet Genomics, 284(2): 105-119. DOI:10.1007/s00438-010-0552-5 |
Zhang Deqiang, Yang Xiaohui, Zhang Zhiyi, et al. 2010b. Expression and nucleotide diversity of the poplar COBL gene[J]. Tree Genetics and Genomes, 6(2): 331-344. DOI:10.1007/s11295-009-0252-7 |
Zhang Deqiang, Zhang Zhiyi, Kai Yang. 2007. Identification of AFLP markers associated with embryonic root development in Populus tomentosa[J]. Silvae Genetica, 56(1): 27-32. |
Zhang J Z, Creelman R A, Zhu J K. 2004. From laboratory to field:Using information from Arabidopsis to engineer salt, cold, and drought tolerance in crops[J]. Plant Physiol, 135(2): 615-621. DOI:10.1104/pp.104.040295 |
 2011, Vol. 47
2011, Vol. 47