文章信息
- 孙山, 张立涛, 高辉远, 束怀瑞
- Sun Shan, Zhang Litao, Gao Huiyuan, Shu Huairui
- 苹果绿色果实的光合生理特性
- Photosynthetic Characteristics of Green Apple Fruits
- 林业科学, 2011, 47(4): 33-37.
- Scientia Silvae Sinicae, 2011, 47(4): 33-37.
-
文章历史
- 收稿日期:2010-04-14
- 修回日期:2010-08-11
-
作者相关文章
2. 山东农业大学作物生物学国家重点实验室 泰安 271018
2. State Key Laboratory of Crop Biology, Shandong Agricultural University Tai'an 271018
果实的个体发育分为2个明显不同的时期, 第1个时期为受精后果实细胞分裂体积不断膨大的生长阶段, 第2个时期是生化组分剧烈变化的成熟阶段(Goldschmidt, 1980)。在生长阶段的果实外层组织具有发育完全的叶绿体(Brady, 1987), 绿色果实如同叶片一样也可进行光合作用并影响到果实的品质(Blanke, 1998; Robert et al., 1999)。对猕猴桃(Actinidia deliciosa)果实的研究表明:内果肉即使接受到大约仅为照射到果实表面1/30的光线, 其叶绿体也能较好地发育(Possingham et al., 1980; 宗亦臣等, 2004), 猕猴桃果肉不同组织区的光环境不同(Guido et al., 2003), 光合色素的分布也存在差异(郭学民等, 2008)。现有的光合作用的研究方法几乎都是建立在叶片基础上的, 果实无论是形态还是组织结构均与扁平的叶片截然不同, 已有的建立在叶片基础上的方法无法直接应用于果实, 这是人们对果实光合作用的了解有限的主要原因之一。绿色果实光合作用的研究仍停留在对整个果实的测定水平(Blanke, 1992; Fleancu, 2007)。球形果实与叶片不同, 只有外层细胞进行光合作用, 其测定结果明显受果肉呼吸强度的影响。随着果实生长, 果皮的比表面逐渐下降, 使得以单位体积或质量计算的果实光合速率难以进行不同大小果实或不同发育期果实的比较, 测定单位面积果皮的光合速率则可以解除这一限制。
植物在其生长过程中能够适应其所处的光环境, 如叶片可分为阴生叶和阳生叶2类(Yano et al., 2004)。在苹果(Malus pumila)果实的发育过程中, 其阳面比阴面处于更强的光照环境下, 另外果实的上、中、下各部分接受日光的照射角度也不同。因此, 要比较不同时期和不同环境条件下果实光合能力的差异, 必须首先了解果皮各部位的光合能力的差异, 以及果皮进行光合作用所需的饱和光强和最适温度。上述光合参数的确定, 对于阐明果皮的光合作用及其对光照、温度的适应, 了解果实光合作用对果实生长和产量的贡献以及果实对光、温氧化胁迫的响应都有重要的理论和实际意义。
本研究以新红星苹果(M. pumila cv. Starkrimson)为材料, 通过对绿色果皮的光合作用及其对光、温的响应规律的研究, 以及对果皮光合色素和光合能力随果实发育的变化的研究, 加深对苹果果实光合能力变化规律的了解, 为进一步深入研究苹果绿色果实的光合生理及逆境生理奠定基础。
1 材料与方法本试验于2007—2008年进行。不同年份的苹果绿色果实发育动态, 分别以花后天数进行比较分析。
1.1 试验材料供试苹果果实取自泰安市岱岳区季家庄果园, 试验树为9~10年生八棱海棠(Malus micromalus)砧木的新红星品种。树形为主干疏层形, 植株生长健壮, 株行距为3 m×4 m, 果园管理水平中等。从树冠的南向外围, 选择色泽相似、发育正常、无损伤的绿色果实, 取下后放入铺有湿纱布的保温桶内迅速带回实验室, 进行相关的试验测定。
1.2 果皮光合速率的测定用配置LED光源(发光峰值在650 nm)的ChloloLab2液相氧电极(Hansatech, 英国)测定果皮的光合放氧。每次选取3~4个果实, 除特殊注明外, 均切取阳面的中心区域。果实首先在30 ℃、光强为200 μmol·m-2 s-1的光照培养箱中适应半小时, 用打孔器在果皮上切取面积0.5 cm2、厚度0.5 mm的果皮圆片直接用来测定光合放氧, 以消除因切碎果皮不均匀所产生的误差。将果皮圆片置于盛有反应液的注射器中抽负压排除细胞间隙的空气, 然后, 用自制的金属丝钩将果皮片悬挂于ChloloLab-2氧电极的反应室中, 并使表面垂直于光源, 反应室内加入2 mL 20 mmol·L-1 NaHCO3反应液, 通过磁性转子连续搅动反应液, 反应室温度通过NESLAB RTE-10恒温水浴(Thermo Electron Corp., 美国)将反应室的温度保持在30.0 ℃, 在饱和光强下(500 μmol·m-2 s-1)光照15 min, 以最后4 min间隔的斜率计算光合放氧速率。
测定光照、温度响应曲线时, 分别以LED光源和恒温水浴控制光强和反应室的温度。
1.3 果实反射光谱测量用配有自制果实测量探头的Unispec-SC便携式光谱仪(PP System, 美国)进行苹果果实的反射光谱测量。每次测量选取尽可能一致的4~6个果实测定阳面的中心区域。反射光谱数据用Multispec 5.1.5软件进行分析, 以参比白板(Spectralon, 美国)作为反射标准计算反射率。分别用改进型归一化植被指数mND(mND=(R750-R705)/(R750+R705-2R445)、类胡萝卜素反射光谱指数CRI(CRI=R800/(R520-/R550)表示叶绿素和类胡萝卜素的相对含量(Sims et al., 2002; Merzlyak et al., 2003), 以反射光谱指数PSRI(PSRI=(R678-/R486)/R800)表示类胡萝卜素与叶绿素含量的相对比值(Merzlyak et al., 2003)。
1.4 数据统计分析方法应用SPSS统计分析软件进行数据分析, 应用Excel软件进行图形处理。
2 结果与分析 2.1 苹果绿色果实不同部位果皮光合速率的变化 2.1.1 绿色果实阴、阳面果皮的光合能力差异从图 1可看出:新红星苹果果皮阴、阳面的光合能力存在显著性差异。花后35天新红星阳面果皮的光合放氧速率是阴面果皮的2.06倍。

|
图 1 花后35天新红星苹果果实阴、阳面果皮的光合放氧速率 Figure 1 Photosynthetic O2 evolution rates in sun-exposed peels and shaded peel of Starkrimson fruit for 35 days after bloom (DAB) 每个数据为4个果实测定的平均值, 不同字母表示差异水平P<0.05。下同。 Data are mean values of 4 independent measurements Differences at P<0.05 are indicated by different letters. The same below. |

|
图 2 花后35天新红星苹果果实阳面果皮纵向不同部位的光合放氧速率 Figure 2 Photosynthetic O2 evolution rates in the sun-exposed peel at different longitudinal positions of Starkrimson fruit for 35 days after bloom (DAB) |
从花后35天新红星阳面果皮纵向比较看, 萼端部位果皮的光合放氧速率最大, 果肩部位果皮的光合放氧速率最小, 二者之间存在显著差异, 而阳面中部果皮的光合放氧速率(3.46 μmol·m-2s-1)与纵向平均值(3.50 μmol·m-2s-1)接近, 能较好地反映果实的平均光合速率。
2.2 苹果绿色果皮光合作用对光强的响应从新红星苹果果皮光合放氧对光强的响应可以看出:花后28天时的饱和光强为300 μmol·m-2s-1左右; 随着果实的发育, 果实的最大光合能力下降, 饱和光强也略有下降(图 3)。

|
图 3 花后28天和56天新红星苹果果皮的光合对不同光强的响应 Figure 3 Responses of photosynthetic O2 evolution rates in Starkrimson peel to different photosynthetic active radiation for 28 and 56 days after bloom(DAB) respectively 每个数据为3个果实测定的平均值。 Data are mean values of 3 independent measurements. |
花后28天时新红星苹果果皮的光合最适温度范围为25~38 ℃。尽管果实的最大光合能力随着果实的发育下降, 但后期的光合适温范围变宽, 且在高温下光合放氧值的下降速度较慢(图 4)。

|
图 4 花后28天和56天新红星苹果果皮光合放氧速率对不同温度的响应 Figure 4 Responses of photosynthetic O2 evolution rates in Starkrimson peel to different peel temperatures for 28 and 56 days after bloom respectively 每个数据为3个果实测定的平均值. Data are mean values of 3 independent measurements. |
新红星苹果的阳面果皮中叶绿素总量的动态变化整体上随果实发育呈下降的趋势(图 5)。在绿色果实发育前期(盛花后41天之前)果皮中的叶绿素含量都处于较高水平, 而后叶绿素含量随着果实发育快速下降。
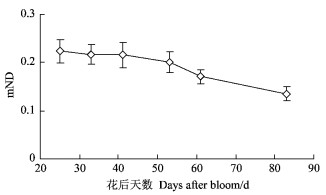
|
图 5 苹果绿色果实发育过程中阳面果皮相对叶绿素含量(mND)的动态变化 Figure 5 Dynamic variation of relative chlorophyll content (mND) in the sun-exposed peel during apple green fruit development 每个数据为11次测定的平均值. Data are mean values of 11 independent measurements. |
新红星苹果阳面果皮中的类胡萝卜素含量表现出与叶绿素相似的变化规律(图 6), 但与叶绿素的比值则随发育期而逐渐增加(图 7), 说明阳面果皮内叶绿素的降解速度大于类胡萝卜素。
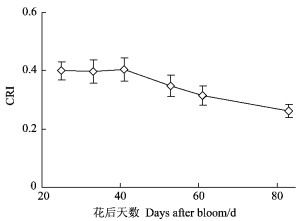
|
图 6 苹果绿色果实发育过程中阳面果皮相对类胡萝卜素含量(CRI)的动态变化 Figure 6 Dynamic variation of relative carotenoids contents (CRI) in the sun-exposed peel during apple green fruit development 每个数据为11次测定的平均值. Data are mean values of 11 independent measurements. |

|
图 7 苹果绿色果实发育过程中阳面果皮类胡萝卜素与叶绿素含量相对比值(PSRI)的动态变化 Figure 7 Dynamic variation of carotenoids/chlorophyll ratio (PSRI) in the sun-exposed peel during apple green fruit development 每个数据为11次测定的平均值. Data are mean values of 11 independent measurements. |
新红星苹果阳面果皮光合放氧速率, 在花后25~83天的发育过程中, 果皮的最大光合能力一直在下降。当果实发育至着色前的83天时, 净光合速率已不足花后25天时的30%(图 8)。
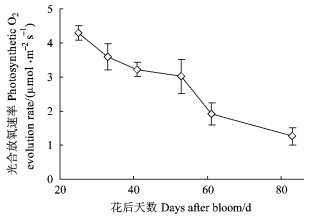
|
图 8 苹果绿色果实发育过程中阳面果皮光合放氧速率的动态变化 Figure 8 Dynamic variations of photosynthetic O2 evolution rates in the sun-exposed peel during apple green fruit development 每个数据为3个果实测定的平均值. Data are mean values of 3 independent measurements |
尽管植物叶片是植物进行光合作用的重要器官, 绿色果实同叶片一样也能进行光合作用(Blanke et al., 1989)。本研究结果表明:新红星苹果果实阴、阳面以及阳面果皮纵向的光合能力之间存在明显差异, 阳面果皮的光合放氧速率明显大于阴面果皮。纵向比较可知:萼端部位果皮的光合放氧速率最大, 果肩部位果皮的光合放氧速率最小, 阳面中部果皮的光合放氧速率与纵向平均值接近, 具有较好的代表性。不仅果皮的光合能力低于叶片(苹果叶片10~15 μmol·m-2 s-1), 其光合作用的饱和光强也较低。测定果实光合放氧速率的适宜光强和温度分别为500 μmol·m-2 s-1和30 ℃。随着果实发育, 其光合能力下降, 但饱和光强变化不大, 最适温度范围变宽。
叶片的光合能力在展叶过程中逐步提升(孙山等, 2009b), 但苹果的绿色果皮完全不同, 其绿色果皮的光合放氧速率随着发育过程一直在下降(花后25天幼果至着色前)。苹果果实为异养的繁殖器官, 生长发育所需的营养主要靠临近的枝叶供应。作为光合生产器官的叶片其自身建造过程也是对光合产物的消耗过程, 只有在自身建成进入光合生产的净积累之后, 才能将光合产物的盈余大量输送至果实用于果实发育。花后50余天内正是新梢快速生长和叶幕迅速形成期, 此时外来光合产物不能满足果实生长发育的需要, 所以, 在幼果发育早期, 果实光合作用保持较高水平, 可以补充其自身发育过程中外源碳供应的不足。
由于叶绿素参与光合作用过程中的光能吸收、传递和原初光化学反应, 光合速率与叶绿素含量之间必然存在密切的联系。新红星苹果阳面果皮中叶绿素含量在果实发育前期处于较高水平, 而后随着果实发育单位面积果皮的叶绿素含量快速下降。类胡萝卜素表现出与叶绿素相似的变化规律, 但单位果皮面积类胡萝卜素总量与叶绿素总量的比值则随发育期而逐渐增加。
由于果实自身的构造特点, 例如果皮表面的气孔频度只有同种植物叶片的1%~10%, 而且气孔数目在花期即已确定, 随着果实膨大气孔频度进一步下降(Fleancu, 2007), 使得果实的气体交换和通过蒸腾散热的能力均远远低于叶片, 造成果实的光合作用经常会受到光照、温度的大幅度变化的影响。笔者前期的工作已经证实, 在强光下, 绿色果皮中也存在光抑制(孙山等, 2009a)。如果绿色果实吸收的过量激发能不能被及时有效地耗散掉, 就会产生大量的活性氧, 对光合器官和其他组织造成严重的伤害。植物要减少过剩激发能的产生, 除了通过多种热耗散过程以外, 还可以主动地通过提高光合能力降低过剩光能的程度和减少光能的吸收来实现。但相对于叶片, 苹果绿色果实的光能利用能力较低, 加之叶片发育进入叶功能期后, 上述供需矛盾已不存在。因此笔者推测, 苹果绿色果实发育的中后期, 通过叶绿素的降解以减少光吸收, 是一种主动的光破坏防御机制, 具有光破坏防御作用的类胡萝卜素与叶绿素的比值的上升也间接的证明了这一点。苹果果实在发育过程中的这些变化可能是长期进化过程中形成的对光环境的一种适应机制。
郭学民, 王贵禧, 高荣孚. 2008. 猕猴桃果实发育期不同组织区光合色素和叶绿体的分布[J]. 园艺学报, 35(9): 1277-1284. |
孙山, 张立涛, 高辉远, 等. 2009a. 晴天条件下光、温变化对苹果绿色果皮原初光化学反应的影响[J]. 应用生态学报, 20(10): 2431-2436. |
孙山, 张立涛, 杨兴华, 等. 2009b. 板栗幼叶展开过程中的反射光谱和叶绿素荧光动力学[J]. 林业科学, 45(4): 162-166. |
宗亦臣, 施定基, 王贵禧, 等. 2004. 猕猴桃果肉叶绿体的超微结构[J]. 中国农学通报, 20(3): 76-77. |
Blanke M M, Lenz F. 1989. Fruit photosynthesis[J]. Plant Cell Environment, 12(1): 31-46. DOI:10.1111/pce.1989.12.issue-1 |
Blanke M M. 1992. Photosynthesis of avocado fruit[J]. Proceedings of the Second World Avocado Congress: 179-189. |
Blanke M M. 1998. Fruit photosynthesis and pome fruit quality[J]. Acta Horticulturae (ISHS), 466: 19-22. |
Brady C J. 1987. Fruit ripening[J]. Annual Review of Plant Physiology, 38: 155-78. DOI:10.1146/annurev.pp.38.060187.001103 |
Fleancu M. 2007. Correlations among some physiological processes in apple fruit during growing and maturation processes[J]. International Journal of Agriculture & Biology, 9(4): 613-616. |
Goldschmidt E E.1980.Pigment changes associated with fruit maturation and their control.//Thimann K V.Senescence in Plants.Boca Raton:CRC Press Inc, 207-217.
|
Guido A, Hardy P. 2003. Non-foliar photosynthesis:a strategy of additional carbon acquisition[J]. Flora, 198(2): 81-97. DOI:10.1078/0367-2530-00080 |
Merzlyak M N, Solovchenko A E, Gitelson A A. 2003. Reflectance spectral features and non-destructive estimation of chlorophyll, carotenoid and anthocyanin content in apple fruit[J]. Postharvest Biology and Technology, 27(2): 197-211. DOI:10.1016/S0925-5214(02)00066-2 |
Possingham J V, Coote M, Hawker J S. 1980. The plastids and pigments of fresh and dried Chinese gooseberries (Actinidia chinensis)[J]. Annals of Botany, 45(5): 529-533. DOI:10.1093/oxfordjournals.aob.a085856 |
Robert M S, Suzan E H, Davies W J. 1999. Photosynthetic activity of the calyx, green shoulder, pericarp and locular parenchyma of tomato fruit[J]. Journal of Experimental Botany, 50(344): 707-718. |
Sims D A, Gamon J A. 2002. Relationship between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and development stages[J]. Remote Sensing of Environment, 81(213): 337-354. |
Yano S, Terashima I. 2004. Developmental process of sun and shade leaves in Chenopodium album L[J]. Plant, Cell & Environment, 27(6): 781-793. |
 2011, Vol. 47
2011, Vol. 47

