文章信息
- 张军, 杨敏生, 张钢, 郭仲军, 臧润国
- Zhang Jun, Yang Minsheng, Zhang Gang, Guo Zhongjun, Zang Runguo
- 新疆野苹果天然群体抗寒性的电阻抗图谱分析
- Assessing Frost Hardiness of Malus sieversii Natural Populations by Electrical Impedance Spectroscopy
- 林业科学, 2011, 47(4): 20-26.
- Scientia Silvae Sinicae, 2011, 47(4): 20-26.
-
文章历史
- 收稿日期:2010-04-14
- 修回日期:2011-03-03
-
作者相关文章
2. 河北农业大学园艺学院 保定 071001;
3. 新疆林业科学院 森林生态研究所 乌鲁木齐 830000;
4. 中国林业科学研究院森林生态环境与保护研究所 北京 100091
2. College of Horticulture, Agricultural University of Hebei Baoding 071001;
3. Institute of Forest Ecology, Xinjiang Academy of Forestry Science Urumqi 830000;
4. Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091
新疆野苹果(Malus sieversii)属于第三纪孑遗物种, 是珍贵的种质资源, 在我国仅分布于新疆的伊犁和塔城地区海拔1 000~1 700 m的山地, 是该地落叶阔叶林的主要组成树种(林培钧等, 2000)。野苹果具有抗寒性强、耐虫、耐病、耐旱等优良性状, 为我国果树生产和遗传育种提供大量的抗逆性强的种苗和基因资源。对新疆野苹果天然群体进行抗寒性的分析, 探明不同群体间的抗寒差异, 可以从生理方面反映新疆野苹果天然群体的多样性, 也可以反映其适应性, 为新疆野苹果抗寒育种资源的选择和保存打下基础, 也为其合理保护、繁殖和科学研究提供依据。
常用于植物抗寒性测定的方法有:电导法(electrolyte leakage, EL)、全株冰冻测试法(whole-plant freeze testing, WPFT)、叶绿素荧光法(chlorophyll fluorescence, CF)、差热分解法(differential thermal analysis, DTA)和电阻抗图谱法(electrical impedance spectroscopy, EIS)。应用电阻抗图谱(EIS)法对生物系统进行研究, 开始于19世纪后期, 并且在植物生理学研究方面的应用范围不断扩展, 作为一种测定植物抗寒性的方法, 近年来在农业、林业和园艺领域的应用正在扩大(张钢等, 2005)。但对于木本植物进行EIS法的研究才兴起。国内对EIS法研究正处于萌芽阶段, 利用其对新疆野苹果抗寒性方面的研究目前还未见报导。本研究采用电导法(EL)和电阻抗图谱法(EIS)首次对新疆野苹果进行抗寒性测定, 分析和比较群体间抗寒性的差异, 并且对比分析单-DCE模型中6个EIS法参数(弛豫时间τ、弛豫时间的分布系数ψ、电阻率r和r1、胞外电阻率re、胞内电阻率ri)估测抗寒性的可能性, 并与电导率法进行对比, 证明EIS法在测定不同新疆野苹果抗寒性的可行性, 丰富测定抗寒性的方法。
1 材料与方法 1.1 试验材料2007年11月中旬分别在新疆伊犁地区巩留县莫胡尔乡选定4个天然群体, 新源县交吾托海野苹果原位保护示范区选定3个天然群体, 采样地的位置见表 1。每个群体中随机选取20株个体, 要求株间距离30~50 m, 生长正常, 无明显缺陷, 未发现病虫害。在各个群体内选定的单株上采集当年生营养枝条10~20个封于塑料袋中室外背阴低温冷藏。
|
|
电流通过细胞膜时产生电势差, 电势差通过细胞膜的有效运输系统和可选择的渗透特性来保持。细胞器具有不同电学特性(Smith, 1983; Zhang et al., 1992); 液泡和细胞质具有电阻器的性质, 而细胞膜相当于电容。细胞在受冻害时以及冻害后的结构改变, 而原生质膜和液泡膜有可能是植物细胞对冻害最敏感的部分(Steponkus et al., 1990; Leborgne et al., 1992), 因此, 可以用电阻抗来研究植物体对冻害胁迫的响应(Glerum, 1980; Coleman, 1989)。
当交变电流(AC)通过植物组织、器官时, 通过细胞外间隙和细胞内的比例取决于AC频率和组织特性(Glerum, 1980)。该组织的结构特性和生理特性可用等效电路进行量化。分析测定不同AC频率下电阻抗数据的方法, 被称为EIS法(Macdnald, 1987; 张钢等, 2005)。
1.2.1 EIS法参数的数学解释及意义新疆野苹果茎段的EIS只有一个弧, 适用于单-DCE模型(图 1)。单-DCE模型共涉及10个参数, 分别为单分布电路元素电阻(resistances in the single-DCE model, R, R1)、胞外电阻(extracellular resistance, Re)、胞内电阻(intracellular resistance, Ri)、弛豫时间(relaxation time, τ)、弛豫时间的分布系数(distribution coefficient of τ, ψ)、单分布电路元素电阻率(specific resistance in the single DCE, r, r1)、胞外电阻率(specific extracellular resistance, re)、胞内电阻率(specific intracellular resistance, ri)。各个参数的含义和计算方法参见文献(Repo et al., 1993, 1994; Ryyppö et al., 1998; 张军等, 2009)。

|
图 1 未冷冻处理的新疆野苹果1年生枝条电阻抗图谱 Figure 1 Impedance spectra of non-frost-exposed one-year-old stem |
每个群体中选取20个当年生枝条(每个个体1个), 用蒸馏水将其冲洗3次, 表面水分晾干后, 每个枝条剪成4 cm小段10段, 随机选取1段, 20段为1份(每个个体1段), 每个群体10份(10个温度处理), 分别用自封袋装好后置于冰箱中进行低温处理。冷冻处理设置4, -5, -10, -15, -20, -25, -30, -35, -40, -45 ℃ 10个温度样度, 其中4 ℃为对照。以6 ℃·h-1速率降温, 到达每个设定的温度, 保持24 h, 每个群体取出1份放入4 ℃冷藏室缓慢解冻24 h, 其他材料继续进行下个温度处理。
1.2.3 电阻抗测定参见张军等(2009)的方法。
1.2.4 半致死温度计算阻抗数据求得的τ, ψ, r, r1, re, ri参数(Y轴)与处理温度(X轴)作图(图 2), 它们与处理温度的关系可以表示为Logistic S曲线函数(logistic sigmoid function), 用SPSS 11.5软件, 通过Logistic方程拟合求出曲线出现拐点时的温度, 以此作为试材的低温半致死温度, 从而估算抗寒性。

|
(1) |
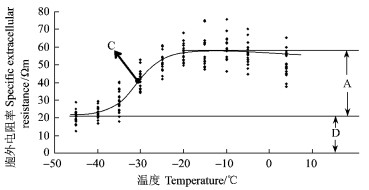
|
图 2 新疆野苹果经不同冷冻温度处理后胞外电阻率(re)的变化 Figure 2 Changes in specific extracellular resistance (re) of Malus sieversii |
式中:y为τ, ψ, r, r1, re, ri参数中的一个;x为低温处理温度(℃); A为S型曲线中2条渐近线的距离; B为斜率;C为拐点温度(℃); D为S型曲线下渐近线到X轴的距离。
1.3 电导率法测定新疆野苹果抗寒性方法电导率测定参照Zhang等(2002)和张钢(2005)方法。
1.3.1 试验材料预处理每个个体称取当年生枝条15 g, 用蒸馏水及去离子水将其冲洗3次, 晾干后剪成2 cm小段, 将每个群体内个体混匀, 称样5 g为1份, 每个群体30份(10个温度处理, 3次重复), 分别用自封袋装好后置于冰箱中。冷冻处理见1.2.2。
1.3.2 电导率测定参见张军等(2009)的方法。
1.3.3 半致死温度计算用SPSS 11.5软件, 通过计算Logistic方程的拐点温度表示试材半致死温度, 估算抗寒性。试中y为相对电导率。
2 结果与分析 2.1 电阻抗图谱法测定新疆野苹果群体抗寒性参数的对比分析对7个新疆野苹果居群1年生枝条在不同温度处理下测定的电阻抗数据求出的阻抗参数用SPSS分析, 按照Logistic方程进行S型曲线拟合, 计算出半致死温度及其变化范围, 并对拟合精度进行分析。
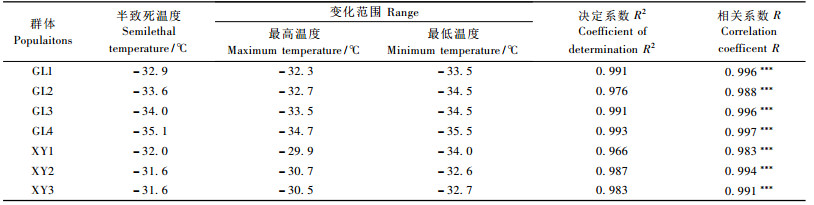
各群体re值随温度变化趋势呈S型曲线, 以Logistic方程为模型, 经过非线性回归分析, 可以拟合出各个群体的半致死温度, 由表 2可得:各群体半致死温度变化幅度为-29.8~-31.7 ℃, XY2最高(-29.8 ℃), GL4最低(-31.7 ℃)。巩留群体间差异不显著, 极差为-0.3 ℃; 新源群体间的差异也不显著, 极差为-0.6 ℃, 但是巩留群体的LT50均小于新源群体, 表现出巩留群体的抗寒性高于新源群体的趋势。相关系数变化范围在0.860~0.917, 均达到0.01显著水平, 绝大多数达到了0.001显著水平。通过拟合方程, 可计算出半致死温度和95%置信区间, 结果显示:各个群体的半致死温度95%置信区间均有不同程度的重合。说明各个群体之间的半致死温度差异不显著。
|
|
由表 2可知:各群体r1值随温度变化均能用Logistic方程进行较好拟合, 各群体半致死温度变化幅度为-30.1~ -31.7 ℃, XY2, XY3最高(均为-30.1 ℃), GL3最低(-31.7 ℃)。巩留群体间差异不显著, 极差为-0.6 ℃; 新源群体间的差异也不显著, 极差为-0.7 ℃, 与re结果相似, 巩留群体的LT50均小于新源群体, 呈现出巩留群体的抗寒性高于新源群体的趋势。相关系数变化范围在0.891~0.931, 均达到0.001显著水平。通过拟合方程, 可计算出半致死温度和95%置信区间, 结果显示:各个群体的半致死温度95%置信区间均有不同程度的重合。说明各个群体之间的半致死温度(LT50)差异不显著。
由此可知:各群体τ值随温度变化均能用Logistic方程进行较好拟合(表 2), 各群体半致死温度变化幅度为-28.3 ~ -31.6, XY3最高(均为-28.3 ℃), GL4最低(-31.6 ℃)。XY3的半致死温度(LT50)明显高于其他群体, XY3的半致死温度95%置信区间为-26.7~30.0 ℃, 与GL4的半致死温度95%置信区间(-30.3~-32.9 ℃)无重合, 与其他群体间有不同程度的重合, 表明群体XY3的半致死温度显著高于群体GL4, 而与其他群体没有显著的差异。巩留群体的半致死温度均值为-30.9 ℃, 低于新源群体LT50均值(-29.6 ℃)。相关系数变化范围在0.813~0.876, 均达到0.01显著水平, 群体XY3达到0.001显著水平。
根据6个阻抗参数(τ, ψ, r, r1, re, ri)计算出的半致死温度进行综合比较, 阻抗参数re, r1, τ在不同的温度处理下其分布成S型曲线, 经Logistic方程拟合可得到半致死温度, 并且95%的置信区间较小; 参数r, ri, ψ与处理温度的关系没有显示出明显的S曲线, 经Logistic方程拟合均未得到半致死温度, 说明参数r, ri, ψ不适用于新疆野苹果居群的抗寒性测定。
2.2 电导率法测定新疆野苹果居群抗寒性分析用相对电导率与处理温度的对应关系, 通过计算方程的拐点温度表示组织半致死温度值, 估算抗寒性。其半致死温度及决定系数、相关系数见表 3。各群体相对电导率值随温度变化均能用Logistic方程进行较好拟合, 各群体半致死温度变化幅度为-31.6~35.1 ℃, XY2, XY3最高LT50同为-31.6 ℃, GL4最低(-35.1 ℃)。群体GL4的半致死温度95%置信区间为-34.7~-35.5 ℃, 与其他群体的半致死温度95%置信区间无重合, 表明群体GL4的半致死温度显著低于其他群体。从半致死温度95%置信区间有无重合上判断可知:GL3的LT50显著低于GL1, XY2, XY3, GL2显著低于XY2。巩留群体的半致死温度均值为-33.9 ℃, 低于新源群体LT50均值(-31.7 ℃)。相关系数变化在0.966~0.993, 均达到0.001显著水平。由于电导法得出的半致死温度能与Logistic方程达到相当高的拟合度, 所以一般的方法均以电导率法为标准, 来评价其他方法的优劣。
|
|
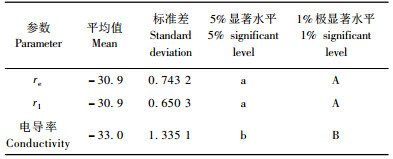
用电导率法得到的半致死温度与电阻抗法各参数得到的半致死温度进行对比分析, 结果见表 4。以电导率法得到的半致死温度为标准, 用DPS3.01测定出各种方法得出的半致死温度的相关系数, 其与阻抗法以参数r1拟合得到的半致死温度的相关系数最大, 为0.904;而与以参数re拟合得到的半致死温度的相关系数次之, 为0.884;与以参数τ拟合得到的半致死温度的相关系数最小, 为0.689。在电阻抗法中, 电阻抗参数r1, re适用于新疆野苹果居群抗寒性的测定。
|
|
选用电导率, re, r1 3个参数计算出的各个新疆野苹果群体的半致死温度进行二因素无重复试验统计分析, 由表 5可知:群体间、抗寒参数间差异都达到了极显著水平, 进而对新疆野苹果群体间的半致死温度(LT50)进行多重比较, 结果见表 6。新源群体间(XY2, XY3, XY1)的半致死温度没有显著差异, 巩留群体间(GL1, GL2, GL3, GL4)也未达到显著差异的水平, 但是新源与巩留2个地域间的半致死温度达到极显著差异水平, 新源群体极显著高于巩留群体, 从而说明巩留地区新疆野苹果的抗寒性显著高于新源地区。
|
|
|
|
新疆野苹果不同抗寒参数间的多重比较列于表 7, 从表中可以看出:re, r1 2个参数得到的半致死温度没有差异, 但同时极显著高于电导率所得的半致死温度。从而说明由电导法得出的抗寒性要高于电阻抗图谱法。
|
|
根据不同抗寒测定方法计算出的各供试群体的半致死温度, 采用非加权算术平均聚类方法(UPGMA)对7个新疆野苹果群体进行聚类分析, 从树状图可以看出, 巩留群体与新源群体分为明显的2类, 从而说明各个地点间的群体在抗寒性上存在一定的差异(图 3)。

|
图 3 7个新疆野苹果群体基于半致死温度的聚类图 Figure 3 Cluster graph based on LT50 of 7 populations in M.sieversii |
抗寒性是植物在对低温寒冷环境的长期适应中, 通过本身的遗传变异和自然选择获得的一种抗寒能力(Glerum, 1985), 是植物对低温长期适应的一种遗传特性。但这种遗传特性只有在特定环境条件诱导下, 才能表达出来, 随环境的改变也可消失(杨敏生等, 2008)。本研究首次对分布于新疆伊犁地区的新疆野苹果天然群体进行了抗寒性研究, 结果表明:巩留居群的4个群体间抗寒性没有显著差异, 新源居群的3个群体间也没有形成显著的差异, 但是巩留居群抗寒性要高于新源居群, 分析其原因可能是由于当地气候特征造成的。徐德炎(1989)和林培钧等(2000)研究认为, 新疆伊犁河谷地带有逆温层的存在。据伊犁州气象台1961—1969年探空观测记录, 逆温强度最强的1月份平均强度为9.5 ℃, 最大边22.6 ℃, 逆温层1月平均厚度为950 m, 最大为2 077 m。从地面实测资料可以看出冬季逆温最强是在海拔800~1 500 m之间的前山带里, 这也正是野果林集中分布带, 其1月平均气温和平均最低气温分别为-6.5~-6.7 ℃和-10.4~-13.5 ℃, 较前山带的上部和下部分别提高1.6~7.5 ℃和4.2~8.3 ℃。1月份逆温的平均递增率每100 m为2.1 ℃, 最大达7.3 ℃。海拔1 500 m以上逆温强度逐渐减弱, 野果林分布也逐渐减少。冬季逆温一般从11月中、下旬开始形成, 到次年3月上旬消退。新源群体的平均海拔为1 382 m左右, 而巩留群体的平均海拔为1 318 m左右, 两地相差70 m左右, 从导致新源采样地的平均气温要高于巩留样地1.5 ℃左右, 野苹果群体经过长期的环境适应, 从而使群体的抗寒性产生差异, 使新源群体(半致死温度-30.7 ℃)的抗寒性稍低于巩留群体(半致死温度-32.3 ℃)。在供试群体中, GL4的海拔最低(1 189 m), 但半致死温度最低的结果可以用逆温层的存在解释。2007年11月下旬, 在实地采样过程发现新源群体中存在尚未封顶的个体, 从而也反映出采样地的气温较高。
3.2 电阻抗图谱法测定抗寒性在对红千层属(Callistemon)4个种和银桦属(Grevillea)2个种植物的抗寒性测定研究中发现, 2种方法所求出的抗寒性结果相似(Mancuso et al., 2004)。在欧洲赤松(Pinus sylvestris)抗寒性研究中发现:试材抗寒性较低时, EIS法所求出的抗寒性与EL法相近; 当试材抗寒性很强时, EIS法有可能比EL法低估抗寒性(Repo et al., 1994; Ryyppü et al., 1998)。用EIS法re参数求出的欧洲赤松茎的抗寒性低于EL法求出的针叶抗寒性(Repo et al., 2000; Hurme et al., 1997)。本研究中用EIS法得到的试材抗寒性低于EL法, 与前人的研究结果基本相同, 具体原因有待于进一步研究。在对欧洲赤松幼树当年生枝条为期1年的试验中发现:EIS法re参数求出的茎抗寒性与EL法确定的针叶抗寒性之间存在很强的相关性(r=0.97)(Repo et al., 1995; 1997)。本研究中, EIS法用r1, re估计的半致死温度与EL法接近, 相关系数分别为0.904, 0.884, 达到0.01水平的极显著相关, 与前人研究的结果相似。
在EIS法的6个参数中, r1, re拟合结果最好, 分析其原因可能是与植物材料在低温胁迫下, 细胞膜逐渐受到伤害, 细胞膜透性逐渐增大, 胞内电解质逐步外渗, 从而造成胞外的电阻率re逐步减小, 与EL法的测定原理基本相同, 只是测定方法不同。由公式Re=R+R1(张军等, 2009)可得:re=r+r1, r1与温度处理呈现S型曲线变化趋势, 而r基本上不受温度处理的影响保持恒定, 从而使得re与温度处理也呈现出S型曲线变化趋势, 因此, 是r1的变化导致胞外电阻率re的变化。单分布电路元素电阻R1在茎段具体代表的组织、器官有待于进一步研究。
EL法可以得出客观、精确、量化的数据, 并且得到的半致死温度比较精确, 拟合曲线接近于S型曲线, 因此一般都以电导率法得到的半致死温度作为标准, 来评价其他方法的优劣。由表 4可知:电导率法得到的半致死温度与EIS法r1, re参数拟合得到的LT50相关系数高, 说明用阻抗法也适用于新疆野苹果抗寒性的研究。用EIS法测定植物的抗寒性不需要进行耗时的化学测定, 也不需要对植物样本进行温育, 保持细胞的自然状态, 较好的保护了供试材料; 此方法特别适合样本量大的群体抗寒性研究。而EL法破坏供试材料, 使材料失去自然状态, 是其主要缺点。EIS法简易、快速地测定植物的抗寒性, 是一种研究植物抗寒性有效的物理方法, 在抗寒性测定, 尤其是群体抗寒研究上具有良好的效果。
林培钧, 崔乃然. 2000. 天山野果林资源-伊犁野果林综合研究[M]. 北京: 中国林业出版社.
|
徐德炎. 1989. 新疆野核桃生态气候特征的研究[J]. 生态学杂志, 8(4): 24-47. |
杨敏生, 李伍宝. 2008. 杨树抗逆性研究[M]. 天津: 天津科学技术出版社: 30-31.
|
张钢. 2005. 国外木本植物抗寒性测定方法综述[J]. 世界林业研究, 18(5): 14-20. |
张钢, 肖建忠, 陈段芬. 2005. 测定植物抗寒性电阻抗图普法[J]. 植物生理与分子生物学报, 31(1): 19-26. |
张军, 赵惠娟, 张钢, 等. 2009. 电阻抗图谱法在刺槐种质资源抗寒性测定中的应用[J]. 植物遗传资源学报, 10(3): 419-425. |
Coleman W K. 1989. Electrical impedance and freezing injury in apple shoots[J]. J Hortic Sci, 64(3): 249-257. DOI:10.1080/14620316.1989.11515952 |
Glerum C. 1980. Electrical impedance techniques in physiological studies[J]. New Zealand Journal of Forestry Science, 10(1): 196-207. |
Glerum C.1985.Frost hardiness of coniferous seedling:principles and applications//Duryea M L.Evaluating seeding quality:principles, procedures, and predicitive abilities of major test.Cotrallis(USA):Forest Research Laboratory Oregon State University, 107-123.
|
Hurme P, Repo T, Savolainen O, et al. 1997. Climatic adaptation of bud set and frost hardiness in Scots pine (Pinus sylvestris)[J]. Can J For Res, 27: 716-723. DOI:10.1139/x97-052 |
Leborgne N, Dupou-Cézanne L, Teulières C, et al. 1992. Lateral and rotational mobilities of lipids in specific cellular membranes of Eucalyptus gunnii cultivars exhibiting different freezing tolerance[J]. Plant Physiol, 100: 246-254. DOI:10.1104/pp.100.1.246 |
Macdnald J R. 1987. Impedance Spectroscopy[M]. New York: John Wiley and Sons, Inc.
|
Mancuso S, Nicese F P, Masi E, et al. 2004. Comparing fractal analysis, electrical impedance and electrolyte leakage for the assessment of cold tolerance in Callistemon and Grevillea spp[J]. J Hortric Sci Biotech, 79(4): 627-632. DOI:10.1080/14620316.2004.11511817 |
Repo T. 1994. Influence of different electrodes and tissues on the impedance spectra of Scots pine shoots[J]. Electromagnetic Biology and medicine, 13(1): 1-14. |
Repo T, Leinonen M, Pääkkönen T. 1997. Electrical impedance analysis of shoots of Scots pine:intracellular resistance correlates with frost hardiness.//Proceedings of the Finnish-Japanese Workshop on Molecular and Physiologcial Aspects of Cold and Chilling Tolerance of Northern Crops[J]. Jokioinen, Finland: 27-30. |
Repo T, Leinonen M, Pääkkönen T. 1995. The application of electrical impedance spectroscopy in assessing the frost hardiness of Scots pine.Proceedings of the Ⅸ.International Conference on Electrical Bio-impedance[J]. Heidelberg/Germany: 370-373. |
Repo T, Zhang G, Ryyppö A, et al. 2000. The electrical impedance spectroscopy of Scots pine(Pinus sylvestris L.) shoots in relation to cold acclimation[J]. J Exp Bot, 51(353): 2095-2107. DOI:10.1093/jexbot/51.353.2095 |
Repo T, Zhang M. 1993. Modelling woody plant tissues using a distributed electrical circuit[J]. Journal of Experimental Botany, 44(262): 977-982. |
Repo T, Zhang M, Ryyppö A, et al. 1994. Effects of freeze-thaw injury on parameters of distributed electrical circuits of stems and needles of Scots pine seedlings at different stages of acclimation[J]. Journal of Experimental Botany, 45(275): 823-833. |
Ryyppö A, Repo T, Vapaavuori E. 1998. Development of freezing tolerance in roots and shoots of Scots pine seedlings at nonfreezing temperatures[J]. Can J For Res, 28(4): 557-565. DOI:10.1139/x98-022 |
Smith J R. 1983. The tonoplast impedance of Chara[J]. J Exp Bot, 34(2): 120-129. DOI:10.1093/jxb/34.2.120 |
Steponkus P L, Lynch D V, Uemura M, et al. 1990. The influence of cold acclimation on the lipid composition and cryobehaviour of the plasma membrane of isolated rye protoplasts[J]. Phil Trans R Soc Lond B, 326: 571-583. DOI:10.1098/rstb.1990.0032 |
Zhang G, Ryyppö A, Repo T. 2002. The electrical impedance spectroscopy of Scots pine needles during cold acclimation[J]. Physiologia Plantarum, 115(3): 385-392. DOI:10.1034/j.1399-3054.2002.1150308.x |
Zhang M, Willison J H M. 1992. Electrical impedance analysis in plant tissues:the effect of freeze-thaw injury on the electrical properties of potato tuber and carrot root tissues[J]. Can J Plant Sci, 72: 545-553. DOI:10.4141/cjps92-068 |
 2011, Vol. 47
2011, Vol. 47