文章信息
- 徐川梅, 高欣, 汤定钦
- Xu Chuanmei, Gao Xing, Tang Dingqin
- 利用激光共聚焦显微镜研究孝顺竹花粉粒发育
- Observation of Pollen Development in Bambusa multiplex with Laser Scan Confocal Microscope
- 林业科学, 2010, 46(11): 158-161.
- Scientia Silvae Sinicae, 2010, 46(11): 158-161.
-
文章历史
- 收稿日期:2010-02-02
- 修回日期:2010-04-01
-
作者相关文章
激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)是20世纪80年代发展的高科技产品,主要是采用激光作为光源,在荧光显微镜的基础上添加了激光扫描装置和计算机图像处理系统等,通过对观察样品进行光学断层扫描及三维结构重建等,可得到细胞或组织内部细微结构的荧光图像,同时激光扫描共聚焦显微镜还是活细胞动态观察、多重免疫荧光标记和Ca2+荧光观察(Chen et al., 2009)的有力工具,目前已在花粉(Fang et al., 2008)和花粉管发育(Chen et al., 2008; Wu et al., 2008)、蛋白质功能(Zheng et al., 2009)及信号传导(Liu et al., 2009)等的研究中发挥了重要作用。
竹类植物是禾本科(Gramineae)竹亚科(Bambusoideae)植物的总称,其利用价值极高,被公认为21世纪世界上最重要的植物资源之一。竹类植物开花现象异常复杂,主要表现为开花周期长、开花后多数死亡、结实率低下或无种子等。近几年,不少地区陆续出现竹子开花现象,一些研究者在一些竹种的开花生物学特性(程有龙等,1995; 杜凡等,2000; 赖广辉,2001; 何其江,2003)、花粉粒形态及花粉活力(张文燕等,1989; 1992; 汪奎宏等,2000; 林树燕等,2008)、竹子杂交育种(Fu,1995; 张光楚,2000)等方面开展了研究,但总体上进展缓慢。花粉粒发育是植物生活周期中一个重要的过程,直接决定着植物的有性生殖(Li et al., 2010),与植物遗传育种有十分密切的关系,因此探讨竹类植物花粉的发育特性可以丰富其开花结实的内容,阐明竹类植物结实率低下的部分原因,为竹类植物遗传改良提供依据和参考。
孝顺竹(Bambusa multiplex)属竹亚科簕竹属(Bambusa),在竹子分类学上属于丛生竹,是重要的园林绿化竹种,被广泛用作绿篱、栅栏等; 竹秆细长强韧,可用于编织、造纸等(袁金玲等,2009)。目前对于孝顺竹的研究主要集中于加工利用及生理生化等方面,关于其雄配子体发育研究还未见报道。本研究利用激光共聚焦显微镜,对孝顺竹雄配子体发育过程进行细胞学观察分析,旨在揭示孝顺竹结实率低下原因,并为小孢子单倍体育种等研究提供理论依据。
1 材料与方法 1.1 材料孝顺竹花粉及花药均采集于浙江林学院翠竹园。剪取孝顺竹花枝,剥出花药,用刻度尺量出花药长度,根据长度差异分装在不同离心管中。
1.2 方法1) 材料预处理 花药及花粉用卡诺固定液固定2 h以上,经70%,50%,30%酒精逐级脱水至蒸馏水,每级停留30 min,在蒸馏水中停留数小时,并换水数次把材料中的固定液冲洗干净。
2) Hoechst 33342荧光染色 参照李国平等(2006b)的方法略有改进。先用柠檬酸-磷酸氢二钠缓冲液(0.1 mol·L-1,pH5.0)预处理6 h,加入20 μg·mL-1 Hoechst 33342在25 ℃黑暗条件下染色14 h。染色后的材料在30%,50%,70%,90%,95%,100%酒精中各梯度脱水30 min,无水乙醇中脱水3次,前2次为1 h,最后1次12 h以上。转入冬青油及无水乙醇的等量混合液中透明2 h,最后用冬青油透明3次,前2次为2 h,最后1次12 h以上。透明后的材料保存于4 ℃冰箱中。
3) 制片 用镊子将花药取出置于清洁的载玻片上,用镊子将花药夹碎,加入抗褪色胶,盖上22 mm×22 mm的盖玻片。
4) 激光共聚焦显微镜观察 将制备好的制片放置在激光共聚焦显微镜(LSM510 meta,蔡司公司)上,用20倍、63倍镜头选取所需观察对象。启动扫描软件ZEN 2007,利用UV激光器的激光作光源进行预扫描,UV激光器激发波长405 nm,检测发射光波长410~550 nm,伪彩色采用兰色。设置合适的光路及扫描参数,通过单次扫描(single scan)和连续扫描(series scan)方式进行图像采集。
2 结果与分析 2.1 四分体时期孝顺竹花粉母细胞经减数分裂后,首先形成四分体,在四分体周围及各细胞之间均有胼胝质包围和分隔,由于胼胝质的低透性控制着细胞之间的物质交流,因此四分体各细胞之间具有独立性(图版Ⅰ-1:三维重建立体图; 图版Ⅰ-2:平面扫描图)。
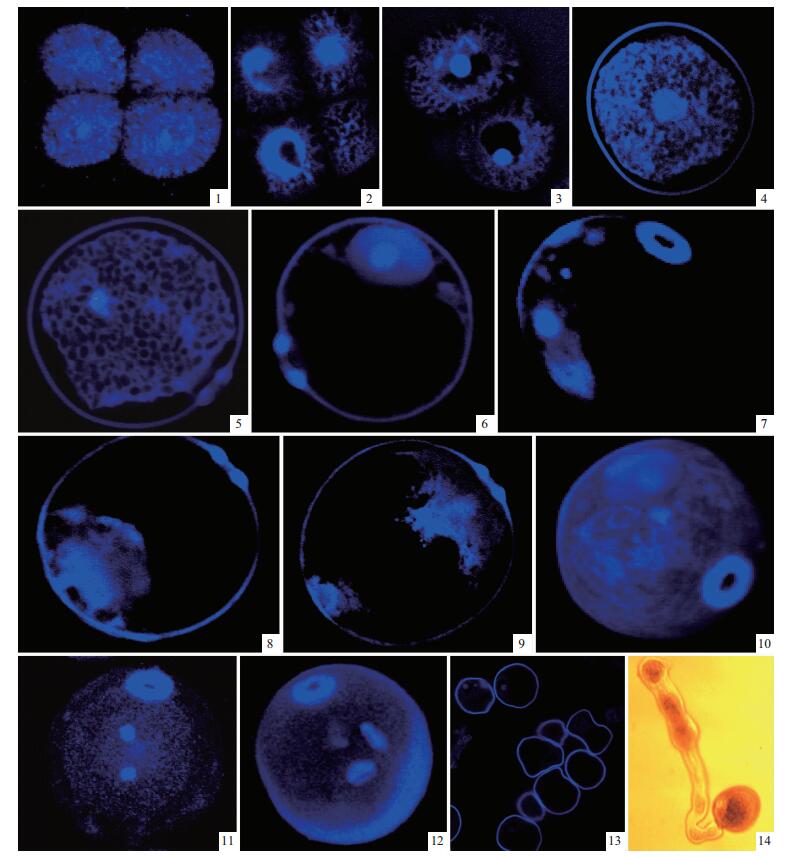
|
图版Ⅰ Plate Ⅰ 1-14.孝顺竹雄配子体发育.1-13.蔡司激光共聚焦显微镜(LSM510)63倍油镜拍摄的图片;14.莱卡DM2000相差显微镜20倍物镜拍摄图片。 1.四分体立体图;2, 3.四分体解体,小孢子散开;4.单核居中期;5.细胞质液泡化;6, 7.大液泡形成和单核靠边期的平面图及立体图;8.单核有丝分裂中期;9.二细胞时期,生殖细胞贴壁;10.生殖细胞开始脱离花粉粒内壁的立体图;11.生殖细胞脱离花粉粒内壁后进入营养细胞质中的立体图;12.生殖细胞经有丝分裂后形成的3细胞成熟花粉粒立体图,具有1个萌发孔;13.不育小孢子;14.成熟花粉粒萌发出花粉管。 1-14. The development of male gametophyte in Bambusa multiplex. 1-13. Obtained by Zeiss LSM510 (63×, oil); 14. Captured by Leica DM2000 (20×). 1. Tetrad; 2, 3-Tetrad disintegration, four scattered microspores; 4. Uninuclete microspore in center; 5. Vacuolated cytoplasm; 6, 7. The plate of formed vacuolation and uninuclete microspore at periphery; 8. Metaphase of mitosis of uninucleus microspore; 9. 2-celled stage, generative inner cell near pollen wall; 10. Generative cell away from the inner pollen wall; 11. Generative nucleus entering into cytoplasm of vegetative cell; 12. Mature 3-celled pollen with one aperture; 13. Aborted microspore; 14. Mature pollen with tube. |
在多数植物中四分体持续时间很短,随后,由于胼胝质壁的溶解,子细胞彼此分离,成为4个各含1个细胞核的花粉粒,此时的花粉粒,细胞壁薄(图版Ⅰ-3)。随着小孢子的进一步发育,其细胞壁逐渐加厚,在准备形成萌发孔的地方细胞壁发生凹陷,细胞质变浓,细胞核增大且细胞核位于细胞中央(图版Ⅰ-4)。
2.3 单核靠边期由于小孢子不断地从周围的绒毡层分泌物或其降解物质吸取营养物质及水分,其体积增大,细胞质中的小液泡逐渐合并成大液泡,细胞核逐渐向细胞壁靠近(图版Ⅰ-5),随着大液泡的增大,细胞核完全移向与花粉粒萌发孔相对应的一侧(图版Ⅰ-6,7:三维重建图),即单核靠边期。由图版Ⅰ-7花粉粒的三维重建立体图,可以清楚地看出此时萌发孔已经形成,且只具有1个萌发孔。
2.4 二细胞花粉粒单核花粉粒的核在靠近细胞壁的位置进行1次有丝分裂(图版Ⅰ-8),形成2个子核,2个子核中,1个贴近花粉粒内壁为生殖核,另1个靠近花粉粒萌发孔为营养核(图版Ⅰ-9); 随后,细胞质发生分裂,细胞质分裂时,其细胞板成弧形,弯向生殖核一侧,最后生殖细胞呈现凸透镜型或球形,只含有少量的细胞质,花粉粒中其余大量的细胞质为营养细胞所有(图版Ⅰ-10:三维重建立体图)。生殖细胞形成后不久,生殖细胞由最初紧贴花粉内壁处逐渐沿壁向内推移、收缩,细胞渐渐变圆,最后细胞和花粉内壁分离,游离在营养细胞之中,出现细胞中有细胞的独特现象(图版Ⅰ-11:三维重建立体图),最后营养细胞和生殖细胞构成了二细胞花粉粒。
2.5 三细胞花粉粒及不育花粉粒随着二细胞花粉粒进一步发育,生殖细胞再进行1次有丝分裂,形成2个精细胞,成为三核花粉粒,即三细胞花粉粒(图版Ⅰ-12); 此时孝顺竹花粉粒完全成熟,从开裂的花粉囊中散出,经过传粉在雌蕊的柱头上萌发,形成花粉管,为受精准备条件(图版Ⅰ-14:成熟的孝顺竹花粉粒人工培养72 h后萌发)。在试验过程中,还发现大约有38%的小孢子不能发育成正常的花粉粒,而停止在雄配子体发育过程中的某一阶段,这些败育的小孢子表现为外形皱缩,形态不规则,细胞质稀薄,细胞核小或者消失(图版Ⅰ-13)。
3 讨论竹类植物具有开花周期长、开花时间和空间难以预测等诸多的特殊开花习性,因此目前关于竹类植物雄配子体发育的研究不多。仅在爬竹(Ampelocalamus scandens) (庞延军等,1994)、雷竹(Phyllostachys praecox) (黄坚钦等,1999)、巨龙竹(Dendrocalamus sinicus) (王曙光等,2006)和月月竹(Menstruocalamus sichuanensis) (林树燕等,2009)等少数竹种有过报道,上述研究多采用传统的组织石蜡切片方法,观察花粉的外部形态变化。本试验将荧光染色技术应用于孝顺竹雄配子体发育研究,并结合激光扫描共聚焦显微镜观察拍照,与传统石蜡切片技术及普通荧光显微镜拍照系统相比,激光共聚焦显微镜能够实现图像的三维重建与显示,即所谓“细胞CT”,把获得的系列扫描图像经计算机软件处理,可得到一幅能体现样品空间形态结构且具立体感的三维图像,并能对三维图像的整体结构任意旋转,从各个角度进行体视学分析(李国平等,2006a)。因而在缩短试验周期,简化试验步骤的同时,能够更为清晰直观、立体、连续地观察雄配子体内部结构的变化。图版Ⅰ-1,7,10,11,12是孝顺竹花粉粒经激光共聚焦显微镜系列扫描,然后经三维重建获得的立体图,可以清晰地看出孝顺竹花粉粒具有1个萌发孔,且其各时期的细胞核变化情况及空间分布得以很好展示。图版Ⅰ-11是生殖细胞脱离花粉粒内壁后游离在营养细胞中的二细胞花粉粒,图版Ⅰ-12是成熟的花粉粒三维重建后旋转,其具有3个细胞核,营养细胞核靠近萌发孔,2个生殖细胞成楔形远离萌发孔。花粉粒内部这些结构细节是通过普通的光学显微镜很难观察到的。
被子植物花粉的形成通常经历如下几个过程: 1)通过几次有丝分裂形成二倍体造孢组织; 2)通过1次减数分裂和1次有丝分裂形成单倍体小孢子; 3)小孢子通过2次有丝分裂形成含精细胞的雄配子体(蔡雪,1999)。一些研究表明,在不同科属植物间,其雄配子体发育过程存在很大差异,如百合科(Liliaceae)和茄科(Solanaceae)的一些植物,其小孢子发育为成熟的花粉粒只需经历1次有丝分裂成为二细胞花粉粒,授粉后在花粉管萌发的过程中再发生第2次有丝分裂,即其成熟的花粉粒为二细胞花粉粒; 而十字花科(Cruciferae)及禾本科(Gramineae)一些植物,其小孢子要经历2次有丝分裂发育为具有3个细胞核的成熟花粉粒,然后从花药中散出进行授粉(McCormick,1993; 2004; Twell et al., 1998; Ma,2005; Singh et al., 2007)。本研究中观察到孝顺竹单倍体小孢子经过2次有丝分裂过程最终形成了具有1个萌发孔和3个细胞核的成熟花粉粒,与禾本科和十字花科中的一些植物相似。万双粉等(2006)对十字花科青花菜(Brassica oleracea var. italica)雄配子体发育的研究表明其成熟的花粉粒为三细胞型,同时具有3个萌发孔,孝顺竹与其存在很大差异,与水稻(Oryza sativa)、小麦(Triticum aestivum)相似,仅具有1个萌发孔。
本研究观察发现孝顺竹小孢子发育过程中,大约有38%孢子不能发育成正常的花粉粒,这些败育的小孢子与正常的小孢子相比,主要表现为外形皱缩、形态不规则,以及内部细胞质稀薄、细胞核小或者消失等现象,这可能是孝顺竹花粉萌发率低的主要原因。笔者对孝顺竹花粉萌发率也进行了测试,其实际萌发率也只有20% (数据未发表)。植物种子败育或结实率低下主要受内部因素和外部环境影响(梁春莉等,2005),低下的萌发率是影响许多竹种结实率的主要原因(张文燕等,1989; 汪奎宏等,2000; 林树燕等,2008)。可以推测孝顺竹花粉败育率较高及萌发率低下是造成其结实率低下的主要原因。
竹类植物目前还没有花药培养成功的报道。禾本科植物水稻、小麦等花药培养的最佳时期是单核靠边期(陈红等,2007),竹类植物与水稻亲缘关系较近同属于禾本科,其花药培养最佳时期选择可借鉴同科的水稻或者小麦。本研究表明,孝顺竹雄配子体发育单核靠边期持续时间较长,单核靠边期花药长度为4~6 mm,这可为孝顺竹花药培养取材提供理论依据。
蔡雪. 1999. 被子植物花粉形成过程中细胞骨架的动态及生物学意义[J]. 植物学通报, 16(4): 339-344. |
陈红, 秦瑞珍. 2007. 水稻花药培养过程中各种影响因子的研究进展[J]. 中国农业科技导报, 9(3): 52-56. |
程有龙, 任德唐, 朱白玉, 等. 1995. 角竹开花习性观察及复壮更新对策[J]. 浙江林业科技, 15(2): 50-56. |
杜凡, 薛嘉榕, 杨宇明, 等. 2000. 15年来云南竹子的开花现象及其类型研究[J]. 林业科学, 36(6): 57-68. DOI:10.11707/j.1001-7488.20000616 |
何其江. 2003. 雷竹花穗和花器的观察研究[J]. 浙江林业科技, 23(2): 10-11. |
黄坚钦, 黄华宏, 何福基, 等. 1999. 雷竹的小孢子发生和雄配子体形成[J]. 竹子研究汇刊, 18(3): 55-58. |
赖广辉. 2001. 10种刚竹属植物花部形态的补充描述[J]. 武汉植物研究, 19(1): 7-13. |
李国平, 黄群策, 秦广雍. 2006a. 用激光扫描共聚焦显微镜观察雪松花粉和花粉管[J]. 激光生物学报, 15(1): 1-8. |
李国平, 黄群策, 杨鹭生, 等. 2006b. 油杉小孢子发生的激光扫描共聚焦显微镜观察[J]. 激光生物学报, 15(5): 462-470. |
梁春莉, 刘孟军, 赵锦. 2005. 植物种子败育研究进展[J]. 分子植物育种, 3(1): 117-122. |
林树燕, 丁雨龙, 张昊. 2008. 5种竹子花粉萌发率及开花特性[J]. 林业科学, 44(10): 159-164. DOI:10.3321/j.issn:1001-7488.2008.10.027 |
林树燕, 郝娟娟, 辛华, 等. 2009. 月月竹大、小孢子发生和雌、雄配子体发育研究[J]. 南京林业大学学报:自然科学版, 33(3): 9-12. |
庞延军, 喻富根, 胡成华, 等. 1994. 爬竹雄蕊发育异常的初步观察[J]. 竹子研究汇刊, 10(4): 42-46. |
万双粉, 张蜀宁, 张杰, 等. 2006. 青花菜花粉母细胞减数分裂及雄配子体发育[J]. 西北植物学报, 26(5): 970-975. |
汪奎宏, 何奇江, 吴蓉. 2000. 早竹花粉形态与生物学特性[J]. 浙江林学院学报, 17(2): 137-141. |
王曙光, 普晓兰, 丁雨龙. 2006. 巨龙竹生殖器官形态结构及雌、雄配子体的发育[J]. 植物研究, 26(3): 270-274. |
袁金玲, 顾小平, 李潞滨, 等. 2009. 孝顺竹愈伤组织诱导及植株再生[J]. 林业科学, 45(3): 35-40. DOI:10.11707/j.1001-7488.20090307 |
张光楚. 2000. 竹子育种工作近况[J]. 竹子研究汇刊, 19(3): 13-15. |
张文燕, 马乃训, 陈红星. 1989. 竹类花粉形态及萌发试验[J]. 林业科学研究, 2(1): 67-70. |
张文燕, 马乃训, 吴玲玲, 等. 1992. 五月季竹开花结实的研究[J]. 竹子研究汇刊, 11(2): 15-25. |
Chen Kunming, Wu Guoli, Wang Yuhua, et al. 2008. The block of intracellular calcium release affects the pollen tube development of Picea wilsonii by changing the deposition of cell wall components[J]. Protoplasma, 233: 39-49. DOI:10.1007/s00709-008-0310-2 |
Chen Tong, Wu Xiaoqin, Chen Yanmei, et al. 2009. Combined proteomic and cytological analysis of Ca2+ calmodulin regulation in Picea meyeri pollen tube growth[J]. Plant Physiology, 149: 1111-1126. |
Fang Kefeng, Wang Younian, Yu Tongquan, et al. 2008. Isolation of de-exined pollen and cytological studies of the pollen intines of Pinus bungeana and Picea wilsonii Mast[J]. Flora, 203: 332-340. DOI:10.1016/j.flora.2007.04.007 |
Fu Maoyi. 1995. A review on crossing between bamboo species in China//Williams J T, Ramanuja R, Rao A N. Genetic enhancement of bamboo and rattan. 1st ed. India: Scenario Publications, 87-98.
|
Li Tang, Gong Chunyan, Wang Tai. 2010. RA68 is required for postmeiotic pollen development in Oryza sativa[J]. Plant Mol Biol, 72(3): 265-277. DOI:10.1007/s11103-009-9566-y |
Liu Peng, Li Ruili, Zhang Liang, et al. 2009. Lipid microdomain polarization is required for NADPH oxidase-dependent ROS signaling in Picea meyeri pollen tube tip growth[J]. Plant Journal, 60(2): 303-313. DOI:10.1111/tpj.2009.60.issue-2 |
Ma H. 2005. Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants[J]. Annu Rev Plant Biol, 56: 393-434. DOI:10.1146/annurev.arplant.55.031903.141717 |
McCormick S. 2004. Control of male gametophyte development[J]. Plant Cell, 16: S142-S153. DOI:10.1105/tpc.016659 |
McCormick S. 1993. Male gametophyte development[J]. Plant Cell, 5(10): 1265-1275. DOI:10.1105/tpc.5.10.1265 |
Singh M B, Bhalla P L. 2007. Control of male germ-cell development in flowering plants[J]. BioEssays, 29(11): 1124-1132. DOI:10.1002/(ISSN)1521-1878 |
Twell D, Park S K, Lalanne E. 1998. Asymmetric division and cell-fate determination in developing pollen[J]. Trends Plant Sci, 3(8): 305-310. DOI:10.1016/S1360-1385(98)01277-1 |
Wu Xiaoqin, Chen Tong, Zheng Maozhong, et al. 2008. Integrative proteomic and cytological analysis of the effects of extracellular Ca2+ influx on Pinus bungeana pollen tube development[J]. Journal of Proteome Research, 7(10): 4299-4312. DOI:10.1021/pr800241u |
Zheng Maozhong, Beck Martina, Muller Jens, et al. 2009. Actin turnover is required for myosin-dependent mitochondrial movements in Arabidopsis root hairs[J]. Plant Mitochondrial Motion, 4(6): 1-14. |
 2010, Vol. 46
2010, Vol. 46

