文章信息
- 王政, 何松林
- Wang Zheng, He Songlin
- 文心兰试管苗低温贮藏条件
- Storage Conditions of Oncidium Plantlets in vitro in Low Temperature
- 林业科学, 2010, 46(10): 173-177.
- Scientia Silvae Sinicae, 2010, 46(10): 173-177.
-
文章历史
- 收稿日期:2010-03-30
- 修回日期:2010-08-05
-
作者相关文章
在文心兰(Oncidium sp.)试管苗商业化生产过程中,试管苗的销售多被限定在某一特定季节和时期(如夏季开花型栽培时,生产者多集中在2月份购入试管苗)。这就要求种苗生产企业必须在这一限定期间内大量生产出规格一致的试管苗来满足市场需求。该情况下,若能将其他时间快繁的试管苗利用生长抑制的方法进行短期保存,就能做到试管苗的计划性生产,并在需求集中期大批量供应生长均一的试管苗。因此,种苗生产过程中大批量试管苗的短期贮藏技术被认为是试管苗商业化生产中亟待研究和开发的新技术之一(田中道男等,1995)。目前,国内外试管苗贮藏研究主要集中在种质资源保存方面(Negash et al., 2001; 艾鹏飞等,2004; 刘月学等,2004; 宋希强等,2005; 吴金寿等,2005; 牛爱国等,2005; González et al., 2006; 赵密珍等,2006; 陈辉等,2006; 王越等,2006; 刘剑锋等,2007; 王艳芳等,2007; 翟晓巧等,2009; Kovalchuk et al., 2009; Pacheco et al., 2009),在规模化生产中的应用研究甚少; 且传统贮藏容器如三角瓶、罐状瓶等具有体积大、空间利用率低等缺点,而有关其他容器在试管苗短期贮藏方面的应用研究尚未见报道。树脂膜培养容器以其高透气性、低透湿性等特点成为替代植物试管苗培养用传统培养容器(三角瓶和罐状瓶)的新型容器,其中利用树脂膜制作的箱型培养容器(culture pack; 简称CP)已在文心兰(何松林等,2003a; 2003b; 2003c; 2003d)和大花蕙兰(Cymbidium hybrid) (何松林等,2007; 2008)试管苗培养及环境调控中得到应用,而树脂膜容器在试管苗贮藏中尚未进行研究及应用。因此,本研究拟利用树脂膜制作封筒型树脂膜培养容器(polymer film culture bag,简称CB)进行文心兰试管苗低温贮藏性研究,探讨CB在文心兰试管苗低温贮藏中的有效性,并在利用CB条件下研究试管苗不同预处理对文心兰试管苗低温贮藏性的影响,以确定低温贮藏前文心兰试管苗最佳的预处理时间,为商业化生产中文心兰试管苗的贮藏和运输提供技术参考。
1 材料与方法 1.1 封筒型树脂膜培养容器(CB)的制作及接种方法采用50 μm厚的Neoflon®四氟乙烯与全氟烷基乙烯基醚共聚物(PFA),制作14 cm × 9 cm的CB,制作及接种步骤如图 1所示。首先,将塑膜裁成长方形(15 cm × 20 cm),并纵向对折; 其次用塑膜封口机(志贺包装机制,K-250EW)沿斜线部分热封,再将封口线外的剩余部分剪除(图 1A)。接种时先将CB置于高压灭菌锅内灭菌(121℃,1.2 kg· cm-2,35 min),在超净工作台中将已灭菌的液体培养基注入CB; 被贮藏试管苗放入到CB内后(图 1B),用塑料夹具在CB开口部下方密封,最后用塑料封口机将开口部热封后除去塑料夹具(图 1C)。

|
图 1 封筒型树脂膜培养容器(CB)的制作及接种方法 Figure 1 The manufacture and inoculating methods of polymer film culture bag(CB) |
试材为薄叶系文心兰品种‘Aloha Iwanaga’。将由茎尖诱导并增殖形成的原球茎(PLB)接种于MS +蛋白胨(Peptone)2 g·L-1 +植物结冷胶(Gellan gum) 2 g·L-1 +蔗糖30 g·L-1培养基上(pH 5.3)。在常规培养条件[温度(25 ± 1) ℃,光强30.6 μmol·m-2s-1、光照时间16 h·d-1 ]下诱导PLB分化、形成幼苗,然后选择生长状况一致、株高2.5 cm、展叶4片的去根试管苗作为供试贮藏材料。
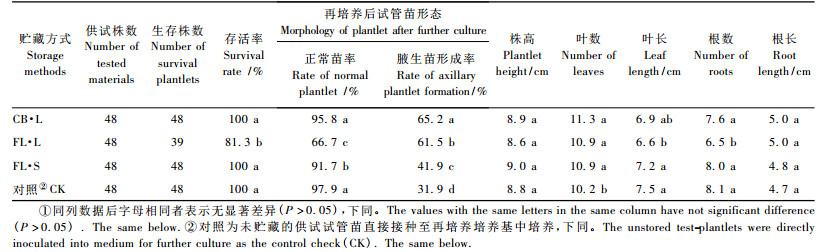
1.3 方法1) 贮藏容器类型及方式 试验以CB和100 mL三角瓶作为培养容器,采用CB容器+液体培养基方式(CB·L)、三角瓶+液体培养基方式(FL·L)、三角瓶+固体培养基方式(FL·S)3种贮藏方式进行低温贮藏试验。每种贮藏方式均接种3容器,每个容器培养基用量30 mL,试管苗16株。对照为未贮藏的供试试管苗直接接种至再培养培养基中培养。
2) 贮藏条件及再培养处理 将供试试管苗转入CB·L,FL·L和FL·S 3种贮藏方式后,在常规培养室内预培养7天(据实验室经验设定时间,培养条件同1. 2),然后分别移入低温贮藏箱(HYC-68A,海尔)贮藏。贮藏温度8 ℃,贮藏期4周。贮藏结束后试管苗在常规培养室内放置12 h,使其适应培养室内的环境条件,然后接种于500 mL的柱状培养瓶内再培养,90天后测定试管苗的相关生理指标。
贮藏用培养基: 1/2 MS + Peptone 2 g·L-1 +蔗糖30 g·L-1,其中固体培养基添加Gellan gum 2 g·L-1,pH5.3;再培养培养基: MS + Peptone 2 g·L-1 + Gellan gum 2 g·L-1 +蔗糖30 g·L-1,pH5.3。
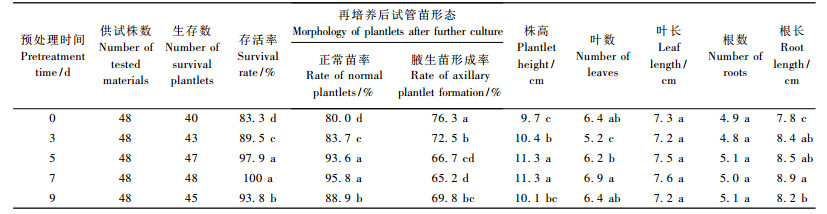
3) 不同预处理 采用CB·L方式将供试试管苗接种后,在常规培养室内进行预处理,即分别培养0 (接种后立即贮藏),3,5,7,9天后再移入低温贮藏箱内。贮藏温度8 ℃,贮藏期4周。然后各处理按前述方法进行再培养,并测定各项生长指标。
4) 生长指标测定 再培养结束后,分别调查各贮藏方式下试管苗的存活率、正常苗率、腋生苗形成率,以及恢复培养后试管苗的株高、叶数、叶长(最大叶长平均值)、根数、根长(最大根长平均值),整株、地上部及根部鲜质量,整株、地上部及根部干质量,干质量比率等指标。测定干质量时,用剪刀将试管苗的根全部剪下后,分地上部和根部分别进行烘干和称量。烘干时首先将植物材料在105 ℃条件下干燥30 min,之后移入恒温干燥箱,在60 ℃条件下继续加热干燥48 h后测定。正常苗率=恢复培养后主茎正常生长的试管苗数/总贮藏试管苗数× 100%;腋生苗形成率=试管苗中萌发腋生苗(株高≥1 cm以上)的株数/正常苗总数× 100%,其中腋生苗是指主茎正常的试管苗叶腋间的腋生芽萌发后形成的新植株。
所有试验数据均采用邓肯氏新复极差测验法(SSR法)进行比较,显著水平P < 0.05。数据统计采用软件DPS 3.01版。
2 结果与分析 2.1 不同贮藏容器类型及方式对文心兰试管苗低温贮藏性的影响1) 不同贮藏容器类型及方式对文心兰试管苗生长的影响 在3种贮藏方式下,贮藏4周的文心兰试管苗经90天再培养后的生长情况见表 1。3种贮藏方式中,CB·L和FL·S贮藏方式下试管苗存活率均达100%,且与FL·L方式差异显著; FL·L方式下存活率最低,仅为81. 3%。从再培养后试管苗形态来看,正常苗率以CB·L方式最高,其次为FL·S和FL·L。其中FL·L方式显著低于对照的97. 9%。但在再培养后试管苗腋生苗形成率方面,2种液体贮藏方式(CB·L和FL·L)均显著高于固体贮藏方式的FL·S。表 1和图 2表明,3种贮藏方式中FL·S贮藏方式下株高值最大,其次为CB·L、对照和FL·L,但处理间差异不显著。试管苗贮藏后叶数均有所增加,且与对照相比差异显著,但不同贮藏方式间差异并不明显。叶长方面,对照略高于FL·S和CB·L贮藏方式,并与FL·L方式间存在显著差异。与叶长的情况类似,对照、FL·S和CB·L的根数均多于FL·L贮藏方式,且与FL·L间差异显著。根长方面,3种贮藏方式和对照间差异不大。
|
|

|
图 2 不同贮藏方式下文心兰试管苗再培养后生长状况 Figure 2 The growth of Oncidium plantlets in vitro after further culture with different storage methods |
2) 不同贮藏容器类型及方式对文心兰试管苗鲜、干质量及干质量比率的影响 从表 2看出,3种不同贮藏方式中,试管苗整株鲜质量大小依次为FL ·S,FL·L和CB·L,且3种贮藏方式与对照间差异均不显著; 地上部鲜质量的变化基本上与整株鲜质量相似。根部鲜质量方面,对照与3种低温贮藏方式间无显著差异。低温贮藏的试管苗在干质量方面与对照处理间差异均不显著,除CB·L方式下的根部干质量外,整株与地上部干质量均以对照较好,但3种低温贮藏方式相比较,CB·L方式下试管苗的干质量最大。表 2表明,CB·L方式下的试管苗在整株、地上部和根部干质量比率方面均高于FL·L,FL·S和对照,特别是根部干质量比率高达7. 6%,而FL·L,FL·S和对照之间差别并不明显。
|
|
3种贮藏方式中,CB·L方式下的文心兰试管苗存活率、正常苗率等指标显著高于其他2种贮藏处理。再培养后,CB·L方式下的文心兰试管苗在株高、叶数、叶长、根数、根长及鲜、干质量等指标方面与其他处理差异不显著。因此,CB是文心兰试管苗低温贮藏的有效容器,CB·L方式是其经济有效的低温贮藏方式。
2.2 不同预处理对文心兰试管苗低温贮藏性的影响1) 不同预处理时间对文心兰试管苗生长状况的影响 试管苗经过不同预处理后进行低温贮藏,再培养后的生长状况如表 3所示。试管苗再培养后的存活率以预处理时间为5天和7天的处理最高,分别为100%和97. 9%,且与其他处理差异显著; 接种后立即进行贮藏时(预处理0天),存活率最低,仅为83. 3%。从再培养后试管苗的形态来看,试管苗的正常苗率以预处理5天和7天的较高,其次是预处理9天,且与其他处理差异显著; 而再培养后试管苗的腋生苗形成率以7天最低,其次分别为预处理5天、9天和3天,预处理0天的试管苗腋生苗形成率最高,且处理间差异显著。5种预处理中,以预处理7天的试管苗株高值最大,其次为预处理5天和3天; 且3种处理均显著高于预处理0天的处理(表 3)。在叶数和叶长方面,预处理5天和7天的试管苗在叶数上显著高于其他3种处理; 预处理7天条件下的试管苗叶长最大,且与预处理5天和3天之间差异显著。根数和最大根长方面,5种处理间的试管苗根数差异不大; 而预处理7天的试管苗根长最大,其次是5天和3天处理,3者差异不显著; 预处理0天和9天试管苗根长显著低于上述3种处理。
|
|
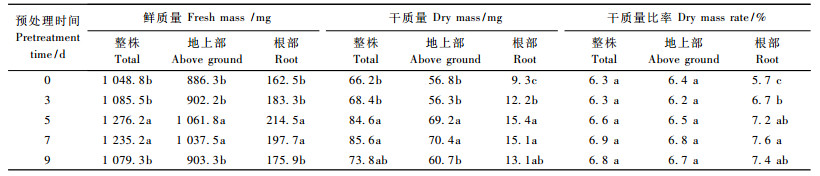
2) 不同预处理对文心兰试管苗鲜、干质量及干质量比率的影响 如表 4所示,5种处理的试管苗在整株、地上部及根部鲜质量方面的变化较为一致,均以预处理5天和7天处理最大,并与其他处理间差异显著。与鲜质量相比,不同处理在干质量方面略有不同,试管苗整株、地上部及根部干质量以预处理5天、7天2个处理的效果最好,且与预处理0天和3天差异显著,但在整株及根部干质量方面与预处理9天差异不显著。在干质量比率方面,预处理7天的试管苗在整株、地上部和根部干质量比率方面均高于其他处理,其次为预处理9天和5天; 预处理0天的根部干质量比率低于预处理3天的处理,但其整株和地上部干质量比率与预处理3天的处理差异不显著。
|
|
5种预处理中,预处理时间为5天、7天下的文心兰试管苗存活率及正常苗率等综合指标高于其他预处理; 且再培养后2种处理下的文心兰试管苗在株高、叶数、根数、根长及干质量比率等指标方面略高于其他处理,但差异不显著; 而其鲜、干质量显著高于其他处理。因此,5种预处理中,文心兰试管苗适宜的预处理时间为5 ~ 7天。
3 讨论在植物组培苗低温保存研究中,多采用试管或三角瓶等作为贮藏容器。玻璃容器用于种质资源保存较为有效,但在组培苗规模化运输和贮藏中,上述容器由于占用较大的贮藏空间,提高了试管苗的成本,也极大地制约了低温贮藏技术在试管苗商业化生产中的应用。本研究以CB作为文心兰试管苗低温贮藏用容器,研究结果表明,与传统的三角瓶相比,试管苗再培养后2种容器在存活率及生长状况等方面无显著差异,与对照相比差异也不显著。但由于CB是热压封口,试管苗在贮藏期间和运输过程中污染和破损的机率较小; 且CB为袋形,体积相对较小,贮藏时可将其并排放置,与其他贮藏用容器(三角瓶、罐头瓶等)相比,贮藏空间的利用率大幅度提高。因而,认为,在规模化文心兰试管苗低温贮藏中,CB是文心兰试管苗低温贮藏的有效容器,CB·L贮藏方式是其贮藏的有效方式。
酒井昭(1982)在马铃薯(Solanum tuberosum)试管苗低温贮藏研究中证明,培养体在低温贮藏前进行预处理可以提高其低温贮藏性。本研究也表明文心兰试管苗在低温贮藏前,进行适当时间的预处理可以提高其低温贮藏性能,预处理时间以5 ~ 7天为宜。同时还发现,在预处理为0 ~ 7天内预培养时间愈短,再培养后正常苗率愈低,而腋生苗形成率愈高,这与Fukai等(1990)在菊花(Dendranthema grandiflorum)茎尖低温保存研究中的结论一致。前人在对大田作物研究中发现,处于迅速生长期的植物对低温的抵抗能力通常较差。本研究中,文心兰试管苗在预处理9天时出现正常苗率大幅下降的现象,其原因目前尚不清楚,是否与此时试管苗已处于恢复生长期有关,尚需进一步探讨。今后,若能在文心兰试管苗CB容器低温贮藏温度、贮藏时间等方面进一步研究,将会完善其低温贮藏技术,为文心兰试管苗的运输和贮藏提供技术支持。
艾鹏飞, 罗正荣. 2004. 柿和君迁子试管苗缓慢生长法保存及其遗传稳定性研究[J]. 园艺学报, 31(4): 441-446. |
陈辉, 陈晓玲, 陈龙清, 等. 2006. 百合种质资源限制生长法保存研究[J]. 园艺学报, 33(4): 789-793. |
何松林, 王鹏飞, 杨秋生, 等. 2003a. CO2施肥时树脂膜培养容器在文心兰试管苗培养中应用研究[J]. 北京林业大学学报, 25(3): 33-36. |
何松林, 刘震, 杨秋生, 等. 2003b. CO2施肥时非无菌条件下容器内文心兰试管苗接种技术研究[J]. 北京林业大学学报, 25(4): 49-53. |
何松林, 孔德政, 杨秋生, 等. 2003c. 高分子树脂膜培养容器在文心兰原球茎增殖中的应用[J]. 北京林业大学学报, 25(5): 55-58. |
何松林, 杨秋生, 孔德政, 等. 2003d. 施CO2时培养基糖浓度对文心兰试管苗生长的影响[J]. 园艺学报, 30(6): 745-747. |
何松林, 蒋要卫, 孔德政, 等. 2007. 不同培养方式对大花蕙兰试管苗生长的影响[J]. 河南农业大学学报, 41(6): 619-622. |
何松林, 蒋要卫, 孔德政, 等. 2008. CO2施用对大花蕙兰试管苗生长和叶片气孔特征的影响[J]. 河南农业大学学报, 42(2): 162-166. |
刘剑锋, 阎秀峰, 程云清, 等. 2007. 高山红景天(Rhodiola sachalinensis)试管苗缓慢生长法保存及试管苗DNA含量分析[J]. 浙江大学学报:农业与生命科学版, 33(4): 373-378. |
刘月学, 刘小军, 王家福, 等. 2004. 低温等因素对枇杷种质离体保存的影响[J]. 植物资源与环境学报, 13(1): 28-31. |
牛爱国, 张开春, 张晓明, 等. 2005. 樱桃种质资源试管苗保存方法[J]. 园艺学报, 32(2): 298-300. |
宋希强, 罗毅波, 钟云芳, 等. 2005. 石斛属植物生物技术研究概况[J]. 园艺学报, 32(4): 741-747. |
王艳芳, 房伟民, 陈发棣, 等. 2007. '神马'菊花的离体保存及遗传稳定性[J]. 西北植物学报, 27(7): 1341-1348. |
王越, 刘燕. 2006. 玻璃化法超低温保存石楠茎尖的初步研究[J]. 林业科学, 42(12): 134-136. DOI:10.3321/j.issn:1001-7488.2006.12.024 |
吴金寿, 胡又厘, 林顺权, 等. 2005. 芳樟离体快繁与离体保存试管苗再生植株培养[J]. 福建农林大学学报:自然科学版, 34(1): 44-50. |
赵密珍, 王壮伟, 钱亚明. 2006. 不同培养基对草莓种质离体保存的影响[J]. 果树学报, 23(1): 27-30. |
翟晓巧, 程斐, 朱延林. 2009. 二乔刺槐愈伤组织超低温保存及适宜降温方法[J]. 林业科学, 45(10): 49-54. DOI:10.11707/j.1001-7488.20091009 |
酒井昭. 1982. 植物の耐凍性と寒冷反應[M]. 東京: 學會出版ヤンタ-.
|
田中道男, 新居清, 高村武二郎. 1995. シン ビ ジ ウ ム メ リ ク ロ ン苗の計劃生産の た め の苗條低溫貯藏[J]. 園學雜, 64(1): 522-523. |
Fukai S, Masaharu O E. 1990. Morphological observations of chrysanthemum shoot tips cultured after cryoprotection and freezing[J]. Japanese Society for HortScience, 59(2): 383-387. |
González M L, Mallón R, Reinoso J, et al. 2006. In vitro micropropagation and long-term conservation of the endangered moss Splachnum ampullaceum[J]. Biologia Plantarum, 50(3): 339-345. DOI:10.1007/s10535-006-0047-8 |
Kovalchuk I, Lyudvikova Y, Volgina M, et al. 2009. Medium, container and genotype all influence in vitro cold storage of apple germplasm[J]. Plant Cell Tiss Organ Cult, 96(2): 127-136. DOI:10.1007/s11240-008-9468-8 |
Negash A, Krens F, Schaart J, et al. 2001. In vitro conservation of enset under slow-growth conditions[J]. Plant Cell, Tissue and Organ Culture, 66(2): 107-111. DOI:10.1023/A:1010647905508 |
Pacheco G, Gagliardi R F, Valls J F M, et al. 2009. Micropropagation and in vitro conservation of wild Arachis species[J]. Plant Cell Tiss Organ Cult, 99(3): 239-249. DOI:10.1007/s11240-009-9599-6 |
 2010, Vol. 46
2010, Vol. 46