文章信息
- 陈祖静, 曹支敏, 苟兴庆, 姜自如
- Chen Zujing, Cao Zhimin, Gou Xingqing, Jiang Ziru
- 杨树与松杨栅锈菌互作中寄主活性氧及抗性相关酶变化
- Dynamic Changes of Active Oxygen and Related Enzymes of the Host in Interaction between the Poplar and Melampsora larici-populina
- 林业科学, 2010, 46(8): 101-105.
- Scientia Silvae Sinicae, 2010, 46(8): 101-105.
-
文章历史
- 收稿日期:2009-10-27
- 修回日期:2009-12-11
-
作者相关文章
2. 西北农林科技大学生命科学学院 杨凌 712100
2. College of Life Sciences, Northwest A&F University Yangling 712100
大量研究表明,受病原菌侵染的植物体内活性氧(ROS)的产生与植物抗病性密切相关,ROS(主要包括O2·和H2O2)能参与一系列抗病防卫反应,直接杀伤病原菌或通过参与细胞壁木质化及富含羟脯酸蛋白的氧化交联来提高寄主细胞的抵御入侵能力(Bradley et al., 1992;Brission et al., 1994;Wu et al., 1995),ROS参与寄主过敏性坏死反应(HR)和防卫基因表达的信号传递(Tenhaken et al., 1995;Lamb et al., 1997;Delledonne et al., 2002)。随着植物体内ROS的积累,其清除系统中的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶活性也随植物抗病性的不同而发生明显差异(宋凤鸣等,2001;王媛等,2008;王晨芳等,2009)。同时,病原真菌入侵能够诱导寄主植物苯丙氨酸解氨酶(PAL)、几丁质酶等活性升高而增加其抗病性(胡景江等,2000;郭文硕等,2002)。由落叶松-杨栅锈菌(Melampsora larici-populina,MLP)引起的叶锈病是杨树分布广、危害重的一种叶部病害,其发生程度与杨树品种抗病性密切相关(陈建珍等,2003;刘莉丽等,2008)。国内目前有关杨树抗该叶锈病机制研究主要局限于一般的生理生化指标测定(赵鹏等,2007;2008),关于杨树在与锈菌互作中的活性氧变化及其与寄主抗病性的关系未见报道。近年来,在研究落叶松-杨栅锈菌致病性与生理小种分化过程中发现,不同杨树(Populus)种或品种之间的侵染反应型差别很大(曹支敏等,2005;刘春梅等,2008)。因此,本试验以不同抗性杨树品种与落叶松-杨栅锈菌不同生理小种间的互作进程为对象,研究叶锈病病程中杨树叶片组织ROS的爆发及相关酶活性的动态变化规律与寄主品种抗病性的关系,为进一步揭示杨树的抗锈病分子机制及抗病育种提供基础。
1 材料与方法 1.1 供试菌种与杨树供试菌种为我国落叶松-杨栅锈菌生理小种CMLP4和CMLP2(曹支敏等,2005)的甘肃临夏单孢菌系Gl052和四川宝兴单孢菌系Sb052,由西北农林科技大学林学院森林病理学实验室提供。
供试杨树品种(种)分别为美洲黑杨(P. deltoides)、川杨(P. szechuanica)、欧美108杨(P. ×euramericana cv.‘Guarieto’)、波兰15号杨(P. ×euramericana cv. ‘Polska 15 A’)和中林美荷杨(P. deltoides × P. nigra),均采自西北农林科技大学苗圃。
2009年3月采集各品种杨树1年生的插条,盆栽于西北农林科技大学植物保护学院温室。6月初选取叶龄指数(leaf plastochron index,LPI)为5~8的健康叶片作为接种叶片,参照曹支敏等(1998)方法分别接种Gl052(G)、Sb052(S)夏孢子悬浮液(1~2 mg·mL-1),同时涂抹自来水作为对照(CK)。每个处理设2个重复。接种后置于保湿桶内保湿24 h,然后放在22~26 ℃的温室培养。
1.2 反应型的测定接种后记载各处理寄主的锈病潜育期和反应型。反应型分级标准按照曹支敏等(1998),并以接种15~20天后的寄主反应型为基准。
1.3 活性氧及相关酶活性测定分别于接种后0.5, 1,2,3,5,7天和9天随机取各处理杨树叶片,每处理每次取0.5 g,样品用锡箔纸包好后迅速投入液氮中并置于-80 ℃冰箱保存。
1.3.1 O2·产生速率的测定参照刘俊等(2000)的羟胺氧化法。所有处理均设3个重复(下同)。
1.3.2 H2O2含量的测定参照林植芳等(1988)的钛复合物测定法。
1.3.3 SOD测定参照高俊凤等(2006)NBT法,以抑制NBT光还原反应50%所需的酶量为1个酶活性单位(U)。
1.3.4 POD测定参照高俊凤等(2006)愈创木酚法,以每分钟OD470变化值表示酶活力大小。
1.3.5 PAL活力测定参照高俊凤等(2006)紫外线吸收法,以每小时A290增加0.01为1个酶活性单位(U)。
1.3.6 几丁质酶活力的测定参照Boller等(1983)等方法,以每克叶片组织产生0.1 mg NAG为1个酶活力单位(U)。
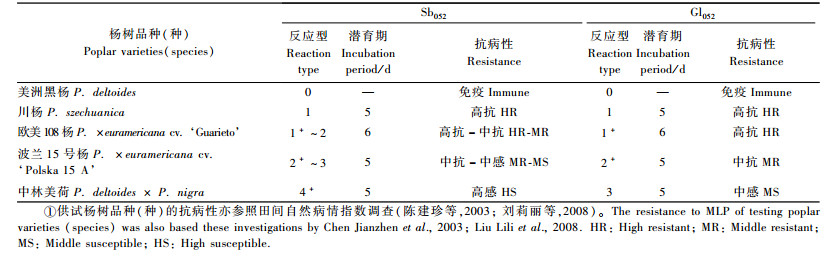
2 结果与分析 2.1 反应型测定结果各供试杨树品种(种)与落叶松-杨栅锈菌2菌系的接种反应型及抗病性记载如表 1。菌系Sb052的寄主反应型与刘春梅(2007)试验结果基本相符,但Gl052在川杨上表现为高抗,而在波兰15号杨上呈现中度侵染反应。
|
|
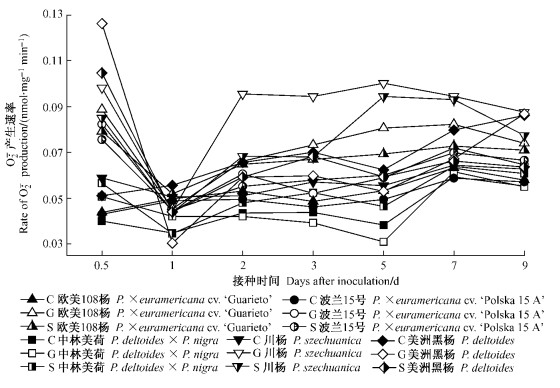
各处理杨树品种O2·产生速率见图 1。杨树接种后0.5天时,各组合寄主O2·产生速率均有显著升高并达到最大,其值大小依次为免疫组合>高抗组合>中抗(感)组合>高感组合,其中免疫、高抗与中抗(感)、高感组合分别比对应CK升高了100%以上、40%~100%、20%~40%。但在1天时显著下降到CK水平,之后免疫和高感组合均长时期低于对应CK,而高抗、中抗(感)组合分别在第2,5天与2,7天出现2个峰值,表现为抗性越高,2次峰值越大且出现时间越早。
|
图 1 不同组合中杨树叶片O2·产生速率的变化 Figure 1 Changes in the rate of O2· production in poplar leaves with different interactions C: CK; G:接种Gl052 Inoculated with Gl052; S:接种Sb052 Inoculated with Sb052. |
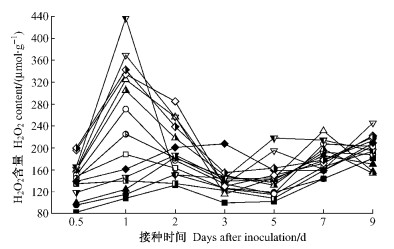
图 2显示,接种后各组合寄主受侵组织中H2O2含量均有所升高,并于1天时出现第1个显著高峰,杨树品种(种)的抗性越强,升高幅度越大,免疫、高抗、中抗(感)、高感组合分别比对应CK升高了100%~120%、150%~200%、90%~150%、30%~75%。1天后各组合寄主H2O2含量迅速下降,并在3天时低于或接近CK,之后波动上升。高抗、中抗组合寄主分别在第5,7天出现第2个峰值。试验结果亦显示,受侵组织中H2O2含量积累高峰期较O2·产生速率高峰滞后0.5天,并且与后者的低谷期相吻合(图 1)。这与O2·→H2O2的歧化反应密切有关,H2O2成为诱导寄主HR和防卫反应的主要信号物质(Desikan et al., 1998;Delledonne et al., 2001)。
|
图 2 不同组合中杨树叶片H2O2含量的变化 Figure 2 Changes in the content of H2O2 in poplar leaves with different interactions |
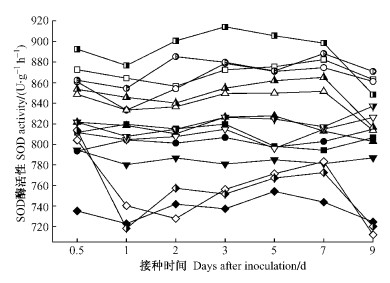
杨树接种后,所有组合寄主SOD活性在0.5天时较CK均有明显上升,1天时略有下降,之后又有升高,7天后缓慢下降。整个进程中杨树寄主SOD酶活性大小排序为高感组合>中抗(感)组合>高抗组合>免疫组合(图 3),证明SOD酶活性与寄主抗病性呈负相关。此结果与抗病组合寄主SOD活性低、歧化作用差、叶组织中有较多O2·积累而对病原菌产生杀伤作用相符合。同时可以看出,各组合寄主在0.5天时SOD活性升高正逢O2·产生速率的高峰期(图 1),证明O2·的产生会迅速激发SOD酶活性的升高,并由后者催化O2·产生H2O2。
|
图 3 不同组合中杨树叶片SOD活性的变化 Figure 3 Changes in the activity of SOD in poplar leaves with different interactions |
由图 4可看出,接种后期(3天后)杨树各品种POD活性与其抗病性呈负相关。高感组合寄主POD酶活性在2~3天后迅速升高、且增幅大,而中抗(感)组合于3天或5天、免疫和高抗组合均于7天后迅速升高,9天时感病品种POD活性大于或近似于高抗病品种,但免疫杨树品种在整个进程中POD酶活性仅高于其CK。由于POD具有清除ROS的作用,可将H2O2分解为H2O和O2,所以感病品种叶组织中的ROS积累较少,从而利于栅锈菌的侵染。试验显示POD酶活性升高时间在H2O2积累最高峰的1天以后,也说明了这一点。此外,各组合寄主后期的ROS明显降低也可能与POD活性大幅升高有关。
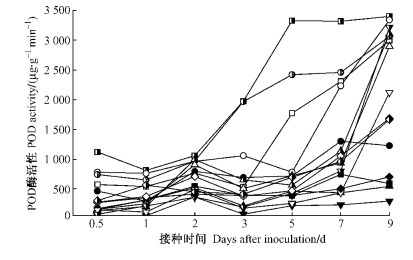
|
图 4 不同组合中杨树叶片POD活性的变化 Figure 4 Changes in the activity of POD in poplar leaves with different interactions |
接种后0.5天时,免疫和抗病组合的PAL活性明显上升,中抗(感)组合略有上升,而高感组合接近或低于对应CK。1天时各组合寄主PAL活性下降至低谷,此后又上升,并在2天时出现第2个明显高峰,3天后,除高抗组合寄主(川杨)在第5天出现第3个酶活性高峰外,其他组合寄主的酶活性接近或者低于相应CK(图 5)。表现为杨树品种(种)的抗病性越强,其PAL被诱发的活性越高,且持续的时间较长。
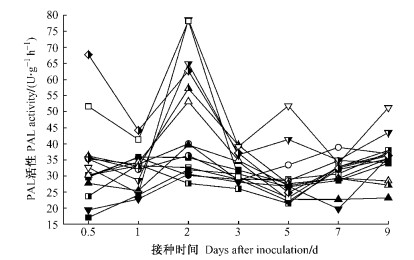
|
图 5 不同组合中杨树叶片PAL活性的变化 Figure 5 Changes in the activity of PAL in poplar leaves with different interactions |
图 6显示,各组合杨树品种在接种后0.5天时几丁质酶活性较CK均有所升高,其中高抗品种川杨的升高幅度最为明显。除免疫树种外,各组合杨树的几丁质酶活性在1天时迅速下降,之后高抗品种于第2,7天先后出现2个峰值,呈现抗性越强,几丁质酶活增幅越大。免疫品种美洲黑杨接种后几丁质酶活性持续升高,在2天时达到1个显著峰值,比其他组合高出50 %以上,且后期下降缓慢。而高感品种中林美荷杨的几丁质酶活性在接种1天后一直接近或低于CK。试验结果清楚表明,几丁质酶活性与杨树品种(种)的抗锈病性正相关。
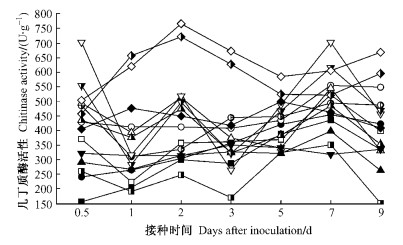
|
图 6 不同组合中杨树叶片几丁质酶活性的变化 Figure 6 Changes in the activity of chitinase in poplar leaves with different interactions |
在植物的防卫反应快速启动机制中,受病原菌的入侵寄主体内ROS被激发,一般认为O2·与H2O2有2次爆发高峰,第1次高峰十分短促,不论是亲和互作还是非亲和互作均有此反应; 第2次高峰是非亲和性互作关系的特征峰,持续时间较长(Glazebrook et al., 2005)。本试验结果基本证明了以上观点,即杨树品种(种)的抗锈性越强,ROS升高幅度越大,且抗性组合寄主呈现2~3次积累高峰。但O2·在0.5天第1次突增后,高抗、中抗(感)组合均再次出现2个峰值,说明在不同寄主植物与不同的病原菌互作中,O2·爆发的次数可能不同。免疫组合中寄主H2O2也先后出现2个升高峰,但O2·产生速率在0.5天第1次高峰出现后一直低于对照,其机制仍有待进一步研究。本试验证明免疫、抗病组合杨树组织O2·、H2O2分别在接种松-栅锈菌0.5,1天时迅速爆发并积累达到最高峰,此时正值锈菌吸器母细胞形成和寄主过敏性坏死反应及程序性细胞死亡(PCD)的关键时期(Laurans et al., 1999;Heath, 2000;田呈明等,2001)。笔者在组织学观察中发现,高抗川杨接种松-栅锈菌2天后出现明显HR现象,而其他免疫和感病品种中未发现或不明显,说明抗病组合可能通过ROS的爆发诱导HR从而阻止锈菌的侵染,免疫组合在侵入前期就能够成功阻止病原菌的入侵,而感病组合中ROS含量低有利于锈菌侵染。
3.2 抗氧化酶与杨树抗病性的关系本研究证明,SOD、POD活性与杨树寄主抗病性呈负相关,结果与赵鹏等(2007)研究结论相同,也与王晨芳等(2009)对小麦-条锈菌(Puccinia striiformis)互作过程中活性氧及保护酶系的变化研究结果基本一致。但有关抗氧化酶活性与寄主植物抗病性的关系因病害系统不同而不尽一致。王媛等(2008)用溃疡病菌接种杨树发现,抗病杨树POD活性与抗病性呈正相关,抗病和感病杨树SOD活性呈现前期上升后期下降的趋势,抗病性强弱与病害后期的SOD活性呈正相关。曾永三等(2004)用豇豆单胞锈菌(Ueomvces vignae)接种长豇豆(Vigna sesquipedalis)品种后发现免疫和感病品种POD、SOD活性在12 h内升高而抗病品种相反,后期抗病品种升幅高于感病品种。一般说来,植物POD、SOD和CAT等抗氧化酶具有清除ROS作用,以减轻其对自身的危害。因此,感病寄主植物抗氧化酶活性高于抗病性寄主,在此类保护酶的作用下,导致组织ROS含量降低,从而有利于病原菌的扩展与繁殖,使得寄主表现为感病。而在免疫、抗病等非亲和互作中,其情况恰恰相反,O2·、H2O2等ROS诱发了一系列的寄主防卫反应(Chisholm et al., 2006),尽管后期保护酶活性升高也有助于抗病寄主清除体内的ROS,但由于发生时期较晚,且酶活性较低,对寄主的抗入侵影响不大,使其最终表现为免疫或抗病反应型。
3.3 PAL、几丁质酶与抗病性的关系本研究结果证明,免疫、高抗病性杨树品种受松-杨栅锈菌侵染后PAL活性上升速度快、强度大。由PAL控制的苯丙烷代谢途径能合成多种酚类化合物, 其中的植保素类物质能强烈地抑制病原菌生长和侵染(高雪,2009)。郭文硕等(2002)证明PAL能通过参与木质素合成来增强寄主细胞壁强度从而发挥其抗病性。Durner等(1998)和Polverari等(2003)认为NO能诱导PAL基因的表达,关于诱导受侵杨树PAL表达的信号分子仍需要研究。本试验也同时证明几丁质酶活性与杨树品种的抗病性基本呈正相关,与胡景江等(2000)研究结果基本吻合。但此次试验显示高抗、中抗杨树品种的几丁质酶活性随接种后时间的推移出现波动及2~3次高峰,其机制有待进一步研究。
曹支敏, 李振岐, 胡景江. 1998. 落叶松-杨栅锈菌(Melampsora larici-populina Kleb)生理分化研究[J]. 西北林学院学报, 13(1): 53-57. |
曹支敏, 余仲东, 潘彦平, 等. 2005. 中国落叶松-杨栅锈菌(Melampsora larici-populina Kleb)生理小种分化[J]. 植物病理学报, 35(2): 184-186. |
陈建珍, 曹支敏, 樊军锋. 2003. 杨树叶锈病寄主抗性调查[J]. 西北林学院学报, 20(1): 153-155. |
高雪. 2009. 植物苯丙氨酸解氨酶研究进展[J]. 现代农业科技, (1): 30-33. |
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社: 211-222.
|
郭文硕. 2002. 杉木对炭疽病的抗性与苯丙氨酸解氨酶的关系[J]. 应用与环境生物学报, 8(6): 592-595. |
胡景江, 曹支敏, 文建雷. 2000. 落叶松-杨栅锈菌寄主抗病性的研究[J]. 林业科学研究, 13(专): 114-118. |
林植芳, 李双顺, 林桂珠. 1988. 衰老叶片和叶绿体中H2O2的积累与膜脂过氧化的关系[J]. 植物生理学报, 14(1): 16-22. |
刘俊, 吕波, 徐朗莱. 2000. 植物叶片中过氧化氢含量测定方法的改进[J]. 生物化学与生物物理进展, 27(5): 548-551. |
刘春梅, 曹支敏, 余仲东. 2008. 中国落叶松-杨栅锈菌生理小种鉴定[J]. 西北林学院学报, 23(2): 105-108. |
刘莉丽, 曹支敏, 樊军锋, 等. 2008. 杨树品种叶锈病抗病性研究[J]. 西北林学院学报, 23(6): 132-134. |
宋凤鸣, 葛秀春, 郑重. 2001. 活性氧及膜脂过氧化与棉花对枯萎病抗性的关系[J]. 植物病理学报, 31(2): 110-115. |
田呈明, 梁英梅, 康振生, 等. 2001. 杨树与栅锈菌互作的组织病理学研究[J]. 林业科学, 37(6): 52-58. DOI:10.11707/j.1001-7488.20010610 |
王晨芳, 黄丽丽, 张宏昌, 等. 2009. 小麦-条锈菌互作过程中活性氧及保护酶系的变化研究[J]. 植物病理学报, 39(1): 52-60. |
王媛, 梁军, 张星耀. 2008. 抗、感病杨树与溃疡菌互作中活性氧及相关酶的动态[J]. 南京林业大学学报:自然科学版, 32(5): 41-46. |
曾永三, 王振中. 2004. 豇豆与锈菌互作中的活性氧代谢研究[J]. 植物病理学报, 34(2): 146-153. |
张伟丽, 郭振飞. 2007. 不同抗性品活性及种柱花草接种炭疽菌后CAT、SOD活性及H2O2、脐月氏质含量的变化[J]. 扬州大学学报, 28(2): 74-77. |
赵鹏, 田呈明, 曹支敏. 2007. 杨树与栅锈菌互作中生理代谢变化[J]. 西北林学院学报, 22(4): 124-127. |
赵鹏, 田呈明, 曹支敏. 2008. 杨树与栅锈菌互作过程中光合、蒸腾作用变化研究[J]. 中国森林病虫, 27(1): 5-8. |
Boller T, Gehri A, Mauch F, et al. 1983. Chitinase in bean leaves: induction by ethylene, purification, properties, and possible function[J]. Plant, 157: 22-31. DOI:10.1007/BF00394536 |
Bradley D J, Kjellbom P, Lamb C J. 1992. Elicitor-induced and wound-induced oxidative cross-linking of a proline rich plant cell wall protein: a novel, rapid defense response[J]. Cell, 70(1): 21-30. DOI:10.1016/0092-8674(92)90530-P |
Brission F L, Tenhaken R, Lamb C. 1994. Function of oxidative cross-linking of cell wall structural protein in plant disease resistance[J]. Plant Cell, 6: 1703-1712. DOI:10.1105/tpc.6.12.1703 |
Chisholm S T, Coaker G, Day B, et al. 2006. Host microbe interactions: Shaping the evolution of the plant immune response[J]. Cell, 124: 803-814. DOI:10.1016/j.cell.2006.02.008 |
Delledonne M, Murgia I, Ederle D, et al. 2002. Reactive oxygen intermediates modulate nitric oxide signaling in the plant hypersensitive disease-resistance response[J]. Plant Physiol Biochem, 40: 605-610. DOI:10.1016/S0981-9428(02)01397-9 |
Delledonne M, Zeier J, Marocco A, et al. 2001. Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response[J]. Proc Natl Acad Sci USA, 98(6): 13454-13459. |
Desikan R, Reynolds A, Hancock J T, et al. 1998. Harpin and hydrogen peroxide both initiate programmed cell death but have differential effects on defence gene expression in Arabidopsis suspension cultures[J]. Biochem J, 330: 115-120. DOI:10.1042/bj3300115 |
Durner J, Wendehennne D, Klessig D F. 1998. Defense gene induction in tobacco by nitric oxide, cyclic GMP, and cyclic ADP-ribose[J]. Proc Natl Acad Sci USA, 95: 10328-10333. DOI:10.1073/pnas.95.17.10328 |
Glazebrook J. 2005. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J]. Phytopathology, 43: 205-227. DOI:10.1146/annurev.phyto.43.040204.135923 |
Heath M C. 2000. Hypersensitive response-related death[J]. Plant Molecular Biology, 44(3): 321-334. DOI:10.1023/A:1026592509060 |
Lamb C, Dixon R A. 1997. The oxidative burst in plant disease resistance[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 48: 251-275. DOI:10.1146/annurev.arplant.48.1.251 |
Laurans F, Pilate G. 1999. Histological aspects of a hypersensitive response in poplar to Melampsora larici-populina[J]. Phytopathology, 89(3): 233-238. DOI:10.1094/PHYTO.1999.89.3.233 |
Polverari A, Molesini B, Pezzotti M, et al. 2003. Nitric oxide-mediated transcriptional changes in Arabidopsis thaliana[J]. Mol Plant-Microbe Interact, 16: 1094-1105. DOI:10.1094/MPMI.2003.16.12.1094 |
Tenhaken R, Levine A, Brisson L F, et al. 1995. Function of the oxidative burst in hypersensitive disease resistance[J]. Proc Natl Acad Sci USA, 92(10): 4158-4163. DOI:10.1073/pnas.92.10.4158 |
Wu G S, Short B J, Lawrence E B. 1995. Disease resistance conferred by expression of a gene encoding H2O2 -generation glucose oxidase in transgenic potato plants[J]. Plant Cell, 7: 1357-1368. |
 2010, Vol. 46
2010, Vol. 46