文章信息
- 高慧, 詹怀宇, 付时雨, 罗小林, 刘盛全
- Gao Hui, Zhan Huaiyu, Fu Shiyu, Luo Xiaolin, Liu Shengquan
- 马尾松正常木与应压木木素结构的比较
- Comparison on the Lignin Structures of Normal and Compression Wood of Masson Pine
- 林业科学, 2010, 46(5): 141-146.
- Scientia Silvae Sinicae, 2010, 46(5): 141-146.
- DOI: 10.11707/j.1001-7488.20100523
-
文章历史
- 收稿日期:2008-07-02
-
作者相关文章
2. 华南理工大学制浆造纸工程国家重点实验室 广州 510640
2. State Key Laboratory of Pulp and Paper Engineering, South China University of Technology Guangzhou 510640
马尾松(Pinus massoniana)是我国南部最主要的针叶材造林树种之一,适应性强,速生丰产,是重要的制浆造纸和人造板等工业用材。应压木是针叶材由于环境的关系迫使树干倾斜、弯曲而形成的偏心材。据资料介绍(《制浆造纸手册》编写组,1987),应压木的制浆造纸等性能不如正常木,原因主要与其化学组成和纤维形态有关,木素是植物纤维原料细胞壁的主要成分之一,树木在生长过程中,在不同的生长期、不同的环境影响下,所形成的木素在结构上就会有所差异(秦特夫等,2004;秦特夫,1999;2001)。木素作为一种正在被广泛应用的丰富可再生资源,在木材化学、植物生化等领域都引起越来越浓厚的兴趣,它的化学官能团和键型组成变化都会影响木材的力学性质和化学反应性质。为了探索应压木的利用价值,弄清它与正常木木素的结构差别对其在制浆造纸和生物质精炼方面的应用具有非常重要的意义。
研究木素结构有化学和物理的方法,化学方法主要对木素进行降解,如硫代酸解结合脱硫化反应(Hans,2003)、碱性硝基苯氧化、高锰酸钾氧化、乙醇解和酸解等(杨淑蕙,2001),这些方法都对木素结构进行了改变。近年来,研究人员运用包括红外、紫外、核磁共振等光谱技术对木素进行非破坏性的物理分析(Jahan et al., 2007;Holtman et al., 2007;Xu et al., 2008;Boonstra et al., 1996),1964年,Ludwig首次将1H-NMR应用到木素结构的研究中,接着13C-NMR被广泛应用,31P-NMR用于测定木素结构是20世纪90年代才发展起来的新手段(Argyropoulous et al., 1993a;1993b; 1994;付时雨等,1999)。
本文对从马尾松正常木和应压木中分离出的纤维素酶酶解木素进行紫外、红外、凝胶渗透色谱、1H-NMR、31P-NMR和有机元素分析,探讨它们的化学结构差异,为应压木在制浆造纸和生物质精炼方面应用提供一定的理论依据。
1 材料与方法 1.1 原料马尾松采自安徽省寿县八公山人工林场,18年生。在纤维素酶酶解木素制备、提取、提纯和乙酰化过程中所用的化学试剂均为分析纯,在仪器测定中所用化学试剂均为优级纯。
1.2 方法 1.2.1 样品制备应压木选取是在年轮特别宽的偏心材上,通过横切面切片在显微镜下观察其管胞圆形、细胞间隙明显,有的管胞内部可见螺纹裂隙来划分的;正常木选取是在无偏心的木材,尽量选择与应压木同一年轮。风干木片切成火柴杆大小,粉碎后用标准筛筛取40~120目的木粉,然后用苯-乙醇(体积比为2:1)溶液在索氏抽提器上连续抽提48 h,试样风干后放进有P2O5的真空干燥箱72 h。干燥后的木粉用Vibration振动球磨机(在陶瓷缸中加圆柱形陶瓷颗粒)进行球磨处理4 h。
1.2.2 纤维素酶酶解木素的提取磨碎后的木粉用纤维素酶进行酶解。首先用浓度50 mmol·L-1、pH4.8的NaAc/HAc缓冲溶液调节木粉浓度为5%左右,再加入纤维素酶(用量为500 IU·g-1木粉),然后在50 ℃带有水浴的摇床内连续酶解48 h,摇床的振动频率为120 r·min-1。酶解完成后,离心弃去上层清液,沉淀用缓冲溶液调整体积,再加入纤维素酶(用量同前),进行第2次酶解。酶解完以后的离心沉淀物用pH 2的盐酸溶液洗涤数次,然后于真空冷冻干燥机冷冻干燥,即得到酶解粗木素。
1.2.3 纤维素酶酶解木素的提纯参照Lundquist(1979)的液-液纯化法对酶解后的粗木素进行精制(陈嘉翔等,1989),以尽量减少粗木素中的糖类和木素-碳水化合物复合体等物质。为了避免由于有机溶剂层和水层分离不完全而造成的混淆,精制分2步进行:第1步,将粗木素溶于210 mL吡啶-醋酸-水(体积比为9:1:4)中,溶液用270 mL CHC13萃取,静置12 h分层后振荡,再次分为3层后,分离出下层溶有木素的有机层;第2步,往剩下的沉淀层和水层中加人270 mL左右的CHC13再次萃取,振荡后静置,分层、分离出下层的有机层;合并2次萃取的有机层,在旋转真空蒸发器中浓缩至大约200 mL左右,再慢慢滴入搅动着的2 000 mL乙醚中,木素即可沉淀出来,将沉淀出来的木素用乙醚多次洗涤至无吡啶气味为止,然后置于放有P2O5的真空干燥器中干燥,即得到浅灰白色的木素。
1.2.4 木素的乙酰化反应称取300 mg木素溶于15 mL体积比为1:2的吡啶-醋酸酐溶液中,通入氮气赶走瓶中空气后,迅速盖紧瓶塞,置于暗处,室温下反应72 h。反应完成后,将溶液慢慢滴入搅动着的200 mL乙醚中沉淀出乙酰化木素。用乙醚洗涤沉淀多次直至无吡啶气味,最后置入放有P2O5的真空干燥箱中干燥。乙酰化木素用于GPC和1H-NMR的测定。
1.2.5 木素的分子质量分布测定称取5 mg乙酰化木素溶于1 mL四氢呋喃中,然后以聚苯乙烯标样为基准分子质量,用凝胶渗透色谱仪测定。仪器为美国Waters公司515型凝胶渗透色谱仪。
1.2.6 木素的有机元素测定C,H和N的含量用德国Vario EL Ⅲ型元素分析仪测定,O的含量通过计算所得。
1.2.7 木素的紫外光谱测定取干燥的木素试样溶于二氧六环-水溶液(9:1,体积比)中,木素试样的浓度为30 mg·L-1。以二氧六环-水溶液为参比溶液,测定木素样品的紫外吸收光谱。仪器为日本岛津(Shimadzu)UV-2201型紫外-可见分光光度计,扫描波长为200~500 nm。
1.2.8 木素的红外光谱测定采用KBr压片法,在Nicolet Nexus红外光谱仪上测定木素样品的红外吸收光谱。样品用量为每100 mg KBr 1 mg木素,测定波数为400~4 000 cm-1。
1.2.9 木素的核磁共振波谱测定1H-NMR是将乙酰化木素溶于0.5 mL CDCl3中,用四甲基硅烷作内标;31P-NMR是将约40 mg的木素试样溶于氘代吡啶-氘代氯仿溶剂中,以胆固醇为内标,以乙酰基丙酮络酸铬为驰豫剂,加入2-氯-4,4,5,5-四甲基-1,3,2-二氧膦杂戊环后,在德国Bruker DRX-400超导核磁共振谱仪上测试所得。
2 结果与讨论 2.1 紫外光谱特征由于木素是芳香族化合物,对紫外光有很强的特性吸收,而饱和的碳水化合物等在紫外区不吸收。由原紫外光谱在280 nm处归一化处理后的图 1可以看出,马尾松正常木与应压木木素的紫外吸收光谱是相似的,最大吸收都出现在280 nm处,这是因为针叶材木素的结构单元主要是愈创木基型。但应压木木素在300~400 nm的吸光度大于正常木木素的吸光度,300~400 nm是羰基或者含有羰基及其双键结构等生色和助色基团的吸收带(杨淑蕙,2001),表明应压木木素中的生色和助色基团较多,这可能也是应压木颜色比正常木深的原因。
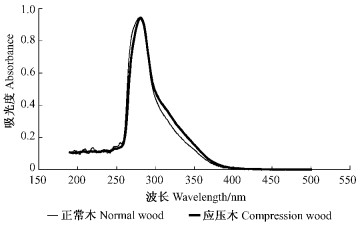
|
图 1 马尾松正常木与应压木木素紫外光谱 Figure 1 UV spectrogram of lignin samples in normal and compression wood of Masson Pine |
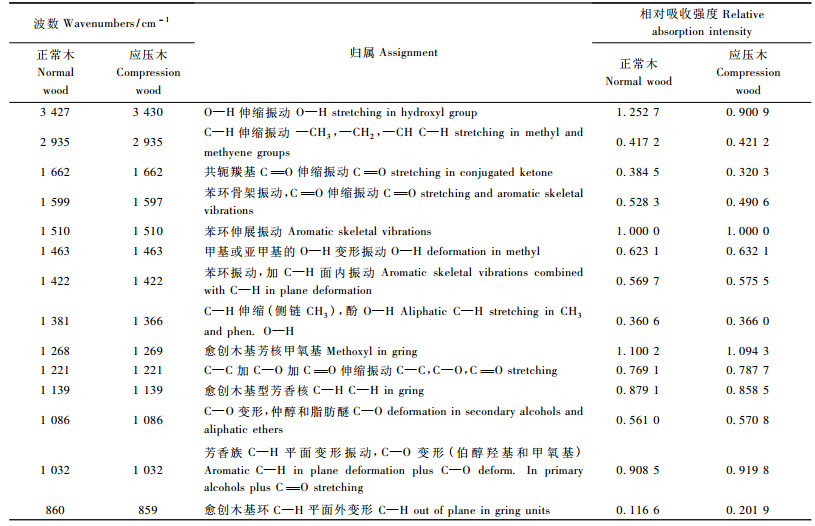
采用1 510 cm-1吸收峰作为内标,以内标吸收峰的吸收强度为100%,其他峰吸收与之对比,即得出该吸收峰的相对吸收强度(陈嘉翔等,1989)。由表 1和图 2可看出,马尾松正常木与应压木2种木素化学官能团的组成波数基本相同,但从相对吸收强度看,各种官能团的相对含量存在差异。2种木素在1 269和1 139 cm-1处有较大的吸收峰,均为愈创木基的特征吸收,说明马尾松正常木与应压木木素都是以愈创木基为主,应压木木素中愈创木基含量比正常木低;在3 430 cm-1处都有强而宽的谱带,表示都含有较多的酚羟基和醇羟基,但应压木木素中总的羟基含量比正常木少;此外,应压木木素中共轭羰基(1 662 cm-1)官能团比正常木要低。
|
|
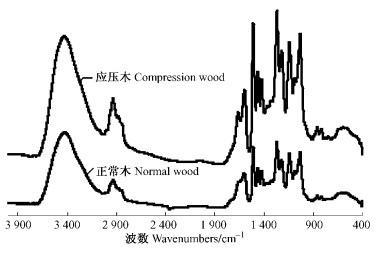
|
图 2 马尾松正常木与应压木木素红外光谱 Figure 2 FTIR spectrogram of lignin samples in normal and compression wood of Masson Pine |
氢谱是研究木素结构常用的核磁共振研究法,由于1H的天然丰度很高(接近100%),灵敏度非常大,因而易于观测到满意的信号;同时,13C和17O虽有自旋,但由于天然含量低,一般情况下不会影响氢的共振谱。为了增加木素中羟基分析的准确性,对木素进行乙酰化处理,使只有1个质子的羟基转变成为具有3个质子的乙酰基,以增强1H-NMR信号的强度。在一个共振谱图中,各种氢的峰,其面积与氢的数目成正比,因而可以利用这一点来计算出各种类型质子的相对含量。
由图 3和表 2可看出,马尾松正常木与应压木木素都是以愈创木基型为主,含有少量的对羟基苯基;脂肪族羟基含量较多。与正常木相比,马尾松应压木木素含有较高的对羟基苯基单元和酚羟基,较少的愈创木基、脂肪族羟基和甲氧基,较少的β-O-4醚键、β-5键、β-β键和β-1键,应压木木素中碳水化合物质子较多,可能因为存在较多的木素-碳水化合物复合体。
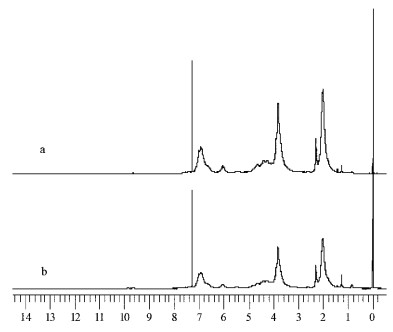
|
图 3 马尾松正常木与应压木木素的1H-NMR波谱 Figure 3 1H-NMR spectrogram of lignin samples in normal and compression wood of Masson Pine a.正常木Normal wood;b.应压木Compression wood. |
|
|
由于31P-NMR谱图中对应于木素不同羟基结构的信号峰之间分离良好,化学位移处于明显不同的区域,因而可以清晰地分辨木素中的脂肪族羟基、酚羟基和羧基等功能基团。对这些羟基信号区域进行积分,就可以得到积分值,然后根据内标量,计算出木素中各官能团的含量。
羟基含量的计算公式如下:
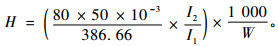
|
式中:H为羟基含量,mmol·g-1;80为内标胆固醇含量,mg·mL-1;50为内标胆固醇用量,μL;386.66为内标胆固醇摩尔质量;I1为胆固醇中羟基的积分面积,此处I1=1;I2为木素结构中羟基的积分面积;W为木素样品质量,mg。
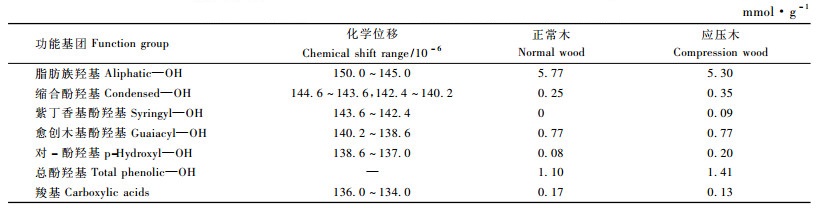
由图 4和表 3可知,马尾松正常木与应压木木素中都含有大量的脂肪族羟基,分别占总羟基数的84.0%和79.0%,酚羟基分别占16.0%和21.0%,应压木酚羟基比正常木多5.0%,这一结果与1H-NMR得出的规律是一致的。另外,在31P-NMR中,发现应压木有少量的紫丁香基酚羟基,这一现象在1H-NMR中不易发现,可能因为一是紫丁香基含量较少,二是紫丁香基在1H-NMR中容易被相邻的愈创木基峰所屏蔽。
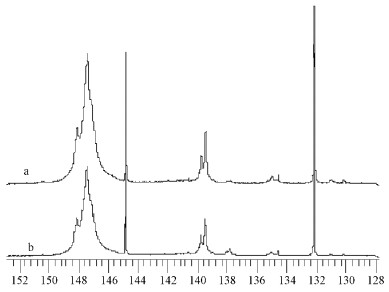
|
图 4 马尾松正常木与应压木木素的31P-NMR波谱 Figure 4 31P-NMR spectrogram of lignin samples in normal and compression wood of Masson Pine a.正常木Normal wood;b.应压木Compression wood. |
|
|
从表 3还可看出,与正常木木素相比,应压木木素中含有较多的缩合酚羟基和对羟基酚羟基,较少的羧基。在31P-NMR中,愈创木基酚羟基、紫丁香基酚羟基和对羟基酚羟基所显示的含量并不真正代表木素中结构单元类型,因为它们代表的只是游离酚羟基,只占木素的一小部分,大部分酚羟基是与其它木素结构单元连接,成醚化了的形式存在。
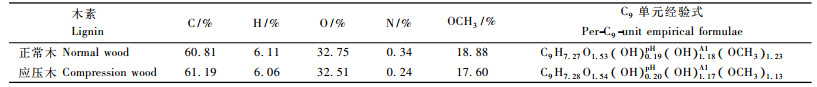
2.5 木素的经验式和分子质量表 4中列出了马尾松正常木和应压木2种纤维素酶木素的有机元素组成、甲氧基含量及C9结构经验式,其中甲氧基含量是根据1H-NMR中质子含量计算的(魏华丽等,2007;李友明等,1999),如正常木木素由表 2中得出甲氧基数目为0.61,这样,C5.07H6.11O2.05就可以换算为C9结构经验式为C9H8.64O2.90(OCH3)1.23。同理,可计算出脂肪族羟基和酚羟基的数目,并单独列出,结果为C9H7.27O1.53(OH)0.19pH(OH)1.18A1(OCH3)1.23。
|
|
由表 4可知,马尾松应压木木素中碳元素含量比正常木高0.38%,而氢元素和氧元素含量分别比正常木低0.05%和0.24%,甲氧基含量比正常木低1.28%,这是因为应压木木素中含有较多的对羟基苯基单元。由此可见,马尾松应压木木素的化学结构与正常木不同。
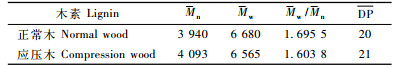
由表 5可知,马尾松应压木木素数均分子质量大于正常木,而质均分子质量和多分散性却小于正常木。应压木木素的平均聚合度比正常木大,这就意味着当应压木用于化学制浆时,其木素较难脱除。
|
|
红外光谱研究表明,马尾松正常木与应压木木素都是以愈创木基为主的,应压木木素中愈创木基含量比正常木低;都含有较多的羟基,应压木木素中总的羟基和共轭羰基官能团比正常木要低。
1H-NMR研究表明,马尾松正常木与应压木木素都是以愈创木基型为主,含有少量的对羟基苯基;脂肪族羟基含量较多。与正常木相比,应压木木素含有较高的对羟基苯基单元和酚羟基,较少的愈创木基、脂肪族羟基和甲氧基,较少的β-O-4醚键、β-5键、β-β键和β-1键。
31P-NMR研究表明,马尾松正常木与应压木木素中都含有大量的脂肪族羟基,与正常木相比,应压木木素中总酚羟基较多,缩合酚羟基和对羟基酚羟基较多,羧基较少,含有少量的紫丁香基酚羟基。
马尾松正常木与应压木的纤维素酶酶解木素具有不同的化学结构。正常木木素的C9经验式为C9H7.27O1.53(OH)0.19pH(OH)1.18A1(OCH3)1.23,应压木木素的C9经验式为C9H7.28O1.54(OH)0.20pH(OH)1.17A1(OCH3)1.13。
陈嘉翔, 余家鸾. 1989. 植物纤维化学结构的研究方法[M]. 广州: 华南理工大学出版社.
|
付时雨, 詹怀宇, 余惠生. 1999. 31P-核磁共振光谱在木素结构分析中的应用[J]. 中国造纸学报, 14(增刊): 121-125. |
李友明, 陈中豪. 1999. 木素苯基丙烷结构单元经典式的表达与计算[J]. 中国造纸学报, 14(1): 98-100. |
秦特夫, 黄洛华, 周勤. 2004. 杉木幼龄材与成熟材木质素的化学官能团和化学键特征研究[J]. 林业科学, 40(2): 137-141. DOI:10.11707/j.1001-7488.20040224 |
秦特夫. 1999. 杉木和"三北一号"杨磨木木质素化学官能团特征的研究[J]. 林业科学, 35(3): 69-75. |
秦特夫. 2001. "Ⅰ-214杨"心材、边材木质素的红外光谱、质子和碳-13核磁共振波谱特征研究[J]. 林业科学研究, 14(4): 375-382. |
魏华丽, 于文吉, 钟磊. 2007. 葵花杆木素的结构特征[J]. 中国造纸学报, 22(4): 11-13. |
杨淑惠. 2001. 植物纤维化学[M]. 3版. 北京: 中国轻工业出版社.
|
《制浆造纸手册》编写组. 1987. 制浆造纸手册.第一分册.纤维原料和化工原料[M]. 北京: 轻工业出版社.
|
Argyropoulos D S. 1994. Quantitative 31P-NMR analysis of six soluble lignins[J]. Wood Chemistry and Technology, 14(1): 63-82. |
Argyropoulous D S, Bolker H I, Heitner C, et al. 1993a. 31P-NMR spectroscopy in wood chemistry.Part Ⅴ. Qualitative analysis of lignin functional groups[J]. Journal of Wood Chemistry and Technology, 13(2): 187-212. DOI:10.1080/02773819308020514 |
Argyropoulous D S. 1993b. 31P-NMR spectroscopy in wood chemistry.A review of recent progress[J]. International Symposium on Wood and Pulping Chemistry Proceedings, Beijing, China, 2: 776-786. |
Boonstra M G, Pizzi A, Tekely P, et al. 1996. Chemical modification of Norway Spurce and Scots Pine[J]. Holzforschung, 50: 215-220. DOI:10.1515/hfsg.1996.50.3.215 |
Hans O. 2003. Lignin structures in normal and compression wood.Evaluation by thioacidolysis using ethanehiol and methanethiol[J]. Holzforschung, 57: 377-384. |
Holtman K M, Chang Houmin, Kadla J F. 2007. An NMR comparison of the whole lignin from milled wood, MWL, and REL dissolved by the DMSO/NMI procedure[J]. Journal of Wood Chemistry and Technology, 27(3 & 4): 179-200. |
Jahan M S, Mun S P. 2007. Characteristics of dioxane lignins isolated at different ages of Nalita Wood (Trema orientalis)[J]. Journal of Wood Chemistry and Technology, 27(2): 83-98. DOI:10.1080/02773810701486865 |
Lundquist K. 1979. NMR studies of lignins. 2. Interpretation of the 1H-NMR spectrum of acetylated birch lignin[J]. Acta Chemica Scandinavica, B33(1): 27-30. |
Xu Feng, Jiang Jianxing, Sun Runcang, et al. 2008. Fractional isolation and structural characterization of mild ball-milled lignin in high yield and purity from Eucommia ulmoides Oliv[J]. Wood Science and Technology, 42(3): 211-226. DOI:10.1007/s00226-007-0162-5 |
 2010, Vol. 46
2010, Vol. 46