文章信息
- 王达, 袁芳芳, 黄大庄, 刘春延, 毕华明
- Wang Da, Yuan Fangfang, Huang Dazhuang, Liu Chunyan, Bi Huaming
- 绿僵菌侵染光肩星天牛幼虫过程的透射电镜观察
- Infection Process of Metarhizium anisopliae in Anoplophora glabripennis Larvae Observed with Transmission Electron Microscopy
- 林业科学, 2010, 46(5): 113-115.
- Scientia Silvae Sinicae, 2010, 46(5): 113-115.
- DOI: 10.11707/j.1001-7488.20100518
-
文章历史
- 收稿日期:2008-09-26
-
作者相关文章
2. 河北农业大学林学院 保定 071000;
3. 廊坊市林业局 廊坊 065000;
4. 塞罕坝机械林场 围场县 068400
2. Forestry College, Hebei Agricultural University Baoding 071000;
3. Langfang Forestry Administration Langfang 065000;
4. Saihanba Machinery Tree Farm Weichang 068400
光肩星天牛(Anoplophora glabripennis)是国内外危险性林木蛀干害虫,现已猖獗危害我国27个省市自治区的多种阔叶树(王志刚,2004),严重降低木材的利用价值,给我国林业经济造成巨大损失。随着环保意识的增强,加之诸多与化学药剂相关的环境问题日益突出,寻求和完善对其生物防治或以生物防治为主的综合治理已成为当前光肩星天牛防治研究的热点之一。
绿僵菌(Metarhizium anisopliae)是虫生真菌的主要类群之一,目前已广泛用于防治甘蔗(Sacch-arum officinarum)、牧草、林木及卫生害虫(王音等,2006)。国内外曾有一些应用绿僵菌防治天牛的研究(樊美珍等,1987;童森林等,1991;徐金柱,2002;王四宝等,2004;夏成润等,2005;何学友等,2005;2007;Shimazu et al., 2002;Dubois et al., 2004a;2004b;2008;Hajek et al., 2006;2007;Shanley et al., 2008),但未见有关绿僵菌对光肩星天牛幼虫的入侵及致病过程的报道。为了探明绿僵菌对光肩星天牛幼虫的侵染过程,本试验应用透射电镜观察并研究了该过程中二者的超微结构变化,从而为揭示其致病机制提供依据。
1 材料与方法 1.1 供试昆虫光肩星天牛幼虫:在保定市采集光肩星天牛成虫,按3:1雌雄比,人工接虫到5年生垂柳(Salix babylonica)上,整树套笼进行室外饲养,产卵后见蛀屑和虫粪排出确认幼虫成活,45天后剖取幼虫用于透射电镜制样。
1.2 供试菌株及孢子悬浮液制备绿僵菌MS01为室内生测对光肩星天牛幼虫具有较高毒力的菌株。待蛋白胨-马铃薯葡萄糖琼脂培养基中培养的绿僵菌完全产孢后,刮下分生孢子,用含0.1%吐温-80无菌水润湿,磁力搅拌器搅拌均匀,经血球计数板计数后,配成1×108 ·mL-1的孢子悬浮液。
1.3 接种及取样方法将50天龄的光肩星天牛幼虫浸入孢子悬浮液中30 s后,接入柳树的人工刻槽中饲养。采用插枝水培法,枝条上端覆湿纱布,下端插在水里,放入26 ℃、相对湿度90%的人工气候箱中培养。分别于16,24,48,60,72 h虫体僵硬、虫体有菌丝穿出时依次取样,以未染菌的幼虫作对照,作为透射电镜样品。
1.4 透射电镜样品制备及观察样品用4%戊二醛前固定过夜,之后解剖虫体取出中肠,再将原样品及中肠用1%锇酸后固定1 h。磷酸缓冲液冲洗0.5 h。经脱水、渗透、包埋、聚合、修块后,莱卡UTC型透射电镜超薄切片机切片,采用醋酸双氧轴和柠檬酸铅双染法染色,日立H-T500透射电子显微镜下观察并拍照光肩星天牛幼虫感染绿僵菌不同时间后各组织的病理变化。
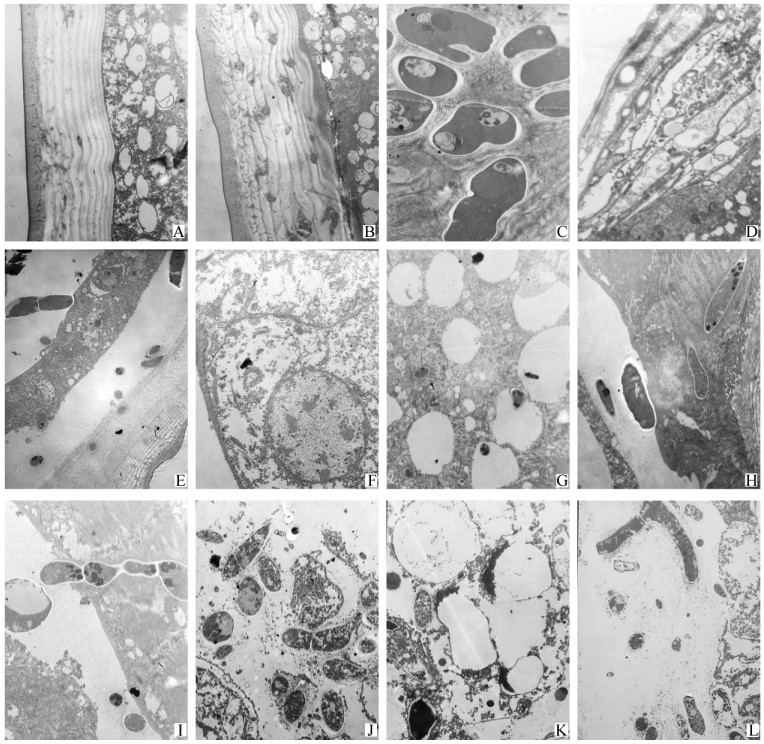
2 结果与分析 2.1 感染绿僵菌后寄主体壁的超微结构变化接种后16 h,观察到少量菌丝段侵入到表皮层中(图版Ⅰ-A)。接种后24 h,穿透菌丝已形成大小、形状各异的菌丝段和菌丝(图版Ⅰ-B);此时还可观察到穿透菌丝周围出现电子密度很低的光晕,表皮层内原来规则而连续的片层结构在侵入丝的周围变形和消失(图版Ⅰ-C),这表明芽管在穿透过程中的机械压力和酶活性(Hassan et al., 1989)。侵染48 h时,表皮层逐渐崩解(图版Ⅰ-D);大量菌丝段穿透皮细胞层,表皮层与皮细胞层分离(图版Ⅰ-E)。相对于健康体壁细胞(图版Ⅰ-F),侵染至60 h时细胞器因菌丝穿透遭到破坏;细胞排列松弛,部分变成空泡(图版Ⅰ-G)。72 h时侵入脂肪体内的菌丝大量吸收营养,破坏脂肪细胞结构(图版Ⅰ-H);同时肌纤维因菌丝穿透被破坏(图版Ⅱ-I)。菌丝主要以出芽和缢离2种方式进行大量增殖,同时随血淋巴循环侵入各器官组织,与寄主争夺营养,破坏寄主组织与器官,致使寄主死亡,直至整个体腔充满菌丝和菌丝段,随后菌丝穿出虫体向体外生长(图版Ⅱ-J—L)。
|
图版Ⅰ Plate Ⅰ A.接种后16 h,少量菌丝侵入到寄主表皮层中; B.接种后24 h,菌丝普遍侵入到寄主表皮层中; C.表皮层内规则而连续的片层结构在菌丝段的周围变形和消失; D~E:接种后48 h; D.表皮层逐渐崩解; E.大量菌丝段穿透皮细胞层,表皮层与皮细胞层分离; F.健康的皮细胞层; G.接种后60 h,细胞器因菌丝穿透遭到破坏; 细胞排列松弛,部分变成空泡; H.接种后72 h,侵入脂肪体内的菌丝; I~J:接种后72 h; I.肌纤维因菌丝穿透被破坏; J.体腔充满大量增殖的菌丝段,菌丝段无隔或有1个隔; K.细胞器严重破坏,细胞普遍空泡化(僵虫); L.表皮层内缢离的菌丝正向体外生长。 A. A few hyphae invaded the host cuticle, 16 h post-inoculation; B. Vast hyphae penetration into the host cuticle, 24 h post-inoculation; C. Deformation and disappearance of regular and consecutive lamellae around the hyphal bodies in cuticle; D-E: 48 h post-inoculation; D. Gradual disintegration of the cuticle; E. Penetration of vast hyphal bodies through epidermis, separation of the cuticle and the epidermis; F. Healthy epidermis; G. Organelles destroyed by hyphae penetration, cells loosely arranged and some became vacuole, 60 h post-inoculation; H. Invasion of hyphae into fat body, 72 h post-inoculation; I-J: 72 h postinoculation; I. Muscle fibers destroyed by hyphae penetration; J. Body cavity filled with hyphal bodies proliferated in large amount, no or one septal in a hyphal body; K. Organelles seriously destroyed and cells widely vacuolated (muscardine cadaver); L. Hyphae in cuticle growing outward through abstriction. |
|
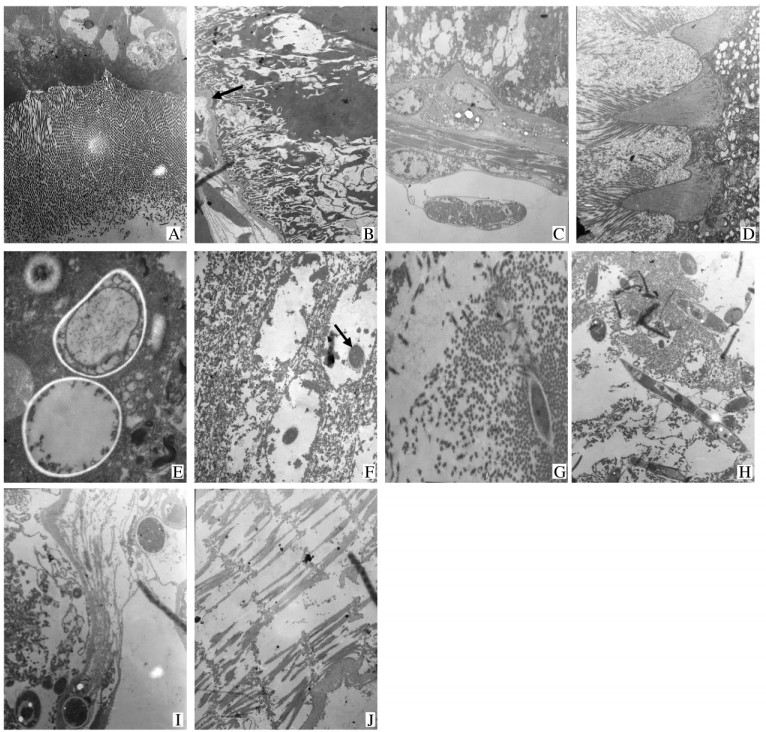
图版Ⅱ Plate Ⅱ A.健康的中肠壁细胞; B.接种后48 h,中肠壁细胞及围食膜(箭头处); C~D:接种后60 h。C.菌丝段接近肠壁细胞; D.中肠微绒毛部分脱落,呈现稀疏; E~G:接种后72 h。E.中肠壁细胞内充满菌丝段; F.空泡化的中肠壁细胞内的菌丝段(箭头处); G.菌丝段正在侵染中肠微绒毛; H.肠壁细胞内充满菌丝和菌丝段(僵虫); I~J:虫体有菌丝穿出时。I.大量菌丝段致使中肠组织结构破裂、离散; J.中肠组织解体。 A. Healthy midgut epithelium; B. Midgut epithelium and peritrophic membrane (arrow), 48 h post-inoculation; C-D:60 h post-inoculation; C. A hyphal body approaching midgut epithelium; D. The midgut microvilli partially exfoliated and became sparse; E-G:72 h post-inoculation; E. Midgut epithelium filled with hyphal bodies; F. Hyphal bodies in the vacuolated midgut epithelium(arrow); G. Hyphal bodies invading midgut microvilli; H. Midgut epithelium filled with hyphae and hyphal bodies (muscardine cadaver); I-J:Hyphae penetrating larvae body; I. Large amount of hyphal bodies resulted in midgut tissue rupture and discrete; J. Midgut tissue disintegrated. |
超薄切片观察表明:健康幼虫中肠壁细胞排列规整,柱状细胞顶膜特化成的微绒毛排列整齐(图版Ⅱ-A)。接种后48 h,微绒毛排列有些紊乱,但仍可见到围食膜(图版Ⅱ-B)。接种后60 h,可观察到菌丝段接近肠壁细胞(图版Ⅱ-C),中肠微绒毛部分脱落,呈现稀疏(图版Ⅱ-D)。接种后72 h,肠壁细胞内充满带有光晕的菌丝段(图版Ⅱ-E),肠壁柱状细胞形成空泡(图版Ⅱ-F),同时还可观察到菌丝段正在分解中肠微绒毛,使其稀疏;围食膜也被分解消失(图版Ⅱ-G)。就这样肠壁组织被大量增殖的菌丝和菌丝段不断破坏,最后全部被它们消解,中肠组织崩溃、解体(图版Ⅱ-H—J)。
3 结论与讨论一般认为,多数真菌在入侵时产生相应的酶来降解构成昆虫表皮的蛋白质、几丁质等主要成分,被降解的位点是真菌侵染的突破口。一些研究结果曾相继报道过绿僵菌菌丝在穿透过程中所表现的机械压力和酶活性(Hassan et al., 1989;王音等,2006)。本试验在透射电镜超薄切片中观察到寄主表皮层内规则而连续的片层结构在穿透菌丝的周围变形和消失,同时观察到穿透菌丝内含大量参与代谢功能的细胞器。这一切都意味着菌丝正在旺盛地合成和分泌水解酶,进一步证实了绿僵菌依靠机械压力和酶降解共同作用的方式穿透寄主表皮。
有关真菌从昆虫消化道侵入血腔的报道很少(蒲蛰龙等,1996)。王音等(2004)首次报道了体壁是绿僵菌侵染小菜蛾(Plutella xylostella)的主要途径,消化道是绿僵菌入侵的次要途径。本研究通过透射电镜观察到光肩星天牛幼虫肠道被绿僵菌侵染的48~72 h期间,随着菌丝和菌丝段在肠壁细胞中迅速大量增殖,肠壁组织逐渐被破坏,中肠微绒毛脱落,肠壁细胞形成空泡,围食膜被分解消失,最终中肠组织崩溃、解体。因此,首次发现了光肩星天牛幼虫消化道也是绿僵菌入侵的途径之一。这一侵染方式的存在,对今后在野外更有效地应用绿僵菌这一生物制剂防治光肩星天牛幼虫具有指导意义。
目前,有学者认为,绿僵菌毒素会干扰寄主细胞的免疫系统,亦影响中枢神经系统,使神经传导受到障碍,失去正常的反射作用(蒲蛰龙,1992)。在本试验中,绿僵菌在侵染光肩星天牛幼虫过程中会分泌哪些毒素,这些次生代谢产物作用于哪些目标器官以及如何起作用等问题还有待进一步研究。
樊美珍, 郭超, 燕新华. 1987. 从青杨天牛分离的几种致病真菌[J]. 真菌学报, 6(2): 97-102. |
何学友, 陈顺立, 黄金水. 2005. 感染松墨天牛的金龟子绿僵菌菌株的初步筛选[J]. 昆虫学报, 48(6): 975-981. |
何学友, 陈顺立, 杨希, 等. 2007. 金龟子绿僵菌在森林土壤中的分布及对松墨天牛致病性测定[J]. 菌物学报, 26(2): 289-294. |
蒲蛰龙. 1992. 昆虫病理学[M]. 广州: 广东科学技术出版社.
|
蒲蛰龙, 李增智. 1996. 昆虫真菌学[M]. 合肥: 安徽科学技术出版社.
|
童森林, 宫建, 苟英杰. 1991. 应用绿僵菌防治青杨天牛试验研究//中国菌物学会虫生真菌专业委员会. 中国虫生真菌研究与应用Ⅲ. 北京: 中国农业出版社, 155-157.
|
王四宝, 黄勇平, 张心团, 等. 2004. 松褐天牛成虫高毒力病原菌筛选及林间感染试验[J]. 中国森林病虫, 23(6): 13-16. |
王音, 雷仲仁, 张青文, 等. 2004. 小菜蛾感染绿僵菌后的病征及组织病理变化[J]. 中国生物防治, 20(3): 156-160. |
王志刚, 2004. 中国光肩星天牛发生动态及治理对策研究. 哈尔滨: 东北林业大学林学院博士学位论文. http://cdmd.cnki.com.cn/article/cdmd-10225-2004106790.htm
|
王音, 雷仲仁, 张青文, 等. 2006. 绿僵菌侵染小菜蛾幼虫过程的透射电镜观察[J]. 昆虫学报, 49(6): 1042-1045. |
徐金柱. 2002. 应用虫生真菌防治天牛的研究. 合肥: 安徽农业大学林学与园林学院硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10364-2002123881.htm
|
夏成润, 丁德贵, 刘云鹏, 等. 2005. 金龟子绿僵菌无纺布菌剂与引诱剂结合使用防治短角幽天牛的试验[J]. 安徽农业大学学报, 32(4): 419-422. |
Hajek A E, Dubois T A, Lund J, et al. 2007. Developing fungal bands for control of Asian longhorned beetle, Anoplophora glabripennis, in the U. S. Journal of Anhui Agricultural University(安徽农业大学学报), 34(2): 149-156.
|
Dubois T A, Hajek A E, Hu J F, et al. 2004a. Evaluating the efficiency of entomopathogenic fungi against the Asian longhorned beetle, Anoplophora glabripennis, by using cages in the field[J]. Environmental Entomology, 33(1): 62-74. DOI:10.1603/0046-225X-33.1.62 |
Dubois T A, Li Z Z, Hu J F, et al. 2004b. Efficacy of fiber bands impregnated with Beauveria brongniartii cultures against the Asian longhorn beetle, Anoplophora glabripennis[J]. Biological Control, 31: 320-328. DOI:10.1016/j.biocontrol.2004.03.011 |
Hajek A E, Huang B, Dubois T A, et al. 2006. Field Studies of Control of Anoplophora glabripennis (Coleoptera: Cerambycidae) using fiber bands containing the entomopathogenic fungi Metarhizium anisopliae and Beauveria brongniartii[J]. Biocontrol Science and Technology, 16(4): 329-343. DOI:10.1080/09583150500335962 |
Hassan A E M, Charnley A K. 1989. Ultrastructural study of the penetration by Metarhizuim anisopliae through dimilin-affected cuticle of Manduca sexta[J]. Journal of Invertebrate Pathology, 54: 117-124. DOI:10.1016/0022-2011(89)90148-1 |
Shanley R P, Hajek A E. 2008. Environmental contamination with Metarhizium anisopliae from fungal bands for control of the Asian longhorned beetle, Anoplophora glabripennis (Coleoptera: Ceramby-cidae)[J]. Biocontrol Science and Technology, 18(2): 109-120. DOI:10.1080/09583150701774860 |
Shimazu M, Zhang B, Liu Y N. 2002. Fungal pathogens of Anoplophora glabripennis (Coleoptera: Cerambycidae) and their virulences[J]. Bulletin of the Forestry and Forest Products Research Institute, 1(1): 123-130. |
Dubois T A, Lund J, Bauer S L, et al. 2008. Virulence of entomopathogenic hypocrealean fungi infecting Anoplophora glabripennis[J]. Biological Control, 53(3): 517-528. |
 2010, Vol. 46
2010, Vol. 46

