文章信息
- 李琰, 冯俊涛, 王永宏, 李玉平, 张兴
- Li Yan, FengxFeng Juntao, Wang Yonghong, Li Yuping, Zhang Xing
- 培养基及培养条件对雷公藤愈伤组织生长和次生代谢产物含量的影响
- Effects of Basic Media and Culture Conditions on Callus Growth and Secondary Metabolite Content of Tripterygium wilfordii
- 林业科学, 2010, 46(5): 64-69.
- Scientia Silvae Sinicae, 2010, 46(5): 64-69.
-
文章历史
- 收稿日期:2009-04-17
-
作者相关文章
2. 西北农林科技大学生命科学学院 杨凌 712100
2. College of Life Science, Northwest A&F University Yangling 712100
雷公藤(Tripterygium wilfordii)系卫矛科(Celastraceae)雷公藤属植物,它既是一种重要的杀虫植物,又是著名的药用植物,其杀虫成分主要是雷公藤甲素和生物碱(李琰等,2008; 周琳等,2006; Swingle et al., 1941)。雷公藤甲素又称雷公藤内酯醇,是中药雷公藤的主要有效成分之一,作为免疫抑制药物,可应用于许多自身免疫性疾病的治疗(夏焱等,2005)。雷公藤生物碱具有明显的体液和细胞免疫抑制作用,也是治疗类风湿性关节炎的有效成分,其含量对评价生药质量具有一定的意义。在农业害虫防治中,雷公藤内酯醇有较好的触杀活性(罗都强等,2001),雷公藤总生物碱有较好的拒食活性(周琳等,2006)。这些有效成分人工合成困难,价格昂贵,市场需求量大,而且资源日益遭到破坏,因此,通过细胞培养技术生产雷公藤药用次生代谢物质,具有特殊的理论和现实意义(于树宏等,1998)。
利用雷公藤组织培养生产次生代谢产物的研究并不多见(李耀维等,2000; 尹作鸿等,1992; Pépin et al., 2004; Nakano et al., 1998)。本研究通过对基本培养基的筛选和对培养条件的优化试验,旨在筛选雷公藤愈伤组织生长和次生代谢产物含量较高的培养基及培养条件,为进一步进行组织培养生产雷公藤内酯醇和雷公藤总生物碱奠定基础。
1 材料与方法 1.1 试验材料试验用雷公藤植物采自福建省泰宁地区,取其1年生枝条,扦插于苗床上,新长出的幼茎高度达5 cm时取叶、幼茎及1个月后长出的新根作为外植体进行愈伤组织诱导,形成愈伤组织在6,7-V+1.0 mg·L-12,4-D+0.5 mg·L-1KT培养基上连续培养5代以上,形成的各种愈伤组织作为供试材料。除不同愈伤组织种类对雷公藤愈伤组织生长和雷公藤内酯醇及雷公藤总生物碱含量的影响试验中用幼茎及叶愈伤组织外,其余愈伤组织均为根诱导形成的愈伤组织。
1.2 仪器与药剂日本岛津LC-6ATVP高效液相色谱仪,紫外检测器。UV120-02型紫外/可见分光光度计(日本岛津)。雷公藤内酯醇标准品(批号1566-200201,纯度95%)由中国药品生物制品鉴定所提供。雷公藤总生物碱,由西北农林科技大学无公害农药研究服务中心提供,为本课题组从雷公藤根皮中提取得到,经光谱鉴定结构HPLC面积归一法测定纯度大于95%。甲醇(天津市科密欧化学试剂有限公司,色谱纯),水为超纯水,2,4-二氯苯氧乙酸(2,4-D)(上海试剂四厂,化学纯),6-糠胺基嘌呤(KT)(In Vitro Diagnosticum Sanland International Inc.,化学纯), 蔗糖(广东西陇化学试剂有限公司,分析纯),乙酸乙酯(西安化学试剂厂,分析纯),其他试剂均为分析纯。
1.3 培养基及培养条件筛选采用MS,B5,NT,H,1/2MS,6,7-V(Veliky et al., 1970)及White培养基,分别添加1.0 mg·L-12,4-D和0.5 mg·L-1KT。检测不同pH值、光照条件、接种量、不同外植体以及培养时间对愈伤组织生长和雷公藤内酯醇及总生物碱含量的影响,试验采用NT培养基加入1.0 mg·L-12,4-D和0.5 mg·L-1KT。
以上培养基,加入蔗糖30 g·L-1,用琼脂6 g·L-1固化,pH用PHS-2C型酸度计高压灭菌前调至5.8(培养基pH值对愈伤组织生长及雷公藤内酯醇和总生物碱含量的影响除外)。试验每个处理接种30瓶,每瓶接种大小基本相近的愈伤组织3块,总鲜质量控制在0.3~0.4 g(不同接种量对雷公藤愈伤组织生长的影响除外)。培养室温度(25±1)℃,不同光照条件试验的光照强度为1 000~1 500 lx,其余为自然光照。培养50天后收获(不同培养时间对愈伤组织生长和雷公藤内酯醇及总生物碱含量的影响试验每5天收获1次),冷冻干燥至恒质量,粉碎过60目筛并计算愈伤组织增长量(愈伤组织增长量=收获量/瓶-接种量/瓶)。
愈伤组织褐化级别:1级:轻度褐化,愈伤组织底部及培养基呈淡黄色; 2级:褐化,愈伤组织底部及周围培养基呈黄褐色; 3级:较严重褐化,愈伤组织底部及周围培养基呈褐色; 4级:严重褐化,愈伤组织底部及周围培养基呈黑褐色。
1.4 次生代谢产物含量的测定 1.4.1 样品的制备精密称取雷公藤愈伤组织样品1 g,置磨口三角瓶中,加入乙酸乙酯20 mL浸泡过夜,超声提取40 min,过中性氧化铝柱(含3 g中性氧化铝,玻璃柱d=1.0 cm),然后用20 mL乙酸乙酯冲洗柱子,合并洗脱液,减压回收乙酸乙酯至干,用流动相溶解并定容至5 mL容量瓶中。
1.4.2 雷公藤内酯醇的测定采用高效液相色谱(HPLC)法(李琰等,2009),色谱条件为:色谱柱C18,4.6 mm×250 mm,5 μm; 流动相:甲醇:水体积分数为45:55;流速:1 mL·min-1; 检测波长:218 nm; 以雷公藤内酯醇为标准品,其回归方程为A=46 866C-10 771,R2=0.999 9。
1.4.3 雷公藤总生物碱的测定紫外分光光度法测定总生物碱的含量,将提取液用45%甲醇稀释10~30倍,用紫外/可见分光光度计在268 nm波长下进行比色测定吸光度(李琰等,2009); 以总生物碱为标准品,其回归方程为A=0.008 7C-0.008 1,R2=0.999 8。
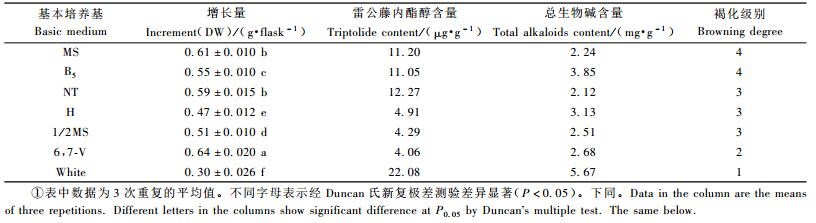
2 结果与分析 2.1 基本培养基对雷公藤愈伤组织生长和次生代谢产物含量的影响组织培养的培养基一般可以分为含盐量高的(MS)、高硝酸钾的(B5)、中等无机盐的(NT,H,1/2MS,6,7-V)和低盐的(White)4种类型,不同类型的培养基对雷公藤愈伤组织增长量和次生代谢产物含量的影响有明显差异(表 1)。愈伤组织的增长量在6,7-V培养基上高于其他类型培养基,且在这种培养基上的愈伤组织生长旺盛、质地疏松、富有光泽,褐化程度也比其他培养基轻,但在这种培养基上雷公藤内酯醇及总生物碱含量较低,其中雷公藤内酯醇含量为NT的1/3,适合愈伤组织继代保存。NT培养基上雷公藤内酯醇含量较高,但愈伤组织增长量不及6,7-V培养基,褐化程度也较6,7-V培养基严重。MS和B5培养基上生长的愈伤组织致密、褐化严重,不适宜进一步继代培养。低盐的White培养基上愈伤组织生长最差,生长量仅为6,7-V的1/2,但雷公藤内酯醇及总生物碱含量最高,褐化也较6,7-V轻。权衡愈伤组织生长、雷公藤内酯醇及总生物碱产量,使用NT培养基较为合适。
|
|
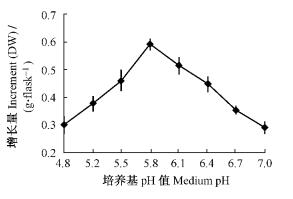
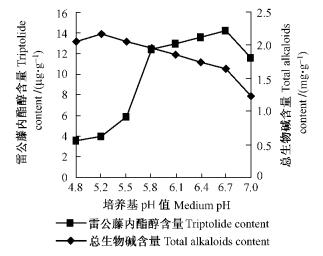
培养基pH值通过影响细胞对离子的吸收,进而影响细胞的生长和次生代谢产物的合成(Marschner,1995)。本试验中7种pH值的培养基对雷公藤愈伤组织增长量、雷公藤内酯醇含量及总生物碱含量影响差异较大(图 1,2)。当pH值为5.8时,雷公藤愈伤组织增长量达最大值,然后随pH值升高而下降。雷公藤内酯醇的合成适合偏碱性的环境条件,含量在pH6.7时较高; 而总生物碱的合成适合偏酸性的环境条件,含量随pH值升高而下降,在pH5.2时最高; 此时愈伤组织增长量仅为pH5.8时的64%。
|
图 1 pH值对雷公藤愈伤组织生长的影响 Figure 1 Effects of different pH on callus growth of T. wilfordii |
|
图 2 pH值对愈伤组织中雷公藤内酯醇及总生物碱含量的影响 Figure 2 Effects of different pH on triptolide and total alkaloids content of T. wilfordii callus |
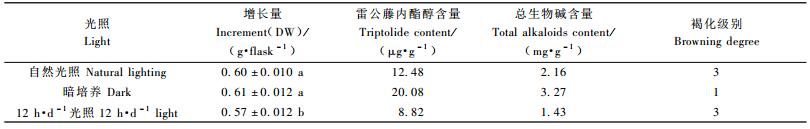
试验中设计了4种光照处理条件(表 2),暗培养的愈伤组织增长量、雷公藤内酯醇及总生物碱含量均最高,褐化程度较轻,但培养的愈伤组织呈乳白色、无光泽,不适合进一步继代培养。自然光照与12 h·d-1光照培养的愈伤组织质地疏松,颗粒状,适合进一步继代培养,但自然光培养的愈伤组织雷公藤内酯醇及总生物碱含量均较12 h·d-1光照高。在连续光照条件下,愈伤组织逐渐失去光泽,生长速度缓慢,致密,褐化程度严重,该条件也不利于雷公藤内酯醇和总生物碱的形成。雷公藤内酯醇、总生物碱等有效成分主要集中在根皮中,可见,有效成分积累已完全适应了黑暗的环境条件。
|
|
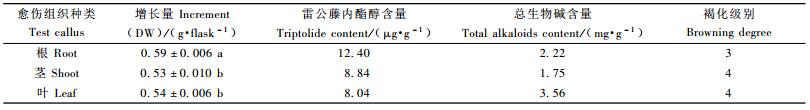
以雷公藤根、幼茎及叶为外植体诱导的愈伤组织,在同样培养基上连续继代培养多代以后,根愈伤组织逐渐变得疏松、颗粒状,而茎、叶愈伤组织致密、呈块状,褐化严重。产生这种情况的原因可能是不同生长部位、不同生理状态的外植体材料酚类物质的含量及PPO的活性上有所差异(付影等,2007)。根愈伤组织增长量、雷公藤内酯醇含量也明显高于茎、叶愈伤组织(表 3),而叶愈伤组织中总生物碱的含量明显高于根、茎愈伤组织中的含量。而在雷公藤植株中雷公藤内酯醇及总生物碱主要存在于根部,根皮中雷公藤内酯醇及总生物碱的含量显著高于其他部位(杨春欣等,2001; 戴克敏等,1994)。一般次生代谢产物含量高的植物或器官诱导出的愈伤组织次生物质的含量也高(李琰等,2004; 李春斌等,2003; Knobloch,1982),而在雷公藤中并不完全一致,可见次生代谢产物形成的复杂性。
|
|
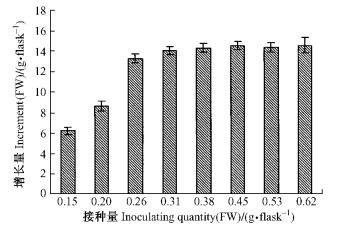
由图 3可知,接种量在0.15~0.38 g之间,雷公藤愈伤组织的增长量随接种量的增加而增加,当接种量超过0.38 g后,愈伤组织的增长量趋于平稳,因此在100 mL三角瓶中,雷公藤愈伤组织接种量控制在0.38 g时,愈伤组织增长量为最大值。愈伤组织的生长状态也与接种量有关,接种量不足时,到达对数期所经历的时间明显延长,接种量过大,营养供给不足,愈伤组织生长时间缩短,且褐化加重。
|
图 3 不同接种量对雷公藤愈伤组织生长的影响 Figure 3 Effect of different inoculating quantity on callus growth of T. wilfordii |
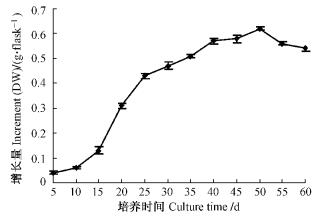
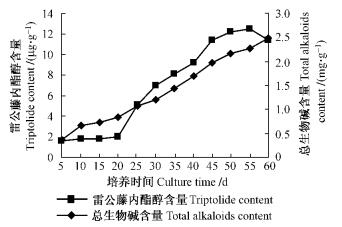
雷公藤愈伤组织的生长曲线大致呈S形(图 4,5)。生长延迟期较长,接种后第15天进入对数生长期,在15~40天期间,愈伤组织生长速度明显加快,40~50天处于生长平稳期,50天后开始逐渐下降。所以雷公藤愈伤组织最适继代时间为40~45天。雷公藤内酯醇含量在培养到第55天时达到最大值,总生物碱的含量随着培养时间的延长而持续增加,但产量在第50天时也可以达到最高,这是由于产量是由愈伤组织增长量及次生代谢产物含量共同决定的;虽然在培养到第55天时雷公藤内酯醇含量达到最大值,但其增长量已开始下降,在第50天即对数期末期,总积累量达最大,故本试验采取产量最高的阶段,即生长到第50天时收获愈伤组织。当愈伤组织增长量达到最大值时,雷公藤内酯醇和总生物碱的含量持续上升。说明了雷公藤愈伤组织细胞中雷公藤内酯醇和总生物碱的合成与细胞生长是不一致的。
|
图 4 不同培养时间对雷公藤愈伤组织生长的影响 Figure 4 Effect of culture time on callus growth of T. wilfordii |
|
图 5 不同培养时间对愈伤组织中雷公藤内酯醇 Figure 5 Effects of culture time on triptolide and total alkaloids content of T. wilfordii callus |
不同培养基的无机元素浓度差异很大,对植物细胞生长和次生代谢产物的形成必然会有较大的影响(上官新晨等,2006; 袁弟顺等,2004)。一般认为,高盐的培养基较适合愈伤组织的生长,低盐的培养基较适合次生代谢产物的积累(上官新晨等,2006)。而本试验中,高盐的MS,B5不仅对雷公藤愈伤组织生长不利,褐化也比较严重,雷公藤内酯醇的含量明显高于低盐培养基; 而低盐的6,7-V培养基较适合雷公藤愈伤组织的生长,褐化也比较低,雷公藤内酯醇的含量明显低于高盐培养基。可见,不同植物细胞生长及次生代谢所需的培养基是不同的。
付影等(2007)报道,培养基中无机盐浓度过高可引起酚类外溢物质的大量产生,导致外植体褐变,降低盐浓度则可以减少酚类外溢,从而减轻褐变。无机盐中有些离子,如Mn2+,Cu2+是参与酚类合成与氧化酶类的组成成分或辅因子,因此盐浓度过高会增加这些酶的活性,酶又进一步促进酚类合成与氧化。本试验所用的7种基本培养基中,比较其离子浓度,可以看出:NT,H等培养基的大量元素含量要低于MS,B5培养基,褐化程度也较MS,B5培养基轻,6,7-V培养基中大量元素又偏低于NT,H等中等无机盐的培养基,褐化程度也较中等无机盐轻。可见,为了抑制褐变,使用低盐培养基,可以收到较好的效果。
培养条件如光照对褐变及次生代谢也有影响。有研究结果表明,很多植物经过暗培养预处理可减轻组织培养外植体褐变(印芳等,2006; 杨博等,2003; 高蓉等,2001)。在雷公藤愈伤组织培养中,发现光照越强愈伤组织的褐变也越严重,而黑暗可以抑制褐变的发生。光照强度主要通过影响次生代谢途径的关键酶苯丙氨酸解氨酶和查尔酮合成酶等的活性及苯丙氨酸解氨酶基因的表达而影响次生代谢物的合成和积累(谢灵玲等,2000)。叶和春等(1991)发现,光照对新疆紫草(Amebia euchroma)愈伤组织紫草宁衍生物的形成有强烈抑制作用。在栽培条件下,光照强度的减弱诱导总生物碱的积累,而使植物组织中的总生物碱含量增加(Haegele et al., 1999)。本试验中,随着光照强度的增加不仅愈伤组织的生长受到了抑制,雷公藤内酯醇及总生物碱的合成也明显受到了抑制。詹亚光等(2007)在沙枣(Elaeagnus angustifolia)愈伤组织培养中发现,暗培养的沙枣愈伤组织增长比光照下大,分裂产生的细胞大、排列疏松,原儿茶酸含量也比光照培养高得多,说明暗培养更有利于原儿茶酸的积累。本试验也得出了类似的结论。
戴克敏, 王艳. 1994. 不同地区药用部位雷公藤和昆明山海棠的总生物碱含量测定[J]. 中成药, 16(11): 41-42. |
付影, 荣俊冬, 陈礼光, 等. 2007. 植物组织培养中褐变问题研究进展[J]. 亚热带农业研究, 3(3): 190-195. |
高蓉, 赵博光. 2001. 防止黑松外植体及其愈伤组织褐变的方法[J]. 南京林业大学学报:自然科学版, 25(5): 75-77. |
李春斌, 王关林, 岳玉莲, 等. 2003. 培养条件对银杏悬浮培养细胞黄酮合成影响研究[J]. 大连理工大学学报, 43(3): 287-291. |
李琰, 董娟娥, 姜在民, 等. 2004. 杜仲愈伤组织中次生代谢产物积累动态研究[J]. 西北植物学报, 24(11): 2033-2037. DOI:10.3321/j.issn:1000-4025.2004.11.009 |
李琰, 冯俊涛, 王永宏, 等. 2008. 雷公藤愈伤组织诱导及杀虫活性研究[J]. 西北农林科技大学学报:自然科学版, 36(5): 103-108. |
李琰, 冯俊涛, 史晓燕, 等. 2009. 雷公藤组培产物中雷公藤甲素和总生物碱含量的测定[J]. 农药学学报, 11(3): 367-372. |
李耀维, 冯文新, 武增寿, 等. 2000. 激光诱变选育雷公藤次生物质高产细胞系[J]. 激光生物学报, 9(4): 281-284. |
罗都强, 秦建春, 张兴. 2001. 雷公藤甲素对粘虫中肠消化酶及其组织结构的影响[J]. 西北农林科技大学学报:自然科学学版, 29(6): 57-60. |
上官新晨, 郭春兰, 杨武英, 等. 2006. 培养基及培养条件对青钱柳愈伤组织生长和黄酮含量的影响[J]. 福建农林大学学报:自然科学版, 36(6): 588-592. |
夏焱, 段宏泉, 张铁军, 等. 2005. 雷公藤属药用植物的研究进展[J]. 中草药, 36(7): 1093-1096. |
谢灵玲, 赵武玲, 沈黎明. 2000. 光照对大豆叶片苯丙氨酸裂解酶(PAL)基因表达及异黄酮合成的调节[J]. 植物学通报, 17(5): 443-449. |
杨博, 韩振海, 张永, 等. 2003. 不同光照强度对玫瑰组织培养中初代培养物褐化的影响[J]. 中国农学通报, 19(6): 194-196. |
杨春欣, 周庭川, 秦万章. 2001. 雷公藤内酯醇不同季节的含量变化[J]. 中国医院药学杂志, 21(1): 25-26. |
叶和春, 尹作鸿, 李国凤, 等. 1991. 不同理化因子对新疆紫草愈伤组织生长及紫草宁生物合成的影响[J]. 植物学报, 33(12): 927-931. |
尹作鸿, 朱蔚华. 1992. 雷公藤愈伤组织悬浮培养的研究[J]. 生物工程学报, 8(1): 95-98. |
印芳, 葛红, 彭克勤, 等. 2006. 酚类物质与蝴蝶兰褐变关系初探[J]. 园艺学报, 33(5): 1137-1140. |
于树宏, 李玲, 何晓明. 1998. 利用细胞培养技术提高次生代谢物的产量[J]. 生物学通报, 33(7): 40-42. |
袁弟顺, 林丽明, 孙威江, 等. 2004. 不同品种茶树愈伤组织的培养与茶氨酸的积累[J]. 福建农林大学学报:自然科学版, 33(2): 178-181. |
詹亚光, 宋继园, 王巍巍. 2007. 暗培养对沙枣愈伤组织中原儿茶酸含量的影响[J]. 植物生理学通讯, 43(5): 954. |
周琳, 冯俊涛, 马志卿, 等. 2006. 雷公藤总生物碱对粘虫的生物活性[J]. 植物保护学报, 33(4): 401-406. |
Haegele B F, Rowell R N M.1999.Genetic and environmental-based variability in secondary metabolite leaf content of Adenostyles alliariae and A. alpin(Asteraceae): A test of the resource availability hypothesise. Oikos, 85: 234-246.
|
Knobloch K H. 1982. Medium and light-induced formation of serpentine and anthocyanins cell suspension culture of Catharanthus[J]. Phytochen, 21(3): 591-594. DOI:10.1016/0031-9422(82)83146-4 |
Marschner H. 1995. Mineral nutrition of plant[J]. London Harcourt Braoe & Company Plublishers, 11. |
Nakano K, Yoshida C, Furukawa W, et al. 1998. Terpenoids in transformed root culture of Tripterygium wilfordii[J]. Phytochemistry, 49(6): 1821-1824. DOI:10.1016/S0031-9422(98)00300-8 |
Pépin M F, Chavarie C, Archambault J. 2004. Growth and immobilization of Tripterygium wilfordii cultured cells[J]. Biotechnol Bioeng, 38(11): 1285-1291. |
Swingle W T, Haller H L, Siegler E H, et al. 1941. Chinese insecticidal plant Tripterygium wilfordii introduced into the United State[J]. Science, 93(2403): 60-61. DOI:10.1126/science.93.2403.60 |
Veliky I A, Martin S M. 1970. A fermenter for plant cell suspension cultures[J]. Can J Microbiol, 16(4): 223-226. DOI:10.1139/m70-041 |
 2010, Vol. 46
2010, Vol. 46