文章信息
- 吴振宇, 师光禄, 艾启俊, 王燕, 张伟
- Wu Zhenyu, Shi Guanglu, Ai Qijun, Wang Yan, Zhang Wei
- 鹿蹄草素对采后苹果轮纹病菌的抑制作用
- Inhibitory Effect of Pyrolin on Physalospora piricola in Postharvest Apple
- 林业科学, 2010, 46(4): 156-160.
- Scientia Silvae Sinicae, 2010, 46(4): 156-160.
-
文章历史
- 收稿日期:2008-08-25
-
作者相关文章
2. 北京农学院食品科学系 北京 102206
2. Department of Food Stuff Science, Beijing University of Agriculture Beijing 102206
苹果轮纹病菌(Physalospora piricola)是黄河故道地区苹果(Malus sp.)树主要病害之一。近年来,该病的发生与危害日趋严重,给苹果生产造成了很大的损失,严重影响了苹果的质量和产量。苹果轮纹菌不仅侵染田间生长的苹果,由于其潜伏侵染特性,还可引起苹果采后腐烂,成为贮藏期的重要病害(薛莲等, 2004; 葛永红等, 2004; 李广旭等, 2006)。
植物在抵御病原微生物的侵染过程中,抗性相关酶发挥了重要作用,这主要包括酚类代谢系统中的一些酶和病原相关蛋白(PR蛋白)家族。多酚氧化酶(PPO)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)是存在于植物体内与抵抗病原微生物侵染有关的酶(秦国政等, 2003)。
近年来,有关抗性相关酶在植物抵抗病菌侵染过程中的变化已有大量报道(Brownleader et al., 1995; Rasmussen, 1991; Ippolito et al., 2000)。鹿蹄草素(pyrolin)是一种天然的抗菌成分,具有抗菌、抗病毒、清除羟自由基、抗氧化以及在临床上具有治疗肺部、肠道和尿道感染等作用(艾启俊等, 2006)。据报道,鹿蹄草素对果蔬病原真菌如链核盘菌(Monilinia spp.)、苹果轮纹病菌、链格孢菌(Alternaria sp.)、根霉菌(Rhizopus stolonifer)、灰葡萄孢菌(Botrytis cinerea)都有较好的抑制作用(张伟等, 2007)。为此,本试验以苹果轮纹病菌为供试菌,研究鹿蹄草素对苹果采后轮纹病的防病效果,并测定鹿蹄草素和病原菌对采后苹果PPO, POD和PAL活性的影响,进一步深入探讨抗性相关酶在采后果实抵抗病原菌侵染中所起的作用。通过电镜观察药物处理后菌体超微结构的变化,研究鹿蹄草素的抑菌机制。
1 材料与方法 1.1 试验材料菌种:苹果轮纹病菌,由北京农学院植物保护实验室提供。鹿蹄草主要抑菌成分:鹿蹄草素,由江苏盐城捷阳精细化工有限公司提供。富士苹果(M. domestic cv. Red Fuii):购于北京市回龙观镇城北水果批发市场,产地山东烟台。
1.2 方法1) 病原菌及菌悬液的制备 从自然发病的苹果果实轮纹病病果上分离得到轮纹菌,于PDA培养基上,28 ℃活化培养7天,用含有0.05% Tween-80的无菌水制成5万个·mL-1的孢子悬浮液,备用。悬浮液孢子计数采用血球计数板法。
2) 鹿蹄草素对采后苹果轮纹病的防治效果 挑选大小一致、无病虫害和机械伤的果实,用2%的次氯酸钠溶液消毒2 min后,自来水冲洗,晾干备用。试验分3个不同处理:A,用灭菌打孔器在果实腰部打直径5 mm深3 mm的伤口,接上30 μL 5 mg·mL-1的鹿蹄草素处理液,再接种5 ×104个·mL-1的病菌孢子悬浮液15 μL;B,打孔后只接种15 μL的病菌孢子液;C,不打孔不接种的果实作为对照。每处理3个重复,每个重复10个果实,整个试验重复3次。所有果实放于400 mm×300 mm×100 mm的塑料筐中,外套一塑料袋以保持95%左右的相对湿度,贮于25 ℃下。每隔24 h测定果实的发病率和病斑直径。
3) 酶活性的诱导 苹果果实按照上述方法进行处理并贮于常温下,每处理50个果实。于不同时间间隔(0, 24, 48, 72, 96 h)取样测定酶活性,每次测定的样品组织取自于10个果实的病健交界处,整个试验重复3次。
4) PPO及POD酶液制备与活性测定 取2 g果肉组织,立即加入0.2 g聚乙烯吡咯烷酮(PVP),再加入0.2 mol·L-1的磷酸缓冲溶液10 mL (pH 6.4),冰浴匀浆,12 000 r·min-1离心30 min,上清液用于酶活性测定。PPO活性测定参照陈建中等(1997)的方法加以改进,以每分钟ΔOD398变化0.01为1个酶活性单位;POD活力测定参照田世平等(2001)的方法加以改进,以每分钟ΔOD460变化0.01为1个酶活性单位。
5) PAL酶液制备与活性测定 取2 g果肉组织,立即加入0.2 g聚乙烯吡咯烷酮(PVP),再加入0.05 mol·L-1的硼酸缓冲溶液10 mL (pH 8.8,含有0.01 mol·L-1巯基乙醇),冰浴匀浆,12 000 r·min-1离心30 min,上清液用于酶活性测定。PAL酶活性测定参照薛应龙(1985)的方法加以改进,以每小时ΔOD290变化0.01为1个酶活性单位。
6) 鹿蹄草素对病原真菌最小抑菌浓度(MIC)的测定 采用倍比稀释法:将鹿蹄草素稀释液与PDA培养基混合均匀,分别制成5, 2.5, 1.25, 0.625, 0.313, 0.156, 0.078, 0.039 mg·mL-1的含药平板,接种100 μL含菌量约为5万个·mL-1的菌悬液,用无菌涂棒涂布均匀。同时以纯的培养基接种真菌作对照,置于28 ℃恒温培养箱内培养,每个处理设3次重复。48 h后取出观察菌的生长情况,以完全无菌丝生长的最低药物浓度为MIC。在MIC测定的基础上,将没有长菌的平板继续培养7天,以完全无菌丝生长的最低药物浓度为MFC (王红星等, 1996)。
7) 扫描电镜观察鹿蹄草素对苹果轮纹菌超微结构的影响 将培养好的各处理菌落在无菌操作下切取0.8~1 cm2的菌块,迅速投入2%戊二醛固定液中室温固定2~4 h,之后用0.1 mol·L-1 PH7.2的磷酸缓冲液(PBS)冲洗,1%饿酸后固定1~2 h,继用重蒸水冲洗,然后分别用30%, 50%, 70%, 80%, 90%, 95%, 100%的乙醇梯度脱水,醋酸异戊酯置换30 min或过夜,CO2临界点干燥,粘样,离子溅射法镀膜,最后在扫描电镜下观察、照相(谢家仪等, 2005)。
8) 透射电镜观察鹿蹄草素对苹果轮纹菌超微结构的影响 切取1 mm3的数个菌块投入2%戊二醛(pH7.4)中室温固定2~4 h,用PBS缓冲液冲洗干净,再用饿酸进行后固定,不同浓度的乙醇脱水,丙酮或环氧丙烷置换,浸透液浸透。然后进行包埋(包埋剂:丙酮以2:1)、聚合、组织修块、超薄切片、醋酸铀和硝酸铅双染色,最后在透射电镜下观察、照相(张新春, 2003)。
9) 试验数据的统计分析 所得数据用Finney机率分析法求出毒力回归式, 并对该方程式进行卡方适合性检验。方差分析的计算方法依据LSD法。
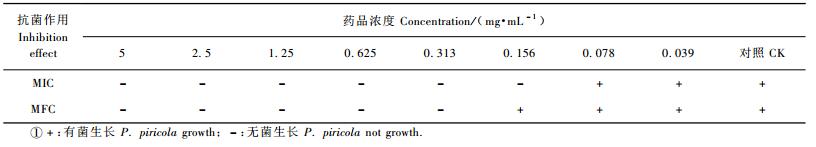
2 结果与分析 2.1 鹿蹄草素对采后苹果轮纹病的防治效果鹿蹄草素在常温下对苹果轮纹病的发病率和病斑直径(图 1)都有明显的抑制效果。用鹿蹄草素处理的苹果果实,在72 h以后才开始发病;而只接种病原菌的果实48 h就开始发病,到72 h发病率为78%,病斑直径达到15.8 mm,极显著高于鹿蹄草素处理的果实(P<0.01)。到96 h只接种病原菌的果实全部发病,病斑直径也达到20.8 mm。而用鹿蹄草素处理过的果实的发病率仅为48%,病斑直径也只达到7.7 mm,极显著高于鹿蹄草素处理的果实(P<0.01)。证明鹿蹄草素能推迟果实的发病和降低发病率,并对病斑扩展也有一定的抑制作用。
|
图 1 鹿蹄草素对采后苹果轮纹病的防治效果 Figure 1 Effect of pyrolin on physalospora rot of harvested apple fruits 图中相同字母代表差异性不显著(P<0.05)。Mean values in each figure with the same letter are not significantly different at the P < 0.05 level. A:鹿蹄草素+苹果轮纹病菌Pyrolin+P. piricola; B:只接种苹果轮纹病菌Only P. piricola;C:不接种的对照CK. |
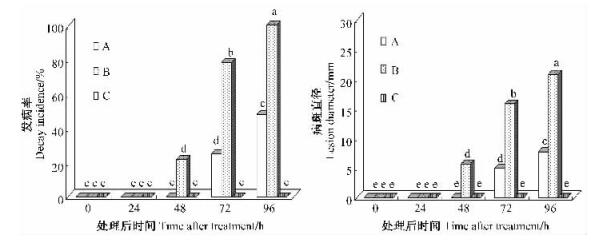
从图 2可知,鹿蹄草素+苹果轮纹病菌和只接种苹果轮纹病菌都能诱导采后苹果果实PPO活性的升高。鹿蹄草素+病原菌处理果实后,苹果果实PPO活性开始升高,72 h达到最高峰,极显著高于对照(P<0.01)。只接种病原菌的苹果果实在24 h以后PPO活性迅速升高,变化趋势于鹿蹄草素处理的一致,其活性也极显著高于对照(P<0.01)。这说明单独接种病原菌也能诱导PPO活性的提高,但其酶活初始升高时间晚于鹿蹄草素+病原菌诱导。
|
图 2 不同处理下采后苹果果实多酚氧化酶(PPO)活性的变化 Figure 2 Changes of polyphenoloxidase (PPO) activity with different treatments in harvested apple fruits A:鹿蹄草素+苹果轮纹病菌Pyrolin+P. piricola; B:只接种苹果轮纹病菌Only P. piricola; C:不接种CK.下同The same below. |
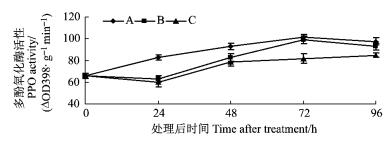
鹿蹄草素+苹果轮纹病菌和只接种苹果轮纹病菌都能诱导采后苹果果实POD活性的升高(图 3)。鹿蹄草素+病原菌处理果实后,苹果果实POD活性开始升高,72 h达到最高峰,极显著高于对照(P < 0.05)。只接种病原菌的苹果果实在48 h以后POD活性迅速升高,变化趋势于鹿蹄草素处理基本一致,其活性也极显著高于对照(P<0.01)。但72 h以后POD活性下降较鹿蹄草素+病原菌处理更快。这说明单独接种病原菌和接种鹿蹄草素+病原菌都能诱导POD活性的提高。
|
图 3 不同处理下采后苹果果实过氧化物酶(POD)活性的变化 Figure 3 Changes of peroxidase (POD) activity with different treatments in harvested apple fruits |
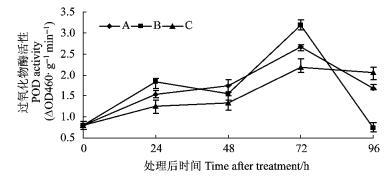
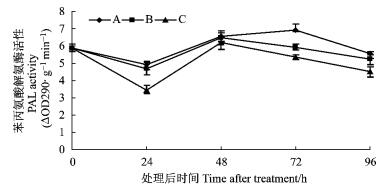
接种鹿蹄草素+苹果轮纹病菌和只接种苹果轮纹病菌都能诱导采后苹果果实PAL活性的诱导于PPO、POD的相似,都表现出上升的趋势(图 4)。鹿蹄草素+病原菌处理果实24 h后,苹果果实PAL活性都显著高于对照(P<0.05)。在整个试验中,鹿蹄草素+病原菌处理的果实的PAL活性升高保持到72 h,而对照和只接种病原菌的果实PAL活性48 h后开始下降。
|
图 4 不同处理下采后苹果果实苯丙氨酸解氨酶(PAL)活性的变化 Figure 4 Changes of ammonia-lyase (PAL) activity with different treatments in apple fruits |
从表 2可以看出,随着鹿蹄草素浓度的增加,其抑菌作用越明显,鹿蹄草素对苹果轮纹病菌的MIC和MFC分别为0.156,0.313 mg·mL-1。
|
|
扫描电镜下观察可见,鹿蹄草素处理后苹果轮纹病菌的形态结构发生明显的变化。未经处理的对照菌丝体生长正常,分布均匀,表面光滑,结构完整(图 5-1,2)。而在MIC药物处理下,菌丝软化,扭曲变形,菌体之间相互凝聚、缠结,菌丝断裂,细胞壁皱折剥脱,表面出现絮状凝集物(图 5-3,4)。

|
图 5 对照和处理的苹果轮纹病菌菌丝形态扫描电镜照片 Figure 5 The untreated and treated mycelium shape of P. piricola under SEM 1 (3 000×), 2 (10 000×):对照菌丝圆润饱满,结构完整,表面光滑Mycelium was round and plump, the structure was integrity, and surface was smooth. 3 (3 000×),4 (10 000×):MIC的鹿蹄草素处理后,菌丝扭曲变形,相互黏附,局部凹陷,部分断裂After treated by MIC of pyrolin, the mycelium was warped, deformed, adhered together, and local depressed, some of them was broken. |
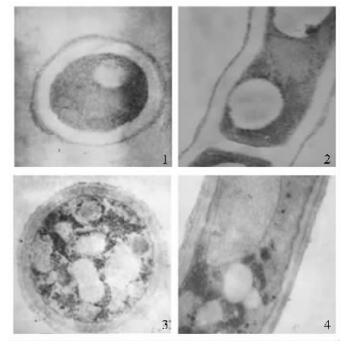
在H-7500型透射电镜下观察发现,正常苹果轮纹病菌细胞壁、细胞膜结构完整,紧密,细胞基质均匀(图 6-1,2)。MIC药物处理下,细胞内部组成紊乱(图 6-3,4)。
|
图 6 对照和处理的苹果轮纹病菌菌丝形态透射电镜照片 Figure 6 The untreated and treated mycelium shape of P. piricola under TEM 1 (横切Horizontal section), 2 (纵切Vertical section):对照菌丝结构规整,胞质均匀The structure was regular, cytoplasm was uniformity. 3 (横切Horizontal section)、4 (纵切Vertical section):MIC的鹿蹄草素处理后,细胞内部组成紊乱After treated by MIC of pyrolin, the internal composition of cell disorder. |
鹿蹄草素是一类有开发价值的天然抑菌剂资源,可用于防治果蔬病害。本试验采用活体抑菌试验表明,鹿蹄草素在设定的浓度下不能完全抑制其相应病原菌的侵染,但可以在不同程度上降低发病率和减小果实的病斑直径。
抗真菌药物的体外药敏试验结果影响因素较多,测定MIC值是探讨抗真菌药物的敏感性和决定应用方案的有效方法。本试验采用倍比稀释法测定了鹿蹄草素对苹果轮纹病菌的MIC和MFC,结果分别为0.156,0.313 mg·mL-1,其结果与张伟等(2007)测定结果相似,表明鹿蹄草素在较低的浓度下能抑制和杀死供试病原真菌。
本试验发现,鹿蹄草素+病原菌或只接种病原菌都能诱导苹果果实PPO, POD和PAL活性的升高。特别是鹿蹄草素+病原菌的苹果果实PPO, PAL活性一直处于较高水平(图 2),与此相伴随的是果实的发病率低,病斑直径也较小(图 1)。说明鹿蹄草素对病菌的抑制作用与诱导果实PPO, PAL活性的提高存在着显著关系。
应用电镜技术就鹿蹄草素对苹果轮纹病菌生长的影响进行了研究,表明鹿蹄草素对苹果轮纹病菌的形态和细胞结构有明显的破坏作用,推测鹿蹄草素与菌丝细胞壁合成的相关酶或蛋白结合,使细胞壁的合成不正常,细胞壁通透性增强,导致质壁分离,菌丝软化变形,相互缠连并发生断裂,鹿蹄草素也可能与真菌蛋白质结合反应,破坏蛋白质分子结构而变形或失去活性,导致细胞质的固缩和解体,但其抗病机制还有待于进一步研究。
艾启俊, 王储炎, 吴小虎, 等. 2006. 鹿蹄草素的研究[J]. 农产品加工·学刊, 55(2): 16-18, 21. |
陈建中, 盛炳成, 刘克均. 1997. 苹果感染轮纹病菌后过氧化物酶和多酚氧化酶活性的变化[J]. 江苏农业学报, 13(1): 63-64. |
葛永红, 李轩, 李梅, 等. 2004. 采后Harpin处理对损伤接种苹果梨黑斑病的影响[J]. 甘肃农业大学学报, (1): 22-24. |
李广旭, 沈永波, 高艳敏, 等. 2006. Botryosphaeria dothidea在苹果果实上的侵染过程[J]. 果树学报, 23(1): 69-72. |
秦国政, 田世平, 刘海波, 等. 2003. 拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J]. 中国农业科学, 36(1): 89-93. |
田世平, 徐勇, 姜爱丽, 等. 2001. 冬雪蜜桃在气调冷藏期间品质及相关酶活性的变化[J]. 中国农业科学, 34(6): 656-661. |
王红星, 张口, 郭燕群, 等. 1996. 芳香型植物精油抑菌效果的测定和比较[J]. 中国饲料, (6): 32-34. |
谢家仪, 董光军, 刘振英. 2005. 扫描电镜的微生物样品制备方法[J]. 电子显微学报, 24(4): 440. |
薛莲, 檀根甲. 2004. 采后苹果果实轮纹病的研究进展[J]. 安徽农业科学, 32(6): 1227-1230, 1266. |
薛应龙. 1985. 植物生理学实验手册[M]. 上海: 上海科学技术出版社: 191-192.
|
张伟, 艾启俊, 吴小虎. 2007. 鹿蹄草素对几种果蔬采后病原真菌的离体抑制作用研究[J]. 北京农学院学报, 22(2): 47-50. |
张新春. 2003. 油菜菌核病菌与寄主互作及羟菌唑对病菌影响的超微结构与细胞化学研究. 西北农林科技大学植物保护学院硕士学位论文.
|
Brownleader M D, Ahmed N, Trevan M, et al. 1995. Purification and partial characterization of tomato extension peroxidase[J]. Plant Physiol, 109: 1115-1123. DOI:10.1104/pp.109.3.1115 |
Ippolito A, El-Ghaouth A, Wilson C L, et al. 2000. Control of postharvest decay of apple fruit by Aureobasidium pullulans and induction of defense responses[J]. Postharvest Biol Technol, 19: 265-272. DOI:10.1016/S0925-5214(00)00104-6 |
Rasmussen J B. 1991. Systemic induction of salicylic acid accumulation incucumber after inoculation with Pseudomonas syringae pv. syringae[J]. Plant Physiol, 97: 1342-1347. DOI:10.1104/pp.97.4.1342 |
 2010, Vol. 46
2010, Vol. 46