文章信息
- 杨帆, 丁菲, 杜天真
- Yang Fan, Ding Fei, Du Tianzhen
- 盐胁迫下构树DREB转录因子基因表达的实时荧光定量PCR分析
- DREB Gene Expression in Leaves of Broussonetia papyrifera Seedlings under Salt Stress Detected by Real-Time Fluorescent Quantitative PCR
- 林业科学, 2010, 46(4): 146-150.
- Scientia Silvae Sinicae, 2010, 46(4): 146-150.
-
文章历史
- 收稿日期:2009-01-09
-
作者相关文章
2. 江西农业大学园林与艺术学院 南昌 330045
2. College of Garden and Art, Jiangxi Agricultural University Nanchang 330045
转录因子是指那些专一性地结合于DNA特定序列上、能激活或抑制其他基因转录的蛋白质(王少峡等,2004)。DREB(dehydration responsive element binding protein)转录因子是一种特异性的转录因子,当植物在干旱、低温及盐等逆境胁迫下,DREB转录因子被诱导表达,与DRE元件特异结合,启动下游与抗逆性相关的功能基因的表达,导致基因产物的累积,调节植物体内各种生理生化反应,最终使植物对环境胁迫的抗逆性得到提高(孙静文,2006)。由于植物的抗逆性属于复杂的数量性状,是多种调控机制共同作用的结果,因此用单一的功能基因转化植物其效果往往有限(秦红霞等,2006)。相比之下,转录因子基因可以通过与DNA元件的结合调控下游一系列基因的表达,因此寻找植物抗逆过程中起重要作用的转录因子基因,探究其作用范围及机制之后将其用于植物抗逆基因工程中,预期能获得更为理想的效果。目前,关于DREB转录因子基因的研究主要集中在草本植物中,有关木本植物的DREB转录因子基因的克隆及表达的研究较少。
构树(Broussonetia papyrifera)具有良好的生态和经济效益, 它分布广, 适应性强, 整株均有利用价值。构树叶是很好的动物饲料; 树皮纤维洁白细长,强度高、韧性好,是制备木浆的高级原料; 根和种子均可入药; 树液可治皮肤病; 果实富含氨基酸等有效成分。构树耐干旱、耐贫瘠、抗盐碱,是迅速绿化荒山、荒坡、荒滩和盐碱地的优良树种之一。同时,由于其良好的适应性,还可作为研究木本植物应答环境逆境信号途径的一种植物材料。在人口、粮食和土地的矛盾日益加剧的今天,对这些适应性强且具有较高经济价值的植物进行逆境的生理及分子机制的研究十分必要。
实时荧光定量PCR技术是在常规PCR基础上发展起来的可用于基因表达分析的核酸定量技术,于1996年由美国Applied Biosystems公司推出(袁亚男等,2008),具有精确、操作简单、成本适中、可以实现高通量的优势。实时荧光定量PCR技术在同一密闭试管中,同时进行PCR扩增与靶核苷酸探针杂交, 与其他检测目的基因mRNA表达水平的方法,如杂交、RT-PCR相比,其污染可能是最低的, 检测需要的时间更短,灵敏度高(王明旭等,2005)。操作相对简单,不需要跑胶和手工收集数据,影响因素大大减少,也不需后期处理。基因芯片技术是分析大量基因表达的良好方法,但与此技术相比,操作过程繁杂,成本也高,且具有一定的假阳性。目前,该技术在生物医学领域有着广泛的应用,近年来也被逐渐运用于农作物的转基因检测和基因差异表达研究上,如转基因玉米(Zea mays)(陈颖等, 2004)和棉花(Gossypium)(刘娜等, 2007)的检测;水稻(Oryza sativa)OsRDB1(余舜武等, 2007),GSK(魏敏等, 2006),Adh2(赵森等, 2008)等基因以及玉米中的水分胁迫诱导基因(张中保等, 2007)的表达,但在林业上的运用还未见报道。
目前最常用的实时定量PCR方法有染料(SYBR Green Ⅰ)法和TaqMan探针法2种,本研究选择探针法。SYBR Green荧光染料为双链DNA特异性染色,它不仅和靶基因的扩增产物结合,也会同非特异性PCR产物结合,所以特异性不如探针法(Yin et al., 2001; Schmittgen et al., 2000),需要熔解曲线判断PCR扩增反应是否特异。探针法除了1对特异性引物,增加了1条和模板互补的基因特异性探针,探针上5′端和3′端分别标记了1个报告荧光基团(供体)和1个猝灭荧光基团(受体),可提高定量PCR的专一性。每扩增1个特异产物只释放1个分子的荧光染料,仪器检测的是特异扩增的结果,非特异产物对检测信号没有影响,有效提高了检测的特异性,不需要用到熔解曲线,但探针设计有一定难度。
本文应用实时荧光定量PCR技术研究了构树幼苗叶片中2个DREB转录因子基因在不同程度盐胁迫下的表达差异,以此进一步验证它们与构树抗盐性的关系,初步探讨盐胁迫下DREB转录因子的分子机制,为利用DREB转录因子改良植物抗逆性的基因工程技术提供线索。
1 材料与方法 1.1 材料来源于同一株健康母树的构树种子播于装有洗净石英砂的培养皿中,待幼苗长至2片真叶时,移栽于装有相同质量洁净砂的塑料钵中,每钵种植1株,用1/2Hoagland营养液培养,尽量控制每钵水分和养分一致, 至株高10 cm左右开始NaCl处理。NaCl溶液以营养液配制,设3个梯度,分别是100,200和300 mmol·L-1,每梯度3个重复。分别剪取未经NaCl处理和处理后6,12,24 h的幼苗叶片,立即投入液氮中,用于RNA抽提。
1.2 引物和探针选择已从构树中克隆到的编码DREB类转录因子的2个BpDREB基因(GenBank的序列号分别为DQ211836和EU096527,下文中分别称为BpDREB1和BpDREB2)作为目标基因进行分析,以已发表的构树Actin基因(李岩等,2007)作内标。引物运用PRIMER 5.0软件设计,探针及引物由上海生工提供(表 1)。
|
|
1) RNA抽提、纯化 Trizol试剂(Invitrogen)提取总RNA,Dnase(TaKaRa)酶解可能混杂的基因组DNA,用适量的DEPC水溶解RNA,用紫外分光光度计测定RNA的浓度和纯度,琼脂糖凝脉电泳评价RNA质量。
2) cDNA合成 取各样品总RNA 2 μg分别进行反转录,加入1 μL Oligo dt(Invitrogen), Dnase抑制剂(TaKaRa)0.5 μL,补DEPC水至终体积10 μL。轻轻混匀并在微量离心机低速将混合液收集在底部。每个反应管中顺序加入5×RT Buffer 4 μL,dNTP Mix (10 mmol·L-1 each) (TOYOBO) 1 μL,RNase抑制剂(TaKaRa) 0.5 μL,DEPC水3.5 μL,MMLV(100 units·μL-1)(Invitrogen) 1 μL。42 ℃空气浴孵育1 h,99 ℃ 5 min,4 ℃保存。
3) 荧光定量PCR分析 反应体系30 μL,包括Master MIX 27.5 μL,上、下游引物(上海生工)各0.6 μL,探针(上海生工)0.3 μL,cDNA模板1 μL。反应于Bio-Rad Icycler荧光定量PCR仪上进行,每个样品做3次平行反应,反应条件为:95 ℃预变性3 min,95 ℃ 20 s,60 ℃ 20 s,循环40次。电脑自动分析,直接读出CT值。
4) 基因表达差异的分析(Kenneth et al., 2001)分析方法的确立:以不同处理的cDNA模板混合样进行梯度稀释,对于每一个稀释样本,用目标基因和内标基因的荧光探针及引物进行扩增。计算出它们的平均CT值以及△CT值,通过cDNA浓度梯度的lg值对△CT值作图,如果所得直线斜率接近于0,说明反应优化较好,目标基因和内标基因的扩增效率相同,可以通过比较CT值的方法进行相对定量,分析基因表达的差异。另外, 运用2△CT′[△CT′=CT(参照)-CT(处理)]分析作为内标的Actin基因的相对表达量, 以判断该基因的表达受试验处理的影响, 确定其作为内标的有效性。
基因表达相对定量分析:当反应条件优化较好,将参照样本的基因表达设为1,那么处理样本中的基因表达量变化的倍数可以用2△△CT来表示,其中△△CT=△CT(参照)-△CT(处理),△CT=CT(目标基因)-CT(内标基因)。
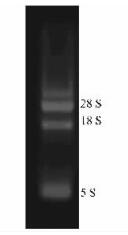
2 结果与分析 2.1 RNA抽提质量提取总RNA经分光光度计检测,OD 260/280在1.8~2.1之间。经1%琼脂糖变性凝胶电泳显示(图 1),条带清晰,无明显降解,可用于反转录反应。
|
图 1 RNA电泳图 Figure 1 RNA electrophoregram |
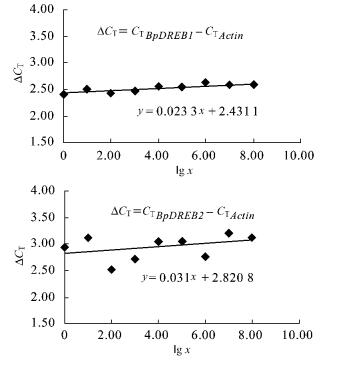
不同处理所得的cDNA模板混合样进行10倍8个梯度的稀释。根据1.3所述的方法,对于每一个稀释样本,用目标基因和内标基因的荧光探针及引物进行扩增,通过cDNA浓度梯度的lg值对△CT值作图,得到图 2。所得直线斜率分别为0.023 3和0.031,均接近于0,说明反应优化较好,DREB转录因子基因和Actin基因的扩增效率相同,因此,可以通过比较CT值的方法, 运用2△△CT公式进行相对定量,参照样本为NaCl处理前的叶片。
|
图 2 目标基因与内标基因的扩增效率分析 Figure 2 Analysis of amplification efficiency of target gene and internal gene x:cDNA稀释倍数cDNA dilution. |
每样品每基因均按照3孔平行试验,得出3个基因CT值的标准偏差均小于0.3(表 2),说明试验建立的定量PCR反应具有较强的准确性和可重复性。此外,运用2△CT′计算作为内标的Actin基因的相对表达量,得出100,200和300 mmol·L-1 NaCl胁迫处理过程中它的相对表达量均稳定在1左右,变幅很小。方差分析得到P值分别为0.205 6, 0.351 4和0.196 7,说明胁迫处理时间对Actin基因表达的影响也很小。因此,Actin基因在这里作为内标是合适的。
|
|
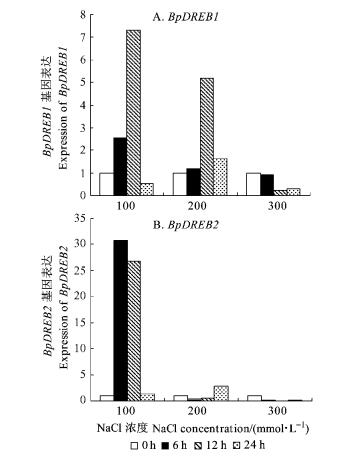
从图 3A可以看到,BpDREB1基因在100和200 mmol·L-1 NaCl胁迫下都能被显著诱导表达。其中,在100 mmol·L-1 NaCl胁迫下,6, 12 h时均被诱导上调,表达量分别比未胁迫的参照样本增加了2.5, 7.3倍,而后又表现为下调趋势,到24 h时,表达量比对照下降一半。在200 mmol·L-1的NaCl胁迫下,胁迫6 h表达量被诱导上调达对照的1.2倍,12 h时高达5.2倍,而后又表现为下降趋势,但在24 h时它的表达量仍然高于对照,为对照的1.6倍; 而在300 mmol·L-1 NaCl胁迫下,BpDREB1基因的表达量却始终低于未经盐胁迫处理的。
|
图 3 不同浓度NaCl胁迫下BpDREB1和BpDREB2基因相对表达差异 Figure 3 Relative expression of BpDREB1 and BpDREB2 under different concentrations of NaCl stress |
如图 3B所示,BpDREB2基因在100 mmol·L-1NaCl胁迫下的相对表达量先被强烈诱导升高而后又逐渐下降。在100 mmol·L-1NaCl胁迫6 h时表达量上调到对照的30.7倍,12 h时为对照的26.7倍,而后继续下降并且下降幅度明显增大,24 h时降至对照的1.3倍。在200 mmol·L-1NaCl胁迫6, 12 h时表达量均低于对照,然后缓慢上升,到24 h时表达量达对照的2.8倍; 而在300 mmol·L-1 NaCl胁迫下,BpDREB2基因的表达量始终小于对照,说明它未被NaCl胁迫诱导。
3 结论试验表明,BpDREB1基因能被100, 200 mmol·L-1 NaCl胁迫所诱导,BpDREB2基因能被100 mmol·L-1NaCl胁迫所诱导,对盐胁迫做出表达水平增高的应答,但超过一段时间之后表达量又逐渐下降。后期表达量的下降可能有2种解释:一是DREB转录因子被诱导表达后启动下游与抗逆性相关的功能基因的表达,调节植物体内各种生理生化反应,使构树对盐胁迫的抗逆性得到提高,已经对胁迫环境产生了适应,盐胁迫不再诱导DREB转录因子基因的表达上调;二是DREB转录因子的诱导会受到胁迫时间的限制,超过一定的时间,表达逐渐受到抑制,植物对逆境的耐受性也逐渐降低。以上推断还需要进一步深入的试验加以论证。BpDREB2基因也能被200 mmol·L-1 NaCl胁迫所诱导表达量升高,但是在表达量升高之前的一段时间里它的表达被抑制,可能是在中度盐胁迫下,BpDREB2基因要经历一个启动期才能被诱导表达。BpDREB2基因在100 mmol·L-1NaCl胁迫下比BpDREB1基因的表达量大,可能暗示着较低程度的盐胁迫对BpDREB2基因的诱导影响更大,在低盐胁迫下它的抗逆作用更强。当NaCl浓度达到300 mmol·L-1,BpDREB1和BpDREB2基因对胁迫的应答均表现为表达水平的降低,也就是说它们的表达被抑制。结合对植株外部形态的观察,经300 mmol·L-1NaCl胁迫处理的构树幼苗, 在胁迫6 h之后就陆续出现叶片失绿枯萎等症状,24 h左右开始陆续有植株死亡,推断在24 h之后不可能出现BpDREB基因表达量被诱导升高的情况。
构树幼苗叶片中DREB基因的转录表达受盐胁迫因子所诱导,它可能参与构树应答盐胁迫逆境的信号传递途径,但超过一定的胁迫时间和程度此类基因可被阻遏。
陈颖, 徐宝梁, 苏宁, 等. 2004. 实时荧光定量PCR技术在转基因玉米检测中的应用研究[J]. 作物学报, 30(6): 602-607. |
李岩, 李冠. 2007. 光叶楮肌动蛋白基因片段的克隆及其序列分析[J]. 生物技术, 17(4): 1-3. |
刘娜, 张锐, 罗淑萍, 等. 2007. 荧光定量PCR技术检测vgb基因在棉花中的表达[J]. 新疆农业大学学报, 30(3): 6-9. |
秦红霞, 宋玉霞, 刘敬梅. 2006. 植物DREB转录因子的研究进展及应用[J]. 生物技术通讯, 17(5): 780-783. |
孙静文. 2006. 构树DREB转录因子及木质素合成代谢相关基因的克隆及功能分析. 中国科学院植物研究所博士学位论文.
|
王明旭, 朱永芳, 罗宽, 等. 2005. 松材线虫rDNA-ITS2 TaqMan探针实时荧光PCR检测[J]. 林业科学, 41(2): 82-85. DOI:10.11707/j.1001-7488.20050213 |
王少峡, 王振英, 彭永康, 等. 2004. DREB转录因子及其在植物抗逆中的作用[J]. 植物生理学通讯, 40(1): 7-13. |
魏敏, 熊建华, 李阳生, 等. 2006. 实时PCR定量分析干旱胁迫下水稻糖原合成酶激酶基因表达差异[J]. 中国水稻科学, 20(6): 567-572. |
余舜武, 刘鸿艳, 罗利军. 2007. 利用不同实时定量PCR方法分析相对基因表达差异[J]. 作物学报, 33(7): 1214-1218. |
袁亚男, 刘文忠. 2008. 实时荧光定量PCR技术的类型、特点与应用[J]. 中国畜牧兽医, 35(3): 27-30. |
赵森, 陈永华, 陈昊, 等. 2008. 荧光定量PCR检测淹涝胁迫下水稻Adh2基因的表达量变化[J]. 中国生态农业学报, 16(20): 455-458. |
张中保, 李会勇, 石云素, 等. 2007. 应用实时荧光定量PCR技术分析玉米水分胁迫诱导基因的表达模式[J]. 植物遗传资源学报, 8(4): 421-425. |
Kenneth Livak J, Thomas Schmittgen D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Method, 25: 402-408. DOI:10.1006/meth.2001.1262 |
Schmittgen T D, Zakrjsek B A, Mills A G, et al. 2000. Quantitative reverse transcription-polymerase chain reaction to study mRNA decay: comparison of endpoint and real-time methods[J]. Anal Biochem, 285: 194. DOI:10.1006/abio.2000.4753 |
Yin J I, Shackel N A, Zekry A, et al. 2001. Real-time reverse-transcriptase polymerase chain reaction(RT-PCR)for measurement of cytokine and growth factor mRNA expression with fluorogenic probes or SYBR Green Ⅰ[J]. Immunol Cell Biol, 79: 213. DOI:10.1046/j.1440-1711.2001.01002.x |
 2010, Vol. 46
2010, Vol. 46