文章信息
- 马良进, 林君阳, 李桥, 张立钦, 陈安良
- Ma Liangjin, Lin Junyang, Li Qiao, Zhang Liqin, Chen Anliang
- 山核桃外果皮中的抑菌活性成分
- Antifungal Constituents from the Husk of Carya cathayensis
- 林业科学, 2009, 45(12): 90-94.
- Scientia Silvae Sinicae, 2009, 45(12): 90-94.
-
文章历史
- 收稿日期:2008-10-29
-
作者相关文章
2. 浙江省天台县林业特产局 天台 317200
2. Tiantai Forestry Speciality Bureau Tiantai 317200
山核桃(Carya cathayensis)属胡桃科(Juglan-daceae)山核桃属(Carya)木本植物(郑万钧,1985)。主要分布于浙、皖2省交界的天目山区周围,是浙江省乃至世界性特色干果。目前,浙江省山核桃面积超过4.7万hm2,年产量达8 000 t以上,而山核桃外果皮达21 000 t以上。山核桃外果皮的如何处理问题一直困扰着产区地方政府和农民(王国平等,2006)。当前尚无理想的处理方法,绝大部分外果皮都是随意倾倒于河边、路旁,任其腐烂发酵被河水冲走,对周围生态环境产生严重的影响。
胡桃科胡桃树属植物果实的肉质果皮是我国传统中药,称为青龙衣,具有治疗胃痛、胃溃疡、皮肤病、子宫脱落、镇痛等作用(杜旭等,1996)。近年来研究表明,青龙衣具有一定的抗肿瘤活性(兰英等,2003;王春玲等,2004)。通过对该属植物果实外果皮化学成分的研究,发现其含有黄酮类、萜类、萘醌及其苷、多酚、有机酸等多种成分(易醒等,2001)。山核桃外果皮粗提液对小麦赤霉病(Gibberella zeae)、水稻纹枯病(Rhizoctonia solani)等病原真菌有明显的杀菌效果(苏秀等,2008),具有开发成为植物源杀菌剂的潜力。开发利用山核桃废弃外果皮不仅能变废为宝,而且对于保护生态环境也具有重要意义。本研究对山核桃外果皮中抑菌活性成分进行了初步分离,以期为开发利用山核桃外果皮提供依据。
1 材料与方法 1.1 供试植物样品山核桃外果皮由浙江林学院天则山核桃科技开发有限公司提供,于9月初山核桃手剥外果皮,阴干、备用。
1.2 供试菌种供试病原真菌有:番茄早疫病菌(Alternaria solani)、苹果腐烂病菌(Valsa mali)、小麦赤霉病菌、水稻纹枯病菌、黄瓜菌核病菌(Sclerotinia sclerotiorum)、水稻稻瘟病菌(Pyricularia grisea)、玉米大斑病菌(Exserohilum turcicum)等植物病原菌,均由浙江林学院森林保护实验室提供。
1.3 仪器与试剂NMR(核磁共振谱)用Bruker-AVANCE400核磁共振仪测定;ESIMS(电喷雾电离质谱)用Thermo Finnigan-LCQ Advantage质谱仪测定。
无水甲醇、石油醚(30~60 ℃)、氯仿、乙酸乙酯、正丁醇、丙酮等有机溶剂均为分析纯,由杭州大方化学试剂厂生产。
1.4 提取方法将阴干的山核桃外果皮在50 ℃烘箱里烘干,粉碎,过60目筛(孔径0.25 mm),以冷浸法用甲醇提取3次,提取时间分别为48,24,24 h,合并滤液,真空旋转浓缩至干,得山核桃外果皮甲醇浸膏。
1.5 萃取分离方法将山核桃外果皮甲醇浸膏用蒸馏水悬浮,用石油醚、氯仿、乙酸乙酯、正丁醇依次进行萃取分离。将各萃取有机层真空旋转浓缩至干,得石油醚相、氯仿相、乙酸乙酯相、正丁醇相。
1.6 抑菌活性测定方法以生长速率法(张兴等,2000)测定4个有机萃取相对5种病原真菌菌丝生长的抑制作用。称取山核桃外果皮各萃取相浸膏0.25 g,用相应的有机溶剂5 mL配制成质量浓度为50 mg·mL-1的母液,并配制成质量浓度为5,10 mg·mL-1的带毒培养基,以相同浓度的溶剂为对照。在无菌条件下接种供试病原菌,置于25 ℃左右恒温光照培养箱中培养,待培养72 h后取出培养皿(水稻纹枯病菌培养48 h),用游标卡尺量菌落直径(十字交叉测量2次,取其平均数)。按下列公式计算抑制率:菌落直径(cm)=2次直径平均数-0.4(菌饼的直径),抑制率(%)=
以孢子萌发法(方中达,1998)测定2个单体化合物对番茄灰霉病菌、小麦赤霉病菌孢子萌发的抑制作用。用丙酮将化合物溶解,用移液管吸取一定量的药液和制备好的孢子悬浮液加入小试管混合均匀,使混合液中化合物的质量浓度为0.1,0.5 mg·mL-1。用微量加样器吸取混合液滴到凹玻片上,然后架放于带有浅水层的培养皿中,加盖保湿培养于28 ℃培养箱中。每处理设3个重复,并设不含药剂的处理作空白对照。当空白对照孢子萌发率达到90%以上时,检查各处理孢子萌发情况。按下列公式计算抑制率:

|
对抑菌活性较强的氯仿相进行柱层析分离。将氯仿浸膏(19.55 g)进行柱层析,用硅胶作填料,以石油醚和乙酸乙酯的溶剂配比(12:1,10:1,8:1,6:1,4:1,2:1,1:1)为洗脱剂,进行梯度洗脱,合并成分相同的流份,共得到A,B,C,D,E,F,G 7个组分。
反复柱层析,结合HPLC制备,从B组分(0.350 4 g)分离得到化合物7和1;从C组分(1.340 5 g)分离得到化合物2和3;从D组分(3.245 0 g)分离得到化合物4,5,6。
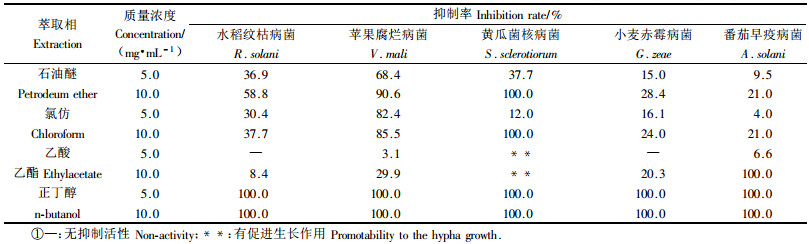
2 结果与分析 2.1 4个萃取相对5种供试病原真菌菌丝生长的抑制作用根据苏秀等(2008)山核桃外果皮甲醇提取液对15种病原真菌的抑制作用的试验结果,选取其中抑制率较高的5种病原真菌进行活性测定,采用生长速率法测定了4种有机萃取相对5种病原真菌菌丝生长的抑制作用(表 1)。结果表明,供试浓度下,正丁醇相对供试病原菌均表现出较高的抑制活性,氯仿相和石油醚相次之,乙酸乙酯相抑菌活性最弱。供试病原菌中,苹果腐烂病菌对各萃取相最为敏感。
|
|
|
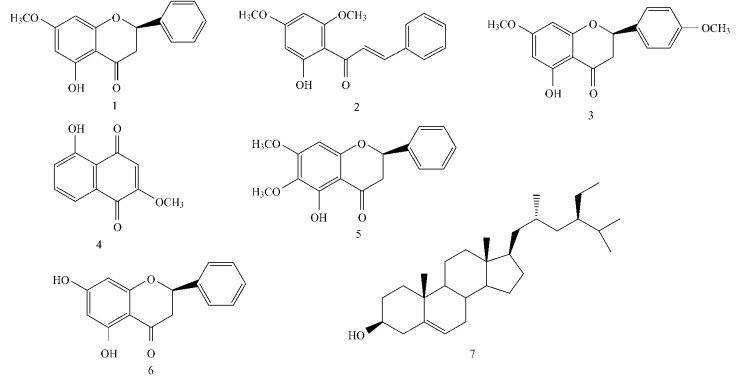
图 1 化合物1~7的结构 Figure 1 Structure of compounds 1~7 |
化合物1:白色片状结晶(CH3OH),mp 98~100 ℃,ESI-MS m /z 271 [M+H]+;1H NMR (CDCl3,400 MHz) δ:2.81 (1H,dd,J=17.2,3.0 Hz,H-3a),3.08 (1H,dd,J =17.2,13.0Hz,H-3b),3.80 (3H,s,OCH3-7),5.41 (1H,dd,J=13.0,3.0 Hz,Η-2),6.07 (1H,d,J=2.4 Hz,H-6),6.06 (1H,d,J=2.4 Hz,H-8),7.40~7.46(5H,m,B-ring-H),12.03 (1H,s,OH-5)。13C NMR (CDCl3,100 MHz) δ:79.2 (d,C-2),43.4 (d,C-3),195.7 (s,C-4),164.2 (s,C-5),95.2 (d,C- 6),168.0 (s,C-7),94.3 (d,C-8),162.8 (s,C-9),103.2 (s,C-10),138.4 (s,C-1′),126.1 (d,C-2′,C-6′),128.9 (d,C-3′,C-4′,C-5′)。根据上述物理数据和波谱数据,并参考文献(Wu et al., 1981;Vries et al., 2005)数据,确定该化合物为乔松酮(pinostrobin)。
化合物2:淡黄色晶体,mp 96~98 ℃,ESI-MS m/z 2 85 [M+H]+;1H NMR (CDCl3,400 MHz) δ:14.3 (1H,s,HO-2′),7.91 (1H,d,J=15.6 Hz,H-b),7.79 (1H,d,J=15.6 Hz,H-a),7.61 (2H,dd,J=7.8,1.6 Hz,H- 2 and H-6),7.42 (3H,m,H-2,H-3 and H-5),6.12 (1H,d,J=2.3 Hz,H-3′),5.97 (1H,d,J=2.3 Hz,H-5′),3.93 (3H,s,OCH 3-6′),3.85 (3H,s,OCH3-4′)。根据上述物理数据和波谱数据,并参考文献(Ranjith et al., 2002)数据,确定该化合物为黄卡瓦胡椒素(flavokawain B)。
化合物3:无色针晶(甲醇),mp 104~106 ℃,ESI-MS m/z 301 [M+H]+;1H NMR (CDCl3,400 MHz) δ:2.79 (1H,dd,J=17.2,3.0 Hz,H-3),3.10 (1H,dd,J=17.2,13.0 Hz,H-3),12.04 (1H,s,OH-5),3.81 (3H,s,OCH3-7),5.37 (1H,dd,J=13.0,3.0 Hz,Η-2),6.07 (1H,d,J =2.3 Hz,H-6),6.04 (1H,d,J=2.3 Hz,H-8),7.38 (2H,m,H-2′ and H-6′),6.95 (2H,m,H-3′ and H-5′),3.84 (3H,s,OCH3-4′)。13C NMR (CDCl3,100 MHz) δ:79.0 (d,C-2),43.2 (d,C-3),196.0 (s,C-4),164.1 (s,C-5),95.1 (d,C-6),167.9 (s,C-7),94.2 (d,C-8),162.9 (s,C-9),103.1 (s,C-10),130.3 (s,C-1′),127.7 (d,C-2′,C- 6′),114.2 (d,C-3′,C-5′),160.0 (d,C-4′)。根据上述物理数据和波谱数据,并参考文献(Duddeck et al., 1978;赵东保等,2005;Lahtinen et al., 2006)数据,确定该化合物为5-羟基-4′,7-二甲氧基黄烷酮(5-hydro xy-4′,7-dimethoxyflavanone)。
化合物4:黄色针状晶体,mp 160~161 ℃,ESI-MS m/z 205 [M+H]+;1H NMR (CDCl3,400 MHz) δ:3.93 (3H,s,OCH3-2),6.11 (1H,s,H-3),12.20 (1H,S,OH-5);7.67 (1H,dd,J=7.5,0.9 HZ,H-8),7.58 (1H,dd,J=8.2,7.5 HZ,H-7),7.27 (1H,dd,J=8.2,0.9 HZ,H-6);13C NMR (CDCl3,100 MHz) δ:179.3 (s,C-1),190.8 (s,C-4),161.1 (s,C-2),161.1 (s,C-5),125.2 (d,C-6),135.4 (d,C-7),119.5 (d,C-8),109.5 (d,C-3),114.2 (s,C-4a),131.1 (s,C-8a),56.6 (q,OCH3)。根据上述物理数据和波谱数据并参考文献(Khalafy et al., 2002;Barre et al., 1986)数据,确定该化合物为5-羟基-2-甲氧基-1,4-萘醌(5-hydroxy-2-methoxy-1,4-naphthoquinone)。
化合物5:淡黄色粉末,1H NMR (CDCl3,400 MHz) δ:2.83 (1H,dd,J=13.0,3.0 Hz,H-3a),3.10 (1H,dd,J=17.2,13.0 Hz,H-3b),11.9 (1H,s,OH-5),3.88 (3H,s,OCH3-6),3.85 (3H,s,OCH3-7),5.42 (1H,dd,J=13.0,3.0 Hz,Η-2),6.13 (1H,s,H-8),7.45 (4H,m,H-2′、3′、5′、6′),7.42 (1H,m,H-4′)。根据上述波谱数据,并参考文献(Christine et al., 2002)数据,确定该化合物为5-羟基-6,7-二甲氧基黄烷酮(onysilin)。
化合物6:白色针晶,mp 195~196 ℃,ESI-MS m/z 257 [M+H]+;1H NMR (CDCl3,400 MHz) δ:5.42 (1H,dd,J=13.0,3.0 Hz,H-2),3.09 (1H,dd,J= 17.2,1 3.0 Hz,H-3a),2.82 (1H,dd,J=17.2,3.0 Hz,H-3b),6.0 (1H,d,J=2.4 Hz,H-6),6.01 (1H,d,J=2.4 Hz,H -8),7.40~7.44(5H,m,H-2′~6′);13C NMR(CDCl3,100 MHz) δ:79.2 (d,C-2),43.4 (d,C-3),195.8 (s,C-4),164.4 (s,C-5),95.8 (d,C-6),164.7 (s,C-7),95.5 (d,C-8),163.2 (s,C-9),103.2 (s,C-10),138.3 (s,C-1′),126.2 (d,C-2′,C-6′),128.9 (d,C-3′,C-4′,C-5′)。根据上述物理数据和波谱数据,并参考文献(Vries et al., 2005;Wollenweber et al., 1982)数据,确定该化合物为乔松素(pinocembrin)。
化合物7:白色针晶,mp 138~140 ℃,与β-谷甾醇标准品共TLC,Rf值一致,混合熔点不下降,故确定为β-谷甾醇(β-sitosterol)。
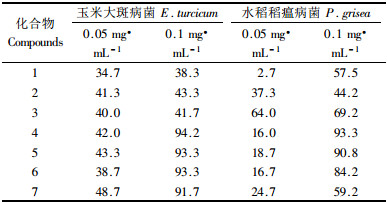
2.3 化合物的活性测定采用孢子萌发法测定了7个单体化合物对玉米大斑病菌和水稻稻瘟病菌孢子萌发的抑制作用(表 2)。结果表明:7个化合物对供试的2种病原真菌孢子萌发均表现出一定的抑制活性,对玉米大斑病菌孢子萌发的抑制作用相对较高,对水稻稻瘟病菌孢子萌发的抑制作用相对较低;在设定的2个供试浓度下,化合物浓度越高,对植物病原真菌孢子萌发的抑制作用越强;在供试浓度为0.1 mg·mL-1时,化合物4,5,6,7对玉米大斑病菌孢子萌发的抑制率均在90%以上,化合物4,5对水稻稻瘟病菌孢子萌发的抑制率在90%以上。化合物6对水稻稻瘟病菌孢子萌发的抑制率也较高,达到84.2%。
|
|
本研究对山核桃外果皮甲醇浸膏的氯仿萃取相中的抑菌活性成分进行了初步分离,得到了7个化合物。β-谷甾醇为植物中常见的化合物,宋晚平(2004)用其做了抑菌试验,发现β-谷甾醇对青霉菌、黑曲霉菌、康氏木霉菌、金黄色葡萄球菌、枯草杆菌均有一定的抑制作用。5-羟基-2-甲氧基-1,4-萘醌为首次从山核桃外果皮中分离得到,Kim等(1996;1998)先后从胡桃科的化香(Platycary strobilacea)以及核桃楸(Juglans mandshurica)根中分离到该化合物,试验表明其具有很强的抗人类结肠癌和肺癌细胞活性。
黄烷酮类化合物广泛存在于自然界中,是多种药用植物有效成分之一。分离到的4个黄烷酮类化合物分别是化合物1(乔松酮,5-羟基-7-甲氧基黄烷酮)、化合物3(5-羟基-4′,7-二甲氧基黄烷酮)、化合物5(5-羟基-6,7-二甲氧基黄烷酮),化合物6(乔松素)。其中乔松酮和乔松素是蜂胶中天然活性化合物,具有抗菌、抗原虫、抗诱变、抗氧化、抑制睾丸酮5α-还原酶、抑制酪氨酸酶、抑制葡糖基转移酶、抑制肥大细胞及中性粒细胞分泌、杀虫、抗肿瘤、局麻等多种药理活性(Sala et al., 2003)。分离得到的各化合物对玉米大斑病菌和水稻稻瘟病菌孢子萌发均有不同程度的抑制作用,表明这些化合物在农用抑菌活性方面具有一定的研究价值。
有研究表明,胡桃醌及其衍生物是胡桃科植物中主要的毒性物质(许绍惠等,1986),本研究并未分离到该类化合物。根据醌类物质的极性,应该分布于正丁醇相。活性研究表明,以正丁醇相的抑菌活性最强,证明山核桃外果皮中具有较高抑菌活性的化合物主要分布其中。作者正在对正丁醇相进行分离,以期得到新的活性化合物,为山核桃外果皮杀菌剂的开发奠定基础,也可能为杀菌剂研究提供新的化合物结构模板。
杜旭, 宋永熙, 彭建华, 等. 1996. 中药青龙衣镇痛机理研究[J]. 哈尔滨医科大学学报, 1(31): 30. |
方中达. 1998. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 152.
|
兰英, 房金波, 张维晶, 等. 2003. 核桃楸青果皮(GPJM)水提物诱生小鼠肿瘤坏死因子的实验研究[J]. 东北师范大学学报:自然科学版, 35(1): 78-81. |
宋晚平.2004.向日葵根中活性成分的提取分离研究.西北农林科技大学硕士学位论文. http://cdmd.cnki.com.cn/article/cdmd-10712-2005111866.htm
|
苏秀, 马良进, 陈安良, 等. 2008. 山核桃外果皮提取物抑菌活性的初步研究[J]. 浙江林学院学报, 25(3): 355-358. DOI:10.3969/j.issn.2095-0756.2008.03.017 |
王春玲, 曹小红. 2004. 核桃青皮对S180实体瘤的作用研究[J]. 食品科学, 25(11): 285-287. DOI:10.3321/j.issn:1002-6630.2004.11.075 |
王国平, 过婉珍. 2006. 山核桃蒲壳污染综合治理及其效应[J]. 现代农业科技, (12): 72-73. |
许绍惠, 唐婉屏, 韩忠环. 1986. 核桃楸毒性成分研究[J]. 沈阳农业大学学报, 17(2): 34-39. |
易醒, 谢明勇, 肖小年. 2001. 胡桃科植物化学及生物活性研究概况[J]. 中草药, 32(6): 559-561. DOI:10.3321/j.issn:0253-2670.2001.06.039 |
赵东保, 杨玉霞, 张卫, 等. 2005. 黑沙蒿黄酮类化学成分研究[J]. 北京:中国中药杂志, 30(18): 1430-1432. |
张兴, 王兴林. 2000. 植物化学保护实验指导[M]. 陕西: 西北农林科技大学出版社, 66-67.
|
郑万钧.1985.中国树木志.2卷.北京: 中国林业出版社, 2379.
|
Barre G, Hocquaux M, Jacquet B, et al. 1986. Différenciation entre les dihydroxy-2, 5 et -3, 5 naphtoquinones-1, 4 par résonance magnétique nucléaire du 13C et 1H, et hétéronucléaire à deux dimensions=Differentiation between the 2, 5- and 3, 5-dihydroxy-1, 4-naphtoquinones by 13C and 1H and heteronuclear two dimensions NMR[J]. Tetrahedron Letters, 51: 6197-6200. |
Christine K D, Nguyen H V, Tran V S. 2002. Constituents from Miliusa balansae (Annonaceae)[J]. Phytochemistry, 61(8): 991-994. DOI:10.1016/S0031-9422(02)00374-6 |
Duddeck H, Snatzke G, Yemul S S. 1978. 13C-NMR and CD of some 3, 8-biflavanoids from Garcinia speices and of related lavanones[J]. Phytochemistry, 17(8): 1369. DOI:10.1016/S0031-9422(00)94591-6 |
Khalafy J, Bruce J M. 2002. Oxidative dehydrogenation of 1-tetralones:synthesis of juglone, aphthazarin, and α-hydroxyanthraquinones[J]. Journal of Sciences, Islamic Republic of Iran, 13(2): 131-139. |
Kim S H, Lee K S, Son J K, et al. 1998. Cytotoxic compounds from the roots of Juglans mandshurica[J]. Journal of Natural Products, 61: 643-645. DOI:10.1021/np970413m |
Kim Y I, Lee S H, Cho T S. 1996. Isolation of anticancer agents from the leaves of Platycarya strobilacea[J]. Korean J Pharmacogn, 27(3): 238-245. |
Lahtinen M, Lempa K, Salminen J P, et al. 2006. HPLC analysis of leaf surface flavonoids for the preliminary classification of Birch species[J]. Phytochemical Analysis, 17: 197-203. DOI:10.1002/(ISSN)1099-1565 |
Ranjith H, Dharmaratne W, Dhammika N P, et al. 2002. Kavalactones from Piper methysticum, and their 13 CNMR spectroscopic analyses[J]. Phytochemistry, 59: 429-433. DOI:10.1016/S0031-9422(01)00443-5 |
Sala A, Reciomc M C, Schinella G R. 2003. Assessent of the anti-inflammatory activity and free radical scavenger activity of tiliroside[J]. Eur J Pharmacol, 461(1): 53-61. DOI:10.1016/S0014-2999(02)02953-9 |
Vries F A, Bitar H E, Green I R, et al. 2005. An antifungal active extract from the aerial parts of Galenia Africana. 11th NAPRECA Symposium Book of Proceedings. Antananarivo, Madagascar, 121-123.
|
Wu T S, Kuoh C S, Ho S T, et al. 1981. Flavanone and other constituents from Onychium siliculosum[J]. Phytochemistry, 20: 527-529. DOI:10.1016/S0031-9422(00)84186-2 |
Wollenweber E, Seigler D S. 1982. Flavonoids from the exudate of Acacia neovernicosa[J]. Phytochemistry, 21: 1063-1066. DOI:10.1016/S0031-9422(00)82416-4 |
 2009, Vol. 45
2009, Vol. 45