文章信息
- 吴锦程, 梁杰, 陈建琴, 戴巧斌, 曹连黄, 许鑫, 许金榜, 官玲.
- Wu Jincheng, Liang Jie, Chen Jianqin, Dai Qiaobin, Cao Lianhuang, Xu Xin, Xu Jinbang, Guan Ling
- GSH对低温胁迫下枇杷幼果叶绿体AsA-GSH循环代谢的影响
- Effects of GSH on AsA-GSH Circulation Metabolism in Chloroplasts of Young Loquat Fruits Under Low Temperature Stress
- 林业科学, 2009, 45(11): 15-19.
- Scientia Silvae Sinicae, 2009, 45(11): 15-19.
-
文章历史
- 收稿日期:2008-10-20
-
作者相关文章
枇杷(Eriobotrya japonica)是福建省的地方名特优果品,果肉柔软多汁,酸甜可口,风味佳美,营养丰富,且具有清肺和胃,降气和痰之功效,深受青睐(吴锦程,2004)。适于南亚热带及热带边缘地区如福建和广东等省份栽培的枇杷品种为耐寒性较差的热带型品种,低温胁迫是热带型枇杷品种生长的关键限制性因子。近年我国南方山地枇杷产区都有不同程度的冻害发生,福建以早熟品种“早钟6号”枇杷(E. japonica cv. Zaozhong No.6)冻害发生较为严重。热带型枇杷在我国现有枇杷栽培面积和产量中占有较大的比重,研究枇杷生产中幼果受冻的问题以减少因冻害造成的损失具有一定的实际意义和理论价值。谷胱甘肽(GSH)是植物体内普遍存在的还原性物质,在防御自由基对膜脂的过氧化中起到重要作用。相关研究表明:生物膜是低温胁迫对植物造成伤害的原初作用部位和反应部位,临界低温下膜上类脂发生由液晶相向凝胶相的转变,并引发如膜透性增大和膜结合酶活化能增高等继发反应,导致组织不可逆伤害的发生(Lyons, 1973;Lyons et al., 1979)。在水稻(Oryza)上,外源GSH可以提高盐胁迫下水稻叶绿体活性氧清除系统中的超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)等相关酶活性以及非酶抗氧化物质还原型抗坏血酸(AsA)和还原型谷胱甘肽(GSH)的含量,降低叶绿体中过氧化氢(H2O2)和丙二醛(MDA)的积累,减轻盐胁迫对叶绿体膜脂过氧化的伤害程度(华春等,2003)。鲁丽丽等(2006)研究还证实外源GSH可明显提高补血草活性氧清除系统中抗氧化剂含量和抗氧化相关酶的活力。林琳等(2006)认为GSH处理降低了鸭梨果实中MDA含量,提高果实AsA和GSH含量以及SOD,过氧化氢酶(CAT),APX等酶的活性,但对GR酶活性影响较小。在低温胁迫条件下,低温敏感作物叶绿体内存在某些对低温敏感的蛋白质而导致其抗氧化系统功能的破坏以及活性氧产生与清除的平衡体系被打破,叶绿体是植物最容易受到低温伤害的细胞器之一(李美茹等,1998;梁颖等,2001)。GSH,AsA和单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR),APX和GR等组成植物叶绿体AsA-GSH循环中的抗氧化防御系统,在清除活性氧方面起重要作用(Asada,1999)。热带型枇杷为喜温果树,易受低温伤害,关于GSH对低温胁迫下枇杷幼果叶绿体AsA-GSH循环代谢影响的研究未见相关报道。本试验采用不同质量浓度的外源GSH处理低温胁迫下枇杷幼果,探讨外源GSH处理对叶绿体AsA-GSH循环代谢的影响,以期为GSH在提高枇杷幼果抗寒性方面的应用提供理论依据。
1 材料与方法 1.1 试验材料以产自我国著名枇杷产区福建省莆田市常太镇的“早钟6号”3年生枇杷容器苗为试材。选取长势一致、无病虫害与损伤、生长正常、花后60天的枇杷容器苗(已疏果),以100,300和500 mg·L-1等不同质量浓度的GSH溶液100 mL均匀喷施于叶面和幼果,以无低温胁迫喷清水处理为对照1,以低温胁迫加喷清水处理为对照2。每个处理5株。将经GSH处理和CK2容器苗置于人工气候室-3 ℃低温下处理6 h,后于室温下平衡10 h,迅速取下幼果经液氮速冻后保存于-40 ℃低温冰箱,待测相关指标。
1.2 主要试剂与仪器本试验使用的牛血清白蛋白(Albumin,Fraction V)、磷酸缓冲液、三氯乙酸(TCA)、考马斯亮蓝G-250、30%过氧化氢、L-半胱氨酸、β-巯基乙醇、乙二胺四乙酸(EDTA)、Tris-HCl缓冲液、还原型谷胱甘肽(GSH)、抗坏血酸(AsA)和NaCl等试剂为国产分析纯或生物级试剂;5,5-二硫代双(2-硝基苯甲酸, DTNB)购自Sigma公司,还原型辅酶Ⅰ(NADH)购自Wolsen公司。主要仪器有:MDF-U4086S型超低温冰箱(日本三洋)、5415R型Eppendorf冷冻离心机(德国产)、BECKMAN COULTER Avanti J-E冷冻离心机(美国产)、日本岛津UV-1240可见紫外分光光度计(苏州产品)和Eppendorf移液枪(德国产)等。
1.3 试验方法 1.3.1 叶绿体的制备参考崔彬彬等(2006)的方法提取完整叶绿体。以缓冲液(含0.05 mol·L-1的磷酸缓冲液PBS,5.0 mmol·L-1的EDTA,pH 7.8)悬浮叶绿体,用于测定APX,GR,MDHAR和DHAR活性以及GSH和AsA含量。
1.3.2 GSH和AsA含量测定取叶绿体悬浮液1.0 mL,加1.5 mL蒸馏水和5%三氯乙酸溶液2.5 mL混匀,于6 600 r·min-1离心10 min,上清液定容至5.0 mL,用于测定GSH含量,GSH含量测定参照Ellman(1959)的方法。取叶绿体悬浮液1.0 mL于2 600 r·min-1离心10 min,沉淀用于制备10%叶绿体匀浆液(叶绿体质量/生理盐水体积为1:9),用于测定AsA含量,AsA的测定参照陈建勋等(2002)的方法。
1.3.3 APX和GR活性的测定APX活性的测定参照陈建勋等(2002)的方法。以1min内OD290nm变化0.01定义为1个酶活力单位,酶活性以U·min-1mg-1 prot表示。取叶绿体悬浮液1.0 mL于2 600 r·min-1离心10 min,沉淀用于制备10%叶绿体匀浆液(叶绿体质量/生理盐水体积为1:9),用于测定GR活性,GR活性的测定参照陈建勋等(2002)的方法,以1 min内OD340 nm变化0.01定义为1个酶活力单位,酶活性以U·min-1mg-1prot表示。
1.3.4 DHAR和MDHAR活性测定取1.0 mL叶绿体悬浮液于2 600 r·min-1离心10 min,取沉淀按1:4(W/V)加入酶提取液,酶提取液为50 mmol·L-1的Tris-HCl缓冲液(pH 7.2)含有0.3 mol·L-1的甘露醇、1.0 mmol·L-1的EDTA、0.1% (W/V)牛血清白蛋白(BSA)和0.05% (W/V)半胱氨酸,4 ℃下匀浆,将匀浆液在4 ℃,19 000 r·min-1离心10 min,上清液即为酶的粗提液,将其在液氮中迅速冷冻,转至-20 ℃冰箱中保存待测。DHAR和MDHAR活性测定参照宋松泉等(2005)的方法, 以μmol AsA·min-1mg-1prot表示DHAR活性,以nmol NADH·min-1mg-1prot表示MDHAR活性。
1.4 数据分析上述测定均设3次独立试验,每次3个重复。测定所得数据经Duncan’s新复极差法进行方差分析, 检验差异显著性。
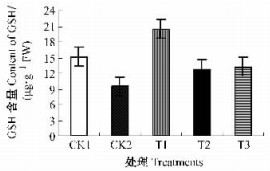
2 结果与分析 2.1 GSH对低温胁迫下枇杷幼果叶绿体GSH含量的影响谷胱甘肽是植物体内重要的抗氧化剂与氧化还原势的调节剂。由图 1可知:经GSH处理的枇杷幼果叶绿体中GSH含量均高于CK2,差异达显著水平(P<0.05)。说明GSH处理可提高低温胁迫下枇杷幼果叶绿体中GSH的含量,其中以100 mg·L-1的GSH处理的枇杷幼果叶绿体GSH含量极显著高于CK1和CK2以及300和500 mg·L-1的GSH处理(P<0.01)。CK1枇杷幼果叶绿体的GSH含量高于CK2,差异达显著水平(P<0.05),表明低温胁迫降低了枇杷幼果叶绿体GSH含量。
|
图 1 GSH对幼果叶绿体GSH含量的影响 Figure 1 Effect of GSH on GSH content in chloroplasts of young loquat fruits CK1:无低温胁迫的GSH处理Treatment without low temperature stress;CK2:低温胁迫处理Treatments with low temperature stress;T1:经低温胁迫和100 mg·L-1 GSH处理Treatments with low temperature stress and 100 mg·L-1 GSH; T2:经低温胁迫和300 mg·L-1 GSH处理Treatments with low temperature stress and 300 mg·L-1 GSH; T3:经低温胁迫和500 mg·L-1 GSH处理Treatments with low temperature stress and 500 mg·L-1 GSH。下同The same below. |
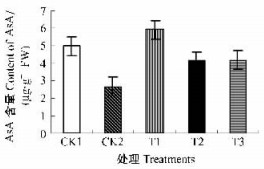
AsA在APX的参与下清除细胞内的H2O2,减轻低温胁迫等逆境条件下引发的膜脂的过氧化伤害。经GSH处理的幼果叶绿体AsA含量均高于CK2,差异达显著水平(P<0.05)。其中以100 mg·L-1的GSH所处理的幼果叶绿体中AsA含量最高,但300和500 mg·L-1的GSH所处理的枇杷幼果叶绿体中AsA含量低于CK1 (图 2)。表明GSH处理可提高枇杷幼果叶绿体中AsA含量,随着GSH处理浓度的增加,幼果叶绿体中AsA含量呈下降趋势,过高的GSH处理浓度将导致AsA含量的下降。CK1幼果叶绿体中AsA含量高于CK2,且差异达显著水平(P<0.05),说明低温胁迫导致枇杷幼果叶绿体中AsA含量的降低。
|
图 2 GSH对幼果叶绿体AsA含量的影响 Figure 2 Effect of GSH on AsA content in chloroplasts of young loquat fruits CK1:无低温胁迫的GSH处理Treatment without low temperature stress;CK2:低温胁迫处理Treatments with low temperature stress;T1:经低温胁迫和100 mg·L-1 GSH处理Treatments with low temperature stress and 100 mg·L-1 GSH; T2:经低温胁迫和300 mg·L-1 GSH处理Treatments with low temperature stress and 300 mg·L-1 GSH; T3:经低温胁迫和500 mg·L-1 GSH处理Treatments with low temperature stress and 500 mg·L-1 GSH。下同The same below. |
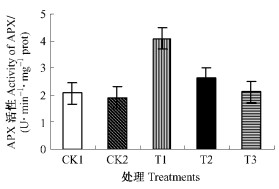
APX是植物和藻类特有的清除过氧化氢(H2O2)的重要酶类,是叶绿体中AsA-GSH循环的关键酶。经100 mg·L-1的GSH处理枇杷幼果叶绿体APX活性极显著高于其他的GSH处理与CK1和CK2 (P<0.01),随着GSH处理浓度的增加,APX活性呈现下降的趋势。300和500 mg·L-1的GSH所处理的幼果叶绿体中APX活性高于CK2,但经500 mg·L-1的GSH处理与CK2差异并不显著(P>0.05)。CK1幼果叶绿体中APX活性略高CK2,表明低温胁迫对枇杷幼果叶绿体APX活性影响不大(图 3)。
|
图 3 GSH对幼果叶绿体APX活性的影响 Figure 3 Effect of GSH on APX activity in chloroplasts of young loquat fruits |
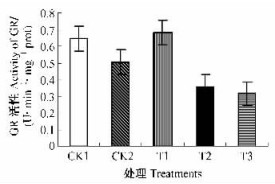
谷胱甘肽还原酶(GR,EC 1.6.4.2)是植物细胞AsA-GSH循环中将GSSG还原为GSH的1种关键酶,存在于微粒体以及细胞液中,在植物氧化还原反应中起重要作用,也是清除细胞内H2O2的酶催化系统的组分之一。GSH处理对低温胁迫下枇杷幼果叶绿体中GR活性影响较大。经100 mg·L-1的GSH处理幼果叶绿体中GR活性最高,且与300和500 mg·L-1的GSH处理差异达极显著水平(P<0.01),与CK2之间也有显著差异水平(P<0.05),但300和500 mg·L-1的GSH处理幼果叶绿体中GR活性极显著低于CK2,表明适当浓度的GSH处理可提高低温胁迫下枇杷幼果叶绿体中GR活性,但过高浓度的GSH处理对GR活性起抑制作用。同时试验结果也显示CK1幼果叶绿体中GR活性显著高于CK2(P<0.05),说明低温胁迫对叶绿体GR活性具有抑制作用。
|
图 4 GSH对幼果叶绿体GR活性的影响 Figure 4 Effect of GSH on GR activity in chloroplasts of young loquat fruits |
细胞内MDHA在MDHAR的作用下被还原成AsA,使AsA得以再生,推动AsA-GSH的循环代谢。枇杷幼果叶绿体在非胁迫条件下CK1的MDHAR酶活力显著高于低温胁迫下的CK2以及GSH各处理(P<0.05);100 mg·L-1的GSH处理其叶绿体MDHAR酶活力高于CK2,而300和500 mg·L-1的GSH处理却低于CK2(图 5),表明低温胁迫强烈抑制了叶绿体MDHAR活性,GSH处理可在一定程度上提高枇杷幼果叶绿体MDHAR酶活力,促进AsA再生,增强抗氧化能力,但GSH处理浓度不当将对MDHAR酶活力起抑制作用。
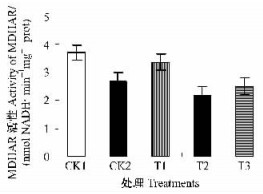
|
图 5 GSH对幼果叶绿体MDHAR活性的影响 Figure 5 Effects of GSH on MDHAR activity in chloroplasts of young loquat fruits |
脱氢抗坏血酸(DHA)能被DHAR还原成AsA,以及时补充并提高细胞内AsA库水平。非胁迫条件下CK1枇杷幼果叶绿体的DHAR酶活力显著高于低温胁迫下的各处理(P<0.05);CK2与GSH各处理之间DHAR酶活力差异不显著(P>0.05)(图 6)。结果表明:低温胁迫导致枇杷幼果叶绿体DHAR酶活力下降,GSH处理对低温胁迫下枇杷幼果叶绿体DHAR酶活力影响较小,可能对枇杷幼果叶绿体内AsA的再生不起主要作用。
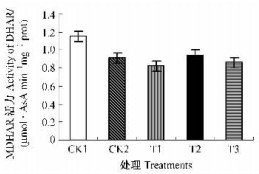
|
图 6 GSH对幼果叶绿体DHAR活性的影响 Figure 6 Effects of GSH on DHAR activity in chloroplasts of young loquat fruits |
细胞内活性氧自由基的积累使膜脂质过氧化作用加强, 是低温胁迫导致细胞伤害与死亡的重要机制之一,胞内H2O2在正常情况下可通过Halliwell-Asada途径清除(荆红梅等,2001)。AsA在APX作用下与H2O2反应, H2O2接受以GSH为中介的NADPH的电子还原成H2O, 从而清除H2O2的毒性,同时AsA被氧化并形成单脱氢抗坏血酸(MDHA), 部分MDHA进一步氧化形成脱氢抗坏血酸(DHA),DHA在脱氢抗坏血酸还原酶(DHAR,EC 1.8.5.1)的作用下以还原型谷胱甘肽(GSH)为底物生成AsA,此反应所产生的氧化型谷胱甘肽(GSSG)又可在谷胱甘肽还原酶(GR)的催化下被还原成GSH;另一部分MDHA则被单脱氢抗坏血酸还原酶(MDHAR,EC 1.6.5.4)还原为AsA (罗娅等,2007)。
GSH作为AsA-GSH循环代谢的重要组成部分参与或直接清除胞内活性氧自由基, 谷胱甘肽还原酶(GR,EC 1.6.4.2)的活性影响到胞内GSH库的水平,植物对环境胁迫的抵抗能力与该酶活性的变化密切相关(Stevens et al., 1997;Noctor et al., 1998;Jin et al., 2003;鲁丽丽等,2006)。本试验研究发现:100 mg·L-1的外源GSH处理可显著提高低温胁迫下枇杷幼果叶绿体GSH含量和GR活力(P<0.05);较高浓度(300和500 mg·L-1)的外源GSH处理对GR活力表现出强烈的抑制作用(即低于CK2),但它们的GSH含量却高于CK2,这可能与叶绿体吸收外源GSH导致其含量上升继而对GR起抑制作用有关。
逆境条件下,AsA可由MDHA和DHA分别在MDHAR和DHAR酶的催化下再生。试验结果表明:低温胁迫对枇杷幼果叶绿体MDHAR和DHAR活性均起抑制作用,适当浓度(100 mg·L-1)的GSH处理可提高低温胁迫下枇杷幼果叶绿体MDHAR的活性,而GSH处理浓度过高(300和500 mg·L-1)则起抑制作用。经GSH处理的枇杷幼果叶绿体DHAR活性与CK2相近,说明GSH处理对枇杷幼果叶绿体DHAR活性影响较小,低温胁迫下GSH对DHAR活性无明显的调节作用,AsA再生主要是通过MDHAR还原MDHA而产生的,这与在番茄叶与根中叶绿体/质体比较研究中所得出的MDHAR为再生AsA主要酶的结论基本相同(Mittova et al., 2000)。
抗坏血酸过氧化酶(APX,EC 1.11.1.11)的活性直接影响到AsA的含量,在AsA-GSH循环代谢中,APX被认为是植物细胞中有效分解H2O2的重要酶之一,APX活性的增加有助于植物抗性的提高。试验结果显示,低温胁迫对枇杷幼果叶绿体APX活性抑制作用较小,外源GSH处理可提高低温胁迫下枇杷幼果叶绿体APX活性,其中以100和300 mg·L-1的外源GSH处理作用较明显。
叶绿体中高含量的GSH能促进叶绿体AsA-GSH循环,使叶绿体内AsA含量增加以及APX,MDHAR和GR活性相应提高(Aono et al., 1995)。本研究结果表明:采用100 mg·L-1的外源GSH处理可提高低温胁迫下枇杷幼果叶绿体中抗氧化剂GSH和AsA含量以及APX,GR和MDHAR的活性,这些非酶抗氧化物质与酶之间的协调作用,促进AsA-GSH循环,叶绿体清除自由基的能力增强,维持叶绿体内较低的膜脂过氧化水平,可能与提高枇杷幼果的抗寒性有关。
陈建勋, 王晓峰. 2002. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 122-126.
|
崔彬彬, 李云, 冯大领, 等. 2006. 杨树叶绿体分离及叶绿体DNA提取方法的研究[J]. 保定师范专科学校学报, 19(2): 25-27. DOI:10.3969/j.issn.1674-2494.2006.02.008 |
华春, 王仁雷, 刘友良. 2003. 外源GSH对盐胁迫下水稻叶绿体活性氧清除系统的影响[J]. 植物生理与分子生物学学报, 29(5): 415-420. |
荆红梅, 郑海雷, 赵中秋, 等. 2001. 植物对镉胁迫响应的研究进展[J]. 生态学报, 21(12): 2125-2130. DOI:10.3321/j.issn:1000-0933.2001.12.022 |
李美茹, 刘鸿先, 王以柔. 1998. 低温下水稻幼苗叶片细胞膜膜脂过氧化和膜磷脂脱酯化反应[J]. 广西植物, 18(2): 173-176. |
梁颖, 王三根. 2001. Ca2+对低温下水稻幼苗膜的保护作用[J]. 作物学报, 27(1): 59-64. DOI:10.3321/j.issn:0496-3490.2001.01.010 |
林琳, 姜微波, 曹健康, 等. 2006. 谷胱甘肽处理对采后鸭梨果实黑心病和抗氧化代谢的影响[J]. 农产品加工(学刊), 8: 4-8. |
鲁丽丽, 刘耕, 李君, 等. 2006. 外源GSH对NaCl胁迫下二色补血草盐害缓冲机理的研究[J]. 山东师范大学学报:自然科学版, 21(2): 108-111. |
罗娅, 汤浩茹, 张勇. 2007. 低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J]. 园艺学报, 34(6): 1405-1410. DOI:10.3321/j.issn:0513-353x.2007.06.010 |
宋松泉, 程红焱, 龙春林, 等. 2005. 种子生物学研究指南[M]. 北京: 科学出版社, 97-100.
|
吴锦程. 2004. 枇杷的生产与科研[J]. 莆田学院学报, 11(3): 31-37. DOI:10.3969/j.issn.1672-4143.2004.03.010 |
Aono M, Saji H, Fujiyama K. 1995. Decrease in activity of glutathione reductase enhances paraquat sensitivity in transgenic Nicotiana tabacum[J]. Plant Physiol, 107: 645-648. DOI:10.1104/pp.107.2.645 |
Asada K. 1999. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 50: 601-639. DOI:10.1146/annurev.arplant.50.1.601 |
Ellman G L. 1959. Tissue sulfhydryl groups[J]. Archives of Biochem and Biophys, 82: 70-77. DOI:10.1016/0003-9861(59)90090-6 |
Jin Y H, Tao D L, Hao Z Q, et al. 2003. Environmental stresses and redox status of ascorbate[J]. Acta Botanica Sinica, 45(7): 795-801. |
Lyons J M. 1973. Chilling injure in plants[J]. Ann Rev Plant Physiol, 24: 445-446. |
Lyons J M, Raison J K, Steponkus P L. 1979. The plant membrane in response to low temperature//Lyons J M, Graham D, Raison J K. Low temperature stress in crop plants: The role of membrane. Academic Press, New York, 1-78.
|
Noctor G, Arisi A C M, Jouanin L, et al. 1998. Glutathione: biosynthesis, metabolism and relationship to stress tolerance explored in transformed plants[J]. J Exp Bot, 49: 623-647. |
Stevens R G, Creissen G P, Mullineaux P M. 1997. Cloning and characterisation of a cytosolic glutathione reductase cDNA from pea (Pisum sativum L.) and its expression in response to stress[J]. Plnat Mol Biol, 35: 641-654. DOI:10.1023/A:1005858120232 |
Mittova V, Volokita M, Guy M, et al. 2000. Activities of SOD and the ascorbate-glutathione cycle enzymes in subcellular compartments in leaves and roots of cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii[J]. Physiologia Plantarum, 110: 42-51. |
 2009, Vol. 45
2009, Vol. 45
