文章信息
- 刘飞, 范国强, 董占强.
- Liu Fei, Fan Guoqiang, Dong Zhanqiang.
- 泡桐离体开花培养系统的建立
- Establishment of in Vitro Flowering Culture System of Paulownia Plants
- 林业科学, 2007, 43(12): 56-63.
- Scientia Silvae Sinicae, 2007, 43(12): 56-63.
-
文章历史
- 收稿日期:2007-03-10
-
作者相关文章
泡桐(Paulownia)为玄参科(Scrophulariaceae)泡桐属多年生落叶乔木,现有9种4变种4类型,是我国重要的速生用材和庭院绿化树种,对生态环境改善具有重要作用。泡桐高大的树体和有些种花期不一致给人工杂交育种带来极大的不便,影响了种质资源的利用。因此,泡桐传统育种需要在缩短营养生长期和便于人工杂交等方面开辟新的途径。为了缩短植物营养生长期,人们开展了植物离体开花研究,并在麻竹(Dendrocalamus latiflorus)、日本梨(Pyrus pyrifolia)、萝芙木(Rauvolfia latifrons)等木本植物上获得成功(张光楚等,2001;Dickens et al., 1988; 1990)。近年来,虽然科技工作者对泡桐离体植株再生及其影响因素进行了大量的研究(范国强等,2002;2005;2007;杨志清等, 2007;翟晓巧等,2004;Bergmann et al., 1997;Fan et al., 2002;Ipekci et al., 2003;Kalaycioglu et al., 2005;Rao et al., 1996),但目前国内外未见有关泡桐离体开花的研究报道。为了给泡桐杂交育种提供便利条件,本文进行了南方泡桐(Paulownia australis)、白花泡桐(P. fortunei)和兰考泡桐(P. elongata)离体开花的研究工作。
1 材料和方法 1.1 试验材料以河南农业大学泡桐研究所用萌发种子在不含任何植物激素1/2MS培养基中培养30 d的6~8片叶龄南方泡桐、白花泡桐和兰考泡桐组织培养苗为材料。植物激素、蔗糖和温度处理试验皆重复3次。
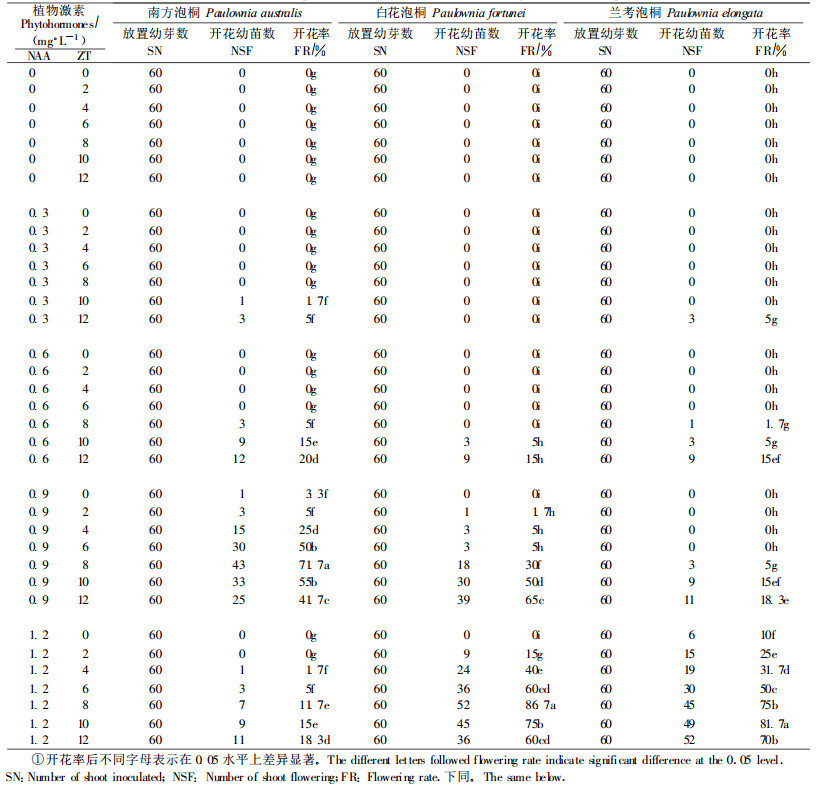
1.2 试验方法 1.2.1 植物激素对泡桐离体开花的影响将上述培养的3种泡桐无菌苗叶片切成约0.5 cm×1.0 cm的小块(外植体), 分别放入装有40 mL含不同浓度NAA和ZT组合MS培养基的100 mL三角瓶中[NAA浓度为0、0.3、0.6、0.9、1.2 mg·L-1,ZT浓度为0、2、4、6、8、10、12 mg·L-1(表 1)],培养基中蔗糖和琼脂的浓度分别为25 g·L-1和0.6 g·L-1。每一种NAA和ZT浓度组合放60瓶(每瓶1块外植体),在温度为(25±2)℃的黑暗培养箱内进行芽诱导。10 d时,将外植体转到温度相同、光照强度为130 μmol·m-2s-1、光周期16 h·d-1的培养箱内继续培养; 20 d时,将不同外植体诱导出的1个长约4 cm生长态势良好的幼芽从基部剪断放到新配制相同MS培养基中(开花统计时为1株幼苗),在相同温度和光照条件下培养。90 d时,统计不同植物激素浓度组合培养基上幼苗开花率(开花幼苗数/放置外植体数×100%)。根据离体开花率,筛选出不同泡桐离体开花基本植物激素浓度组合。
|
|
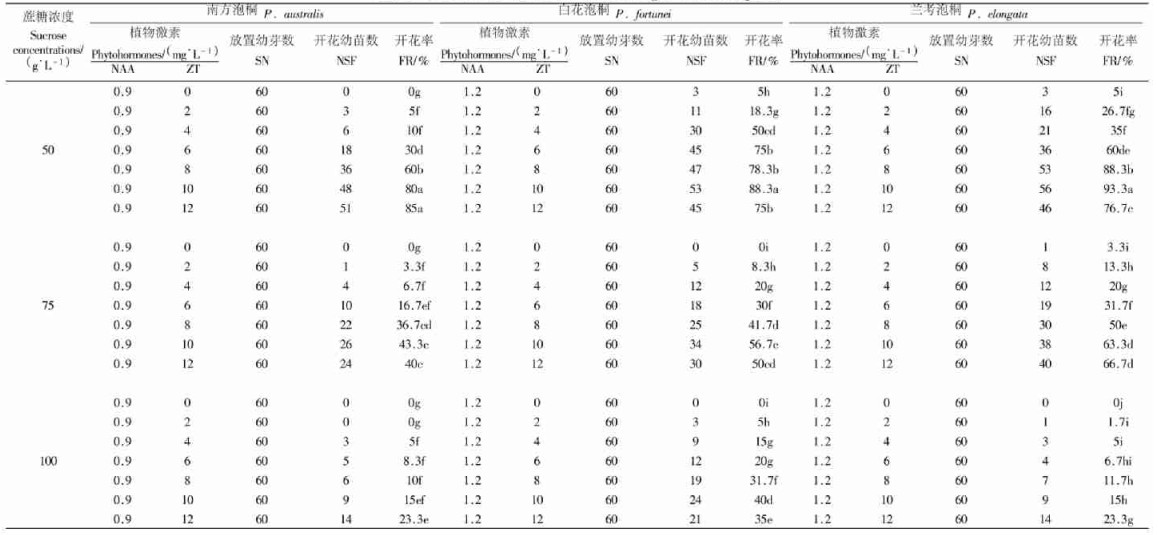
分别将3种泡桐60块外植体接种到装有40 mL其离体开花适宜植物激素浓度组合MS培养基(表 2)的100 mL三角瓶中,按照1.2.1的培养程序和培养条件进行芽的诱导。20 d时,将不同外植体诱导出的1个幼芽分别接种到相同植物激素浓度的MS培养基中,培养基中琼脂浓度为0.6 g·L-1、蔗糖浓度分别为50、75、100 g·L-1,在上述相同条件下培养。90 d时,观察并统计不同种泡桐幼芽开花率。根据离体开花率,筛选出不同泡桐离体开花的适宜蔗糖浓度。
|
|
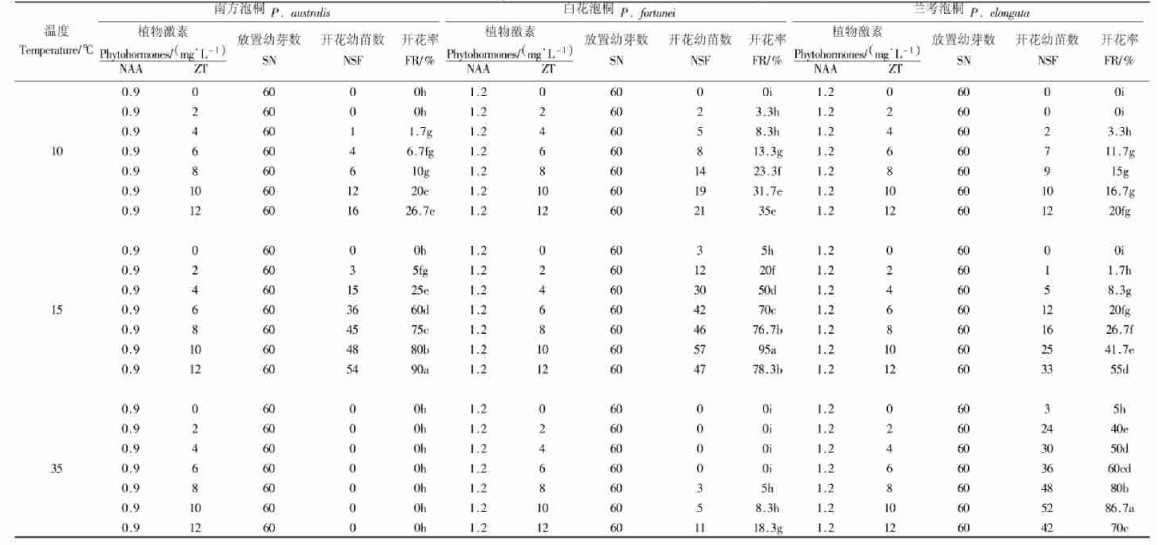
分别将上面3种泡桐的60块外植体接种到装有40 mL离体开花适宜植物激素浓度组合和适宜蔗糖浓度MS培养基的100 mL三角瓶中(培养基中琼脂浓度为0.6 g·L-1),按1.2.1的培养程序和培养条件进行芽诱导。20 d时,将不同外植体上长约4 cm幼芽接种到相同植物激素浓度和蔗糖浓度的MS培养基中,分别在温度为(10±2) ℃、(15±2) ℃和(35±2) ℃,光照强度和光周期如上述条件下培养。90 d时,观察并统计不同种泡桐幼芽开花率。
1.3 数据处理不同种泡桐体外开花率经反正弦转换后, 用SAS V12软件进行处理, 方差分析用LSD方法检验,检验水平P≤0.05。
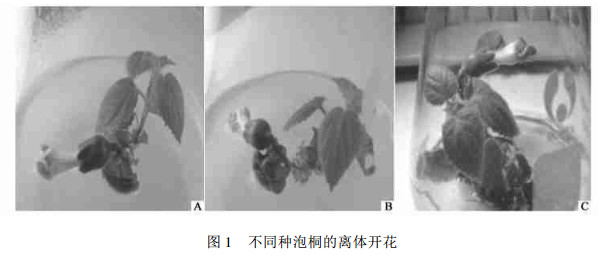
2 结果与分析 2.1 植物激素对泡桐离体开花的影响由植物生长调节剂对南方泡桐、白花泡桐和兰考泡桐离体开花的影响结果(表 1)可以看出,不同浓度的NAA和ZT组合对3种泡桐离体开花的影响存在一定的差异。对南方泡桐来说,当NAA浓度为0 mg·L-1时,在不同ZT浓度组合的培养基上,南方泡桐幼苗皆没有花形成;当NAA浓度为0.3 mg·L-1、ZT浓度为10 mg·L-1和12 mg·L-1时,幼苗才有花的形成,但最高开花率仅为5%;当NAA浓度为0.6 mg·L-1时,只有在ZT浓度为8、10、12 mg·L-13个组合中有花的形成,最高开花率为15%;当NAA浓度为0.9 mg·L-1时,随着ZT浓度的增加,开花率出现先升高后下降的趋势,其中,开花率最高达到71.7%;当NAA浓度为1.2 mg·L-1,在ZT浓度为6、8、10、12 mg·L-1的4个组合中,南方泡桐幼苗开花率分别为5%、15%、15%和18.3%。以上结果表明,南方泡桐幼苗在以上35个NAA和ZT浓度组合中,离体最高开花率对应培养基为MS + 0.9 mg·L-1 NAA + 8 mg·L-1 ZT。因此,选择0.9 mg·L-1的NAA对应ZT的7个浓度组合作为南方泡桐离体开花培养系统建立的基本植物激素组合。南方泡桐、白花泡桐和兰考泡桐离体开花情况如图 1所示。
|
图 1 不同种泡桐的离体开花 Fig. 1 In vitro flowering of different species of Paulownia plants A.南方泡桐P.australis; B.白花泡桐P.fortunei; C.兰考泡桐P.elongata. |
比较白花泡桐幼苗开花结果可以看出,当NAA浓度为0 mg·L-1和0.3 mg·L-1时,ZT的14个浓度组合没有花的形成;当NAA浓度为0.6 mg·L-1时,在ZT浓度为10 mg·L-1和12 mg·L-1组合中有花形成,最高开花率为15%;当NAA浓度为0.9 mg·L-1时,随着ZT浓度的升高,幼苗开花率总体呈现逐渐升高的趋势,在ZT浓度为12 mg·L-1时开花率最高达到65%;当NAA浓度为1.2 mg·L-1时,随着ZT浓度的升高,白花泡桐幼苗开花率呈现先升高后下降的趋势,并在ZT浓度为8 mg·L-1时,最高开花率为86.7%,此后,随着ZT浓度的升高,白花泡桐开花率逐渐下降。该结果表明,白花泡桐幼苗离体开花的最适培养基为MS + 1.2 mg·L-1 NAA + 8 mg·L-1 ZT。因此,选择1.2 mg·L-1的NAA与ZT的7个浓度组合作为白花泡桐离体开花培养系统建立的基本植物激素组合。
兰考泡桐,幼苗离体开花率最高的培养基为MS + 1.2 mg·L-1 NAA + 10 mg·L-1 ZT。所以,选择1.2 mg·L-1的NAA与ZT的7个浓度组合作为兰考泡桐离体开花培养系统建立的基本植物激素组合。
2.2 蔗糖对泡桐离体开花的影响由蔗糖对南方泡桐、白花泡桐和兰考泡桐幼苗离体开花影响结果(表 2)可以看出,在不同蔗糖浓度条件下,3种泡桐幼苗离体开花率存在明显差异。蔗糖为50 g·L-1时,在南方泡桐离体开花最适NAA浓度(0.9 mg·L-1)条件下,随着ZT浓度的增大, 其离体开花率逐渐增大, 特别是当ZT浓度由6 mg·L-1升高到8 mg·L-1时, 南方泡桐离体开花率由30%增大到60%,增大幅度达30%。在白花泡桐和兰考泡桐离体开花最适NAA浓度(1.2 mg·L-1)条件下,随着ZT浓度的增大,2种泡桐幼苗离体开花率皆出现先升高再下降的趋势,但不同ZT浓度对其离体开花影响不同。在此蔗糖浓度下,南方泡桐、白花泡桐和兰考泡桐幼苗离体最高开花率分别为85%、88.3%和93.3%。当蔗糖浓度为75 g·L-1时,在南方泡桐、白花泡桐和兰考泡桐幼苗离体开花最适NAA浓度下,随着ZT浓度的升高,3种泡桐幼苗离体开花率也发生了一定的变化,其幼苗离体最高开花率分别达到43.3%、56.7%和66.7%。蔗糖浓度为100 g·L-1时,南方泡桐、白花泡桐和兰考泡桐幼苗在0.9 mg·L-1NAA和不同ZT浓度组合中,离体最高开花率分别为23.3%、40%和23.3%。这些结果表明,在南方泡桐、白花泡桐和兰考泡桐幼苗离体开花最适NAA浓度条件下,50 g·L-1的蔗糖有利于3种泡桐幼苗离体花的诱导。
结合前面植物激素对3种泡桐离体开花影响的结果可以得出,蔗糖对3种泡桐幼苗离体开花产生了一定影响。当培养温度为25 ℃、光照强度为130 μmol·m-2s-1和光周期为16 h·d-1时,蔗糖浓度为25 g·L-1时,南方泡桐、白花泡桐和兰考泡桐离体最高开花率分别为71.7%、86.7%和81.7%;蔗糖浓度为50 g·L-1时,其最高开花率分别为85%、88.3%和93.3%;蔗糖浓度为100 g·L-1时,幼苗最高开花率分别为23.3%、40%和23.3%。因此,选择MS培养基中50 g·L-1的蔗糖作为3种泡桐幼苗离体开花的最适浓度。
2.3 温度对泡桐离体开花的影响温度对南方泡桐、白花泡桐和兰考泡桐幼苗离体开花影响结果(表 3)表明,3种泡桐幼苗离体开花要求的最适温度不同,并且在相同温度条件下,不同种泡桐离体最高开花率存在着一定的差异。当温度为10 ℃时,南方泡桐、白花泡桐和兰考泡桐在幼苗离体开花最适植物激素和蔗糖浓度条件下,离体最高开花率分别为26.7%、31.7%和20%;当温度为15 ℃时,随着ZT浓度的升高,南方泡桐和兰考泡桐幼苗离体开花率逐渐增大,而白花泡桐则出现先升高后下降的趋势,南方泡桐、白花泡桐和兰考泡桐幼苗最高开花率分别为90%、95% =和55%;当温度为35 ℃时,南方泡桐幼苗离体开花率皆为0,白花泡桐幼苗离体开花率最高为18.3%, 兰考泡桐幼苗离体开花率随着ZT浓度的增大先升高后下降,最高开花率达到86.7%。
|
|
结合蔗糖对3种泡桐离体开花影响的结果,可以得出,温度对3种泡桐幼苗离体开花作用明显。在蔗糖浓度为50 g·L-1条件下,当培养温度为15 ℃时,南方泡桐、白花泡桐和兰考泡桐离体最高开花率分别为90%、95%和55%;25 ℃时,其最高开花率分别为85%、88.3%和93.3%;35℃时,最高开花率分别为28.3%、18.3%和86.7%。也就是说,在培养基中蔗糖浓度为50 g·L-1条件下,15 ℃培养温度有利于南方泡桐和白花泡桐离体开花,而35 ℃的培养温度则有利于兰考泡桐的离体开花。
综上所述,在温度15 ℃、蔗糖浓度为50 g·L-1条件下,南方泡桐和白花泡桐离体开花率最高的培养基分别为MS+0.9 mg·L-1 NAA+12 mg·L-1 ZT和MS+1.2 mg·L-1 NAA+10 mg·L-1 ZT;在温度25 ℃、蔗糖浓度为50 g·L-1条件下,培养基为MS+1.2 mg·L-1 NAA+10 mg·L-1 ZT时,兰考泡桐离体开花率最高。
3 讨论高等植物开花是其营养生长向生殖生长转变的重要过程,是物种遗传因素和环境因素共同作用的结果。正常自然条件下,不同植物由营养生长转变到生殖生长需要的时间存在一定差异。这种差异主要取决于植物的基因型、土壤和植物生长发育所处的环境条件等因素(Bonnet-Masimbert et al., 1987;Dickens et al., 1988;1990;Bernier et al., 1993;Tisserat et al., 1993)。林木为多年生植物,较长的营养生长周期和高大的树体给杂交育种带来了不少困难,影响了林木新品种培育工作的进行。
目前,可通过2种方法缩短木本植物营养生长期。一种是利用基因工程方法将控制植物开花的基因转到植物受体内并使其能够稳定的表达。Weigel等(1992)将来源于拟南芥(Arabidopsis thaliana)的LEAFY开花基因导入杨树(Populus trichocarpa),使需要7年营养生长才能开花的杨树在5个月内开花;Pena等(2001)将组成型表达的LEAFY和APETALAL基因导入柑橘(Citrus reticulata)实生苗,获得的转基因植株第1年就开花结果,明显缩短了这些植物的营养生长周期。另一种是调节组织培养过程中外植体所在培养基的植物激素种类和浓度、C/N比、培养温度和光照强度等因子(Heylen et al., 1988;Tretyn et al., 1994)使植物提前开花。近年来,利用该方法已使麻竹、日本梨、萝芙木等木本植物的营养生长周期明显缩短(张光楚等,2001;Dickens et al., 1988;1990)。在这2种方法中,前者由于操作步骤复杂和仪器设备昂贵等因素的限制很难在生产中推广应用,因此,利用组织培养方法控制木本植物离体开花可能是缩短其营养生长期的最佳途径。植物离体开花过程中,培养基内植物激素的种类及浓度组合、蔗糖浓度和外植体生理状态等因子皆可影响植物离体开花率。研究表明,碳源是影响植物离体开花的重要因子,不同种糖和浓度对火把莲(Kniphofia leucocephala)离体开花的作用有明显差异(Taylor et al., 2007), 提高培养基中蔗糖浓度可提高美丽百金花(Centarium pulchellum)的开花率和座果率(Todorovic et al., 2006)。TDZ或ZT与NAA浓度组合是火把莲离体开花的最适植物激素组合,而BA和IAA则是紫苏(Perilla frutescens)的适宜组合(Zhang,2007)。三叶龙胆(Gentiana ternifolia)幼苗茎段(外植体)位置距顶芽越远,其花诱导率越低(Zhang et al., 2002),成熟龙竹(Dendrocalamus giganteus)腋芽开花与否取决于腋芽内BA的浓度(Ramanayake et al., 2001)。也就是说,外植体的生理状态可通过内源植物激素含量及其细胞分化程度显示出来。调节培养基中植物激素种类及含量植物花序细胞脱分化后长出幼芽(Taylor et al., 2007)。
在本试验中,通过控制组织培养幼苗芽分化和生长培养基中植物激素的浓度、蔗糖浓度和培养温度使多年才能开花的3种泡桐在不到6个月的时间内开花,并且南方泡桐、白花泡桐和兰考泡桐幼苗离体最高开花率分别达到90%、95%和93.3%,这可能是在适宜植物激素浓度组合影响泡桐TFL1基因表达(Guan et al., 2006)的条件下, 50%的蔗糖升高细胞C/N后使泡桐幼苗更有利于启动开花相关基因表达的缘故(Mouradov et al., 2002)。南方泡桐、白花泡桐和兰考泡桐幼苗离体开花最适温度出现较大差异可能因为南方泡桐和白花泡桐为原产于我国南方地区的泡桐种,而兰考泡桐是白花泡桐和毛泡桐花粉天然杂交后通过自然选择后、并在北方地区适宜生长的泡桐种(范国强等,2001)。类似现象在兰属Cymbidium niveo-marginatum和九里香属Murraya paniculata(Kostenyuk et al., 1999;Jumin et al., 1999)出现。至于不同种泡桐离体开花的花粉杂交技术还有待于进一步研究。
范国强, 董占强, 李峰稳, 等. 2007. 光周期对泡桐叶片离体植株再生影响研究. 西北植物学报, 27(1): 104-109. DOI:10.3321/j.issn:1000-4025.2007.01.018 |
范国强, 彭海风, 翟晓巧, 等. 2001. 泡桐叶片蛋白质多态性及其聚类分析. 植物学通报, 18(6): 739-774. DOI:10.3969/j.issn.1674-3466.2001.06.015 |
范国强, 翟晓巧, 蒋建平, 等. 2002. 不同种泡桐叶片愈伤组织诱导及其植株再生. 林业科学, 38(1): 29-35. |
范国强, 翟晓巧, 马新业. 2005. 两种泡桐叶片体细胞胚胎发生及植株再生. 核农学报, 19(4): 274-278. DOI:10.3969/j.issn.1000-8551.2005.04.007 |
杨志清, 范国强, 曹艳春, 等. 2007. 2种同源四倍体泡桐离体植株再生系统建立. 河南农业大学学报, 41(2): 149-153. DOI:10.3969/j.issn.1000-2340.2007.02.006 |
翟晓巧, 王政权, 范国强. 2004. 泡桐离体器官直接发生的植株再生. 核农学报, 18(5): 357-360. DOI:10.3969/j.issn.1000-8551.2004.05.007 |
张光楚, 王裕霞. 2001. 竹子试管苗开花的初步研究. 竹子研究汇刊, 20(1): 1-4. DOI:10.3969/j.issn.1000-6567.2001.01.001 |
Bergmann B A, Moon H K. 1997. In vitro adventitious shoot production in Paulownia. Plant Cell Reports, 16: 315-319. |
Bernier G, Havelange A, Houssa C, et al. 1993. Physiological signals that induce flowering. Plant Cell, 5: 1147-1155. DOI:10.2307/3869768 |
Bonnet-Masimbert M, Zaerr J B. 1987. The role of plant growth regulators in promotion of flowering. Plant Growth Regulation, 6: 13-33. DOI:10.1007/BF00043948 |
Dickens C S, Standen J V. 1988. The induction and evocation of flowering in vitro. Journal of Botany, 54: 325-344. |
Dickens C S, Standen J V. 1990. The in vitro flowering of Kalnchoe blossfeldiana Poellniz Ⅱ: The effects of growth regulators and gallic acid. Plant Cell Physiology, 31: 757-762. |
Fan Guoqiang, Zhai Xiaoqiao, Zhai Cuijuan. 2002. Callus induction from different paulownia plant leaves and their plantlet regenerations. Journal of Forestry Research, 12(4): 209-214. |
Guan C M, Zhu S S, Li X G, et al. 2006. Hormone-regulated inflorescence induction and TFL1 expression in Arabidopsis callus in vitro. Plant Cell Reports, 25: 1133-1137. DOI:10.1007/s00299-006-0165-y |
Heylen C, Vendrig J C. 1988. The influence of different cytokinins and auxins on flower formation in thin cell layer of Nicotiana tabacum L. Plant Cell Physiology, 29: 665-671. |
Ipekci Z, Gozukirmizi N. 2003. Direct somatic embryogenesis and synthetic seed production from Paulownia elongata. Plant Cell Reports, 22: 16-24. DOI:10.1007/s00299-003-0650-5 |
Kalaycioglu H, Deniz I, Hiziroglu S. 2005. Some of the properties of particleboard made from Paulownia. Journal of Wood Science, 51: 410-414. DOI:10.1007/s10086-004-0665-8 |
Kostenyuk I, Oh B J, So I S. 1999. Induction of early flowering in Cymbidium marginatum Mark in vitro. Plant Cell Reports, 18: 764-768. DOI:10.1007/s002990050657 |
Jumin H B, Ahmad M. 1999. High-frequency in vitro flowering of Murraya paniculata (L.) Jack. Plant Cell Report, 18: 764-768. DOI:10.1007/s002990050657 |
Mouradov A, Cremer F, Coupland G. 2002. Control of flowering time: Interacting pathways as a basis for diversity. Plant Cell, 14: S111-S130. DOI:10.1105/tpc.001362 |
Pena L, Martin-Trillo M, Juarez J, et al. 2001. Constitutive expression of Arabidopsis LEAFY or APETALAL genes in citrus reduces their generation time. Nature Biotechnology, 19(3): 263-267. DOI:10.1038/85719 |
Ramanayake S, Wanniarachchi W, Tennakoon T. 2001. Axillary shoot proliferation and in vitro flowering in an adult gigant bamboo, Dendrocalamus giganteus Wall. Ex Munro. In Vitro Cellular and Developmental Biology, 37: 667-671. DOI:10.1007/s11627-001-0116-9 |
Rao C D, Goh C J, Kumar P P. 1996. High-frequency adventitious shoot regeneration from excised leaves of Paulownia spp. cultured in vitro. Plant Cell Reports, 16: 204-209. DOI:10.1007/BF01890868 |
Taylor N J, Light M E, Staden J V. 2007. Monosaccharides promote flowering in Kniphofia leucocephala in vitro. Plant Gowth Regulation, 52: 73-79. DOI:10.1007/s10725-007-9180-4 |
Tisserat B, Galletta P D. 1993. Production of cucumber fruits from the culture of Market more-76'plantlets. Plant Cell Reports, 13: 37-40. |
Todorovic S, Grubisic D, Giba Z, et al. 2006. Sucrose effects on in vitro fruiting and seed production of Centarium pulchellum. Biologia Plantarum, 50: 771-774. DOI:10.1007/s10535-006-0128-8 |
Tretyn A, Czaplewska J, Cymerski M, et al. 1994. The mechanism of calcium action on flowering induction in Pharbitis nil. Journal of Plant Physiology, 144: 562-568. DOI:10.1016/S0176-1617(11)82138-3 |
Weigel D, Alvarez J, Smyth D R, et al. 1992. LEAFY controls floral meristem identity in Arabidopsis. Cell, 69: 843-859. DOI:10.1016/0092-8674(92)90295-N |
Zhang T. 2007. In vitro flowering of Perilla frutescens. In Vitro Cellular and Developmental Biology, 43: 91-94. DOI:10.1007/s11627-007-9038-5 |
Zhang Z, Leung D W. 2002. Factors influencing the growth of micropropagated shoots and in vitro flowering of gentian. Plant Growth Regulation, 36: 245-251. DOI:10.1023/A:1016588302549 |
 2007, Vol. 43
2007, Vol. 43