文章信息
- 王冬梅, 张京芳, 李晓明, 李娟丽, 朱玮.
- Wang Dongmei, Zhang Jingfang, Li Xiaoming, Li Juanli, Zhu Wei.
- 卷叶黄精根中甾体皂苷化学成分及其抗菌活性
- Steroid Saponins of Polygonatum cirrhifolium Root and Their Antisepsis Activity
- 林业科学, 2007, 43(8): 91-95.
- Scientia Silvae Sinicae, 2007, 43(8): 91-95.
-
文章历史
- 收稿日期:2006-12-06
-
作者相关文章
2. 西北农林科技大学资源与环境学院 杨凌712100;
3. 西北农林科技大学理学院 杨凌 712100
2. College of Resource and Environment, Northwest A & F University Yangling 712100;
3. College of Science, Northwest A & F University Yangling 712100
甾体皂苷类化合物是黄精属植物中研究报道最多的成分,迄今为止,国内外已对黄精属的12种植物进行了甾体皂苷类化合物的研究,分离得到了78种甾体皂苷,其中有40多个新的甾体皂苷(张洁等,2006)。对这些甾体皂苷的生物活性研究多集中在降血糖、抗肿瘤、抗HIV等活性方面,而对其抗细菌、抗真菌活性的研究鲜有报道(王冬梅等,2006a)。卷叶黄精(Ploygonatum cirrhifolium),俗名老虎姜,为百合科黄精属植物,是秦岭山区一种普遍的民间食疗中药(刘庆华等,1998),但有关其化学成分国内外还未见报道。卷叶黄精根、茎、叶中均含有多种次生代谢物,其中根茎中的皂苷类化合物含量达3.94%,而且其提取物对植物病原菌和细菌的生长均有不同程度的抑制作用(王冬梅,2006b)。本研究是在对卷叶黄精根茎的乙醇提取物的石油醚、乙酸乙酯及正丁醇萃取物进行抗菌活性跟踪的基础上(王冬梅,2006c),对其进一步分离纯化,从中得到2个甾体皂苷化合物,并进行了抗菌活性比较研究,以期为研究甾体皂苷在抗菌活性方面的构效关系提供一定的参考,为进一步开发和利用卷叶黄精资源奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试材料卷叶黄精采自秦岭太白山厚畛子,柱层析及薄层层析用硅胶(由青岛海洋化工厂生产),SephadexLH-20(瑞典Amersham Biosciences公司产品),ODS-A进口原装(购自北京绿百草科技发展有限公司),反相薄板(德国MERCK公司产品),薯蓣皂苷元标准品(中国药品生物制品鉴定所)。
1.1.2 供试菌种7种细菌:金黄色葡萄球菌(Staphylococcus aureus)、巨大芽孢杆菌(Bacillus megaterium)、蜡状芽孢杆菌(B. cereus)、枯草芽孢杆菌(B. subtilis)、普通变形杆菌(Proteus vulgaris)、大肠杆菌(Escherichia coli)、产气杆菌(Enterobacter aerogenes)。
14种植物病原真菌:玉米大斑病原菌(Exserohilum turcicum)(Z1)、辣椒晚疫PT病原菌(Phytophthora capsici PT)(Z2)、辣椒晚疫pH病原菌(Phytophthora capsici pH)(Z3)、黄瓜炭疽病原菌(Colletotrichum lagenarium)(Z4)、苹果腐烂病菌(Valsa mali)(Z5)、白菜黑斑病菌(Alternaria brassicae)(Z6)、Z7小麦赤霉病原菌(Fusarium graminearum)(Z7)、棉黄萎病原菌(Verticillium dahliae)(Z8)、杨树烂皮病原菌(Cytospora chrysosperma)(Z9)、苹果果腐病原菌(Trichothecium roseum)(Z10)、油松猝倒A病原菌(Fusarium oxysporum)(Z11)、核桃根腐烂病原菌(Colletotrichum coffearum)(Z12)、油松猝倒B病原菌(Rhizoctonia solani)(Z13)、三倍体毛白杨溃疡病原菌(Botryosphaeria ribis)(Z14)。
1.1.3 病菌培养基牛肉膏蛋白胨琼脂培养基(培养细菌):牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂18~20 g,水1 L,pH 7.2~7.4;马铃薯琼脂培养基(培养植物病原菌):马铃薯200 g,蔗糖20 g,琼脂20 g,水1 L。
1.1.4 仪器与试剂FZ102型微型植物样式粉碎机(天津市泰斯特仪器有限公司),渗漉桶(自制),RE-52A旋转蒸发器(上海亚荣生化仪器厂),SHZ-D循环水式真空泵(河南巩义市英峪豫华仪器厂),AY220电子天平(岛津公司),紫外灯(ZF-2型;上海药品检验所监制),ZK型真空干燥箱(北京科伟永鑫实验仪器设备厂),ZAB-HS型质谱仪(英国VG公司),BRUKER-AM-400型超导核磁共振仪,XRC-1型显微熔点仪(北京泰克仪器公司),超净工作台(苏净集团安泰公司制造),303型电热恒温培养箱(北京科伟永鑫试验仪器设备厂),甲醇、氯仿、石油醚、乙酸乙酯、正丁醇、丙酮等其它化学试剂均为分析纯。
1.2 试验方法 1.2.1 甾体皂苷的提取及分离取干燥的卷叶黄精根17 kg,将其切片并装入渗漉桶中,加入体积分数为95%的工业酒精室温浸泡,每24 h收集提取液1次,减压浓缩,向渗漉桶中再加入新酒精,循环6次。减压浓缩得到乙醇提取浸膏,将乙醇提取浸膏悬浮于水,然后依次用石油醚、乙酸乙酯、正丁醇萃取。正丁醇萃取液减压浓缩得总甾体皂苷R(624.1 g)。将总甾体皂苷用适量的甲醇完全溶解,用丙酮溶液进行萃取,移出上清液,沉淀用丙酮溶液反复冲洗,合并冲洗液与上清液,浓缩得R-1(310.0 g),收集沉淀物合并,真空干燥得R-2(309.0 g)。将R-1进行硅胶柱层析,用CHCl3:MeOH进行梯度洗脱,得到不同极性的甾体皂苷混合物R-1-1、R-1-2、R-1-3、R-1-4、R-1-5、R-1-6、R-1-7和R-1-8。将R-1-3(24 g)依次进行硅胶柱层析,RP-18柱层析及SephadexLH-20色谱分离,得化合物Ⅰ(200 mg)和化合物Ⅱ(100 mg)。
1.2.2 化合物Ⅰ皂苷元的提取与分离采用双相酸水解法(杨欢等,2005)。将化合物Ⅰ适量置于圆底烧瓶中,按照样品:浓盐酸:甲醇:水:石油醚为10:21:60:19:100的比例于沸水浴中加热回流提取6 h,反应完毕后,过滤反应物,滤液收集于分液漏斗中,静置分层,收集上层液,下层再用石油醚萃取,合并萃取液,减压浓缩后真空干燥得其苷元(化合物Ⅲ)。将所得皂苷元与薯蓣皂苷元标准品对照,其熔点、Rf值及显色情况均一致,故化合物Ⅰ的皂苷元为薯蓣皂苷元。
1.2.3 抑菌活性测定细菌采用滤纸片扩散法(王冬梅,2006b):将各样品分别用极性相似的溶剂配成含样品质量浓度为400 μg·mL-1的溶液。每平板加入菌悬液0.2 mL,用灭菌刮铲涂抹均匀于整个培养基表面,用消毒镊子夹取含有不同药物的滤纸片,稍干后贴在已接菌的琼脂平板表面,每皿放3片,各纸片间距离相等,呈等边三角形放置,同时以滤纸片浸入溶解药物的溶剂作对照。每个处理设3个重复,28.8 ℃下恒温箱培养96 h,观察抑菌圈的大小。抑菌圈直径(D)=处理抑菌圈直径-对照抑菌圈直径。
抑菌效果判断的依据为:D≤8 mm为不敏感者(+);8 mm<D≤13 mm为低度敏感者(+);13 mm<D≤19 mm中度敏感者(++);D>19 mm为高度敏感者(+++)。
植物病原菌采用菌丝生长速率法(王冬梅,2006c):将各样品分别用极性相似的溶剂溶解,配成含样品浓度为400 μg·mL-1培养基进行抑菌活性试验,同时以等体积的对应溶剂加入到培养基中作对照。待培养基凝固后,在每个培养基中央用接菌针接入已制备好的供试菌饼(内径为6 mm),菌丝面向下,每处理设3个重复,置于28.8 ℃下培养96 h,用十字交叉法测量菌落的2个直径,取其平均值作为代表菌落的平均直径,用下式求出抑菌率。菌落净生长直径(mm)=测量直径-6 mm。抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.4 植物病原菌半抑菌浓度(EC50)的测定选用抑菌效果明显的植物病原菌为供试菌株,进行毒力测定。将各样品采用倍半稀释法,分别配成含样品浓度为400、200、100、50、25 μg·mL-1的培养基进行抑菌活性试验。以浓度对数-抑菌率机率值求出毒力回归方程,根据方程求出EC50值(郭道森等,2004)。
1.2.5 化合物结构鉴定利用NMR和MS等波谱方法和参考文献对照法,对化合物Ⅰ和Ⅱ进行结构鉴定。
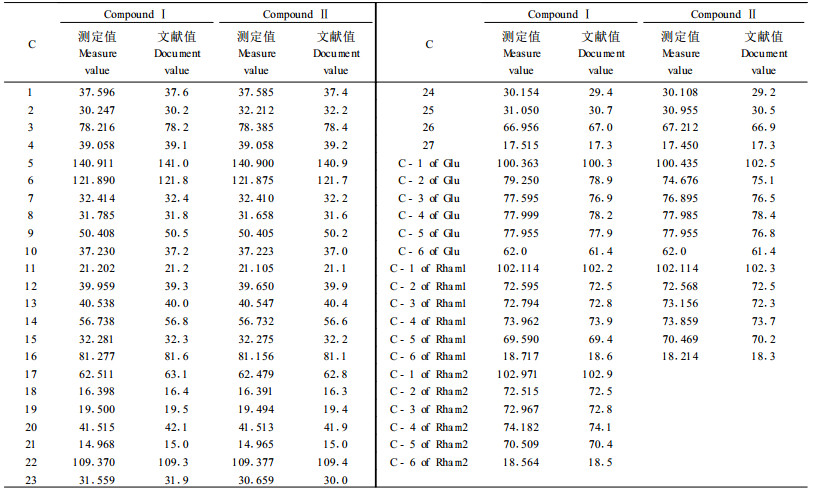
2 结果与分析 2.1 化合物的结构鉴定化合物Ⅰ:白色针状结晶(甲醇),mp.189~193 ℃;Lieberman-Burchand反应呈蓝绿色;Molish反应液界面出现紫色环。FAB-MS负离子给出准分子离子峰为:m/z867[M-H]+;13CNMR给出45个碳信号,结合1HNMR(pyridine-d5,500 MHz)和DEPT谱可归属苷元上的4个甲基质子的特征化学位移δ:0.810 94(3H,s,CH3-18),1.034 18(3H,s,CH3-19),1.059 30(3H,s,CH3-21),0.818 82(3H,s,CH3-27),3个单糖端基信号为δ:4.938 19 (1H,d,H-1 of Glu),5.315 44 (1H,m,H-6),5.832 57(1H,brs,H-1 of Rham1),6.369 86(1H,d,H-1 of Rham2)。化合物Ⅰ的双相酸水解物通过纸层析与糖的对照品进行比较,可检出L-鼠李糖和D-葡萄糖,通过正相硅胶薄层层析(苯:丙酮=17:3)与对照品薯蓣皂苷元进行比较,检出有薯蓣皂苷元;因此,化合物Ⅰ为甾体皂苷。再结合Ⅰ的13CNMR数据给出的45个碳信号减去2个L-鼠李糖和1个D-葡萄糖的碳信号,剩余27个碳信号。更进一步证明Ⅰ的苷元为C27甾体,45个碳原子在DEPT谱上,有6个甲基碳原子、11个亚甲基碳原子、24个叔碳原子和4个季碳原子。化合物Ⅰ的13CNMR数据见表 1。根据解析得波谱数据与文献值对照(庚石山,2005),结果一致,确定化合物Ⅰ为(25R)-spirost-5-ene-3β-ol-3-O-α-L-rhamnopyranosy(1→2)-[α-L-rhamnopyranosyl(1→4)]-β-D-glucopyranoside,分子式为C45H72O16。
|
|
化合物Ⅱ:无色结晶(甲醇),mp.233~237 ℃;Lieberman-Burchand反应呈蓝绿色,Molish反应液界面出现紫色环。FAB-MS负离子给出准分子离子峰为:m/z721[M-H]+;13CNMR给出39个碳信号。化合物Ⅱ的双相酸水解物通过纸层析与糖的对照品进行比较,可检出L-鼠李糖和D-葡萄糖,通过正相硅胶薄层层析(苯:丙酮=17:3)与对照品薯蓣皂苷元进行比较,检出有薯蓣皂苷元;因此,化合物Ⅱ为甾体皂苷。再结合化合物Ⅱ的13CNMR数据给出的39个碳信号减去1个L-鼠李糖和1个D-葡萄糖的碳信号,剩余27个碳信号。更进一步证明化合物Ⅱ的苷元为C27甾体,其苷元为25(R)-spirost-5-ene-3β-ol。39个碳原子在DEPT谱上,有5个甲基碳原子、11个亚甲基碳原子、19个叔碳原子和4个季碳原子。化合物Ⅱ的13CNMR数据见表 1。根据解析得波谱数据与文献值对照(庚石山,2005),结果一致,确定化合物Ⅱ为(25R)-spirost-5-ene-3β-ol-3-O-α-L-rhamnopyranosyl(1→4)-β-D-glucopyranoside,分子式为C39H62O12。
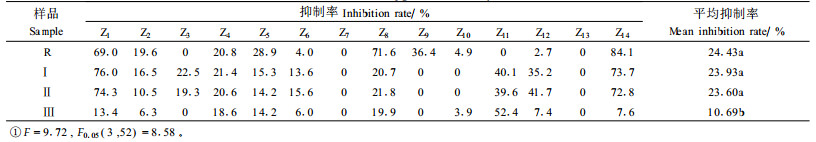
2.2 卷叶黄精甾体皂苷的抑菌效果 2.2.1 甾体皂苷对细菌的抑制效果由表 2可知,卷叶黄精总皂苷R和化合物Ⅰ、Ⅱ的抑菌活性总体上没有其皂苷元的作用强。4个样品均对金黄色葡萄球菌和大肠杆菌没有活性。总皂苷R除了对巨大芽孢杆菌、蜡状芽孢杆菌、普通变形杆菌有较弱抑制活性外,对其他细菌几乎无抑制作用;化合物Ⅰ、Ⅱ对枯草芽孢杆菌、普通变形杆菌有较弱的抑制活性,而对其他细菌均无抑制活性;而其皂苷元(化合物Ⅲ)除了对产气杆菌有较弱的抑制作用外,对普通变形杆菌、蜡状芽孢杆菌、枯草芽孢杆菌抑制作用较强。
|
|
由表 3可知:4个样品均对小麦赤霉病原菌和油松猝倒B病原菌没有活性。除了油松猝倒A病原菌外,卷叶黄精总皂苷R和化合物Ⅰ、Ⅱ的抑菌活性均比其皂苷元的作用强,而且差异显著。多重比较结果表明:总甾体皂苷R和化合物Ⅰ、Ⅱ的抑制效果较明显,其中R对玉米大斑病原菌、棉黄萎病原菌、三倍体毛白杨溃疡病原菌的抑制效果较好,抑制率分别高达69.0%、71.6%、84.1%,对杨树烂皮病原菌也表现出专属的抑制效果,抑制率为36.4%。化合物Ⅰ与化合物Ⅱ均对玉米大斑病原菌、三倍体毛白杨溃疡病原菌的抑制效果较好,抑制率分别达70%以上,对油松猝倒A病原菌、核桃根腐烂病原菌也表现出一定的抑制效果,抑制率分别为35%以上。化合物Ⅲ除了对油松猝倒A病原菌的抑制效果明显外(抑制率为52.4%),对其他病原菌的抑制效果均不明显。
|
|
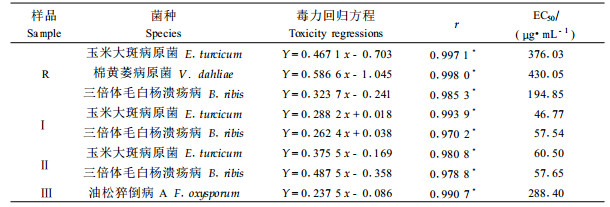
通过活性初筛试验可知,卷叶黄精总甾体皂苷R对植物病原菌中的玉米大斑病原菌、棉黄萎病原菌、三倍体毛白杨溃疡病原菌;化合物Ⅰ及Ⅱ对玉米大斑病原菌、三倍体毛白杨溃疡病原菌;化合物Ⅲ对油松猝倒病A病原菌分别有明显的抑制效果。为了考察各样品对相关病原菌抑菌活性的大小,将各样品分别配成含样品浓度为400、200、100、50、25 μg·mL-1的培养基进行毒力测定。结果由表 4可知:R对玉米大斑病原菌、棉黄萎病原菌、三倍体毛白杨溃疡病原菌的EC50分别为376.03、430.05、194.85 μg·mL-1;化合物Ⅰ对玉米大斑、三倍体毛白杨溃疡病的抑制作用较强,EC50分别为46.77、57.54 μg·mL-1;化合物Ⅱ对玉米大斑、三倍体毛白杨溃疡病的EC50分别为60.50、57.65 μg·mL-1;化合物Ⅲ对油松猝倒病A的抑制作用相对较弱,EC50为288.40 μg·mL-1。从毒力回归方程可以看出:各样品对植物病原菌的毒力随着浓度的增加而增强,即浓度的对数与抑制率呈正相关性。
|
|
甾体皂苷通常都是很好的抗细菌和抗真菌物质。苷元结构对皂苷的生物活性起决定作用,但糖链的个数和连接位置对其活性有着很大的影响(刘美正等,1997a),如多数皂苷的抗真菌活性随糖链的减少而丧失;而源于Hedera helixcivy中的9糖糖链的皂苷Hedera saponin C没有抗细菌活性,去掉糖链后,其苷元显示较高的活性(刘美正等,1997b)。本试验表明:卷叶黄精总甾体皂苷R、化合物Ⅰ、Ⅱ及其苷元对所选供试菌种不但表现出一定的抑菌活性,而且抑菌菌种各不相同。其中总甾体皂苷R和化合物Ⅰ、Ⅱ对植物病原菌的抑制效果均比对细菌的抑制效果明显,而且差异不显著,而其皂苷元恰好相反,对细菌的抑制效果均比对植物病原菌强。这与“一般皂苷的抗真菌作用效果要比皂苷元和乙酰化的皂苷好"的结论相一致(孙麟等,2002),说明卷叶黄精甾体皂苷的抗菌活性很大程度上受组分单糖的个数影响,但有关糖链是通过怎样的机制影响皂苷的抗菌活性的,如通过改变化合物的物理性质、或影响分子与受体的识别和结合等,还有待深入研究。
化合物Ⅰ、Ⅱ比总体、皂苷R对植物病原菌中的玉米大斑、三倍体毛白杨溃疡病的抑制作用高出6倍多,说明化合物Ⅰ、Ⅱ是对这2种菌起抑制作用的主要活性成分,单用化合物Ⅰ、Ⅱ就可以在很低的浓度下对其起到明显的抑制效果。总甾体皂苷R对棉黄萎病原菌、杨树烂皮病原菌、辣椒晚疫P T病原菌、苹果果腐病原菌和苹果腐烂病菌的抑菌活性均比化合物Ⅰ、Ⅱ及其苷元强,特别是对棉黄萎病原菌和杨树烂皮病原菌的抑菌活性较强,说明卷叶黄精具有较强的抗菌活性和潜在的广谱抗菌特点,还存在着多种天然抗菌活性物质,这些物质均表现出不同抗菌活性,值得进一步开发利用。
郭道森, 杜桂彩, 李丽, 等. 2004. 迷迭香酸对几种植物病原菌的抗菌活性. 微生物学通报, 31(4): 72-73. |
庚石山. 2005. 皂苷. 北京: 化学工业出版社, 267-268.
|
刘美正, 郭忠武, 惠永正. 1997a. 皂苷研究——糖链的作用. 有机化学, 17(4): 307-318. |
刘美正, 郭忠武, 惠永正. 1997b. 皂苷研究新进展. 天然产物研究与开发, 9(2): 81-85. |
刘庆华, 刘彦辰. 1998. 实用植物本草. 天津: 天津科学技术出版社.
|
孙麟, 巨勇, 赵玉芬. 2002. 具有生物活性的甾体皂苷. 中草药, 33(3): 276-280. DOI:10.3321/j.issn:0253-2670.2002.03.041 |
王冬梅, 朱玮, 张存莉, 等. 2006a. 黄精化学成分及其生物活性. 西北林学院学报, 21(2): 142-145. |
王冬梅, 朱玮, 陈改侠, 等. 2006b. 卷叶黄精根提取物的抗菌活性初步研究. 西北林学院学报, 21(1): 126-128. |
王冬梅, 朱玮, 张存莉, 等. 2006c. 卷叶黄精对植物病原菌的抗菌活性研究. 西北植物学报, 26(7): 1473-1477. |
杨欢, 杨克迪, 陈钧. 2005. 双相酸水解法提取薯蓣皂苷元的研究. 中国现代应用药学, 22(4): 270-272. DOI:10.3969/j.issn.1007-7693.2005.04.002 |
张洁, 马百平, 杨云, 等. 2006. 黄精属植物甾体皂苷类成分及药理活性研究进展. 中国药学杂志, 41(5): 330-332. DOI:10.3321/j.issn:1001-2494.2006.05.004 |
 2007, Vol. 43
2007, Vol. 43