文章信息
- 胡世俊, 何平, 王瑞波, 方兴.
- Hu Shijun, He Ping, Wang Ruibo, Fang Xing.
- 濒危植物缙云卫矛不同种群的种子萌发研究
- Seed Germination Characters of Populations of the Endangered Plant Euonymus chloranthoides
- 林业科学, 2007, 43(5): 42-47.
- Scientia Silvae Sinicae, 2007, 43(5): 42-47.
-
文章历史
- 收稿日期:2006-10-31
-
作者相关文章
生境的丧失是物种保护工作面临的一个严重问题,生境破坏可以导致种群的消失与分隔,如果种群之间扩散迁移不足,将会导致片断化的产生及种群的隔离(Oliveira et al., 2005)。隔离的小种群很易受统计随机性、遗传随机性、环境随机性的影响(Lande,1988; Groom,1998),存在着很高的局部灭绝的风险(Morgan,1999;何平,2005)。即使产生的小种群没有立即表现出衰退的迹象,从长远来看物种由于种群缺少新的等位基因的迁入仍会破坏其进化适应的潜力(Barbara et al., 1996)。
几乎所有的物种当种群减小时,最直接的后果便是近交系数的增加以及随之而来的近交衰退,种群适合度的降低(Crnokrak et al., 1999;Keller et al., 2002;Reed et al., 2003)。植物种群适合度的降低表现在植物生活史中的一系列环节上。其中,种子萌发是植物生活史中的关键环节,往往决定种群更新是否成功。对濒危植物种子萌发的研究有助于探讨濒危机理,进而对其设计合理的保护措施。
缙云卫矛(Euonymus chloranthoides), 又称绿花卫矛,卫矛科,卫矛属,冬青叶组植物,1983年首次采集开花标本,是一种重庆特有的常绿濒危灌木(汪松等,2004),种群大小不等且处于城镇、公路、建筑、旅游景点等的分隔之下,原本呈大片分布,现退缩分布于一些彼此隔离的岛状区域内(邓洪平等,2000)。经多年调查,目前该植物仅在重庆北碚区缙云山、鸡公山,渝北区统景镇,万盛区黑山谷等地有种群分布(何平,2005)。在以往的种群动态调查中,发现大、小种群的年龄结构图中中龄、老龄各年龄级的个体比例相近,但幼苗比例在小种群中明显偏小,推测缙云卫矛小种群生活史中种子或幼苗阶段可能存在限制其发展的因子。因此,本文在缙云卫矛全分布范围内选取7个大小不同相互间有不同空间隔离程度的种群,通过对其种子萌发模式的研究,以探讨种群大小对种子萌发率的影响及形成原因,为更好的保护该物种提出对策。
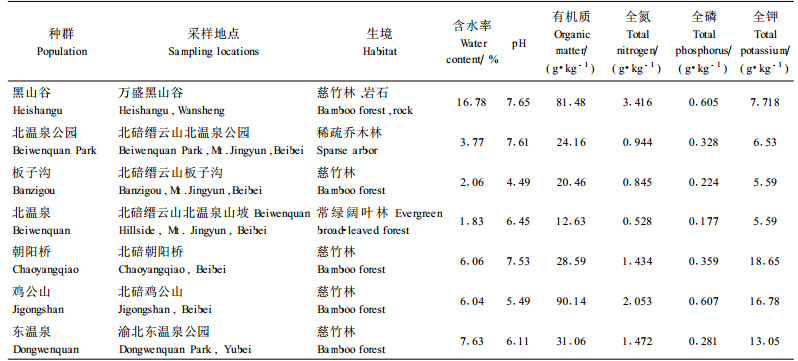
1 材料与方法 1.1 种群的选取北碚缙云山北温泉以前有缙云卫矛成片分布,1927年修建北温泉公园及后来修建的公路、房屋等将其分隔成几个大小不等的斑块,选取最为隔离的2个斑块,一个在公园内,作为北温泉公园种群,一个在公园外的山坡上,作为北温泉种群,两种群相距约1 500 m。北碚缙云山板子沟种群至少在20世纪40年代就已处于公路、庄园等的包围中。北碚鸡公山种群与北碚朝阳桥种群,处于同一个山脊上,在山脊狭窄处断开,均生长在人工种植的慈竹林下,相距800 m。渝北区统景镇东温泉公园所在地1982年开始建园,该公园内一些景点、娱乐场地的开辟使缙云卫矛种群的生境已遭影响。万盛黑山谷以前是一个人迹罕至的峡谷,20 00年开发修建,峡谷中有分散的栈道、浮桥、景点,缙云卫矛现也在谷底呈不连续的线状分布,种群主要集中在南门附近的谷段。东温泉、黑山谷、北温泉公园的种群,年龄结构较合理,幼龄个体比例较大,鸡公山种群幼苗比例偏小,而板子沟、朝阳桥种群幼苗比例很小。
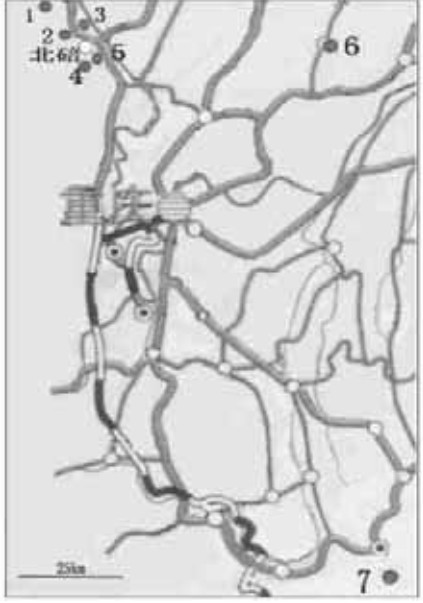
|
图 1 缙云卫矛取样种群的分布 Fig. 1 Distribution of sampling populations of E. chloranthoides 1. 板子沟 Banzigou;2. 北温泉 Beiwenquan;3. 北温泉公园 Beiwenquan Park;4. 鸡公山 Jigongshan;5. 朝阳桥 Chaoyangqiao;6. 东温泉 Dongwenquan;7. 黑山谷 Heishangu. |
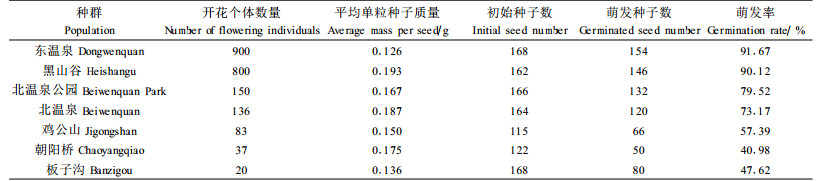
2005年9月,在所选的缙云卫矛7个种群中,小种群直接统计开花植株的个数,不易直接计数的大种群参照Vergeer(2003)的方法来估计,在盛花期统计种群1/10面积的区域的开花个体数量,再据此估计整个种群开花植株数量(表 2),以种群开花个体的数量来表示种群的大小。同年12月,采集成熟种子,林永慧等(2004)发现缙云卫矛的年轮与主茎上的节具有一致性,因此采种时为避免母体植株年龄效应,以高度代替年龄,在各种群中选取高度基本一致、冠幅大体相近的植株,这样也可排除母体植株的大小效应;在植株相似的位置上取果实以避免位置效应。统计各种群的平均种子质量。将7个种群所在样地的土样带回实验室分析。种子采集地点及土壤因子见表 1,土壤因子的测定方法为:含水率采用烘干法、pH值采用电位法、有机质含量采用重铬酸钾容量法、全氮采用开氏法、全磷采用钼蓝光度法、全钾采用火焰AAS法(皮广洁等,1989)。
|
|
|
|
采集的成熟种子,放于4 ℃下贮存1个月,5%次氯酸钠溶液消毒30 min后蒸馏水漂洗。各种群的种子随机取约40粒为一个重复放于一个培养皿中湿润的滤纸上,各种群所取的种子数目见表 2。培养皿置于25 ℃/15 ℃光周期为12 h光照12 h黑暗的培养箱中,培养40 d,每天浇水保湿,记录萌发情况。
数据分析采用SPSS11.0统计软件进行。为分析种子萌发率的种群间差异,将各培养皿里种子的萌发率用反正弦平方根转换后采用方差分析。为检验种群大小对种子平均质量及种子萌发率的影响,将各种群种子平均质量及萌发率与种群的开花数量的对数值进行回归分析(Menges et al., 1998;Morgan,1999);根据缙云卫矛各种群内个体数量将其归为2组:黑山谷,东温泉,北温泉公园种群为大种群组;板子沟,朝阳桥,鸡公山种群为小种群组,对这2个种群的种子萌发率进行两样本t检验。采用线性回归分析生境土壤因子与种子萌发率间的相关性。
2 结果与分析统计得各种群开花盛期的开花个体数、平均单粒种子质量、萌发率(见表 2)。
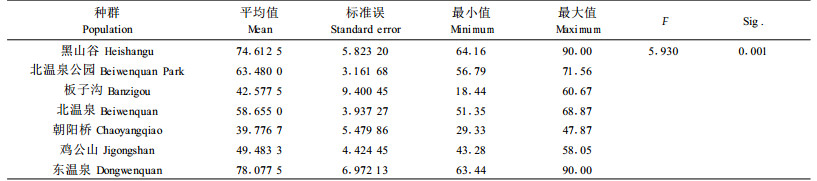
2.1 萌发率的种群间变异各种群萌发率(反正弦平方根转换后)的方差分析结果见表 3。
|
|
由Sig.值为0.001可见,缙云卫矛种子萌发率的种群间差异达到极显著水平。
2.2 种群大小对种子质量及萌发率的影响回归分析表明,种群大小与种群平均种子质量间无线性关系:r=0.12,P=0.798。
种群大小对种子萌发率变异的影响t检验结果(表 4)。由t检验的结果Sig.值0.003可见,大种群与小种群组间的种子萌发率差异达到极显著水平,表明种群间在种子萌发特性上已高度分化。
|
|
种群大小与种群种子萌发率的回归分析结果(r=0.944,P=0.001)也表明种群大小与种子萌发率之间有极显著的相关性。
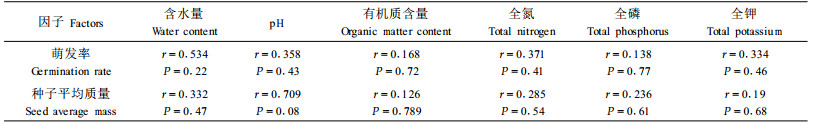
2.3 种群种子萌发率及平均质量与土壤参数间的相关性分析一般认为环境因子,特别是土壤因子对种子的萌发、幼苗的生长等生理和形态变化过程有着较大的选择性。为检验缙云卫矛7个种群的种子平均质量及萌发率是否与原生境土壤因子之间存在着一定的相关性,采用线性回归分析来检验,结果表明:土壤因子对各种群种子的萌发率及种子平均质量影响不显著(表 5)。
|
|
相关分析表明:种群种子的萌发率与种群大小显著相关,并且大种群与小种群的种子萌发差异极显著,这种差异或来自种群遗传上的原因或来自环境的因素。回归分析发现各种群的土壤因子对种群的萌发率无显著影响。气候、地形、土壤、植被等都可能影响到种群后代的变异,也许一些重要的环境因素我们没有研究到,但它们会通过母性效应(maternal carry-over effects)影响子代表现,即使它们的后代都生长在同一个环境里(Oostermeijer et al., 1994)。但母体环境条件对子代表现的影响往往发生子代生活史的早期阶段(Roach et al., 1987),而缙云卫矛种群子代生活史的早期阶段如最易受环境影响的种子质量与种群大小均无关,因此推测种子质量的变异是受遗传或环境因素或其综合作用的影响,而当把它们的种子放于同一培养箱中萌发时,萌发率又与种群大小相关,因此可以推测原来的影响种子质量变异的诸多因素此时已不占主要地位,代之以种群自身的某些原因在子代生活史表现中起主导作用。这就说明影响缙云卫矛各种群种子萌发率的主要因素并不是来自于生境条件,而是来自于种群自身,因此,缙云卫矛小种群的种子萌发率低的原因应该是主要来自于小种群自身。
张仁波等(2006)通过套袋试验发现缙云卫矛的繁育系统为自交亲和,需要传粉者,而小种群对传粉昆虫的吸引减弱(Agren,1996;Sih et al., 1987),结果小种群的个体能获得的花粉的数量及质量都不及大种群,这就导致了小种群生殖成功的花粉限制(Byers,1995;Morgan,1999)。这既影响小种群的种子产量也影响到种子的质量。另外,种群遗传学认为小种群极易发生遗传漂变导致遗传多样性降低,这个过程往往又伴随着有害突变的积累及近交衰退的加深(Ellstrand et al., 1993;Lande,1995;Lynch et al., 1995)。对于长寿命多年生植物,种群的减小(如生境片断化)带来的遗传变异的负面影响需要很长时间才能表现出来,因为种群内个体的更替速率是很低的(Schemske et al., 1994; Colling et al., 2002),但不管是长寿命的还是短寿命的植物,当种群减小时,传粉过程中花粉数量及质量都要受到很大的影响,它们的繁殖很快就会受到冲击(Kearns et al., 1998; Steffan-Dewenter et al., 1999; Ke'ry et al., 2000)。因此,对于缙云卫矛这种长寿命的木本植物,基于本研究的数据,可以说明花粉的限制及近交衰退是导致小种群种子萌发率低的一个原因。事实上,我们曾通过人工授粉试验及萌发试验也发现当人工增加授粉时,缙云卫矛的座果率可以得到显著提高,种群内异交的种子萌发率比自交的种子萌发率高得多。
缙云卫矛种群呈斑块状分布,有些种群间距离较远,这很不利于种群间的基因流。这种斑块状分布可能是通过个体扩散拓殖新的适宜生境产生,也可能是历史上发生的生境片断化引起。若是通过种群拓殖形成,则一些个体通过不合适的生境到达合适的生境是一个必需的过程,因此种子或花粉(基因流)在种群间的扩散是可以进行的并且可以持续下去,会产生低的种群间遗传分化。而历史上生境片断化形成的斑块状分布种群,个体不易通过不合适的生境,基因流是受限的,会产生高的种群间遗传分化(Ronquist, 1997;Moraes et al., 2005)。缙云卫矛大种群与小种群间萌发率的差异说明大小种群之间的基因流是不足的或中断的,否则小种群产生的种子的质量与大种群的应该不会差异太显著。因此,缙云卫矛的种群呈斑块状的分布可能是来自历史上的生境片断化,或者是一些种群是通过拓殖产生,后来又由于生境片断化导致目前种群间基因流受限。不管这种分布是如何产生的,种群萌发率的差异说明目前在大种群与小种群之间的基因流是受限的。
生境的保护尽管是任何生物多样性保护措施中最重要的一个方面(何平,2005),但对小种群来说仍不够,假如座果率及幼苗的更新速率不足以补充衰老的个体时,种群便会逐步走向灭亡,这看起来就是一个种群统计学的问题了,所以Lande(1988)提出对于小种群的保护,最迫切的是要关注并解决其种群的统计学问题,维护小种群的个体数量在有效种群大小(Ne)之上,否则小种群因为Allee效应、统计随机性、边界效应等,很易灭亡。但要长远保护这些小种群还必须加强种群遗传学的研究,加强基因流,克服近交衰退,无论是大种群还是小种群,维持一定水平的遗传多样性才是种群应对环境胁迫,适应进化的关键。所以,对缙云卫矛的保护应将种群统计学原理与种群遗传学的原理结合起来,综合实施保护对策,提高种子萌发率,促进种群更新,扩大种群,才能有效的维持这些小种群的生存发展。
邓洪平, 何平, 陈亚飞, 等. 2000. 濒危植物缙云卫矛的酯酶和超氧化物歧化酶同工酶变异的数量分析. 西南师范大学学报:自然科学版, 25(3): 288-295. |
何平. 2005. 珍稀濒危植物保护生物学. 重庆: 西南师范大学出版社, 3-4.
|
林永慧, 何平, 何兴兵, 等. 2004. 濒危植物缙云卫矛种群数量动态分析. 西南师范大学学报:自然科学版, 29(1): 109-113. |
皮广洁, 唐书源. 1989. 农业环境监测原理与应用. 成都: 成都电子科技大学出版社, 69-86.
|
汪松, 解焱. 2004. 中国物种红色名录:第1卷, 红色名录. 北京: 高等教育出版社, 315.
|
张仁波, 窦全丽, 何平, 等. 2006. 濒危植物缙云卫矛繁育系统研究. 广西植物, 26(3): 308-312. DOI:10.3969/j.issn.1000-3142.2006.03.017 |
Agren J. 1996. Population size, pollinator limitation, and seed set in the self-incompatible herb Lytbrum salicaria. Ecology, 77: 1779-1790. DOI:10.2307/2265783 |
Barbara A S, Wesley J L. 1996. Molecular variation in isolated plant populations. Plant Species Biology, 11: 33-40. DOI:10.1111/j.1442-1984.1996.tb00106.x |
Byers D L. 1995. Pollen quantity and quality as explanations for low seed set in small populations exemplified by Eupatorium (Asteraceae). American Journal of Botany, 82: 1000-1006. DOI:10.1002/j.1537-2197.1995.tb11564.x |
Colling G, Matthies D, Reckinger C. 2002. Population structure and establishment of the threatened long-lived perennial Scorzonera humillis in relation to environment. Journal of Applied Ecology, 39: 310-320. DOI:10.1046/j.1365-2664.2002.00714.x |
Crnokrak P, Roff D A. 1999. Inbreeding depression in the wild. Heredity, 83: 260-270. DOI:10.1038/sj.hdy.6885530 |
Ellstrand N C, Elam D R. 1993. Population genetic consequences of small population size: implications for plant conservation. Annual Review of Ecology and Systematics, 24: 217-243. DOI:10.1146/annurev.es.24.110193.001245 |
Groom M J. 1998. Allee effects limit population viability of an annual plant. The American Naturalist, 151: 487-496. DOI:10.1086/286135 |
Keller L F, Waller D M. 2002. Inbreeding effects in wild populations. Trends in Ecology & Evolution, 17: 230-241. |
Kearns C A, Inouye D W, Waser N M. 1998. Endangered mutualisms: the conservation of plant-pollinator interactions. Annual Review of Ecology and Systematics, 29: 83-112. DOI:10.1146/annurev.ecolsys.29.1.83 |
Ke'ry M, Matthies D, Spillmann H H. 2000. Reduced fecundity and offspring performance in small populations of the declining grassland plants Primula veris and Gentiana lutea. Journal of Ecology, 88: 17-30. DOI:10.1046/j.1365-2745.2000.00422.x |
Lande R. 1995. Risk of population extinction from fixation of new deleterious mutations. Evolution, 48: 1460-1469. |
Lande R. 1988. Genetics and demography in biological conservation. Science, 241: 1455-1460. DOI:10.1126/science.3420403 |
Lynch M, Conery J, Bürger R. 1995. Mutation accumulation and the extinction of small populations. American Naturalist, 146: 489-518. DOI:10.1086/285812 |
Menges E S, Dolan R W. 1998. Demographic viability of populations of Silene regia in Midwestern prairies: relationships with fire management, genetic variation, geographic location, population size and isolation. Journal of Ecology, 86: 63-78. |
Moraes E, M, Abreu A G, Andrade S C S, et al. 2005. Population genetic structure of two columnar cacti with a patchy distribution in eastern Brazil. Genetica, 125: 311-323. DOI:10.1007/s10709-005-0716-0 |
Morgan J W. 1999. Effects of population size on seed production and germinability in an endangered, fragmented grassland plant. Conservation Biology, 13: 266-273. DOI:10.1046/j.1523-1739.1999.013002266.x |
Oliveira E J F, Garcia J E, Contel E P B, et al. 2005. Genetic structure of Blastocerus dichotomus populations in the Paran River Basin (Brazil) based on protein variability. Biochemical Genetics, 43: 211-222. DOI:10.1007/s10528-005-5212-9 |
Oostermeijer J G B, van Eijck M W, den Nijs J C M. 1994. Offspring fitness in relation to population size and genetic variation in the rare perennial plant species Gentiana pneumonantbe (Gentianaceae). Oecologia, 97: 289-296. DOI:10.1007/BF00317317 |
Reed D H, Frankham R. 2003. Correlation between population fitness and genetic diversity. Conservation Biology, 17: 230-237. DOI:10.1046/j.1523-1739.2003.01236.x |
Roach D A, Wulff R D. 1987. Maternal effects in plants. Annual Review of Ecology and Systematics, 18: 209-235. DOI:10.1146/annurev.es.18.110187.001233 |
Ronquist F. 1997. Dispersal-vicariance analysis: a new approach to the quantification of historical biogeography. Systematic Biology, 46: 195-203. DOI:10.1093/sysbio/46.1.195 |
Schemske D W, Husband B C, Ruckelshaus M H, et al. 1994. Evaluating approaches to the conservation of rare and endangered plants. Ecology, 75: 584-606. DOI:10.2307/1941718 |
Sih A, Baltus M S. 1987. Patch size, pollinator behaviour, and pollinator limitation in catnip. Ecology, 68: 1679-1690. DOI:10.2307/1939860 |
Steffan-Dewenter I, Tscharntke T. 1999. Effects of habitat isolation on pollinator communities and seed set. Oecologia, 121: 432-440. DOI:10.1007/s004420050949 |
Vergeer P. 2003. The interacting effects of genetic variation, habitat quality and population size on performance of Succisa pratensis. Journal of Ecology, 91: 18-26. DOI:10.1046/j.1365-2745.2003.00736.x |
 2007, Vol. 43
2007, Vol. 43