文章信息
- 王慧芳, 罗承德.
- Wang Huifang, Luo Chengde.
- 2种野生岩生植物下土壤微生物生态分布研究
- Study on Ecological Distribution of Soil Microbes under Two Kinds of Petrophifle Plants
- 林业科学, 2006, 42(8): 139-143.
- Scientia Silvae Sinicae, 2006, 42(8): 139-143.
-
文章历史
- 收稿日期:2004-10-29
-
作者相关文章
2. 中国科学院水利部水土保持研究所 黄土高原土壤侵蚀与旱地农业国家重点实验室 杨凌 712100;
3. 中国科学院研究生院 北京 100101
2. State Key Laboratory of Soil Erosion and Dryland Farming of Loess Plateau Yangling 712100;
3. Graduate School of Chinese Academy of Sciences Beijing 100101
公路、铁路等道路的建设严重改变原有的景观(张翼等,2000)。尤其在我国南方,多山地丘陵,道路建设形成大量裸露的陡峭岩石边坡给绿化工作带来更大困难。岩石边坡未形成成熟土壤,坡度大,水分易流失、蒸发,一般绿化植物不能生长。选择适生于岩石边坡的野生岩生植物,是进一步解决岩石边坡植被恢复这一难题的关键。
野生岩生植物金发草(Pogonatherum panideum)和丛毛羊胡子草(Erioophorum comosum)在我国西南地区广泛分布。它们具有根系发达、耐瘠薄、耐水蚀、耐干旱,能够插入岩石缝隙或与低等生物藻类、地衣共生,形成立体绿化群落的特点。这些优越性不仅由野生岩生植物的自身生理特性决定,还与土壤-植被系统(soil vegetation system)存在的土壤微生物的数量、群落组成特点有很大关系。已有学者们认识到土壤微生物能够推进系统物质循环和能量流动,并作为分解系统的主要组成成分,分解有机质,促进养分转化;其代谢活动影响土壤形成和发育,改善土壤理化性质(陈文新等,2003)。岩石边坡这一特殊生境土壤微生物区系动态及土壤特性的研究鲜有报道。笔者对这2种岩生植物根系附近微生物特性进行研究,可以为植被护坡提供岩石边坡土壤微生物生态方面的参考。
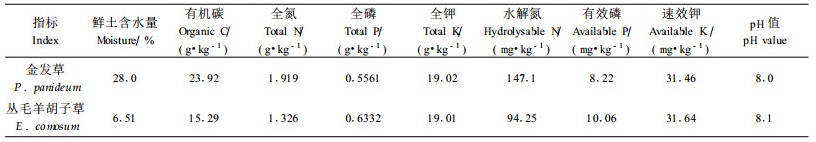
1 材料与方法 1.1 采样区自然概况采样区位于四川盆地边缘,属亚热带湿润季风气候,雨量充沛,年降雨量1 300 mm以上,降雨多集中在夏秋2季,年平均温度17.9 ℃,最高温度35 ℃,最低温度-3.3 ℃,7月最热,年无霜期长。采样点为318国道西南公路四川省雅安市猪儿嘴路段的岩石边坡。边坡因挖方形成,经十余年自然恢复达到60%以上植被盖度。边坡为内凹形,坡向为阳坡、半阳坡。阳坡土壤为泥岩和少量砂页岩风化残留物形成的岩性土和黄沙土组合。半阳坡土壤为岩层风化物和少量因苔藓丰富、滞水形成浅灰色的土壤混合。土壤正经历着原始的成土过程,土层薄,无明显的发生层次,仅表层颜色略暗。土壤状况如表 1所示。
|
|
金发草为多年生禾本科金发草属植物,在采集地坡面的半阳坡、阳坡均有分布;在半阳坡与地衣、藻类低等生物共生,阳坡比较少见,插入岩石缝隙或着生于岩石台上积累的风化物(土壤)上。丛毛羊胡子草为莎草科羊胡子属多年生草本植物,在采样地其根系着生于阳坡岩石缝隙中,在坡面上的分布与泥岩夹层走向相同。
1.3 研究方法1) 采样方法 从2003年3月上旬开始到2004年1月,隔月采集土样。在岩石坡面选择多株研究材料,以消除坡面形状、植株生长密度带来的误差;忽略金发草与丛毛羊胡子草混合生长的坡面区域。金发草吸附于水分较丰富的半阳坡,其根系与土壤形成根毡层(< 5 mm)。选择8~10株植株后,去除表面苔藓层,拔出草,将附着在根系上的土壤抖入无菌袋中,粘着在根系上的土壤连同根系约800 g样品装入无菌袋中。丛毛羊胡子草着生点土壤水分极少,根系插入岩石缝隙中很深。选10~15株植株后,拔出草,将根系上附着的土壤抖入无菌袋中;因土壤和草根多数留于缝隙中,还需用竹签轻轻磨擦根系着生处,可达缝隙深1 cm左右,共计约500 g土壤和根系装入无菌袋中。土样带回实验室,在无菌台上去除根系,立即进行土壤微生物区系分析。
2) 土壤微生物区系分析 土壤微生物采用稀释平板法测数。好气性细菌、放线菌、真菌、厌氧菌分别采用牛肉膏蛋白胨培养基、改良高氏Ⅰ号培养基、马丁孟加拉红培养基和高泽有机氮培养基培养。具体操作参照《土壤微生物研究方法》和《土壤微生物实验法》(小林达治,1983)。
3) 土壤微生物主要类群的鉴定 划线纯化后,接种到不同的培养基中,观察菌落的培养形态。将真菌分别接种到PDA、马丁孟加拉红培养基中培养、观察(魏景超,1979)。放线菌分别接种到高氏Ⅰ号培养基、葡萄糖天门冬素培养基、马铃薯块上培养、观察(阮继生,1977)。真菌、放线菌主要依据培养形态、气味、生长速度、显微特征、繁殖方式进行区分鉴定。细菌除此外,还需要进行生理生化实验(布坎南等,1984)。
2 结果与分析 2.1 土壤微生物数量动态分析金发草和丛毛羊胡子草着生点处土壤微生物数量随时间变化显著(如图 1、2)。因为2种岩生植物的生境有很大的差异,在根区土壤微生物数量的时间动态上表现了不一致性:测得采样时间金发草的土壤微生物数量均高于丛毛羊胡子草;两者土壤微生物数量的峰值出现时间分别在5月和9月,与理论推测的峰值时间相符(陈化癸等,1981)。
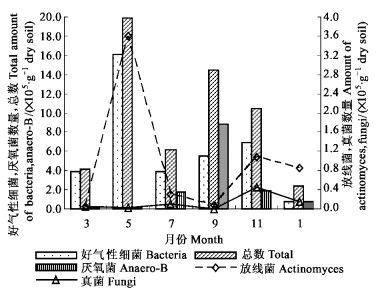
|
图 1 金发草土壤微生物数量月份变化 Fig. 1 Month distribution of soil microbes from the soil under P.panideum |
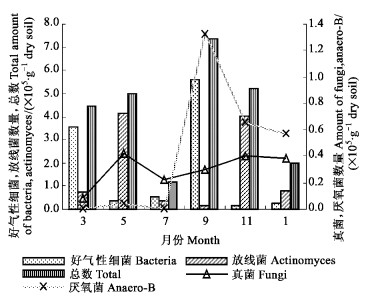
|
图 2 丛毛羊胡子草土壤微生物数量月份变化 Fig. 2 Month distribution of soil microbes from the soil under E.comocum |
从图中可知,金发草的土壤微生物在所测月份里,平均水平上,除细菌数量高于丛毛羊胡子草,培养的其他类群数量均低于丛毛羊胡子草;说明金发草根区土壤水分、养分更加适于细菌的生长繁殖。从变异系数C=S/x计算结果可知:金发草的厌氧菌变异特征最为明显,而丛毛羊胡子草的好气性细菌的数量随时间波动较其他类群大,计算变异系数最小的是丛毛羊胡子草的真菌,仅为0.43;可以看出细菌对温度、水分等环境因子的变化更为敏感。
2.2 土壤微生物组成动态分析对土壤微生物选择培养,测得2种岩生植物根区土壤微生物组成随月份同样有较大的变化:从图 3看出,好气性细菌对金发草土壤微生物总量贡献最大,在所测月份的平均比例达到微生物总数的62.25%;真菌贡献最小;除1月和9月,测定其他月份的土壤微生物组成变异相对小。与丛毛羊胡子草土壤微生物组成相比,金发草的土壤中放线菌、真菌的平均比例明显少于丛毛羊胡子草,而后者的好气性细菌数量仅在3、9月比例超过一半;同样,金发草的厌氧菌较丛毛羊胡子草的比例大(图 4)。
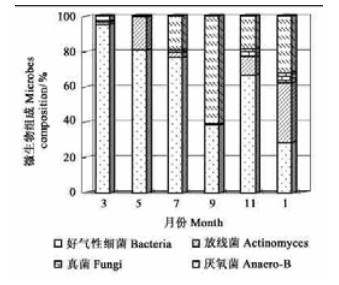
|
图 3 金发草土壤微生物组成月份变化 Fig. 3 Month composition of soil microbes under P.panideum |
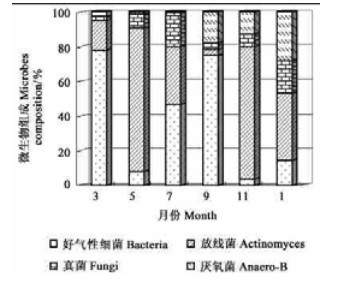
|
图 4 丛毛羊胡子草土壤微生物组成月份变化 Fig. 4 Month composition of soil microbes under E.comocum |
从培养数量组成能够看出,金发草根区土壤真菌的数量较少,因真菌菌体或生物量较大,其对土壤质量的改善、植物生长的促进仍具有不可忽视的作用,在物质转化、有机质分解、养分有效化等方面真菌起到的作用相对金发草而言,对丛毛羊胡子草的贡献大一些。从图 4可知,当丛毛羊胡子草好气性细菌数量比重少于20%,放线菌的比重将超过细菌,而且其放线菌数量平均比例达到42.19%,这一测定结果与许多学者测定的存在差异(韩景军等,1999;张崇邦等,2002),笔者认为丛毛羊胡子草生长环境的特殊性和放线菌自身生理特性导致了这种差异,在干旱贫瘠的岩石边坡土壤中,细菌失去竞争优势,适应碱性条件的放线菌对水分要求较低并可利用较难分解的物质进行繁殖,在丛毛羊胡子草的着生坡面上表现了很大的活性。
2.3 土壤微生物主要类群的时间变化对2种岩生植物土壤微生物主要类群进行鉴定,可以了解植物根区土壤微生物多样性,进一步分析土壤C、N等元素极其相关有机物质如多糖、木质素、纤维素、蛋白质、硝化物等的分解、循环过程,并从分解亚系统评价这一土壤-植被系统的稳定性(陈文新,1990)。
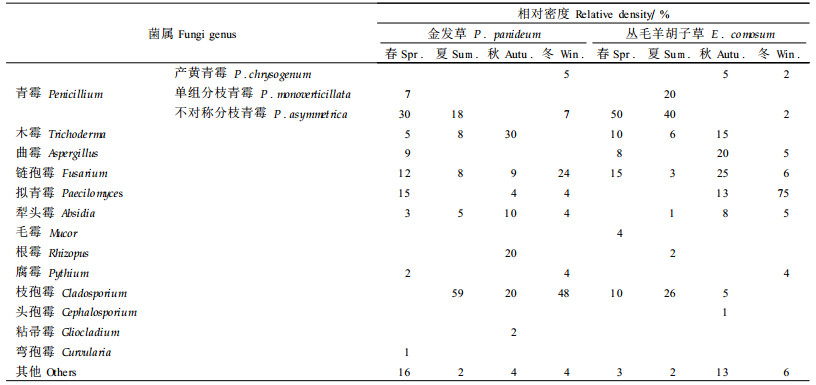
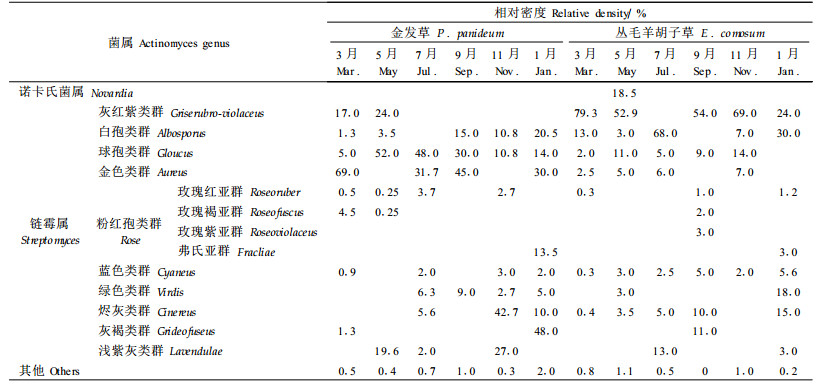
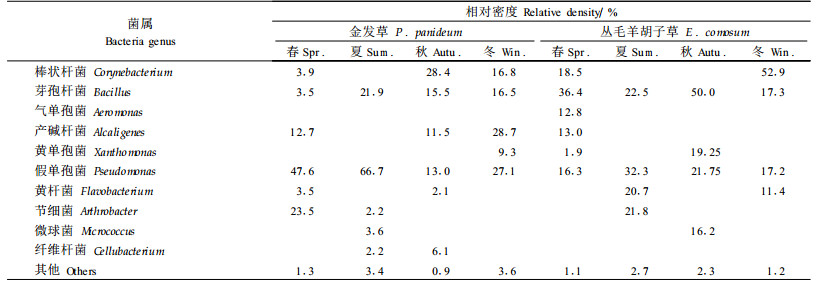
表 2、3、4分别列出从2种岩生植物根区土壤鉴定出的异养丝状真菌、异养放线菌、异养细菌的菌属及其时间变化。根据相对密度的大小可知,土壤微生物不同类群的优势菌属和次要菌属均随时间发生变化,而且2种岩石植物根区的土壤异养真菌和细菌的优势菌属在春夏季节存在相同类别。2种岩生植物的土壤异养丝状真菌分离出13个菌属,在夏秋季优势菌属的类别达到2~3个;好气性细菌共分离出10个属,冬季出现了3~4个优势菌属;放线菌的菌属仅分离出2个,为链霉菌属和诺卡氏菌属,以链霉属为优势菌,链霉属进一步分离出13个类群及亚群,与异养细菌相似,链霉属优势类群类别在冬季最多。5月在丛毛羊胡子草根区土壤中鉴定出诺卡氏属,推测此时土壤养分最为贫瘠,仅维持贫营养的细菌、真菌和耐贫瘠的放线菌类群的生存。次要菌属对环境的要求和耐受力不同,在不同季节出现的次要菌属的类别差异较大。
|
|
|
|
|
|
对所分离出的各菌群的菌株进行生化活性测定时发现,42.7%的菌株具有分泌淀粉酶、溶解淀粉的作用。53.4%的菌株能够在纤维素上生长,具有分解纤维素的能力。芽孢杆菌具有较强的抵抗外界不良环境的能力,同时它是一类氨化作用旺盛的类群,它的数量和存在状态是氨化细菌生命活动状况的特征之一(罗明等,2002)。同时,真菌、放线菌的很多种类对土壤氮分解起到很大的作用,如本试验中分离鉴定出的青霉属和曲霉属。链孢霉属、链霉菌属在有氧和适宜的温度下可以强烈的分解纤维素,不排除2种岩生植物根系附近土壤微生物中某些菌属具有较强的分解和转化有机质的能力。
3 结论与讨论本文采用常规活菌培养法对2种野生岩生植物金发草和丛毛羊胡子草根区的土壤微生物的主要类群进行了培养,将异养丝状真菌、异养放线菌和异养细菌纯化,并鉴定到属。得到了2种岩生植物根区土壤的好气性细菌、放线菌、真菌和厌氧菌数量及组成的时间变化;同时获得了土壤微生物主要类群优势菌属随季节变化的特征。鉴定过程中,对培养的土壤微生物进行生化活性测定,结果表明:50%左右微生物具有分解淀粉和纤维素的功能。2种岩生植物的根区土壤微生物的生态分布特征既表现了一般趋势也具有其特殊分布:金发草和丛毛羊胡子草土壤微生物数量分别在5月和9月达到最高值,且好气性细菌在峰值月的比重均超过70%;丛毛羊胡子草根区土壤中放线菌数量不容忽视,平均比重占到42.19%,大大超出耕作土壤及草原土壤。鉴定出的丝状真菌菌属和链霉菌类群类别丰富,均超出10个,但优势菌属少并随季节发生变化。因活菌培养条件的限制,培养出的土壤微生物的数量小于实际土壤中的数量;可能存在未培养和鉴定出的贫营养土壤微生物,它们对岩生生境的改善起到难以替代的作用。
陈华癸, 李阜隶, 陈文新, 等. 1981. 土壤微生物学. 上海:上海科学技术出版社, 5: 44-45. |
陈文新. 1990. 土壤和环境微生物学. 北京: 北京农业大学出版社, 3-8.
|
陈文新, 李阜隶, 阎章才. 2003. 我国土壤微生物学和生物固氮研究的回顾和展望. 世界科技研究与发展, 24(4): 6-12. |
韩景军, 罗菊春. 1999. 长白山北部林区云冷杉林下土壤的研究. 北京林业大学学报, 16(3): 47-50, 59. |
罗明, 单娜娜, 文启凯, 等. 2002. 几种固沙植物根际土壤微生物特性的研究. 应用与环境生物学报, 8(6): 618-622. DOI:10.3321/j.issn:1006-687X.2002.06.011 |
阮继生. 1977. 放线菌分类基础. 北京: 科学出版社.
|
小林达治.1983.土壤微生物实验.叶维青, 张维谦, 译.北京: 科学出版社, 30-117
|
魏景超. 1979. 真菌鉴定手册. 上海: 科学技术出版社.
|
张崇邦. 2002. 东北麦田土壤微生物、小型动物及其生化活性的季节动态. 植物营养与肥料学报, 8(3): 372-376. DOI:10.3321/j.issn:1008-505X.2002.03.021 |
张红忠. 1990. 微生物分类学. 上海: 复旦大学出版社, 303-366.
|
张翼, 王桂萍, 汪有科. 2000. 河南三灵高速公路水土流失特点及防治措施体系. 西北林学院学报, 15(3): 29-35. DOI:10.3969/j.issn.1001-7461.2000.03.007 |
中国科学院南京土壤研究所微生物室. 1985. 土壤微生物研究. 北京: 科学出版社, 40-47.
|
中国科学院微生物研究所放线菌分类室.1975.链霉菌的鉴定.北京: 科学出版社
|
布坎南R E, 吉本斯N E.1984.伯杰细菌鉴定手册.8版.中国科学院微生物所, 译.北京: 科学出版社
|
 2006, Vol. 42
2006, Vol. 42