文章信息
- 刘丹, 顾万春, 杨传平.
- Liu Dan, Gu Wanchun, Yang Chuanping.
- 中国鹅掌楸遗传多样性研究
- Genetic Diversity of Liriodendron chinense in China
- 林业科学, 2006, 42(2): 116-119.
- Scientia Silvae Sinicae, 2006, 42(2): 116-119.
-
文章历史
- 收稿日期:2004-09-28
-
作者相关文章
2. 中国林业科学研究院林业研究所 北京 100091;
3. 东北林业大学 哈尔滨 150040
2. Research Institute of Forest, CAF Beijing 100091;
3. Northeast Forestry University Harbin 150040
鹅掌楸属(Liriodendron)为古老残遗双种属植物,该属植物在第三纪曾广布于北半球。由于第四纪冰川的压力,现存于中国的鹅掌楸(L. chinense)处于濒危状态,急需保护。中国鹅掌楸星散分布于长江流域以南海拔450~1 800 m的阔叶林中(方炎明, 1994;郝明日等, 1995),是优质速生的工业用材树种和园林绿化树种,是我国二级重点保护的濒危树种。据初步研究,中国鹅掌楸因其星散间断分布型式、群体规模较小、群体结构的衰退趋势和对生境的特定要求,该物种正处在濒危状态(贺善安等, 1999)。因此,对中国鹅掌楸进行遗传多样性的研究进而加以保护利用势在必行。Parks等、朱晓琴等分别进行了鹅掌楸和北美鹅掌楸的等位酶分析(Parks et al., 1990;Parks, 1994;朱晓琴等,1995;1997)。近年来,RAPD分子标记技术广泛应用于生命科学的许多领域(邹喻苹, 1995),也成功地用于鹅掌楸花粉流标记(黄双全等, 1998)和检测鹅掌楸属种间杂交的花粉污染(李周岐等, 2001),并逐渐应用于鹅掌楸属的遗传学研究上(罗光佐等, 2000;李周岐等, 2002a)。本研究运用群体遗传学原理及RAPD分子标记技术,从DNA分子水平上揭示中国鹅掌楸的群体遗传多样性及变异规律等,为中国鹅掌楸遗传资源保存、测定、评价和育种利用提供依据。
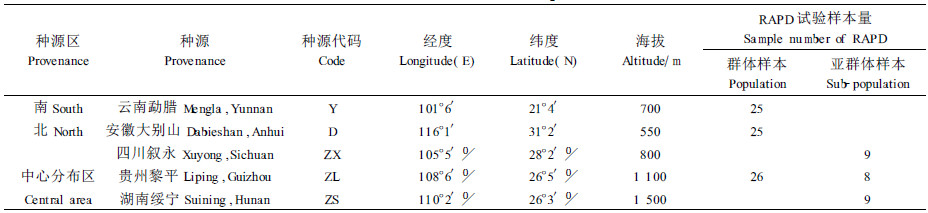
本项研究是在对中国鹅掌楸15个种源试验林的表型区划结果(李斌等,2001a)与天然分布区生态梯度(EGA)划分(顾万春,2004)基础上追加的分子水平的验证性研究。根据中国鹅掌楸天然林保护的客观现状,中部天然群体保存较多,南北现实群体保存较少。故把取样分布区划分成南、北、中3个大区。从早期研究的表型性状上来看,验证了3个分区差异的显著性。本研究通过RAPD分子标记手段,来证明3个分区的真实差异。
1 材料与方法 1.1 试验材料材料取自中国林业科学研究院在江西大岗山营建的鹅掌楸种源试验林(李斌等, 2001a),鹅掌楸的主要分布区的南部、北部、中心种源区各自成为一个群体。南北种源区各1个种源,分别为云南勐腊、安徽大别山,每个种源均随机抽样25株。中心种源区包括3个亚群体(种源),由四川叙永、贵州黎平、湖南绥宁3个种源组成,由于中部3个亚群体表型相似性较近,对中部群体取权重估算后用于评价。为了防止因样本大小产生的遗传漂变,中心分布区的3个亚群体均衡抽样合计26个个体。共有76个样本参试。这样统分为北、中、南3个群体的遗传多样性评价有助于对中国鹅掌楸生态梯度区划与表型区划结果的验证。从每株样木树干中、上部枝条上采集健壮、饱满、无病虫害的顶芽10~15个。
|
|
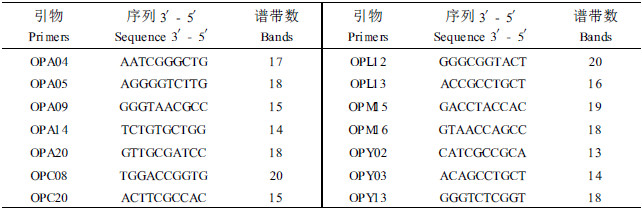
用中国科学院遗传与发育生物学研究所的试验用材料《分子生物学基础实验》中改进的CTAB法提取鹅掌楸新鲜休眠芽中的DNA(Yan et al., 1997)。用OPA、OPC、OPM、OPL、OPY组,共70个寡核苷酸引物(购自Sangon公司),分别扩增来自3个群体的鹅掌楸样品,共31个引物可扩增出多态性,从中再精选出扩增强、重复性好、多态性高的14个引物(序列见表 2), 进行RAPD分析。
|
|
RAPD反应在Idoho公司1818型气浴式毛细管PCR仪上进行。采用10 μL反应体系,其中含约5 ng模板DNA,1.2 mmol·L-1 10碱基引物,50 mmo l·L-1 Tris-HCl,2 mmol·L-1 MgCl2,200 μmol·L-1 dNTP(dA TP, dCTP, dGTP, dTTP),以及0.5 g·L-1 BSA,1% Ficoll 400,1 mmol·L-1酒石黄,0.5 unit Taq DNA聚合酶(购自中国农业大学)。扩增程序为,预扩增2个循环94 ℃变性60 s,35 ℃退火10 s,72 ℃延伸20 s;正式反应40个循环94 ℃变性2 s,35 ℃退火10 s,72 ℃延伸70 s,最后72 ℃延伸4 min。PCR扩增反应结束后,在1.5%的琼脂糖凝胶(EB染色)中电泳3 h(电压为4 V·cm-1),FOTODYNE型投射紫外灯上照相,记录结果。
1.4 随机扩增产物的检测与统计分析RAPD扩增条带用“0”代表“无”、“1”代表“有”进行统计分析,条带的大小范围为200 ~1 800 bp。把统计出的0-1矩阵,输入RAPDistance软件,统计遗传多样性水平。与AMOVA (Analysis Molecular of Variation)分析软件连用(张富民等,2002),分析群体遗传结构、遗传变异在群体间和群体内的分布(%),同时计算遗传距离(D)。
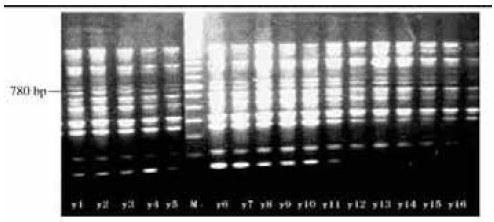
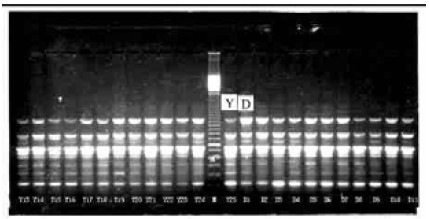
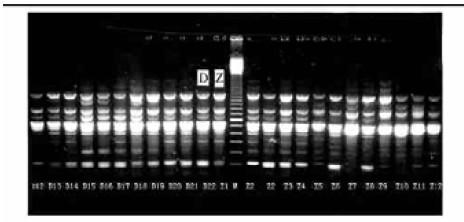
2 结果与分析 2.1 扩增结果引物C08对云南勐腊群体扩增的结果(图 1),显示在780 bp位点上为鹅掌楸云南群体特异性条带。引物A09扩增出的多个多态位点,示中国鹅掌楸群体分化。用代码Y、D、Z分别代表云南、安徽、中心群体,每图最中间为位点标识Marker(图 2,图 3)。
|
图 1 引物C08:780 bp位点示鹅掌楸云南群体特异性条带 Fig. 1 The special band of Yunnan sample amplified with primer C08 |
|
图 2 引物A09:云南和安徽群体的多个多态位点 Fig. 2 RAPD fragments showing genetic diversity of Yunnan and Anhui sample amplified with primer A09 |
|
图 3 引物A09:大别山和中心群体的多个多态位点示鹅掌楸群体分化 Fig. 3 Several polymorphic bands of Dabieshan and Central sample amplified with primer A09 showing genetic diversity of L. chinense |
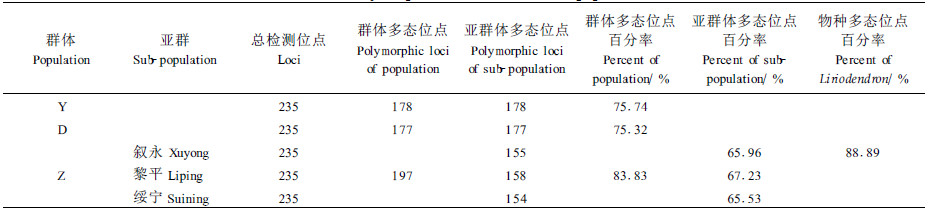
中国鹅掌楸的3个代表群体(云南、安徽、中心分布区)的RAPD分析表明,3个群体的遗传分化明显。群体间占33.03%,群体内占66.97%。遗传多态位点百分率(P)由大到小排序为Z、Y、D;中心群体的多态位点百分率为83.83%,南北两端群体的多态性低,分别为75.74%和75.32%。从物种水平来看,鹅掌楸的多态位点百分率为88.89%(表 3)。
|
|
对中心群体(Z)的亚群体进一步分析得到:中心群体内部的3个亚群体的多态性相对较低,分别为65.96%,67.23%,65.53%,但3个种源联合组成一个群体后多态位点百分率升高为83.83%(表 3)。
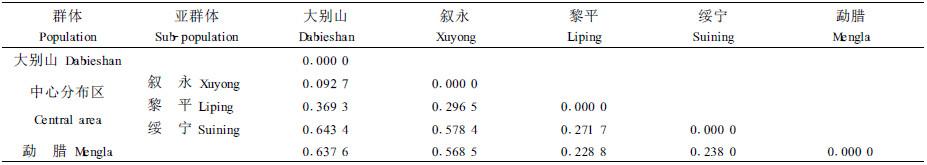
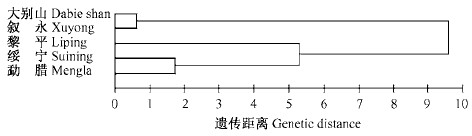
利用RAPDdistance软件和AMOVA软件分析0-1矩阵图时还得到另一组很有意义的数据, 就是群体间的遗传距离矩阵(表 4), 对这组数据深入分析就可以得到群体间直观的距离关系。采用系统聚类最短距离法算得遗传距离的聚类分析结果(图 4),表明鹅掌楸的大别山和叙永种源(纬度偏高,北部种源)合并成第1类,平方距离为0.617 106,说明遗传距离最近;绥宁和勐腊种源合并成第2类, 平方距离为1.718 809,说明这2个种源的遗传距离较近;黎平与绥宁和勐腊种源合并成第3类, 平方距离为5.290 028,说明这3个种源(纬度偏低,南部种源)遗传距离相对较近。可见,从分子水平上测得的遗传距离基本上和各种源的纬度分布相关。
|
|
|
图 4 遗传距离的聚类分析结果 Fig. 4 Dendrogram of 3 populations of L.chinense |
以中国鹅掌楸芽DNA为模板,利用RAPD实验技术获得DNA水平的遗传多样性,精选出14个多态性强、重复性好的引物,从76个个体中检测到235个位点,其中178个为多态位点。
鹅掌楸的RAPD分析,进一步从分子水平上证实了鹅掌楸这一物种确实存在着丰富的基因资源,遗传多样性很高:鹅掌楸群体间遗传变异分量平均占33.03%,群体内占66.97%。鹅掌楸3个群体云南、中心分布区、安徽的多态位点百分率分别为75.74%,83.83%,75.32%,总多态位点百分率为88.98%。这些数据与朱晓琴等(1995)利用等位酶分析得到的鹅掌楸遗传规律“种内遗传变异的20.6%分布在群体间,79.4%分布在群体内”大致相符;与罗光佐等(2000)利用RAPD技术得到的“鹅掌楸的遗传变异主要存在于地理种源内”结论大致相符;与李斌等(2001b)从鹅掌楸材性遗传变异角度,揭示的“种内差异是鹅掌楸属的主要变异来源,种内种源间存在选择的遗传基础”等研究结果表现出较好的一致性。表明鹅掌楸的变异主要分布在群体内的个体间,说明群体内选优的潜力很大。
从中国鹅掌楸群体及亚群体遗传距离矩阵数值分析得到,安徽大别山与云南勐腊遗传距离最大,达0.637 6;中心分布区3个亚群体之间遗传距离较为相近,数值为0.269 5~0.578 4;南部群体云南勐腊与中心分布区3个亚群体间遗传距离变幅在0.238 0~0.568 0。其结果与种源地理分布纬度有很好的一致性。
等位酶研究(Parks et al., 1990; Parks,1994)和本次RAPD研究的结果都表明中国鹅掌楸存在着广泛而丰富的遗传变异,但为什么又处于濒危状态?许多研究分别从不同角度进行了论证,比如,贺善安等(1999)认为是生殖上隔离和濒危生态造成鹅掌楸日趋濒危,那么,如何挖掘自身广泛的遗传资源,还有许多问题有待探讨。
方炎明. 1994. 中国鹅掌楸的地理分布和空间格局. 南京林业大学学报, 18(2): 13-18. |
顾万春著.2004.统计遗传学.北京:科学出版社
|
郝明日, 贺善安, 汤诗杰, 等. 1995. 鹅掌楸在中国的自然分布及其特点. 植物资源与环境, 4(1): 1-6. |
贺善安, 郝明日. 1999. 中国鹅掌楸自然种群动态及其致危生境的研究. 植物生态学报, 23(1): 87-95. DOI:10.3321/j.issn:1005-264X.1999.01.012 |
黄双全, 郭友好, 陈家宽, 等. 1998. 用RAPD方法初探鹅掌楸的花粉流. 科学通报, 43(14): 1517-1519. DOI:10.3321/j.issn:0023-074X.1998.14.016 |
李斌, 顾万春, 夏良放, 等. 2001a. 鹅掌楸种源遗传变异和选择评价. 林业科学研究, 14(3): 237-244. |
李斌, 顾万春, 夏良放, 等. 2001b. 鹅掌楸种源材性遗传变异和选择. 林业科学, 37(2): 42-50. |
李周岐, 王章荣. 2001. 用RAPD标记检测鹅掌楸种间杂交的花粉污染. 植物学报, 43(12): 1271-1274. DOI:10.3321/j.issn:1672-9072.2001.12.012 |
李周岐, 王章荣. 2002a. RAPD标记在鹅掌楸属中的遗传研究. 林业科学, 38(1): 150-153. |
李周岐, 王章荣. 2002b. 用RAPD标记进行鹅掌楸杂种识别和亲本选配. 林业科学, 38(5): 169-174. |
罗光佐, 施季森, 尹佟明, 等. 2000. 利用RAPD标记分析北美鹅掌楸与鹅掌楸种间遗传多样性. 植物资源与环境学报, 9(2): 9-13. DOI:10.3969/j.issn.1674-7895.2000.02.003 |
张富民, 葛颂. 2002. 群体遗传学研究中的数据处理方法Ⅰ:RAPD数据的AMOVA分析. 生物多样性, 10(4): 438-444. DOI:10.3321/j.issn:1005-0094.2002.04.012 |
朱晓琴, 贺善安, 姚青菊. 1997. 鹅掌楸群体遗传结构及其保护对策. 植物资源与环境, 6(4): 7-14. |
朱晓琴, 马建霞, 姚青菊, 等. 1995. 鹅掌楸(Liriodendron chinense)遗传多样性的等位酶论证. 植物资源与环境, 4(3): 9-14. |
邹喻苹. 1995. RAPD分子标记简介. 生物多样性, 3(2): 104-108. DOI:10.3321/j.issn:1005-0094.1995.02.010 |
Parks C R, Wendel N G, Wendel J F, et al. 1990. Genetic control of isozyme variation in the genus Liriodendron (Magnolianceae). The Journal of Heredity, 81(4): 317-323. DOI:10.1093/oxfordjournals.jhered.a110996 |
Parks C R. 1994. The significance of allozyme variation and introgression in the Liriodendron tulipifera complex (Magnoliaceae). American Journal of Botany, 81(7): 878-889. DOI:10.1002/j.1537-2197.1994.tb15569.x |
Yan H J, Dai S L, Wu N H. 1997. RAPD analysis of natural populations of Acanthopanax brachypus. Cell Research, (7): 97-106. |
 2006, Vol. 42
2006, Vol. 42