文章信息
- 张海英, 韩涛, 王有年, 李丽萍, 于同泉.
- Zhang Haiying, Han Tao, Wang Younian, Li Liping, Yu Tongquan.
- 水杨酸对采后桃果实脂氧合酶及相关指标的影响
- Effect of Exogenous Salicylic Acid on Some Parameters of Cell Membrane in Postharvest Prunus persica Fruits
- 林业科学, 2005, 41(3): 182-185.
- Scientia Silvae Sinicae, 2005, 41(3): 182-185.
-
文章历史
- 收稿日期:2003-10-27
-
作者相关文章
水杨酸(salicylic acid,SA)是一种植物体内产生的简单酚类化合物,广泛存在于高等植物中。已发现,外源施用SA可诱导某些植物开花和产热,诱导烟草和黄瓜等植物对病毒、真菌及细菌等病害的抗性,Raskin(1992)提出SA可以被看作是一种新的植物内源激素,其作用和机制受到人们的关注。外源SA处理对园艺产品采后的作用研究还较少,仍有许多问题尚待探讨。
本试验以2个不同品种的桃果实为试材,研究了SA处理后果肉组织脂氧合酶活性以及其他相关指标的变化,并测定了果肉的硬度,为进一步探讨桃果实采后成熟衰老机制,改进现有贮藏方式提供理论依据。
1 材料与方法 1.1 试验材料试材为桃(Prunus persica)中熟品种“大久保”(cv. Dajiubao)、晚熟品种“八月脆”(cv. Bayuecui),均采自北京昌平果园。选果面平展丰满,果实充分发育,绿色开始转淡(俗称发白,有色桃阳面着色),茸毛减少,八成熟的桃。“大久保”果肉硬度大于15 kg·cm-2,“八月脆”果肉硬度大于13 kg·cm-2,挑选无机械伤、无病虫害且质量在200~300 g的果实。
1.2 果实处理用0.1 g·L-1和0.3 g·L-1的水杨酸(SA)浸泡果实15 min,以水浸为对照(CK),自然晾干,放入纸箱中,于室温(22~25 ℃)和低温(0~2 ℃)贮藏。
1.3 指标测定贮藏期间室温下每隔1~2 d取样一次,低温条件下每隔5~6 d取样一次,每次每个处理随机取7个果实进行测定。果肉硬度用GY-1型硬度计测定; 细胞膜透性以果肉中钾离子渗出率表示,采用火焰光度法测定(谭常等,1985); 脂氧合酶(LOX)活性按Axelord等(1981)的方法测定; 细胞膜脂质过氧化物丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)比色法(王爱国等,1986)。
采用SAS统计软件处理数据,结果以平均值±SE表示。
2 结果与分析 2.1 外源SA处理对不同品种桃采后脂氧合酶(LOX)活性的影响在室温条件下2个不同品种桃果实中LOX活性变化趋势不同。“大久保”桃LOX活性在前4天升高,以后下降,在第10天出现高峰,呈先上升后下降的趋势; 而“八月脆”桃LOX活性则在前4天下降,以后变化不大,略有上升趋势,整体来看,“八月脆”LOX在整个贮藏期一直低于“大久保”。可见,桃采后LOX活性的品种间差异较大(图 1A、B)。
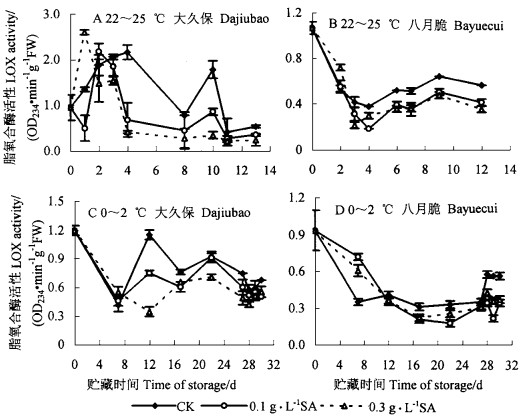
|
图 1 SA处理后桃果实在室温(22~25 ℃)和冷藏期间(0~2 ℃)脂氧合酶活性的变化 Fig. 1 The changes of LOX activity of P.persica fruits treated with SA stored at 22~25 ℃ and 0~2 ℃ |
SA处理能明显降低2个品种果实在室温下4 d后的LOX活性(p < 0.05);但不同浓度SA处理果实间的差异随品种而不同,0.3 g·L-1 SA处理的果实中LOX活性在4 d后几乎一直明显低于0.1 g·L-1 SA处理的果实; 而对“八月脆”桃,这种差异并不显著。
与室温下情况相似,冷藏条件下果实的LOX活性变化趋势在不同品种的表现不同,“大久保”的LOX活性较大,且先下降后又出现高峰; 而“八月脆”则直线下降,与室温下的表现一致,“八月脆”的LOX活性大大低于“大久保”的。SA处理果实在贮藏第12天(“大久保”)或第17天后(“八月脆”),LOX几乎一直显著低于对照,但2种浓度SA处理的果实间无明显差异(图 1C、D):这可能与低温有关。
总之,无论是在室温还是在冷藏条件下,SA处理均能在贮藏一定时间后有效抑制2个品种桃果实中的LOX活性。
2.2 外源SA处理对不同品种桃采后丙二醛(MDA)含量的影响在室温条件下2个品种桃果实中MDA含量的变化虽有较大波动,但变化趋势基本与果实中LOX活性的变化趋势相同,只是在变化的时间和幅度上存在一定差异; 冷藏条件下桃果实中MDA含量呈上升趋势(“大久保”)或基本上平稳变化(“八月脆”)。一般认为MDA是由LOX活性催化膜脂过氧化产物,LOX活性的降低将导致MDA含量降低。本试验中SA处理已经表现出在数值上降低果实在室温下MDA的积累,并与LOX的变化趋势一致,但经统计分析后,除了0.3 g·L-1 SA处理的“大久保”桃果实外[该处理的LOX活性受到的抑制最大(图 1A、B)],其他处理并不显著(p>0.05)(图 2A、B)。SA处理虽也能降低果实中MDA含量,但差异不明显(图 2C、D)。说明生物体内物质代谢是动态的,复杂的,可能只有LOX活性的变化值到一定的程度,才能使MDA的含量出现明显差异。
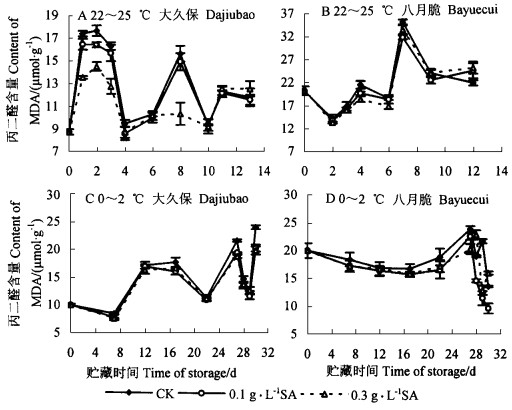
|
图 2 SA处理后桃果实在室温(22~25 ℃)和冷藏期间(0~2 ℃)丙二醛含量的变化 Fig. 2 The changes of MDA content in P.persica fruits treated with SA stored at 22~25 ℃ and 0~2 ℃ |
2个不同品种桃采后在室温后熟期间,果肉细胞膜电解质渗出率均增加,在贮藏的前3天增加速度很快,呈直线上升(细胞膜电解质渗出率随贮藏时间的变化值“大久保”为11.041,R2=0.993;“八月脆”为11.204,R2=0.951),而后趋于平缓(细胞膜电解质渗出率随贮藏时间的变化值“大久保”为2.083,R2=0.865;“八月脆”为1.277,R2=0.469),显示出2个明显不同的上升阶段(图 3A、B)。SA处理桃果实的电解质渗出率在贮藏期间的变化基本与对照相似,但在贮藏6 d后明显高于对照(p < 0.05)(图 3A、B)。室温条件下,SA处理后电解质渗出率在4 d后高于对照,该结果与SA处理后其他指标的变化不相符,其原因有待探讨。
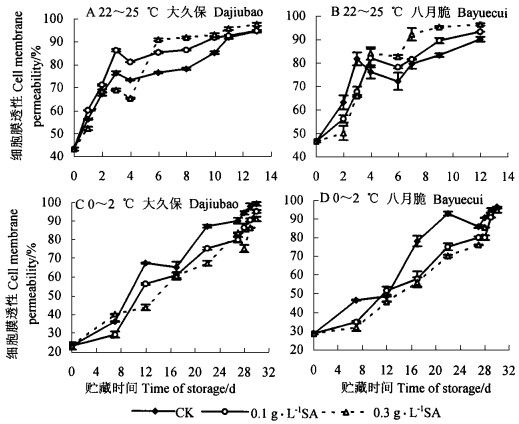
|
图 3 SA处理后桃果实在室温(22~25 ℃)和冷藏期间(0~2 ℃)膜透性的变化 Fig. 3 The changes of cell membrane permeability of P.persica fruits treated with SA stored at 22~25 ℃ and 0~2 ℃ |
在冷藏条件下2个品种桃果实的细胞膜电解质渗出率呈均匀的上升趋势,细胞膜电解质渗出率随贮藏时间的变化值“大久保”为2.529,R2=0.958 7, “八月脆”仅为2.278,R2=0.927;表现出品种间小有差异(图 3C、D)。SA处理桃果实的电解质渗出率在贮藏期间几乎一直明显低于对照(p < 0.05),以0.3 g·L-1SA处理的更低一些(图 3C、D)。
2.4 外源SA处理对不同品种桃的果实硬度的影响在室温下,2个品种桃果实均很快变软。“大久保”桃硬度下降较“八月脆”快,且下降幅度大,表明晚熟品种较耐贮藏。SA处理后2个品种的果实硬度平均值在前4天略低于对照,7 d后,处理果实的硬度表现出高于对照的趋势,统计分析表明,在α=0.05水平上差异不显著,这可能是果实个体差异造成的。依品种的不同,“大久保”以0.3 g·L-1 SA处理的果实硬度略高,“八月脆”则以0.1 g·L-1SA处理的略高(图 4A、B)。
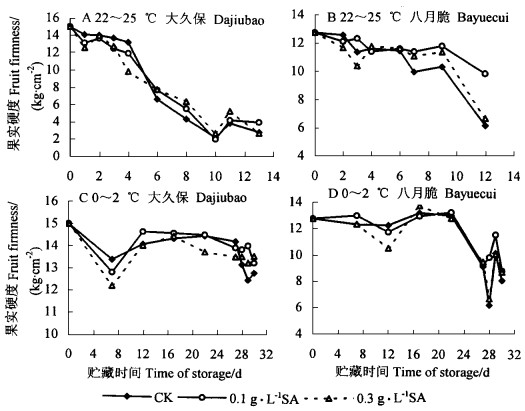
|
图 4 SA处理后桃果实在室温(22~25 ℃)和冷藏期间(0~2 ℃)期间硬度的变化 Fig. 4 The changes of firmness of P.persica fruits treated with SA stored at 22~25 ℃ and 0~2 ℃ |
在0~2 ℃冷藏期间,果实硬度总的变化趋势较室温下缓慢。“大久保”桃在贮藏前期硬度下降比“八月脆”快,随着贮藏期的延长,“大久保”桃硬度下降速度低于“八月脆”(图 4C、D)。SA处理果实的硬度变化和室温条件下变化基本一致,差异也不显著。总体来看,SA处理对桃果实有保硬作用。
3 结论细胞膜的降解是组织衰老的主要特征之一,由于细胞内膜系统遭破坏,导致组织结构和细胞区域化的丧失,最后致使细胞内部平衡失调和功能丧失(Paliyath et al., 1984)。衰老中膜损伤的重要原因之一是磷脂的降解,磷脂的损失是一系列酶分解造成的,其中LOX是使磷脂损失的一种重要的酶(李丽萍等,2002)。
本试验的结果表明,不同品种采后LOX活性大小和变化趋势不同,在室温和低温下,“八月脆”果实的LOX活性均不断下降,且大大低于“大久保”桃,可见LOX活性低的果实耐贮藏性强。李丽萍等(2000)在试验中也观察到SA处理对保持室温0 ℃贮藏期间“大久保”桃的硬度有益。
本试验还首次观察到2个不同品种桃在采后室温后熟期间果肉细胞膜电解质渗出率的增加分为2个明显不同的阶段,第1阶段较快,第2阶段相对慢得多; 但在低温贮藏下则没有这种差别,原因尚待查明。
SA处理对果实的保硬作用在室温下比低温下明显,对果实LOX活性抑制作用与品种和处理浓度有关,对果实细胞膜透性的抑制作用在低温下明显,而室温下4 d后膜透性反而大于对照,其原因还有待探讨。可见,SA处理对果实的作用依品种、贮藏温度、处理浓度的不同而有差异,且SA处理对果实的影响也是复杂的,在具体应用时要将处理方式同贮藏方式结合,并选择合适的应用对象是非常重要的。
韩涛, 李丽萍, 王有年, 等. 2002. 水杨酸处理对桃采后园艺产品的作用. 植物学通报, 19(5): 560-566. DOI:10.3969/j.issn.1674-3466.2002.05.007 |
李丽萍, 韩涛.2002.果实采后的某些生理变化及其调控.见: 彭永宏, 王锋主编.现代果树科学的理论与技术.广州: 广东科技出版社, 361-387
|
李丽萍, 韩涛. 2000. 水杨酸对大久保桃贮藏期品质的影响. 果树科学, 17(2): 97-100. DOI:10.3969/j.issn.1009-9980.2000.02.004 |
谭常, 杨惠东, 余叔文. 1985. 植物生理学手册. 上海: 上海科学技术出版社, 67-70.
|
王爱国, 邵从本, 罗广华. 1986. 丙二醛作为植物脂质过氧化指标的探讨. 植物生理学通讯, (2): 55-57. |
Axelord B, Cheesbrough T M, Leakso S. 1981. Lipoxygenase from soybeans. Methods in Enzymology, 7: 443-451. |
Paliyath G, Poovaiah B W, Munsake G R. 1984. Membrane fluidity in senescencing apples. Plant cell Physiol, 25: 1083-1087. |
Raskin I. 1992. Salicylic acid in plants. Annu Rev Plant Mol Biol, 43: 439-463. DOI:10.1146/annurev.pp.43.060192.002255 |
 2005, Vol. 41
2005, Vol. 41

