文章信息
- 肖祥希.
- Xiao Xiangxi.
- 龙眼幼苗铝吸收特性的研究
- Characteristics of Aluminum absorption by Longan (Dimocarpus longan) seedlings
- 林业科学, 2005, 41(3): 43-47.
- Scientia Silvae Sinicae, 2005, 41(3): 43-47.
-
文章历史
- 收稿日期:2004-05-11
-
作者相关文章
铝是地壳中含量最高的金属元素,占地壳质量的7.1%(臧小平,1997)。我国酸性土壤遍及南方15个省(区),总面积为2 030万hm2,约占全国土地面积的21%,铝毒害是限制植物在酸性土壤上生长的主要因子(李庆逵,1983;刘东华等,1995;黄邦全等,2001)。龙眼(Dimocarpus longan)果园土壤大都富含活性铝,本研究以龙眼为材料研究铝吸收特性,旨在为生产上矫治铝毒提供依据。
1 材料与方法 1.1 材料供试的材料为龙眼品种“乌龙岭”实生苗,苗龄为9个月。试验于2001年7月13日实施,实施之前苗木从圃地移到营养液中恢复培养1个月,在去离子水中饥饿5 d,营养液采用王仁玑等(1981)的配方。
1.2 处理 1.2.1 不同铝浓度对龙眼铝吸收的影响1) 不同铝浓度对铝吸收速率的影响 培养液铝浓度设置0(CK,为蒸馏水)、0.037、0.074、0.111、0.185、0.296、0.370、0.555、0.740、1.111、1.852、2.963、3.703 mmol·L-1共13个处理,铝源采用AlCl3·6H2O,3次重复,在2 L吸收液中培养3株苗,每个处理共9株苗,置于NK System Biotron(LH-200-RD)人工气候箱中(25±0.5 ℃),光照(7 000 lx)培养4 h后取出苗木补充去离子水至2 L(用称重法),采用Hitachi-3210分光光度计,用比色法(LY/T1270-1999)测定铝浓度,计算铝吸收速率(μmol·plant-1h-1)。根据Michaelis-Menten双倒数方程(1/V=Km/Vmax×1/C+1/Vmax,式中V为铝吸收速率,Vmax为最大速率,C为供铝浓度,Km为铝吸收速率达到0.5Vmax时的供铝浓度),计算Km和Vmax值(沈同等,1985)。2)铝吸收量动态变化 吸收液铝浓度设置为0.740 mmol·L-1,在2 L吸收液中培养3株苗,9:00—18:00每隔1 h测定铝浓度,并计算铝吸收量,重复3次。3)铝吸收速率动态变化 吸收液铝浓度设置为0.740 mmol·L-1,在2 L吸收液中培养3株苗,经过1 h后,测定吸收液铝浓度,然后换新的同样浓度吸收液培养测定,时间9:00—18:00,重复3次。4)代谢抑制剂2, 4-DNP对铝吸收的影响 铝浓度为0.037、0.185、0.370、0.740、1.852 mmol·L-1,2, 4-DNP设置0、2 mmol·L-12种处理,在2 L吸收液中培养3株苗,处理9 h(9:00—18:00)。吸收试验结束后,测定吸收液铝浓度,计算铝吸收速率(μmol·plant-1h-1),重复3次。
1.2.2 不同供铝浓度对龙眼幼苗体内铝分布的影响1) 幼苗各器官铝含量测定 苗木培养和铝胁迫处理与肖祥希等(2002)相同,营养液(包括CK)用自来水配制而成。结合生物量调查,分根、茎、叶采样,样品经70 ℃烘干后粉碎,供铝含量、营养元素含量、有机酸和糖等测定。铝含量测定采用硝酸-高氯酸消煮铝试剂比色法(LY/T1270-1999)。试验重复3次。2)幼苗细胞各部位铝含量测定 苗木培养和铝胁迫处理与肖祥希等(2002)相同,在苗木胁迫3个月后采集各处理新鲜叶样用0.1 mol·L-1 Tris-HCl缓冲液研磨成匀浆(pH=7.5),用低温(4 ℃)分级离心分离各组分,200 g离心2 min沉淀为细胞壁及未破碎的残渣(D1),上清液1 000 g离心3 min沉淀为叶绿体为主的成分(D2),上清液10 000 g离心30 min沉淀为线粒体为主的成分(D3),上清液100 000 g离心120 min沉淀为核蛋白成分(D4),最后上清液为可溶性组分(D5)。各组分沉淀用1 mol·L-1KCl浸提,用铝试剂比色法测定铝含量,重复3次。
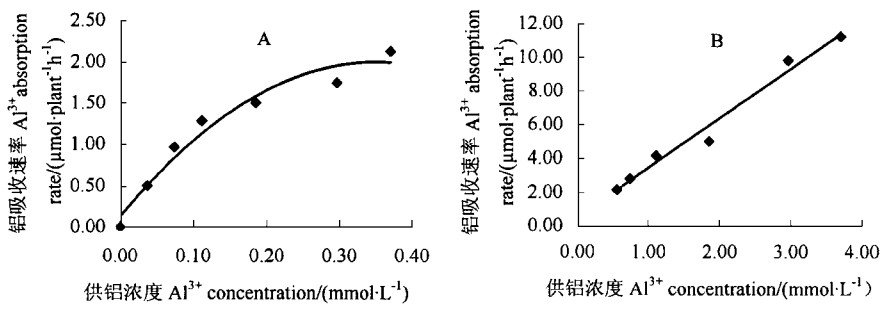
2 结果 2.1 铝的吸收方式在供试的0~3.703 mmol·L-1铝浓度范围内,龙眼对铝的吸收表现出2条不同的特征曲线(图 1)。供铝浓度在0~0.370 mmol·L-1,铝吸收表现为抛物线[y(吸收速率)=-15.296x2(铝浓度)+10.69x+0.129 6,r=-0.98**],铝吸收速率随供铝浓度的增加而增加,到0.370 mmol·L-1 时铝吸收趋于饱和,铝吸收速率与供铝浓度间的关系符合Michaelis-Menten酶动力学方程(Km=0.093 5,Vmax=1.991 μmol·plant-1h-1); 而供铝浓度升高到0.370~3.703 mmol·L-1时,龙眼铝吸收速率与供铝浓度之间呈直线相关[y(吸收速率)=2.937 8x(铝浓度)+0.506 8,r=0.99**]。根据离子主动吸收符合Michaelis-Menten酶动力学原理(韩振海等,1994),可以认为,介质铝浓度低于0.370 mmol·L-1,龙眼铝吸收主要受代谢控制,即为主动吸收; 介质浓度大于0.370 mmol·L-1,则主要受非代谢因素影响,即为被动扩散。
|
图 1 供铝浓度对龙眼Al3+吸收速率的影响 Fig. 1 Effect of Al3+ concentration on Al3+ absorption rate of Longan |
在供铝浓度0.740 mmol·L-1连续培养下,在一定的培养时间内,龙眼幼苗铝吸收量随时间推移而增加,但增加幅度随时间推移而减少(图 2A),在0~5 h内增幅较大,5 h以后,铝的吸收渐趋于饱和;但龙眼铝吸收速率随时间的推移而下降(图 2B),在0~5 h下降幅度较大,5 h后下降趋缓。这种规律与铝吸收量随时间的动态相吻合。龙眼铝吸收呈现这种规律可能与植株-介质之间的铝浓度差有关,即随时间的推移,植株体内铝浓度增加,内外界铝浓度差减小所致。铝吸收速率随时间的动态变化也证明了这一点。
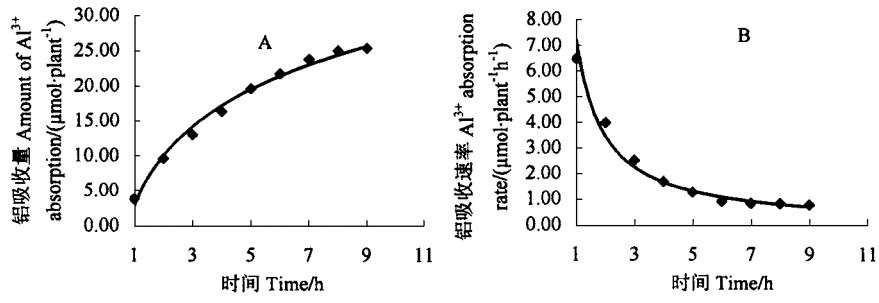
|
图 2 龙眼铝吸收量、吸收速率随处理时间的动态变化 Fig. 2 Trend of amount and rate on Al3+ absorption of Longan along with time |
2,4-DNP抑制了龙眼对铝的吸收(图 3),抑制程度随介质铝浓度的提高而下降,抑制率(以不加2,4-DNP的吸收速率作为100%)与介质中铝浓度呈显著负相关[y(抑制率)=-38.464x(铝浓度)+70.265,r=-0.97**)]。
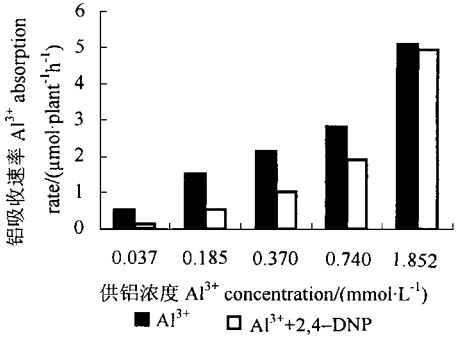
|
图 3 2, 4-DNP对龙眼铝吸收速率的影响 Fig. 3 Effect of 2, 4-DNP on Al3+ absorption rate of Longan |
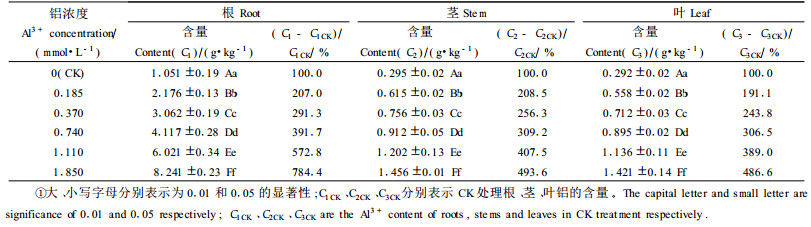
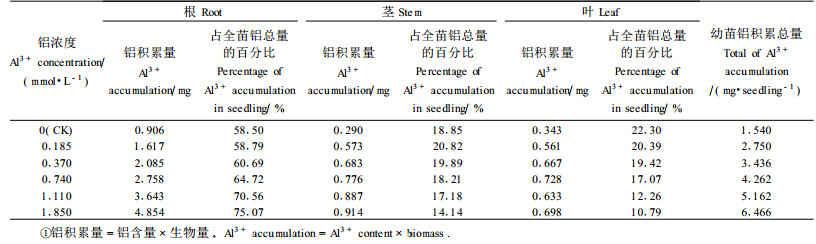
龙眼各器官中根的含铝量最高(表 1),是茎的3.54~5.66倍,是叶的3.60~5.80倍,各器官铝含量随铝处理浓度的增大而增加。在供试的铝浓度范围内,与对照相比较,根的铝含量增加107.0%~684.4%,茎增加108.5%~393.6%,叶增加91.1%~386.6%,其中根中铝含量增加幅度最大,根(yr)、茎(ys)、叶(yl)铝含量与铝处理浓度(x)之间呈直线显著相关,关系式为:yr=3.827 8x+1.396 8(r=0.99**); ys=0.587 1x+0.456 3(r=0.96**); yl=0.578 6x+0.425 4(r=0.97**)。从表 2可见,在龙眼各器官中,铝在根中的积累量最大,占全苗总积累量的58.85%~75.07%,茎、叶铝积累量分别只占全苗总积累量的14.14%~20.82%、10.79%~22.30%。根、茎铝积累量随铝处理浓度的增加而增加,增加幅度根均大于茎,在铝轻度胁迫下叶中的铝积累量随铝处理浓度增加呈增加趋势,当铝浓度超过0.740 mmol·L-1, 则呈下降趋势。根中铝积累量占全苗铝积累总量的百分数随铝处理浓度的增加而不断升高,而叶则相反;茎是低浓度铝胁迫时其铝积累量占全苗铝积累总量的百分数随铝胁迫浓度的增加而升高,0.185 mmol·L-1处理时达到最大值,而铝胁迫浓度>0.185 mmol·L-1时则随铝胁迫浓度的增加而不断下降。
|
|
|
|
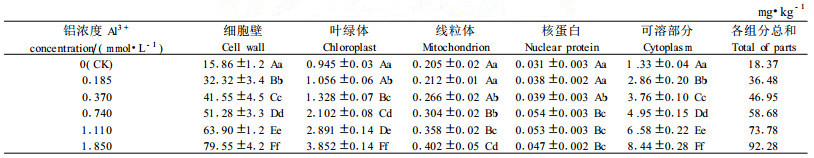
铝胁迫下,叶片细胞吸收的铝主要分布在细胞壁(表 3),细胞壁中的铝含量占86.20%~88.58%,说明细胞壁具有富集铝的功能; 其次是细胞内可溶部分,铝含量占7.3%~9.1%;叶绿体和线粒体的铝含量分别占2.83%~5.14%和0.44%~1.12%;核蛋白中铝含量最小,仅占0.1%左右。随着介质中铝浓度的提高,细胞壁中的铝含量显著增加,各处理之间的差异达到极显著水平。与对照相比较,细胞壁铝含量增加了16.46~63.69 mg·kg-1,细胞可溶部分铝含量增加了1.53~7.11 mg·kg-1,叶绿体铝含量增加了0.11~2.91 mg·kg-1,线粒体铝含量增加了0.007~0.197mg·kg-1,核蛋白铝含量小,铝绝对量增加幅度为0.007~ 0.023 mg·kg-1。由此可见,随着铝胁迫的加重,大部分铝富集在细胞壁,有一部分铝进入了细胞内部,甚至进入了叶绿体、线粒体等细胞器,影响正常的生理功能。
|
|
关于植物铝吸收机制存在2种不同的看法。有人认为,对多种植物的离子动力学研究,可以成功地求得植物根系对铝元素的吸收动力学参数,也就是说铝元素的吸收符合Michaelis-Menten酶动力学方程,属于主动吸收(韩振海等,1994); 而有人则认为,细胞对铝的吸收不是主动吸收,而是被动扩散过程(田仁生等,1990;Zhang et al., 1990),2, 4-DNP、碳酰氰间-氯苯腙(CCCP)(Rincon et al., 1992)和蛋白质合成抑制剂等代谢抑制剂对铝的吸收没有严重阻碍作用,有的反而增加了根系对铝的吸收(黄邦全等,2001), 因此认为植物能够通过主动运输将Al3+运出细胞以降低自身的毒性,这也是植物自我保护的反应机制。本试验通过龙眼幼苗铝的吸收曲线、代谢抑制剂2, 4-DNP对龙眼铝吸收的影响等方面的研究结果认为,龙眼铝吸收特性取决于介质中铝的浓度,在浓度≤0.370 mmol·L -1时,龙眼铝吸收主要受代谢控制,属于主动吸收;介质浓度大于0.370 mmol·L -1时,则主要受非代谢因素影响,即为被动扩散。至于代谢抑制剂2, 4-DNP如何抑制铝吸收,尚有待于进一步探讨。应该指出,龙眼对铝吸收不仅与介质浓度有关,而且与植株-介质之间的铝浓度差有关,铝吸收量随吸收时间的延长而增加,吸收速率随吸收时间的延长而减小。
3.2 龙眼吸收的铝主要积聚在根部铝极易在根尖富集,抑制根的生长(Samuelse et al., 1997)。植物受铝毒害,Al3+主要集中在根系或根尖细胞液泡中,这在针叶树、山毛榉属(Fagus)、玉米(Zea mays)、马铃薯(Solanum tuberosum)、小麦(Triticum aestivum)、燕麦(Avena nuda)、大麦(Genus hordeum)、大豆(Glycine max)中都得到了证实(刘东华等,1995)。通过植物组织分析发现,被植物吸收的铝95%集中在根部,运输到地上部的极少(田仁生等,1990);Samuels等(1997)试验表明,当介质铝浓度为11 μmol·L-1时,小麦敏感性品种根部组织的铝积累量高达546.0 μg·g-1DW,生长抑制达50%。本试验通过龙眼各器官铝含量和积累量的分析表明,铝胁迫下,幼苗吸收的铝也主要集中于根系,根的铝含量是茎的3.54~5.66倍,是叶的3.60~5.80倍,其积累量占全苗铝总积累量的58.85% ~75.07%,且随介质铝浓度的提高根中的铝含量和铝积累量均大幅度增加,根吸收的铝转移到地上部的比例随介质铝浓度的提高而减小。说明铝对龙眼的毒害,首先是对根系产生危害,根系组织积累大量的铝,对根系细胞的结构和功能造成巨大破坏,从而影响地上部的生长。但应该指出,根系铝的富集,是植株自我保护的机制。因为,一方面通过根系的富集阻止铝进入地上部组织、细胞,避免造成更大的毒害;另一方面根系通过分泌物如有机酸等整合Al3+以降低毒性,如Pellet等(1995)研究发现根系柠檬酸分泌与植物抗铝作用相关,Ryan等(1995)认为根尖苹果酸的分泌是小麦抗铝的主要机制,Basu等(1994)发现根系多肽分泌的增加与小麦的抗铝性有关,Taylor等(1985)、Foy等(1965)认为耐铝小麦通过升高根区的pH来增加抗铝性。
3.3 铝在龙眼幼苗叶片细胞中主要分布在细胞壁植物细胞的细胞壁具有很强的积累阳离子的能力。铝主要与细胞壁的成分如细胞壁的胶质、蛋白质等相结合,影响植物正常的代谢活动(Zhang et al., 1992),降低细胞壁的弹性及导水性,影响植物的生长。铝易与磷酸基、羟基等极性基团结合,因此可与细胞质膜的脂质及膜蛋白结合,影响膜的结构和功能(孔繁翔等,2000)。试验表明,龙眼叶片细胞细胞壁具有很强的富集铝的功能,细胞壁中的铝含量占了86.20%~88.58%,然后依次是细胞质、叶绿体、线粒体,核蛋白中铝含量最小。龙眼叶片细胞细胞壁强有力富集铝的功能,也是细胞自我保护的一种机制,阻止大量铝进入细胞内部,避免叶绿体、线粒体等细胞器受到损害而造成更大的伤害。在植物抗铝机制中,细胞壁和细胞膜起着关键的作用。目前的研究表明,植物抗铝性的大小与细胞壁的组成和性质有关,植物细胞壁具有很强的络合阳离子的能力,因此表皮细胞和叶肉细胞的细胞壁可与铝结合,阻止铝进入细胞内的作用位点(孔繁翔等,2000)。细胞膜是阻止植物吸收铝的另一个重要屏障,铝穿过不同耐受性植物细胞膜的能力不同(Wagatsuma et al., 1985)。
韩振海, 王永章, 王倩. 1994. 植物的离子吸收动力学研究的现状和前景. 北京农业大学学报, 20(4): 381-387. |
黄邦全, 白景华, 薛小桥. 2001. 植物铝毒害及遗传育种研究进展. 植物学通报, 18(4): 385-395. DOI:10.3969/j.issn.1674-3466.2001.04.001 |
孔繁翔, 桑伟莲, 蒋新, 等. 2000. 铝对植物毒害及植物抗铝作用机理. 生态学报, 20(5): 855-862. DOI:10.3321/j.issn:1000-0933.2000.05.023 |
李庆逵. 1983. 中国红壤. 北京: 科学出版社.
|
刘东华, 蒋悟生. 1995. 铝对植物的毒害. 植物学通报, 12(1): 24-32. |
沈同, 王镜岩, 赵邦悌主编. 1985. 生物化学(上册). 北京: 高等教育出版社, 232-256.
|
田仁生, 刘厚田. 1990. 酸化土壤中铝及其植物毒性. 环境科学, 11(6): 41-46. |
王仁玑, 庄伊美. 1981. 龙眼幼苗缺素试验初报. 亚热带植物通讯, (2): 5-10. |
肖祥希, 刘星辉, 张学武, 等. 2002. 铝胁迫对龙眼幼苗生长的影响. 福建农业学报, 17(3): 182-185. DOI:10.3969/j.issn.1008-0384.2002.03.014 |
臧小平. 1997. 土壤铝毒与植物钙镁营养. 广西农业科学, (2): 80-82. |
Basu U, Godbold D, Taylor G J. 1994. Aluminum resistance in Triticum aestivum associated with enhanced exudation of malate. J Plant Physiol, 144: 745-753. |
Foy C D, Burns G R, Brown J C, et al. 1965. Differential aluminum tolerance of two wheat varieties associated with plant-induced pH changes around their roots. Soil Sci Soc Am Proc, 29: 64-67. DOI:10.2136/sssaj1965.03615995002900010019x |
Pellet D M, Grunes D L, Kochian L V. 1995. Organic acid exudation as an aluminum tolerance mechamism in maize(Zea mays L.). Planta, 196: 788-795. DOI:10.1007/BF01106775 |
Ryan P R, Delhaize E, Randal P J. 1995. Malate efflux from root apices and tolerance to aluminum are highly correlated in wheat. Aust J Plant Physiol, 22: 531-536. |
Rincon M, Gonzalcs R A. 1992. Aluminum partitioning in intact roots of aluminum-tolerant and aluminum-sensitive wheat(Triticum aestivum L.) cultivars. Plant Physiol, 99: 1021-1028. DOI:10.1104/pp.99.3.1021 |
Samuels T D, Kucukakyuz K, Magaly R Z. 1997. Al partitioning patterns and root growth as related to Al sensitivity and Al tolerance in wheat. Plant physiol, 113: 527-534. DOI:10.1104/pp.113.2.527 |
Taylor G J, Foy C D. 1985. Mechanisms of aluminum tolerance in Triticum aestivum L. (wheat) Ⅰ: Differential pH induced by winter cultivars ivars in nutrient solution. Amer J Bot, 72: 695-701. DOI:10.1002/j.1537-2197.1985.tb08327.x |
Wagatsuma T, Yamasaka K. 1985. Relationship between differential aluminum tolerance and plant-induced pH change of medium among barley cultivars. Soil Sci Plant Nutr, 31: 521-535. DOI:10.1080/00380768.1985.10557461 |
Zhang G, Taylor G J. 1990. Kinetics of aluminum uptake in Triticum aestivum L: Identity of the linear phase of aluminum uptake by excised roots of aluminum-tolerant and aluminum-sensitive cultivars. Plant Physiol, 94: 577-584. DOI:10.1104/pp.94.2.577 |
Zhang G, Taylor G J. 1992. Effects of biological inhibitions on kinetics of aluminum uptake by excised roots and purified cell wall material of aluminum-tolerant and aluminum-sensitive of Triticum aestivum L. J Plant Physiol, 138: 533-539. |
 2005, Vol. 41
2005, Vol. 41