文章信息
- 李云, 王树芝, 田砚亭, 钱永强.
- Li Yun, Wang Shuzhi, Tian Yanting, Qian Yongqiang.
- NAA和IBA对四倍体刺槐试管苗生根影响及不定根发育过程解剖观察
- Effect of NAA and IBA on Rooting of Tetraploid Robinia pseudoacacia in vitro and Anatomical Observation on Adventitious Root Development
- 林业科学, 2004, 40(3): 75-79.
- Scientia Silvae Sinicae, 2004, 40(3): 75-79.
-
文章历史
- 收稿日期:2002-09-16
-
作者相关文章
2. 中国社会科学院考古研究所 北京 100710
2. Institute of Archaeology, Academy of Social Science Beijing 100710
四倍体速生型刺槐(Robinia pseudoacacia)是从韩国引进的饲料型刺槐无性系,具有营养价值高、无刺等优点,适合做饲料。其单叶面积为二倍体刺槐的2倍以上,单叶及复叶干重均为二倍体刺槐的1.5倍以上,叶中粗蛋白、粗脂肪、灰分含量均高于二倍体刺槐。为了在较短的时间里繁殖大量的、具有原优良特性的苗木,从1997年起,对该无性系组织培养技术进行了研究。通常,试管苗生根质量的好坏直接影响试管苗移栽成活率,从而影响经济效益,因此,本试验目的之一,研究NAA和IBA浓度对四倍体刺槐试管苗生根率的影响。由于以往的研究方法精确度不高,重复性差,效率低,为了克服以上这些缺点,本试验采用32析因设计、二次回归正交设计的方法,科学地计算出试管苗生根率最优时的NAA和IBA浓度,从而大大提高了四倍体刺槐试管苗生产效率。另外,在研究该刺槐无性系试管外嫩枝和硬枝扦插繁殖时,发现该无性系扦插生根极为困难,生根率非常低,最高生根率为30%,而该无性系试管苗在瓶内的生根率却高达90%,为探讨该无性系在试管内和试管外生根率差别大的原因,本试验对该刺槐组培苗不定根的发育过程进行了解剖观察,探索该刺槐的无菌茎段在瓶内扦插生根过程的初步规律,以期为今后提高刺槐嫩枝和硬枝扦插生根率提供指导。
1 材料与方法 1.1 试验材料从四倍体刺槐无性系1 a生嫁接苗的当年生健壮枝上剪取带有腋芽的茎段,剪去叶片,留叶柄基部,用毛笔蘸0.1%的洗衣粉溶液轻轻刷干净枝条,用自来水冲洗10 min。在超净工作台上,用70%的酒精溶液浸30 s,无菌水冲洗2~3次,再用0.1%的升汞(HgCl2)溶液进行表面灭菌,并用无菌水冲洗5~6次后,把茎段接种在MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1+蔗糖2%+琼脂0.6%培养基上建立无菌培养体系, 培养基pH为5.8。继代培养周期20 d,培养温度(25±2)℃,光照强度2 000 lx,光照时间12 h·d-1。从该无菌培养体系的试管苗上剪切2cm左右的茎段用于生根试验。
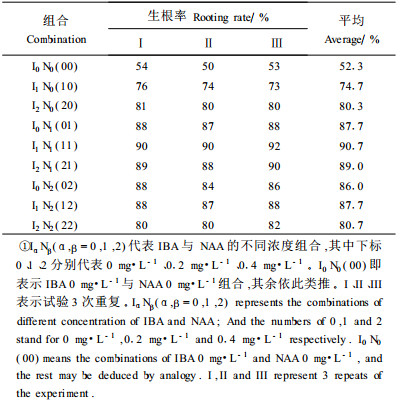
1.2 最适生根培养基的筛选生根试验培养基采用32析因设计(续九如等,1995),试验时剪取上述2cm左右的茎段,接种到分别含有IBA为0、0.2、0.4 mg·L-1和NAA为0、0.2、0.4 mg·L-1不同组合的生根培养基上,3次重复。调查IBA、NAA不同组合的刺槐无性系试管苗生根率,对试管苗生根率数据进行反正弦数据转换后进行了方差分析和二次回归正交分析(续九如等,1995),以期获得IBA、NAA的最佳组合浓度。
1.3 不定根发育的解剖观察将从增殖培养基上剪切的茎段,接种在最适生根培养基上进行生根过程的解剖观察,从接种前一天开始到整个生根诱导过程结束,每天取样一次。取样时先从培养基上取出嫩梢或茎段,然后从其基部剪取0.5 cm小段,放于刷干净的装有FAA固定液(70%酒精90 mL,冰乙酸5 mL,甲醛5 mL)的小瓶子中,盖上胶皮盖,然后,将注射针头插入胶皮盖,对经过固定的材料进行抽气,直到材料沉入瓶子的底部,说明材料中的气体已经抽干净,固定24 h以上。固定好后,将固定液倒掉,用纱布将瓶口扎住,用不太急的流水冲洗5 h,将材料依次转入35%、50%、70%、83%、95%、100%一系列乙醇中脱水,然后,将材料转入二甲苯中,用石蜡将材料包埋,用转动式切片机进行切片,横切切片厚度为17 μm、纵切切片厚度为8 μm,材料经过脱蜡、染色、脱水、透明后制成永久切片。所用染色液为番红和固绿染色液(郑国璠,1978)。用OLYMPUS BHS型显微系统观察不定根的发育过程,同时进行显微拍照(PM-10AD的OLYMPUS自动显微摄影系统)。
2 结果和分析 2.1 IBA、NAA与试管苗生根 2.1.1 IBA、NAA析因设计结果的方差分析生根率统计结果见表 1。
|
|
将茎段接种到无植物生长调节剂和只有IBA或NAA的培养基上,观察到幼叶逐渐展开、变绿,茎生长开始加快。没有任何植物生长调节剂时生根慢,生根率低,加入植物生长调节剂的生根率均高于不加植物生长调节物质的。仅加入IBA的比仅加入NAA的处理生根早,其中在加入IBA的培养基上,培养6 d时可在茎基部观察到白色粒状突起,随后形成根系,但根较细弱,随IBA浓度升高,根更细、更长,根系变褐。当仅加入NAA时,先形成愈伤组织,后由愈伤组织中分化出新根,无侧根,易脱落,继续培养仍无侧根产生;随NAA浓度升高,茎基部愈伤组织量增多,根表面疏松的白色组织也增多,最后抑制根的正常发育。试管苗在IBA和NAA不同搭配的培养基上生根效果均优于仅添加一种生长调节物质的培养基(图 1)。

|
图 1 不同处理最佳激素浓度试管苗生根情况 Fig. 1 The rooting of shoots in test tubes with the best concentration in different treatments |
对表 1数据进行反正弦转换(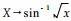
|
|
检验结果表明,IBA和NAA以及它们的交互作用间差异都达到了极显著水平。经多重比较,可初步得出:NAA取0.2 mg·L-1,IBA取0.2~0.4 mg·L-1配合使用时,离体宽叶四倍体刺槐无性系生根效果比较理想。
IBA和NAA的直线效应与二次方效应均达到极显著水平,因此,可以做正交多项回归试验,以期进一步求出NAA及IBA最佳浓度及其配比。
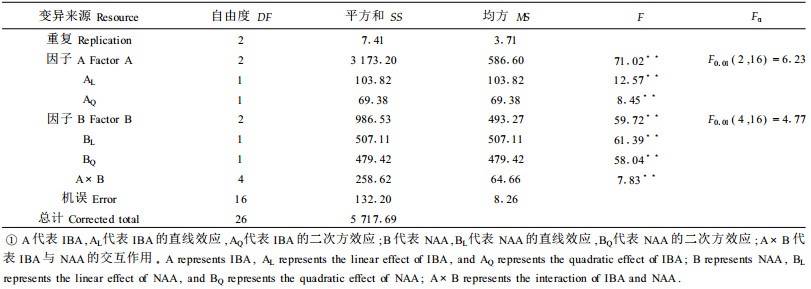
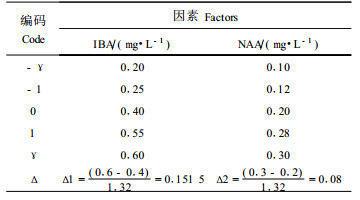
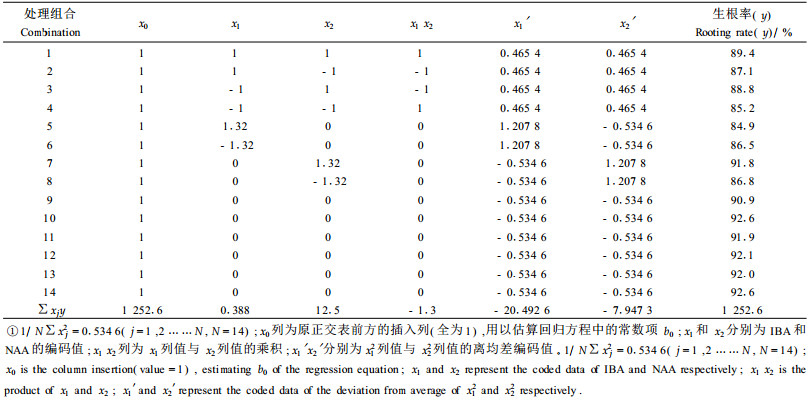
2.1.2 二次回归正交分析确定NAA及IBA的最适浓度在上述试验NAA和IBA参试浓度配比的基础上,进一步对其浓度配比进行二次回归正交设计(续九如等,1995),设计见表 3。同时,为便于对所得回归方程进行拟合测验,整个试验仅在零水平处预先设置重复6次,试验处理结果见表 4。
|
|
|
|
计算求得各项回归系数并对各项回归系数进行显著性检验,b2、b11、b22极显著,b1和b12不显著(b1为因素IBA的一次项系数;b2为因素NAA的一次项系数;b11为因素IBA的二次项系数;b22为因素NAA的二次项系数;b12为因素IBA与因素NAA的交互项系数)。从而可以初步建立二元多项回归方程为:Y=91.9748+1.6701 X2-3.3759 X12-1.3092 X22。对所得回归方程进行显著性检验[F=24.7463 > F0.01(5,8)=6.63]可知,所得回归方程极显著。回归模型的拟合测验结果表明回归方程拟合良好[F=3.914 < F0.05(3, 5)=5.41]。从而建立以浓度为自变量的回归方程:Y=56.08365+117.6669 Z1+102.70125 Z2-147.0836 Z12-204.5625 Z22,其中Y、Z1与Z2分别表示生根率、IBA与NAA的浓度。
依据函数求极值方法,求出获得最高生根率的处理组合为IBA0.40 mg·L-1,NAA0.25 mg·L-1。代入回归方程,得此处理组合的生根率为92.51%。可以看到,这一结果要高于原来试验中所有处理组合的生根率。由此可知四倍体刺槐试管苗最适生根培养基为1/2MS+IBA0.4 mg·L-1+NAA0.25 mg·L-1+蔗糖2%+琼脂0.6%。
2.2 四倍体刺槐试管苗不定根发育的解剖观察对接入生根培养基前的试管苗嫩梢进行解剖观察,可见其横切面从外到内分别由周皮、5~7层薄壁细胞组成的皮层、维管束及髓组成,未发现潜伏根原基(图版Ⅰ-1)。通常形成层细胞比较规则,但偶尔也看到维管束间的形成层细胞和皮层、髓薄壁细胞没差别,维管束间的距离很大(图版Ⅰ-2),这是否对不定根的形成有利,有待今后进一步研究。
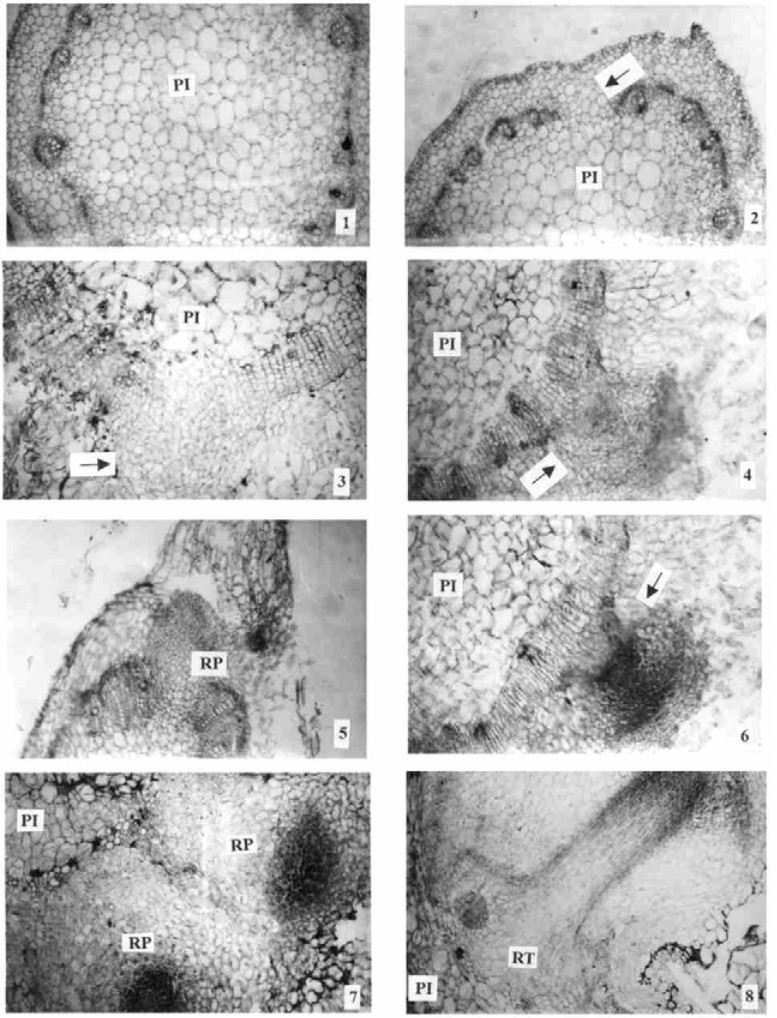
|
图版Ⅰ Plate Ⅰ |
将四倍体刺槐试管苗茎段,接种在1/2MS+IBA 0.4 mg·L-1+NAA 0.25 mg·L-1+蔗糖2%+琼脂0.6%的最适生根培养基上,解剖观察发现嫩梢上发出的不定根是由诱生根原基发育形成,诱生根原基源于初生髓射线细胞的分裂和分化。其不定根形成过程可划分为以下3个时期:①初生髓射线细胞的分裂和分化期由于植物生长调节物质的诱导,初生髓射线细胞开始旺盛分裂,连续平周分裂产生5~7层薄壁、胞质浓、核仁大、染色深的细胞,核仁呈现红色(图版Ⅰ-3)。②不定根原基形成期随着初生射线细胞的分裂和分化,出现染色比其它区域较深的细胞团即分生点(图版Ⅰ-4,5),而后分生细胞逐渐向活跃状态转变,这些细胞继续进行垂周分裂和平周分裂,形成圆球型根原基的轮廓(图版Ⅰ-6,7)。③不定根形成期根原基继续分裂,伸长,开始进行组织分化,根原基形态学上部细胞继续分裂,染色较深,形态学下部细胞分裂变慢,变成长柱型细胞,染色较浅。根原基形态学上部逐渐分层,出现根冠和生长点。形态学下部细胞分化形成维管组织,与嫩梢的输导组织结合在一起。由于生长点的继续分裂、分化,产生机械压力,并在根冠分泌物的作用下,使根原基穿过皮层和表皮向外突起,形成不定根(图版Ⅰ-8)。不定根以内生向外发育,当不定根在嫩梢上出现时,它们与嫩梢已有完整的维管系统联系。
3 结论与讨论四倍体刺槐试管苗最适生根培养基为1/2MS+IBA 0.4 mg·L-1+NAA 0.25 mg·L-1+蔗糖2%+琼脂0.6%,在该培养基上生长的植株生根率高,根系发达,主根粗壮,有侧根和须根;嫩梢生长量大,苗木健壮,并且移栽成活率可达90%以上。刺槐不定根的产生是由诱生根原基发育而成,诱生根原基起源于初生髓射线细胞的分裂和分化。在试验中未发现潜伏根原基,也未发现愈伤组织内产生根原基。
3.1 试管外生根率低可能的原因四倍体刺槐不定根的形成是一个复杂的生理过程。不定根原基的发生与发育是扦插成功与否的关键(Ritchie, 1991)。其形成依赖于多种因子,其中植物激素,尤其是生长素起关键作用(江玲等,2000)。郭素娟认为用植物生长调节剂处理是促进难生根树种插穗生根的重要技术手段,不仅有利于根原始体的诱导,而且能够促进不定根的发育和生长。植物生长调节剂使插穗基部变成吸收养分的中心,起着促进物质交换、调配插穗养分的作用,植物生长调节剂还可能解除基因的抑制,提高mRNA的合成,从而促进多种酶的合成,诱导根原始体的发端(郭素娟, 1997)。Goldfarb等(1997)在研究火炬松(Pinus taeda)下胚轴生根诱导时发现,用NAA处理后24h内,由生长素类诱导的早期基因的表达达到高峰。刺槐试管苗生根过程的解剖观察结果表明,用不同种类和浓度的外源植物生长调节剂处理试管苗茎段,对根原基的诱导有不同的影响,只有同时含IBA (0.4 mg·L-1)和NAA (0.25 mg·L-1)2种植物生长调节剂的处理组合,才能诱导和产生较为理想的不定根,由此推测,瓶外扦插不易生根的原因,可能是由于施加的外源植物生长调节剂的种类和浓度不合适,使其内源激素处于不利于诱导根原基形成的水平,因此生根率低。
3.2 不定根起源植物解剖学家对植物扦插不定根起源部位很感兴趣。早在1758年,法国树木学家Duhamel du Manceau就明确提出了该问题(哈特曼等,1985),此后许多学者对不定根起源问题进行了广泛研究。有的学者认为木本植物的不定根往往从幼嫩的次生韧皮部、维管射线、形成层及髓部发生,其发生的部位也与叶迹、芽迹有关系(王涛,1989)。杉木不定根原基形成于维管形成层和皮层(马英等,1996)。有的学者还认为根原基也可以在愈伤组织内发生,如长白落叶松(Larix olgensis)(刘桂丰等,1992)。但愈伤组织的发育并不能保证根原基的形成(哈特曼等,1985;王涛,1989;郑均宝等,1989)。解剖观察结果表明四倍体刺槐优良无性系不定根起源于髓射线细胞的分裂和分化。
3.3 愈伤组织与不定根的关系通过解剖学观察发现,在试管苗茎段生根过程中,茎段基部有愈伤组织产生,但在愈伤组织中未见根原基的发生,这些愈伤组织是髓射线细胞恢复分裂形成的。髓射线细胞在恢复分裂形成愈伤组织的同时,继续分裂产生球状根原基,根原基分化和生长到一定阶段才形成不定根。从表面看刺槐不定根是从嫩梢基部的愈伤组织中露出的,但从组织解剖结果看,愈伤组织的产生与根原基的发生没有直接关系。
郭素娟. 1997. 林木扦插生根的解剖学及生理学研究进展. 北京林业大学学报, 19(4): 64-69. DOI:10.3321/j.issn:1000-1522.1997.04.011 |
哈特曼, 凯斯特, 郑开文, 等. 1985. 植物繁殖原理和技术. 北京: 中国林业出版社.
|
江玲, 管晓春. 2000. 植物激素与不定根形成. 生物学通报, 35(11): 17-19. DOI:10.3969/j.issn.0006-3193.2000.11.007 |
林艳, 詹亚光, 刘王喜. 1996. 白桦嫩枝扦插不定根形成的解剖观察. 东北林业大学学报, 24(3): 15-19. |
刘桂丰, 杨书文, 杨春华, 等. 1992. 长白落叶松嫩枝扦插生根的解剖研究. 东北林业大学学报, 20(1): 9-13. |
马英, 李明鹤, 沈宝仙, 等. 1996. 杉木优树侧枝接根埋干法的复壮效果. 华中农业大学学报, 15(4): 389-394. |
王涛编著.植物扦插繁殖技术.北京: 北京科学技术出版社, 1989
|
续九如, 黄智慧. 1995. 林业试验设计. 北京: 中国林业出版社.
|
郑国璠. 1978. 生物显微技术. 北京: 人民教育出版社.
|
郑均宝. 1989. 树木的营养繁殖. 北京: 中国林业出版社.
|
Goldfarb B, Lian Z G, Lanz-Garcia C, et al. 1997. Biology of Root Formation and Development. New York: Altmao and Waisel Plenum Press, 163-167.
|
Ritchie G A. 1991. The commercial use of conifer rooted cutting in forestry: a world overview. New Forests, 5: 247-275. DOI:10.1007/BF00028115 |
 2004, Vol. 40
2004, Vol. 40