文章信息
- 范国强, 黎明, 贺窑青, 蒋建平.
- Fan Guoqiang, Li Ming, He Yaoqing, Jiang Jianping.
- 悬铃木体细胞胚胎发生及植株再生
- Somatic Embryogenesis of Platanus orientalis and Its Plantlet Regeneration
- 林业科学, 2004, 40(3): 71-74.
- Scientia Silvae Sinicae, 2004, 40(3): 71-74.
-
文章历史
- 收稿日期:2002-09-26
-
作者相关文章
悬铃木(Platanus)是世界著名的城市绿化树种,目前通常采用嫩枝和硬枝扦插繁育苗木。自20世纪70年代以来,对悬铃木物候期、品种选育和苗木繁殖方法等进行了大量的研究,并取得了一定的成果(卫志明等,1991;周业恒等,1993;宋珍等,1998;范国强等,2003; Liu et al., 2003)。近年来,国内外已对多种木本植物的体细胞胚胎发生及其体外植株再生进行过研究(包慈华,1979;杜克久,1998;范国强等,2002a;2002b;黄敏仁等,1990;李天然等,1998;唐巍等,1998;王影,1991;卫志明等,1991;杨金玲等,1997;袁巧平等,1990;张立功等,1981;Becwar et al., 1990; Fan et al., 2001; Gupta et al., 1987; Hakman et al., 1985;1987; Laine et al., 1990; Julie, 1986; Marino et al., 1993; Mol et al., 1991; Mukherjee et al., 1991; Tang, 2000; Von Arnold et al., 1988; Wang et al., 2002)。然而,至目前有关悬铃木的体细胞胚胎发生及其植株再生的研究,在国内外还未见报道。为了顺利进行悬铃木的基因工程和细胞工程操作及新品种的快速繁育,本文研究了其体细胞胚胎的发生及植株再生。
1 材料与方法 1.1 材料1999年11月在郑州市河南农业大学校园内采集约45 a生、成熟而未脱落的二球悬铃木(Plantanus orientalis)球果。
1.2 方法 1.2.1 无菌苗培养2000年5月25日,用力将经自来水浸泡2 d后(每10 h换水一次)的悬铃木球果压碎,将去掉种(果)毛的种子放入腐熟、湿度适宜的木屑中在室外发芽,同时适时浇水。待种子发芽并且子叶完全展开后, 用0.1%的氯化汞溶液消毒悬铃木幼苗5 min,放入无菌重蒸水中清洗3次,用吸水纸吸干表面水后,接种于不加植物激素的MS(含蔗糖25 g·L-1、琼脂4 g·L-1)基本培养基上培养成无菌苗。
1.2.2 愈伤组织诱导当无菌苗长出的第7片真叶完全展开时,将其叶片分别切成0.5 cm× 0.3 cm的小块(外植体),分别放在基本培养基为WPM、MS(含蔗糖25 g·L-1、琼脂4 g·L-1),附加0.1 mg·L-1 IBA、0.5和5.0 mg·L-1 BA的培养基上(每个外植体放置30瓶),于光照强度为130 μmol·m-2s-1、光照时间为16 h·d-1、温度为25 ℃的培养箱内培养。30 d时观察并统计叶片愈伤组织诱导情况及诱导率。
1.2.3 愈伤组织和胚性愈伤组织的观察 参见陈正华(1986)。 1.2.4 叶片愈伤组织诱导率和胚性愈伤组织诱导率的计算愈伤组织诱导率=(诱导出愈伤组织外植体的数量/放置外植体的数量)×100%;胚性愈伤组织诱导率=(诱导出胚性愈伤组织外植体的数量/放置外植体的数量)×100%。
1.2.5 体细胞胚胎发生将在WPM+0.1 mg·L-1 IBA+5.0 mg·L -1 BA上诱导出的愈伤组织分别放在不加任何激素的WPM、WPM+0.1 mg·L-1 IBA+0.5 mg·L-1 BA、WPM+0.1 mg·L-1 IBA+1.0 mg·L-1 BA和WPM+ 0.5 mg·L-1 BA的培养基上(每一培养基放置30瓶),分别置于温度为5、15和25 ℃的黑暗培养箱内培养3 d后,再放入与愈伤组织培养相同的条件下进行体细胞胚胎的发生。
1.2.6 体细胞胚胎发生的组织学观察将不同生长时期的外植体用卡诺氏液(Carnoy)固定24 h,常规石蜡切片,厚7~8 μm, 番红染色,脱色、脱蜡封片后,在尼康TS-100荧光倒置显微镜下观察体细胞胚发生情况。
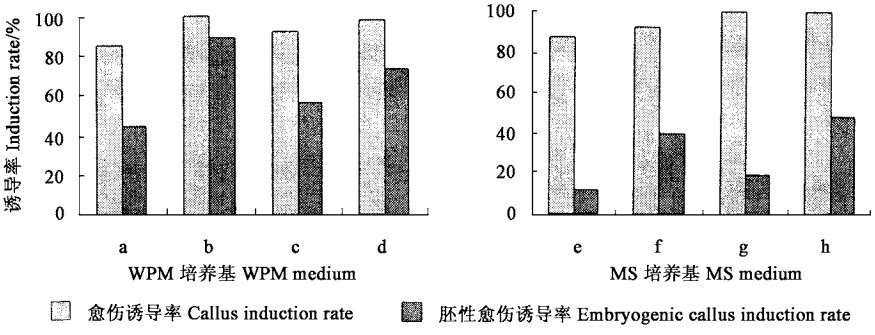
2 结果与分析 2.1 愈伤组织诱导外植体在WPM和MS培养基上的试验结果(图 1)表明,悬铃木幼苗叶片在WPM和MS培养基上愈伤组织和胚性愈伤组织的诱导率存在较大的差异。在WPM培养基上,当IBA浓度为0.1 mg·L-1、ZT为0时,随着BA浓度的增加,愈伤组织诱导率也由85%升高到100%, 胚性愈伤组织则由45%上升到89.1%;当IBA浓度为0.1 mg·L-1、ZT为0.5 mg·L-1,BA浓度由0.5 mg·L-1增加到5.0 mg·L-1时,愈伤组织诱导率由92%上升到98%,其胚性愈伤组织则由56.3%上升到72.8%。在MS培养基上,当IBA为0.1 mg·L-1 、ZT为0时,随BA浓度的增加,外植体愈伤组织诱导率也由87.2%增加到92.5%,胚性愈伤组织诱导率由12.1%上升到3 9.8%。当IBA浓度为0.1 mg·L-1、ZT浓度为0.5 mg·L-1时,外植体愈伤组织诱导率均可达到100%,胚性愈伤组织由19.7%增加到48.3%。也就是说,悬铃木叶片在WPM培养基上诱导愈伤组织体细胞胚胎发生过程中,BA所起的作用大于ZT。以上结果说明,在同样的激素种类和激素浓度条件下,培养基的成分及其含量对悬铃木外植体愈伤组织和胚性愈伤组织的诱导率的大小有一定的影响。
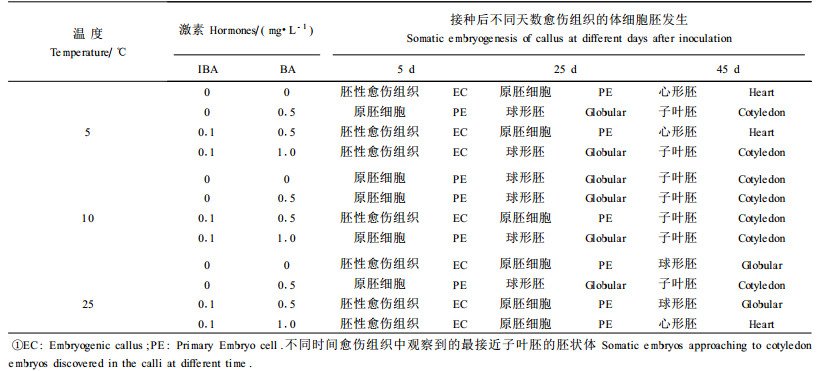
|
图 1 不同培养基对愈伤组织诱导的影响(30 d) Fig. 1 Effect of different media on callus inductions(30 d) a: WPM+0.1 mg·L-1 IBA+0.5 mg·L-1 BA; b: WPM+0.1 mg·L-1 IBA+5.0 mg·L-1 BA; c: WPM+0.1 mg·L-1 IBA+0.5 mg·L-1 BA +0.5 mg·L-1 ZT; d: WPM+0.1 mg·L-1 IBA+5.0 mg·L-1 BA+0.5 mg·L-1 ZT; e: MS+0.1 mg·L-1 IBA+0.5 mg·L-1 BA; f: MS +0.1 mg·L-1 IBA+5.0 mg·L-1 BA; g: MS+0.1 mg·L-1 IBA+0.5 mg·L-1 BA+0.5 mg·L-1 ZT; h: MS+0.1 mg·L-1 IBA+5.0 mg·L-1 BA+0.5 mg·L-1 ZT. |
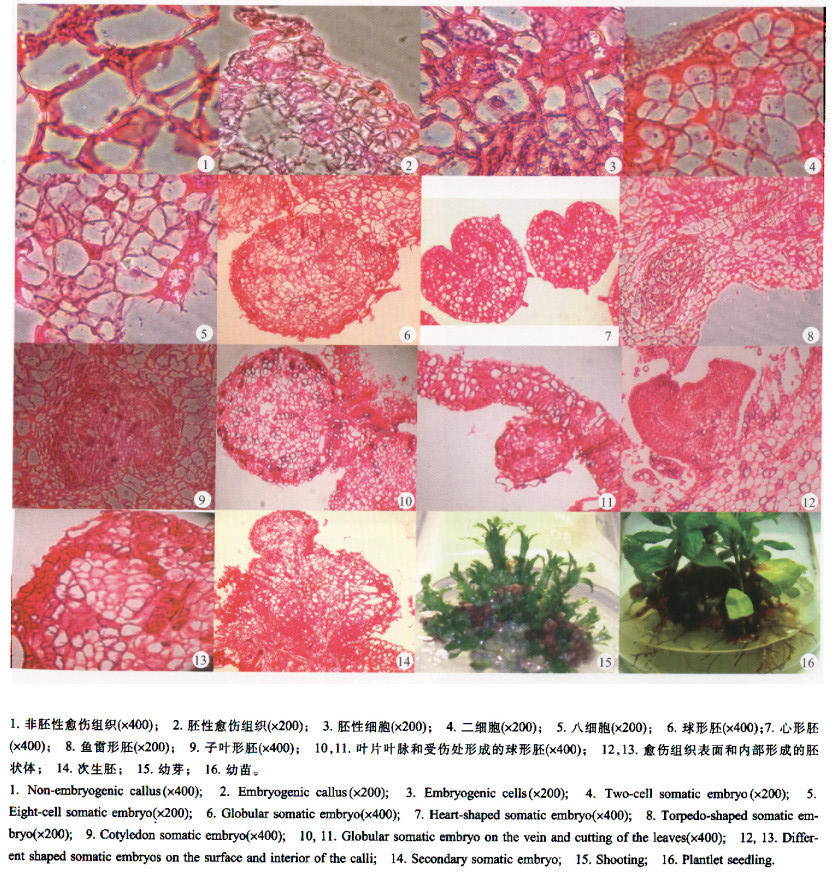
观察悬铃木愈伤组织石蜡切片和愈伤组织成苗结果发现,除了叶片叶脉及叶片外植体伤口处体细胞胚直接发生外,体细胞胚胎还可通过愈伤组织这一间接途径发生。在其间接发生途径中,体细胞胚胎可通过愈伤组织表面和愈伤组织内部等方式发生(图版Ⅰ)。
|
图版Ⅰ Plate Ⅰ |
由WPM+0.1 mg·L-1 IBA+5.0 mg·L-1 BA上形成的胚性愈伤组织在含有不同激素种类和浓度培养基上体细胞胚胎发生的结果(表 1)看出,25℃下,愈伤组织在不加任何激素的WPM培养基上,体细胞胚胎发生的情况与其在WPM+ 0.1 mg·L-1 IBA+0.5 mg·L-1 BA上的相似,即在第5天时,外形上仍为胚性愈伤组织,第25天和第45天时胚性愈伤组织分别形成了原胚和球形胚,只不过是在不加激素的WPM培养基上,第25天和第45天时,形成原胚细胞和球形胚的数量都比在WPM+0.1 mg·L-1 IBA+0.5 mg·L-1 BA培养基上的多。在WPM+0.5 mg·L-1 BA培养基上,第5天时,胚性愈伤组织就开始形成了原胚细胞,这是与其在WPM+0.1 mg·L-1 IBA +1.0 mg·L-1BA上的不同之处,然而在第25天时,胚性愈伤组织都有球形胚的形成,第45天时,在前一培养基上,有子叶胚可以观察到,而在后一培养基上只能观察到心形胚的出现。也就是说,含有IBA的WPM培养基对悬铃木体细胞胚胎的发生有一定的抑制作用。悬铃木叶片体细胞胚胎直接发生和间接发生以及间接发生过程中体细胞胚胎发生的方式和次生胚胎的发生情况如图版Ⅰ-1~14所示。
|
|
胚性愈伤组织在不同温度下体细胞胚胎发生的试验结果(表 1)表明,胚性愈伤组织经过不同温度处理后,体细胞胚胎发生的进程存在着较大的差异。温度为5℃条件下,在不加任何激素的WPM、WPM+0.1 mg·L-1 IBA+0.5 mg·L-1 BA和WPM+0.1 mg·L- 1 IBA+1.0 mg·L-1 BA培养基上,第5天时,愈伤组织的性质没有发生变化,而在WPM+0.5 mg·L-1 BA培养基上,胚性愈伤组织则形成了原胚细胞;第25天时,胚性愈伤组织在不加激素的WPM和WPM+0.1 mg·L-1 IBA+0.5 mg·L-1 BA培养基上形成了原胚,而在WPM+0.5 mg·L-1 BA和WPM+0.1 mg·L-1 IBA+1.0 mg ·L-1 BA培养基上则形成了球形胚;第45天时,胚胎发生过程中出现了子叶胚。在温度为10℃的条件下,总体看来,愈伤组织在4种培养基上的体细胞胚胎发生的进程较快。第5天时愈伤组织体细胞胚胎发生的阶段差异不大,但在WPM+0.1 mg·L-1 IBA+1.0 mg ·L-1 BA培养基上,体细胞胚胎发生处于原胚期,而在5℃和25℃条件下,该培养基上的愈伤组织仍处于胚性愈伤组织阶段;在第45天时,无论WPM培养基中的激素浓度如何,愈伤组织的体细胞胚胎都发育到子叶胚阶段,而在其它温度下,愈伤组织发育到子叶胚阶段的培养基则较少,特别是在温度为25℃条件下,愈伤组织在4种培养基上都没有发育到子叶胚阶段。这说明低温处理有利于促进胚性愈伤组织的体细胞胚胎发生。
2.4 植株再生将处于子叶胚阶段的胚状体在同一培养基上继续发育成幼苗(图版Ⅰ-15)。当芽生长到3 cm左右时,从其茎的基部剪断并转移到无任何植物生长调节剂的WPM培养基上,放入光照培养箱内使其生根,第15天时即可看到形成的完整植株(图版Ⅰ-16)。
3 讨论悬铃木体外器官高效再生一方面与激素的种类和浓度有关,另一方面与幼苗叶片的位置也有一定的关系(范国强等,2003)。本次试验结果表明,悬铃木叶片愈伤组织体细胞胚胎发生的进程和频率除了与激素种类和浓度有关外,还与愈伤组织处理的温度存在密切的关系,即悬铃木叶片在WPM+0.1 mg·L-1 IBA+5.0 mg·L-1 BA上诱导出的胚性愈伤组织经过适当的低温(10℃)处理,加快了其体细胞胚胎的发育进程。此外,不同发育阶段的体细胞胚的发生频率也有一定的提高。造成这种现象的原因可能是低温处理有利于细胞的代谢,产生的激素种类和浓度、多糖和蛋白质等朝着体细胞胚胎发生的方向发展。因此,采用低温处理进行悬铃木的体细胞胚胎发生对其进行基因工程和细胞工程操作及新品种在短期内的大量繁殖具有广阔的应用前景, 而有关悬铃木体细胞胚胎发生的不同步性及发生过程中的生理生化变化将有待进一步的研究。
包慈华. 1979. 海岸红杉组织培养诱导完整植株的初步研究. 科学通报, 24(7): 321-323. |
陈正华. 1986. 木本植物组织培养及其应用. 北京: 高等教育出版社, 62-63.
|
杜克久, 郑均宝, 徐振华, 等. 1998. 741杨器官、体细胞胚胎发生的组织学及生理学研究. 林业科学, 34(6): 99-104. DOI:10.3321/j.issn:1001-7488.1998.06.013 |
范国强, 翟晓巧, 蒋建平, 等. 2002a. 不同种泡桐叶片愈伤组织诱导及其植株再生. 林业科学, 38(1): 29-35. |
范国强, 翟晓巧, 贺窑青, 等. 2002b. 金丝楸组织培养和体外植株再生. 植物生理学通讯, 38(4): 359. |
范国强, 蒋建平, 贺窑青, 等. 2003. 悬铃木体外高效植株再生系统建立. 园艺学报, 30(2): 236-238. DOI:10.3321/j.issn:0513-353X.2003.02.029 |
黄敏仁, 许农. 1990. 林木原生质体培养的现状. 植物生理学通讯, (2): 75-78. |
李天然, 许月英, 征荣, 等. 1998. 珍稀频危植物四合木体细胞胚胎发生的组织学观察. 内蒙古大学学报(自然科学版), 29(2): 245-249. |
宋珍, 张剑, 李艳慧, 等. 1998. 越冬埋藏对提高悬铃木硬枝扦插成活率的影响. 河北林果研究, 13(3): 207-215. |
唐巍, 郭仲琛. 1998. 火炬松胚性愈伤组织诱导和植株再生的研究. 林业科学, 34(3): 115-119. DOI:10.3321/j.issn:1001-7488.1998.03.017 |
王影. 1991. 杨树细胞悬浮培养及体细胞胚胎发生的研究. 南京林业大学学报, 15(3): 31-36. |
卫志明, 尹冬明, 黄敏仁, 等. 1991. 悬铃木叶肉原生质体培养再生植株. 植物学报, 33(11): 813-818. |
杨金玲, 桂耀林, 杨银根, 等. 1997. 白杄体细胞胚胎发生及其植株再生. 植物学报, 39(4): 315-321. |
袁巧平, 董茂山, Jay-Allemand C. 1990. 离体条件下核桃器官发生和体细胞胚胎发生. 林业科学, 26(6): 495-498. |
张立功, 张永华. 1981. 杨树体细胞胚状体的诱导发生. 林业科学, 17(4): 426-427. |
周业恒, 江守和, 鲁润龙, 等. 1993. 悬铃木无球果育种的研究. 园艺学报, 20(3): 295-298. DOI:10.3321/j.issn:0513-353X.1993.03.023 |
Becwar M R, Nagmani R, Wann S R. 1990. Initiation of embryogenic cultures and somatic embryos development in loblolly pine. Can J For Res, 20: 810-816. DOI:10.1139/x90-107 |
Choi Y E, Yang D C, Kim H S, et al. 1997. Distribution and changes of reserve materials in cotyledon cells of ginseng related to direct somatic embryogenesis and germination. Plant Cell Reports, 16: 841-846. DOI:10.1007/s002990050331 |
Emily E C. 1991. Plantlet multiplication from white pine (Pinus strobus L.) embryos in vitro: bud induction and rooting. Plant Cell, Tissue and Organ Culture, 26: 107-114. DOI:10.1007/BF00036114 |
Fan G Q, Zhai X Q, Zhai C J, et al. 2001. Callus induction from leaves of different Paulownia species and its plantlet regeneration. Journal of Forestry Research, 12(4): 209-214. DOI:10.1007/BF02856709 |
Gupta P K, Durzan D J. 1987. Biotechnology of somatic polyembryogenesis and plantlet regeneration in loblolly pine. Biotechnology, 5: 147-151. |
Hakman I, Fowke L C, Von Arnold S, et al. 1985. The development of somatic embryos on tissue cultures initiated from immature embryos of Picea abies. Plant Sci, 38: 53-59. DOI:10.1016/0168-9452(85)90079-2 |
Hakman I, Fowke L C. 1987. Somatic embryogenesis in Picea glauca and Picea mariana. An J Bot, 65: 656-659. |
Julie A. 1986. Techniques for enhanced release of leaf protoplast in Populus. Plant Cell Reports, 5: 284-287. DOI:10.1007/BF00269823 |
Laine E, David A. 1990. Somatic embryogenesis in immature embryos and protoplast of Pinus caribaea. Plant Sci, 69: 215-224. DOI:10.1016/0168-9452(90)90120-D |
Liu G, Bao M. 2003. Adventitious shoot regeneration from in vitro cultured leaves of London plane tree (Platanus acerifolia Willd.). Plant Cell Reports, 21: 640-644. |
Marino G, Bertazza G, Magnanini E, et al. 1993. Comparative effects of sorbitol and sucrose as main carbon energy sources in micropropagation of apricot. Plant Cell Tissue Organ Cultures, 34: 235-244. DOI:10.1007/BF00029712 |
Mol H, Von Arnold S. 1991. Origin and development of embryogenic cultures from seedlings of Norway Spruce(Picea abies). J Plant Physiol, 138: 223-230. DOI:10.1016/S0176-1617(11)80275-0 |
Mukherjee S K, Rathinasabapathi B, Gupta N. 1991. Low sugar and osmotic requirements for shoot regeneration from leaf pieces of Solanum melongena L. Plant Cell Tissue Organ Cultures, 25: 13-16. DOI:10.1007/BF00033906 |
Tang W. 2000. High-frequency plant regeneration via somatic embryogenesis and organogenesis and in vitro flowering of regenerated plantlets in Panax ginseng. Plant Cell Reports, 19: 727-732. DOI:10.1007/s002999900170 |
Von Arnold S, Woodward S. 1988. Organogenesis and embryogenesis in mature embryos of Picea sitchensis. Tree Physiol, 4: 291-300. DOI:10.1093/treephys/4.3.291 |
Wang Z, Lehmann D, Bell J, et al. 2002. Development of an efficient plant regeneration system for Russian wildry (Psathyrostachys juncea). Plant Cell Reports, 20: 797-801. DOI:10.1007/s00299-001-0410-3 |
 2004, Vol. 40
2004, Vol. 40