文章信息
- 李新国, 孟庆伟, 赵世杰.
- Li Xinguo, Meng Qingwei, Zhao Shijie.
- 强光胁迫下银杏叶片的光抑制及其防御机制
- Photoinhibition and Photoprotection Mechanisms in Ginkgo biloba Leaves under Strong Light Stress
- 林业科学, 2004, 40(3): 56-59.
- Scientia Silvae Sinicae, 2004, 40(3): 56-59.
-
文章历史
- 收稿日期:2002-10-10
-
作者相关文章
2. 山东农业大学生命科学学院 泰安 271018
2. College of Life Sciences, Shandong Agricultural University Tai'an 271018
光是植物光合作用的能量来源,但是,光能过剩会引起光合作用的光抑制,甚至会引起光合机构的光氧化破坏(Demmig-Adams et al., 1992a),因此光强对光合作用具有最直接最重要的影响。光抑制是指植物叶片所接受的光能超过光合作用所能利用的数量时光合功能降低的现象(许大全等,1992)。光抑制程度取决于光合机构保护机制的运转与光系统Ⅱ(PSⅡ)反应中心破坏两方面的平衡状态(Demmig-Adams et al., 1992a)。Ögren等(1990)指出,光抑制能使植物的碳同化能力下降10%,并且随着胁迫的增强,光抑制的程度加重。
孟庆伟等(1995;1999)观察到晴天中午银杏(Gingko biloba)叶片会发生严重的光合“午休”现象,并推测与光抑制有关。自然条件下,强光引起银杏叶片D1蛋白的快速周转,但是单一的强光胁迫不会引起D1蛋白的净损失(张宁等,1999),表明银杏叶片的光保护机制是相当有效的,这些保护机制包括依赖于叶黄素循环的非辐射能量耗散、光呼吸、PSⅡ反应中心的可逆失活等。所谓叶黄素循环是指当光能过剩时,双环氧的紫黄质(V)发生去环氧化作用,通过单环氧的花药黄质(A)形成玉米黄质(Z),耗散过剩光能。当光照减弱时,Z又通过环氧化作用形成V(Demmig et al., 1987;Demmig-Adams et al., 1992b)。与小麦不同,光呼吸似乎不能减轻强光下银杏叶片的光抑制程度(孟庆伟等,1999)。同时,强光胁迫下气孔限制是银杏叶片光合下降的主要原因(李新国等,1998)。PSⅡ反应中心的光破坏会造成初始荧光(Fo)上升,而能量耗散增加会引起Fo下降(Demmig et al., 1987)。然而,Fo增加也可能是由PSⅡ反应中心失活造成的(Krause et al., 1991)。相当多的研究表明,PSⅡ反应中心的失活与PSⅡ反应中心的不可逆破坏或降解无关(Kirilovsky et al., 1990)。因此,PSⅡ反应中心的可逆失活也被看作是保护PSⅡ反应中心免受破坏的有效机制(Chow, 1994)。
气孔限制是强光胁迫下银杏叶片光合下降的主要原因(李新国等,1998)。强光胁迫下,银杏叶片的光保护机制,Fv/Fm下降的主要原因?阐明这些问题对指导银杏栽培,尤其是以采叶为主的生产具有重要意义。
1 材料与方法 1.1 植物材料及处理2a生银杏苗自然条件下盆栽。盆直径45cm,盆高50cm,装土5kg,常规管理。将植株置于光下,叶片平展,于室温(25℃)和1 200μmol photons·m-2 s-1光强下照射5h。试验用材为连体完全展开叶,多叶同时处理。
1.2 叶绿素荧光参数的测定采用脉冲调制式荧光仪FMS2(英国Hansatech公司)。用于电子传递的光能占叶片所吸收光能的比例,即PSⅡ实际光化学效率按ΦPSⅡ=(Fm′-Fs)/Fm ′计算,式中,Fm′为光适应条件下的最大荧光,Fs为稳态荧光。另外,通过PSⅡ的电子传递速率ETR=ΦPSⅡ×PFD×0.5×0.84,式中,PFD为光量子通量密度;非光化学猝灭NPQ=(Fm-Fm′)/Fv,式中,Fm为最大荧光,Fv为可变荧光;天线热耗散HDR=(1-Fv′/F m′) ×PFD×0.5×0.84(Demmig-Adams et al., 1992b),式中,Fv ′为光适应条件下的可变荧光;PSⅡ最大光化学效率Fv/Fm=(Fm-Fo)/Fm(Genty et al., 1989),式中,Fo为初始荧光。在进行光强处理之前,将植株置于暗处2h以上以获得其完全暗适应后的Fv/Fm值,而在光强处理过程中的Fv/Fm值,只在暗适应5min后测定。
1.3 叶黄素循环组分分析用直径1cm的打孔器取叶圆片8~10片,放入研钵,加少许石英砂与CaCO3,用100%丙酮研成匀浆。1 000r·min-1离心5min,叶黄素循环各组分的高压液相色谱分析参照赵世杰等(1995)的方法。
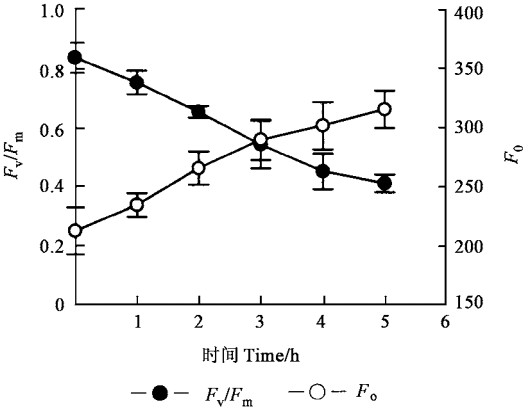
2 结果与分析 2.1 强光胁迫对银杏叶片PSⅡ光化学效率(Fv/Fm)的影响强光胁迫5h,银杏叶片的PSⅡ最大光化学效率(Fv/Fm)大幅度下降,胁迫结束时,Fv/Fm值接近于0.3,说明银杏叶片发生了严重的光抑制,而初始荧光(Fo)在整个处理过程中是上升的(图 1),表明PSⅡ反应中心的可逆失活很可能是银杏叶片的一种有效光保护机制(Xu et al., 1996)。
|
图 1 强光胁迫下银杏叶片的Fo及Fv/Fm的变化(Means±SD,n=5) Fig. 1 Changes of Fo and Fv/Fm in G. biloba leaves under strong light stress(Means±SD, n=5) |
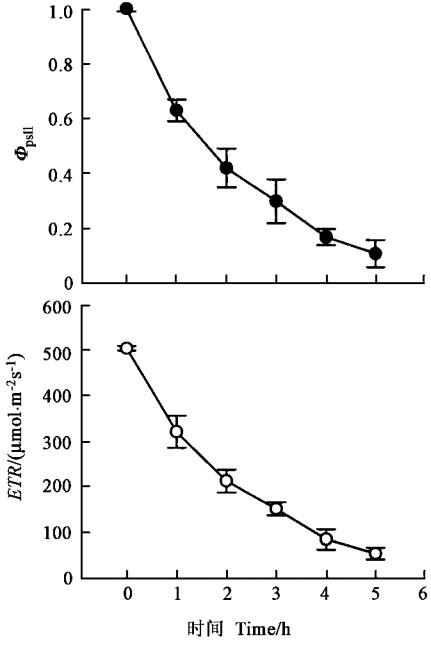
由图 2可以看出,随着处理时间的延长,用于电子传递的能量占PSⅡ所吸收光能的比例(ΦPSⅡ)逐渐降低,通过PSⅡ反应中心的表观光合电子传递速率(ETR)也明显降低,表明光抑制程度加重。ΦPSⅡ越高,意味着PSⅡ光化学反应所利用的光能就越多,同时表明过剩的光能越少,因此光抑制程度越小;相反,ΦPSⅡ越低,则PSⅡ光化学反应利用的光能就越少,过剩的光能就越多,即光抑制程度越大。
|
图 2 强光对银杏叶片PSⅡ实际光化学效率(ΦPSⅡ)和表观光合电子传递速率(ETR)的影响(Means±SD, n=5) Fig. 2 Effect of strong light on ΦPSⅡ and ETR of G. biloba leaves(Means±SD, n=5) |
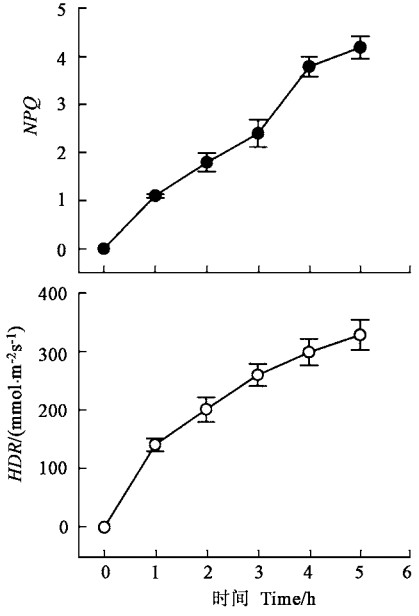
强光胁迫下,银杏叶片的非光化学猝灭(NPQ)明显增加,NPQ由处理前的0升到胁迫结束时的4.2,天线热耗散(HDR)也大幅增加,HDR由0升到330μmol ·m-2s-1(图 3),表明强光胁迫过程中NPQ及HDR都起到有效耗散过剩能量的作用(Demmig-Adams et al., 1992b)。
|
图 3 强光胁迫下银杏叶片的能量耗散(Means±SD,n=5) Fig. 3 Energy dissipation in G.biloba leaves under strong light stress(Means±SD, n=5) |
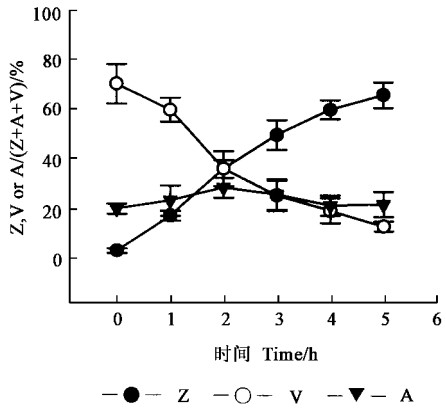
强光胁迫过程中,除环氧玉米黄质(A)变化幅度较小之外,V和Z的变化均较明显(图 4)。随着强光胁迫时间的延长,V的脱环化作用加强,由处理前的70%下降到胁迫结束时的13%,Z的相对含量逐渐增高,由处理前的3%升到胁迫结束时的66%,其变化趋势与NPQ相仿(图 3),而与Fv/Fm相反(图 1),说明强光下叶片光化学效率的降低至少部分地同依赖叶黄素循环的非辐射能量的加强有关。
|
图 4 强光胁迫对银杏叶片叶黄素循环各组分相对含量的影响(Means±SD, n=3) Fig. 4 Effect of strong light stress on the relative levels of Z, A or V of the xanthophyll cycle in G.biloba leaves(Means±SD, n=3) |
Ögren等(1984)认为,非辐射能量耗散的增加会使初始荧光Fo下降,而其上升是由PSⅡ反应中心的破坏造成,但是PSⅡ反应中心的可逆失活也会使Fo升高(Krause et al., 1991)。因此,Xu等(1996)认为,导致Fo改变的至少有非辐射能量耗散、PSⅡ反应中心可逆失活和破坏3个因素,所以Fo变化的方向取决于这些因素中起主要作用的因素。强光胁迫过程中,银杏叶片的Fv/Fm大幅度下降,表明5h的强光处理使银杏叶片发生了严重的光抑制(图 1),而且Fo的大幅度上升则表明PSⅡ反应中心出现可逆失活或破坏(李新国等,1998)。但是强光胁迫并不能造成D1蛋白的净损失(张宁等,1999),所以5h的强光胁迫并不能引起PSⅡ的破坏,而是引起PSⅡ反应中心的可逆失活。
从对高等植物的研究看,NPQ增加与Z含量增加间的联系可能是通过2个途径来完成的(Figueroa et al., 1997)。第一个途径是如果叶绿素与Z紧密排列,能量从叶绿素转移到Z过程中使受激发的单线态叶绿素直接猝灭,叶黄素循环就会起到猝灭作用;第二个途径是Z通过提高大部分聚光色素复合体的聚集程度来改变类囊体膜的特性,或是改变类囊体膜的流动性。在这个途径中Z在热能耗散机制中起一个激活的作用,好象是一个猝灭的放大器而不是起直接的猝灭作用。总之,依赖叶黄素循环的能量耗散作为非辐射能量耗散的一种方式,在光能过剩时对于保护光合机构免受破坏起了非常重要的作用(孟庆伟等,1999)。
大量的证据表明,Z参与了光合机构内防御光破坏的能量耗散过程(张宁等,1999;Demmig-Adams et al., 1992b)。银杏叶片内存在叶黄素循环,并且参与了对光合机构起保护作用的能量耗散过程(图 4)(孟庆伟等,1999),依赖叶黄素循环的非辐射能量耗散(NPQ)增加(图 3)是Fv/Fm降低的一个原因。尽管有许多证据表明,依赖叶黄素循环的热耗散是自然条件下保护光合机构免受强光破坏的重要途径(孟庆伟等,1999;Demmig-Adams et al., 1992a),但Fo在强光下上升的事实(图 1)表明叶黄素循环不可能是强光胁迫下银杏叶片Fv/Fm下降的主要原因,主要原因很可能是PSⅡ反应中心的可逆失活。
HDR是非常重要的能量耗散过程(图 3)(Demmig-Adams et al., 1992b),在叶片吸收光能不变的情况下,ETR明显降低(图 2),因此,过多的能量以非辐射能量耗散的形式耗散掉,减轻对PSⅡ反应中心的激发压力,从而起到保护PSⅡ反应中心的作用。
ΦPSⅡ的变化可以说明2个问题,一是ΦPSⅡ可以反映光抑制的程度;二是ΦPSⅡ短时间的下降是自然条件下光合作用的一种常见现象(Demmig-Adams et al., 1992a),这种下降被认为是PSⅡ功能的下调,用于维持光驱动的电子传递与羧化或加氧作用对还原力需求之间的平衡(Krause et al., 1991)。强光胁迫下,银杏叶片ΦPSⅡ的下降(图 2)同样反映了上述2个方面,而且ETR(图 2)的下降表明随着光照时间的延长,光抑制程度加重。由于PSⅡ反应中心的可逆失活甚至破坏以及PSⅡ功能的下调,通过PSⅡ反应中心用于碳同化的电子流减少,从而减少了流向光系统Ⅰ(PSⅠ)的电子,可能对PSⅠ起到一定的保护作用,因为PSⅡ的破坏逐渐增强会减弱其作为电子受体和通过P700+以热的形式耗散过剩能量以保护PSⅠ(Schnettger et al., 1994)。PSⅠ和PSⅡ之间有相互协调的关系,PSⅡ复合体吸收光能的过程与PSⅠ反应中心的氧化状态有严格的相关性,这种相关性可能对于揭示尚不明确的活体类囊体上PSⅠ和PSⅡ活性之间存在某种调节机制有启示作用,而且胁迫条件下,PSⅡ与PSⅠ之间激发能分配的协调性是植物在生长过程中2个光系统天线色素含量保持基本平衡的结果(李新国等,2002)。
综上所述,尽管强光引起净光合速率下降的主要原因是气孔限制(李新国等,1998),强光胁迫仍然是引起银杏叶片发生光抑制的一个重要原因。发生光抑制时,除D1蛋白的快速周转(张宁等,1999)对银杏叶片反应中心起到保护作用以外,有效的能量耗散过程(NPQ和HDR)是强光胁迫下防御光破坏的一个重要机制,而PSⅡ反应中心的可逆失活则是主要的防御PSⅡ反应中心免受光破坏的保护机制。
李新国, 段伟, 孟庆伟, 等. 2002. PSⅠ的低温光抑制. 植物生理学通讯, 38(4): 375-381. |
李新国, 许大全, 孟庆伟. 1998. 银杏叶片光合作用对强光的响应. 植物生理学报, 24(4): 354-359. DOI:10.3321/j.issn:1671-3877.1998.04.007 |
孟庆伟, Weis E, 邹琦, 等. 1999. 银杏叶片的光抑制和光保护机制:温度、CO2和O2的影响. 植物学报, 41(4): 398-404. |
孟庆伟, 王春霞, 赵世杰, 等. 1995. 银杏光合特性的研究. 林业科学, 31(1): 69-71. |
许大全, 张玉忠, 张荣铣. 1992. 植物光合作用的光抑制. 植物生理学通讯, 28(4): 237-242. |
张宁, 孟庆伟, 赵世杰, 等. 1999. 光胁迫下银杏光合作用的光抑制. 西北植物学报, 19(3): 461-465. |
赵世杰, 孟庆伟, 许长城, 等. 1995. 植物组织中叶黄素循环组分的高效液相色谱分析法. 植物生理学通讯, 31(6): 438-442. |
Chow W S. Photoprotection and photoinhibitory damage. In: Barber J (eds). Molecular processes of photosynthesis. London: JAI Press, 1994: 151-196
|
Demmig B, Winter K, Krüger A, et al. 1987. Photoinhibition and zeaxanthin formation in intact leaves. A possible role of xanthophyll cycle in the dissipation of excess light energy. Plant Physiol, 84: 218-224. DOI:10.1104/pp.84.2.218 |
Demmig-Adams B, Adama W W Ⅲ. 1992b. Photoprotection and other responses of plants to high light stress. Ann Rev Plant Physiol Plant Mol Biol, 43: 599-626. DOI:10.1146/annurev.pp.43.060192.003123 |
Demmig-Adams B, Adams W W Ⅲ. The xanthophyll cycle. In: Young A et al. Carotenoids in photosynthesis. Berlin/Heidelberg: Springer, 1992a: 405-432
|
Figueroa F L, Jiménez C, Lubian L M, et al. 1997. Effects of high irradiance and photoinhibition in Nannochloropsis gaditana Lubian (Eustigmatophyceae). J Plant Physiol, 151: 6-13. DOI:10.1016/S0176-1617(97)80030-2 |
Genty B, Briantais J M, Baker N R. 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochim Biophys Acta, 990: 87-90. DOI:10.1016/S0304-4165(89)80016-9 |
Kirilovsky D, Vernotte C, Etienne A L. 1990. Protection from photoinhibition by low temperature in Synechocystis 6714 and in Chlamydomonas reinhardtii: Detection of an intermediary state. Biochemistry, 29: 8100-8106. DOI:10.1021/bi00487a016 |
Krause G H, Weis E. 1991. Chlorophyll fluorescence and photosynthesis: The basics. Ann Rev Plant Physiol Plant Mol Biol, 42: 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |
Ögren E, Oquist G. 1984. Photoinhibition of photosynthesis in Lemna gibba induced by the interaction between light and temperature Ⅱ. Chlorophyll fluorescence at 77K. Physiol Plant, 62: 193-204. DOI:10.1111/j.1399-3054.1984.tb00370.x |
Ögren E, Sjöstöm M. 1990. Estimation of the effect of photoinhibition on the carbon gain in leaves of a willow canopy. Planta, 181: 560-567. |
Schnettger B, Critchley C, Santore U J, et al. 1994. Relationship between photoinhibition of photosynthesis, D1 protein turnover and chloroplast structure: effects of protein synthesis inhibitors. Plant Cell Environ, 17: 55-64. DOI:10.1111/j.1365-3040.1994.tb00265.x |
Xu D Q, Wu S. 1996. Three phases of dark-recovery course from photoinhibition resolved by the chlorophyll fluorescence analysis in soybean leaves under field conditions. Photosynthetica, 32: 417-423. |
 2004, Vol. 40
2004, Vol. 40

