文章信息
- 肖辉林.
- Xiao Huilin.
- 大气氮沉降对森林土壤酸化的影响
- EFFECTS OF ATMOSPHERIC NITROGEN DEPOSITION ON FOREST SOIL ACIDIFICATION
- 林业科学, 2001, 37(4): 111-116.
- Scientia Silvae Sinicae, 2001, 37(4): 111-116.
-
文章历史
- 收稿日期:1999-11-30
-
作者相关文章
由于人类活动的影响, 几十年来, 大气氮化合物的沉降量已明显增加(Bartnicki et al., 1989; Brimblecombe et al., 1982)。大气氮沉降量的增加, 已成为许多森林的新生态因子(Aber et al., 1989; Skeffington, 1990; Kazda, 1990)。早期的观点认为, 大气氮沉降通常是一种有利且有限的养分来源; 但现在这种观点受到了挑战, 大气氮沉降对森林的作用视林地的养分状况和氮输入量大小而定。大气氮沉降对森林生态系统的影响是多方面的, 其中, 它对森林土壤酸化的影响, 是一个不可忽视的重要问题。本文围绕这方面进行探讨, 旨在为森林生态系统的物质循环研究和环境保护提供科学依据。
1 大气氮沉降状况大气沉降的氮化合物有干、湿两种。湿沉降的氮主要是NH4+和NO3-, 以及少量的可溶性有机氮。干沉降的氮主要有气态NO、N2O、NH3, 以及(NH4) 2SO4和NH4NO3粒子, 还有吸附在其它粒子上的氮。除了自然来源之外, 大气中的氮化合物主要来源于工业(NOX)、化石燃料的燃烧(NOX)、农田施肥和集约畜牧业(NHX)。
北美和西欧非城市地区的雨水分析显示了19世纪中叶以来, NO3-的年沉降量有显著的增加, 而NH4+沉降水平则相对稳定(Brimblecombe et al., 1982)。北欧和西欧的资料也反映了从本世纪50年代至80年代, 雨水中的NO3-平均浓度明显增加, 而NH4+平均浓度在大多数地区有所上升, 在少数地区则变化趋势不明显(Rodhe et al., 1986)。总的来说, 氮沉降量已明显增加。
世界各地大气氮沉降的通量受氮的排放量的支配。氮沉降与氮排放呈线性关系(Bartnicki et al., 1989)。目前欧洲污染最严重的地区, 降雨中的NH4+-N平均浓度大于0.9 mg·L-1, NO3--N大于0.7 mg·L-1, 这种浓度向着污染较轻的地区逐渐下降, 在大不列颠北部和斯堪的纳维亚中部NH4+-N约为0.3 mg·L-1, NO3-约为0.15~0.30 mg·L-1 (Grennfelt et al., 1986)。欧洲大部分地区氮沉降量超过10 kg·hm-2·a, 在比利时、荷兰、卢森堡等3国和中欧的一部分地区, 氮沉降量超过30 kg·hm-2·a, 欧洲边远地区减少至1 kg·hm-2a-1) (Bartnicki et al., 1989)。近十多年来, 我国在南方一些地区对降雨中的氮进行了观测, 结果表明, 各地雨水中的含氮量和由降雨带入的氮量, 都有很大的变幅; 就平均而言, 雨水中的含氮量多在1~2 mg/L之间, 带入的氮量多在9.0~19.5 kg·hm-2a-1之间(朱兆良等, 1992)。
就森林的大气氮输入而言, 目前中欧森林大气氮输入为25~60 kg·hm-2a-1, 大大超过了森林的年需要量(Kazda, 1990); 在北美, 森林地区大气氮沉降量一般为2~40 kg·hm-2a-1 (Lovett et al., 1982; Parker, 1983)。在我国的一些森林中, 已发现有很高的氮沉降量, 例如在江西分宜县大冈山林场的杉木(Cunninghamia lanceolata)林和马尾松(Pinus massoniana)林中, 降雨氮输入分别为60.6 kg·hm-2a-1和57.0 kg·hm-2a-1 (马雪华, 1989)。长期而持续的高氮输入可导致森林土壤酸化。为了更好地说明氮在土壤酸化中的作用, 有必要先概述氮在土壤中的迁移和转化。
2 森林土壤中氮的迁移与转化森林土壤是森林生态系统最大的氮库, 通常超过生态系统总氮量的85% (Cole et al., 1981)。大部分土壤氮是隋性的且对于植物吸收和土壤氮淋溶是无效的, 只有缺乏严格定义的那部分“可矿化的”氮库才具有生物学意义上的活动性。虽然NH4+强烈地吸附于阳离子交换场所, 但在未受扰动的土壤中NH4+库很小。土壤中可交换的NH4+含量在施肥后的一个较短的时期内(6~12个月)可被提高, 但随着被植物和异养微生物吸收, 以及硝化作用、挥发, 而迅速降至低水平(Johnson, 1992)。硝化过程中产生的NO3-可部分地被植物和微生物吸收, 或在一些厌气土壤中被还原为气态氮(N2、N2O)。由于NO3-难以吸附于大多数土壤中, 所以在好气土壤中硝化作用总是导致NO3-淋失的增加。土壤的低pH值通常不利于硝化作用(朱兆良等, 1992), 但在增加氮的有效性或降低植物氮需求的条件下, 低pH土壤中的净硝化也可发生(Jonhnson, 1988; McNulty et al., 1990)。许多研究表明, 在高大气氮输入的条件下, 低pH土壤也有显著的硝化率(Aber et al., 1989; Van Breemen et al., 1982; 1987)。
异养菌、植物和硝化细菌之间对氮的竞争被认为在决定氮保留于生态系统内的程度中起重要作用(Riha et al., 1986)。输入森林生态系统的NH4+和NO3-的去向主要决定于它们的供应动态、土壤有效氮和有效碳状况, 以及土壤中分解者群体对C/N比率的要求(Duckworth et al., 1991)。异养菌是最强的短期的氮竞争者(Schimel et al., 1989)。在氮成为有限基质的土壤中, 异养微生物将对任何有效氮进行激烈的竞争, 导致氮的净固定。有效性氮的较大输入将对这种固定需求起更大的作用。一旦这种需求达到满足, 进一步的氮输入将导致生态系统富氮, 过剩的NH4+将引发硝化作用(Van Miegroet et al., 1990)。
林分年龄是决定森林生态系统中氮吸收量和氮增长率的重要因素(Johnson, 1992)。在生长的早期阶段, 林地自瘦迅速, 凋落物和养分归还在林分的发育过程中只是逐渐增加(Polglase et al., 1992)。在林冠郁闭之后, 当富营养的叶片的生物量达到稳定状态时, 森林对氮的吸收量和吸收增长率迅速下降(Turner, 1981)。所以, 在氮输入相等的条件下, 成熟森林中的NO3-淋失大于幼龄森林中的NO3-淋失。
Johnson (1992)在比较一些施肥试验之后指出, 在缺氮的生态系统中, 以同样的年施氮量, 少量而频繁的氮输入(类似于大气污染物氮的输入)将比传统的、一次性施肥引起更多的氮淋溶。如果起初的硝化细菌群体数量低, 则少量而频繁的氮输入似乎比一次性施肥更有利于硝化细菌群体数量的迅速增长。如果硝化细菌的群体数量高, 则不论输入的次数如何, 硝化作用似乎都可以立即发生, NO3-淋溶将更有可能与过剩的氮输入成比例地增加。
适量的NO3-的输入可被森林生态系统所利用; 过剩的NO3-将通过淋溶或可能的反硝化作用而从土壤中除去或有少部分在土壤中积累下来。随着氮的继续输入, 其它资源(水分、光、其它养分)将成为限制因子。当氮通量(矿化和外部输入)与生物和土壤的吸收能力相等时, 生态系统可被认为是达到了“氮饱和” (肖辉林等, 1995)。
3 氮在土壤酸化中的作用NH4+和NO3-的沉降都能导致各种环境中的土壤发生酸化。土壤酸化涉及了包括植被、土壤溶液和土壤矿物在内的氮迁移的过程。氮转化在酸的生成和消耗中的作用可被定量化(表 1)。植物(或微生物)对阳离子的同化可能伴随着H+从植物体内转移到其环境土壤溶液中; 而在阴离子同化中, H+可能被转移至植物体内。在离子吸收中, 植物通过提高或降低羧化酶的含量来调节细胞溶液的pH。如果植物同化阴离子多于阳离子(例如, 当所有的氮以NO3-供应时), 则往往可通过CO2 (或更确切地说通过H2CO3)的去质子反应就从近乎中性的土壤中实现H+的去除, 导致土壤溶液中的HCO3-的增加。如果同化阳离子多于阴离子(例如, 当大多数氮以NH4+供应时), 则往往可通过风化或离子交换反应来中和反应的副产物H+。所以, 植物的氮营养在土壤-植被生态系统中质子帐中扮演着关键的角色。如果有机氮矿化为NO3-和(或) NH4+的数量等于原来的同化量, 则H+迁移过程达到平衡, 整个过程对于生态系统的质子帐没有重要性。但是, 当氮以肥料[例如, 以(NH4) 2SO4、NaNO3或尿素]或以大气污染物的形式输入时, 氮反应在生态系统的H+帐中就显得极为重要。
|
|
在表 1的反应式中, 在分子氮的环境水平条件下, NO3-具有氮的热力学稳定性, 故那些含有氮的较低氧化态的化合物可最终被氧化成NO3-, 向环境释放出H+。这种氧化反应大多数有微生物作中介参与。N2固定的净效应是一种直接的N2氧化反应。在土壤有机质中那些先前被植物固定的氮可被矿化和硝化。经过一个地质年代的时间尺度, 这些过程可导致土壤和水体的过度酸化。
森林生态系统中, 氮转化产生的净H+通量可用净NH4+输入加上净NO3-输出来计算(Van Breemen, 1983)
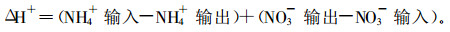
|
不带电荷的气态氮(NOx、N2, NH3)在生态系统中的输入和输出不必列入。不带电荷的气态氮(表 1)不直接参与质子迁移反应, 只有通过NH4+和NO3-的生成或消耗, 这些形式的氮最终才参与H+循环(Van Breemen, 1983)。内部氮循环(氮矿化-矿化氮的吸收-凋落物中的氮, 等等)不需考虑, 因为这些循环是封闭的, 伴随产生的H+或HCO3-将达到平衡(Nilsson, et al., 1988)。
上式中, 输入和输出项应包括所有的输入和输出, 不能只算湿沉降和淋溶。NH4+和NO3-的输入与输出之间的平衡状态影响着土壤-土壤溶液系统的酸化速率。实验表明, 当氮主要以NH4+被植被吸收时, 根际pH下降; 当NO3-为植物的主要氮源时, 可观察到有相反的pH效应(Nye, 1981)。
酸雨通常含有较高浓度的可溶性NH4+、NO3-和SO42-。NH4+在植物表面往往以(NH4) 2SO4的形式存在(Van Breement et al., 1982), 被雨水淋溶之后, (NH4) 2SO4降落到土壤, 并在硝化过程中迅速氧化为HNO3和H2SO4。这个过程可产生极低的pH值, 例如, 在荷兰一处氮沉降量很高并以欧洲白栎(Quercus robur)和垂枝桦(Betula pendula)为主的林地上, 土壤pH值降至2.8~3.5, 引起了非石灰性土壤和石灰性土壤分别出现高浓度的可溶性铝和高浓度的NO3- (Van Breemen et al., 1982)。
由于土壤对NH4+有较强的吸附作用, NH4+淋溶在大多数土壤中可被忽略。如果土壤中的NH4+超过植被和土壤微生物的需求, 硝化细菌的群体数量将迅速增长, 硝化率将提高。如果NO3-淋失和金属阳离子伴随其淋失, 则土壤的ANC (酸中和容量)将相应下降。
大气的NH4+沉降可能比NO3-沉降更能促进土壤酸化(Skeffington, 1990), 因为在硝化过程中, 1 mol NH4+被转化为NO3-时可产生2 mol H+。实验表明, NH4+的硝化和过剩的NO3-的淋失是主要的酸化机制(Bergkvist et al., 1992)。
4 氮沉降的增加将加速森林土壤酸化如前面所述, 在缺氮的森林土壤中, 各种生物组分别对有限供应的有效氮进行激烈的竞争。在有机分解的过程中释放的NH4+将被迅速吸收而达到生物学上的固定, 很少有NH4+基质剩下来作为进一步的微生物氧化。由于硝化减少, 氮通过NO3-淋溶而从土壤中损失将受到限制。在氮沉降量较低的地区, 几乎所有的沉降氮(> 95%)都被林冠或土壤吸收(Grennfelt et al., 1986), 氮沉降将具有施肥作用。在具有充足的氮供应的森林土壤中, 植物和微生物之间的氮竞争将不那么强烈, 大量的NH4+可供给硝化作用。由于氮不再缺乏, 且由于NO3-的易移动性质, NO3-将很可能从土壤剖面中淋出。在氮沉降量较高的地区, 氮淋失增加, 在一些森林中其淋失量达到10~15 kg·hm-2a-1, 甚至更高(Grennfelt et al., 1986)。
一些模拟氮沉降的实验表明, 土壤中NO3-的淋溶随着氮沉降的增加而增加; NO3-的淋溶, 不论是由于硝化引起的, 还是由于NO3-的加入引起的, 都具有强烈的酸化作用; 在氮饱和的森林生态系统中, 氮沉降(以NO3-或NH4+)的适当增加, 将导致NO3-淋溶的增加和土壤酸度的提高(Bergkvist et al., 1992)。有文献(Grennfelt et al., 1986)指出, 在中欧森林生态系统中, 降雨中的氮有30%从径流水中淋失; 当降雨中的无机氮输入超过13 kg·hm-2a-1时, 一些径流水中的NO3-的输出是降雨氮输入的53%~92%。在这些森林生态系统中, 氮饱和可能已经发生。
较高的氮沉降量不仅可引起NO3-的大量输出, 而且可引起盐基阳离子以等价量伴随着NO3-一起淋失(Fernandez et al., 1990)。这将反过来引起土壤盐基饱和度下降的一些养分缺乏。已有证据表明, 由于土壤中产生了过剩的NO3-, Ca2+, Mg2+等盐基阳离子的淋失随之增加(Foster et al., 1989; Watmough et al., 1990);矿质土壤中Ca2+的净损失对土壤有酸化作用(Foster et al., 1989)。土壤酸化将反过来急剧增加土壤中的阳离子特别是Al, Mn和Rb的通量(Bergkvist et al., 1992; Foster et al., 1989)。
土壤pH值和根际Al/Ca比率通常可作森林土壤酸化和潜在的森林危害的指标(Kros et al., 1993)。Van Breemen通过比较酸沉降对森林土壤的影响发现, 在石灰性土壤中, HNO3促使Ca2+活化和淋失; 在酸性土壤中, 则除了Ca2+, 还有Al3+被活化(Ulrich et al., 1983)。Al3+浓度与NO3-浓度密切相关。在许多情况下, Al3+浓度与NO3-浓度的相关性高于它与SO42-浓度的相关性, 这意味着在活化Al3+方面, HNO3比H2SO4更重要(Ulrich et al., 1983; Van Breemen et al., 1988)。NO3-浓度的上升将提高土壤溶液的酸度和Al3+浓度, 使土壤的缓冲范围由盐基阳离子向Al3+离子转移(Bergkvist et al., 1992), 即土壤的缓冲性能向着低pH范围转移。
5 土壤酸化对森林的影响由于土壤酸化, Al形态组分也可能发生变化。土壤pH的下降将可能促使Al形态组分朝着无机形态占优势的方向转移(Nilsson et al., 1988)。这种转移将使酸性的地下水、地表水或森林土壤本身进一步恶化。在中欧的一些森林生态系统中, 氮转化导致酸性土壤中的强酸输入达3.0~7.5 kmol·hm-2a-1; 在低pH条件下, 从矿质土壤中溶解出来的Al主要是以水化-Al3+形式存在(Mulder et al., 1987), 土壤溶液中铝水平的增加可导致土壤中Al-P化合物的沉淀, 引起森林磷素缺乏。
当酸化达到一定程度时, 土壤中的Al的可溶性增加, 因此可危害植物根系和菌根(Tomlinson, 1993)。试验表明, 土壤酸化使糖槭的菌根数量显著地减少(Hutchinson et al., 1999), 削弱了森林的固氮能力。土壤溶液中Al3+/Ca2+的摩尔比率对Al3+的毒性起重要作用, 如果要避免根的损害, 其比率就不应超过1.0 (Ulrich et al., 1983)。土壤中高浓度的NO3-可直接或间接地引起森林衰退, 例如, 在北美的一些森林生态系统中, 土壤中高浓度的NO3-引起了Al活化和Ca2+、Mg2+淋失, 致使Al3+/Ca2+比率和Al3+/Mg2+比率极不平衡, 其比率有的高达30~40, 有的甚至更高, 抑制了森林对Ca2+和Mg2+的吸收, 导致了森林衰退(Tomlinson, 1993)。土壤酸化使植株木质部中的重金属元素(Zn, Cr, Ni, Cd)含量显著提高(Watmough et al., 1999; Hutchinson et al., 1999), 这显然不利于森林生长。由此可见, 高氮沉降量引起的土壤酸化对森林有危害作用。
土壤酸化不仅影响土壤的化学性质, 而且可能影响土壤的物理性质。有研究指出, 土壤酸化可促进土壤腐殖质的分解(Ulrich et al., 1983)。腐殖质的分解和多价盐基离子(Ca2+, Mg2+等)的流失, 不利于土壤团聚体的形成, 有可能造成土壤物理性质恶化。这方面有待于深入研究。
马雪华. 1989. 在杉木林和马尾松林中雨水的养分淋溶作用. 生态学报, 9(1): 15-20. DOI:10.3321/j.issn:1000-0933.1989.01.015 |
肖辉林, 卓慕宁. 1995. 森林生态系统氮饱和与氮临界负荷量研究. 环境科学进展, 3(4): 59-63. |
朱兆良, 文启孝. 1992. 中国土壤氮素. 南京: 江苏科学技术出版社, 97~ 101, 296~ 298.
|
Aber J D, Nadelhoffer K J, Steudler P, et al. 1989. Nitrogen saturation in northern forest ecosystems. BioScience, 39: 378-386. DOI:10.2307/1311067 |
Bartnicki J, Alcamo J. 1989. Caculating nitrogen deposition in Europe. Water Air Soil Pollut, 47: 101-123. DOI:10.1007/BF00469001 |
Bergkvist B, Folkeson L. 1992. Soil acidification and element fluxes of a Fagus sylvatica forest as influenced by simulated nitrogen deposition. Water Air Sois Pollut, 65: 111-133. DOI:10.1007/BF00482753 |
Brimblecombe P, Stedman D H. 1982. Historical evidence for a dramatic increase in the nitrate component of acid rain. Nature, 298: 460-462. DOI:10.1038/298460a0 |
Cole D W, Rapp M. Elemental cycling in forest ecosystems. In: Reichle D E, ed. Dynamic Properties of Forest Ecosystems. London: Cambridge University Press, 1981: 341~ 409
|
Duckworth C M S, Cresser M S. 1991. Factors influencing nitrogen retention in forest soils. Environ Pollut, 72: 1-21. DOI:10.1016/0269-7491(91)90152-M |
Fernandez I J, Rustad L E. 1990. Soil response to S and N treatments in a northern New England low elevation coniferous forest. Water Air Soil Pollut, 52: 23-39. |
Foster N W, Hazlett P W, Nicolson J A, et al. 1989. Ion leaching from a sugar maple forest in response to acidic deposition and nitrification. Water Air Soil Pollut, 48: 251-261. |
Grennfelt P, Hulberg H. 1986. Effect of nitrogen deposition on the acidification of terrestrial and aquatic ecosystems. Water Air Soil Pollut, 30: 945-963. DOI:10.1007/BF00303359 |
Grennfelt P, Hultberg H. 1986. Effect of nitrogen deposition on the acidification of terrestrial and aquatic ecosystems. Water Air Soil Pollut, 30: 945-963. DOI:10.1007/BF00303359 |
Hutchinson T C, Watmough S A, Sager E P S, et al. 1999. The impact of simulated acid rain and fertilizer application on a mature sugar maple(Acer saccharum Marsh.)forest in central Ontario, Canada. Water Air Soil Pollut, 109: 17-39. DOI:10.1023/A:1005077230678 |
Johnson D W, Todd D E. 1988. Nitrogen fertilization of young yellow poplar and loblolly pine plantations at differing frequencies. Soil Sci Soc Am J, 52: 1468-1477. DOI:10.2136/sssaj1988.03615995005200050050x |
Johnson D W. 1992. Nitrogen retention in forest soils. J Environ Qual, 21: 1-12. |
Kazda M. 1990. Indications of unbalanced nitrogen of Norway spruce status. Plant Soil, 128: 97-101. DOI:10.1007/BF00009401 |
Kros J, De Vries W, Janssen P H M, et al. 1993. The uncertainty in forecasting trends of forest soil acidification. Water Air Soil Pollut, 66: 29-58. DOI:10.1007/BF00477059 |
Lovett G M, Reiners W A, Olsen R K. 1982. Cloud droplet deposition in subalpine balsam fir forests: Hydrological and chemical inputs. Science, 218: 1303-1304. DOI:10.1126/science.218.4579.1303 |
McNulty S G, Aber J D, McLellan T M, et al. 1990. Nitrogen cycling in high elevation forest of the Northastern US in relation to nitrogen deposition. Ambio, 19: 38-40. |
Mulder J, Van Grinsven J JM, Van Breement N. 1987. Impacts of acid atmospheric deposition on woodland soils in the Netherlands: Ⅲ. Aluminium chemistry. Soil Sci Soc Am J, 51: 1640-1646. DOI:10.2136/sssaj1987.03615995005100060042x |
Nilsson S I, Berden M, Popvic B. 1988. Experimental work related to nitrogen deposition, nitrification and soil acidification: A case stuey. Environ Pollut, 54: 233-248. DOI:10.1016/0269-7491(88)90114-5 |
Nye P H. 1981. Changes of pH across the rhizosphere induced by roots. Plant Soil, 61: 7-26. DOI:10.1007/BF02277359 |
Parker G G. 1983. Throughfall and stemflow in the forest nutrient cycle. Adv Ecol Res, 13: 57-133. DOI:10.1016/S0065-2504(08)60108-7 |
Polglase P J, Attiwill P M. 1992. Nitrogen and phosphorus cycling in relation to stand age of Eucalyptus regnans F Muell: Ⅰ. Return from plant to soil in litterfall. Plant Soil, 142: 157-166. DOI:10.1007/BF00010962 |
Riha S J, Campbell G S, Wolfe J. 1986. A model of competition for ammonium among heterotrophs, nitrifiers, and roots. Soil Sci Soc Am J, 50: 1463-1466. DOI:10.2136/sssaj1986.03615995005000060017x |
Rodhe H, Rood M J. 1986. Temporal evolution of nitrogen compounds in Swedish precipitation since 1955. Nature, 321: 762-764. DOI:10.1038/321762a0 |
Schimel J P, Firestone M K. 1989. Nitrogen incorporation and flow through a coniferous forest soil profile. Soil Sci Soc Am J, 53: 779-784. DOI:10.2136/sssaj1989.03615995005300030025x |
Skeffington R A. 1990. Accelerated nitrogen inputs: A new problem or a new perspective?. Plant Soil, 128: 1-11. DOI:10.1007/BF00009391 |
Tomlinson G H. 1993. A possible mechanism relating increased soil temperature to forest decline. Water Air Soil Pollut, 66: 365-380. |
Turner J. 1981. Nutrient cycling in an age sequence of western Washington Douglas-fir stands. Ann Bot, 48: 159-169. DOI:10.1093/oxfordjournals.aob.a086109 |
Ulrich B, Pankrath J. Effects of accumulation of air pollutants in forest Ecosystems. Dordrecht: D. Reidel Publishing company, 1983: 1~ 30, 171~ 182
|
Van Breemen N, Burrough P A, Velthorst E J, et al. 1982. Soil acidification from atmospheric ammonium sulphate in forest canopy throughfall. Nature, 299: 548-550. DOI:10.1038/299548a0 |
Van Breemen N, Mulder J, Driscoll C T. 1983. Acidification and alkalinization of soil. Plant Soil, 75: 283-308. DOI:10.1007/BF02369968 |
Van Breemen N, Mulder J, Van Grinsven J JM. 1987. Impacts of acid atmospheric deposition on woodland soils in the Netherlands: Ⅱ. Nitrogen transformation. Soil Sci Soc Am J, 51: 1634-1640. DOI:10.2136/sssaj1987.03615995005100060041x |
Van Breemen N, Van Dijk H F G. 1988. Ecosystem effects of atmospheric deposition of nitrogen in the Netherlands. Environ Pollut, 54: 249-274. DOI:10.1016/0269-7491(88)90115-7 |
Van Miegroet H, Johnson D W, Cole D W. 1990. Soil nitrification as affected by N fertility and changes in forest floor C N ratio in four forest soils. Can J For Res, 20: 1012-1019. DOI:10.1139/x90-135 |
Watmough S A, Hutchinson T C, Sager E P S. 1999. The impact of simulated acid rain on soil leachate and xylem chemistry in a Jack pine (Pinus banksiana Lamb.)stand in northern Ontario, Canada. Water Air Soil Pollut, 111: 89-108. DOI:10.1023/A:1005007518586 |
 2001, Vol. 37
2001, Vol. 37

