文章信息
- 初庆刚, 胡正海.
- Chu Qinggang, Hu Zhenghai.
- 油樟油细胞和粘液细胞发育的超微结构
- DEVELOPMENTAL ULTRASTRUCTURE OF OIL AND MUCILAGE CELLS IN CINNAMOMUM LONGEPANICULATUM
- 林业科学, 2001, 37(4): 19-25.
- Scientia Silvae Sinicae, 2001, 37(4): 19-25.
-
文章历史
- 收稿日期:2000-07-18
-
作者相关文章
2. 西北大学植物研究所 西安 710069
2. Institute of Botany, Northwsest University Xi'an 710069
油细胞和粘液细胞都是异细胞, 属于分泌组织之一。它们分别分布在双子叶植物的一些科内(Metcalf et al., 1957; Fahn, 1979; Bass et al., 1985; Gregory et al., 1989), 在少数科的植物中, 油细胞和粘液细胞同时存在, 樟科(Lauraceae)便是其中之一(Metcalf et al., 1957; Bass et al., 1985; 初庆刚等, 1999a), 是该科重要的解剖学特征(Metcalf et al., 1957; 初庆刚等, 1999a)。关于该科植物油细胞的研究已有一些报道, 但仅限于极少数属种内(West, 1969; Maron et al., 1979; Platt-Aloia et al., 1983; Bakker et al., 1991, 1992; Platt-Aloia et al., 1992; 初庆刚等, 1998, 1999a; 初庆刚等, 1999b, c; 初庆刚等, 1999d), 关于该科粘液细胞的研究报道则很少(初庆刚等, 1999a; Bakker et al., 1991; 1992;West, 1969; 初庆刚等, 1999c; 初庆刚等, 1999d)。同时, 关于油细胞和粘液细胞典型构造的有无, 二者的关系如何以及油和粘液产生的部位和时间等均存在争议。为此, 我们以樟科樟属(Cinnamomum)的油樟(C.longepaniculatum)为材料, 在超微水平上系统研究油细胞和粘液细胞的发育过程, 以期阐明上述有争议的问题。
樟属植物是生产樟油、樟脑等的原料植物, 而樟油、樟脑又是日用化工的重要原料, 它们与樟属植物体内的分泌细胞存在密切的联系。油樟是我国秦岭以南各省区城市主要行道树种之一, 也是林业上主要野生习见树种之一, 因此研究其油细胞和粘液细胞的发育规律, 具有理论和实践意义。
1 材料和方法研究材料于1998年5月采自西北大学植物研究所果园的油樟植株, 取其茎尖、1~4级幼叶及成熟叶片分割成1mm2组织块, 用4%戊二醛或多聚甲醛—戊二醛固定2~4h, 磷酸缓冲液(pH7.2)清洗后, 再用1%锇酸常温固定2h, 磷酸缓冲液清洗, 系列丙酮脱水, Epon812环氧树脂包埋, 60℃温箱中聚合24h (朱丽霞等, 1983)。包埋块经修整后, 在Reichert-Jung型超薄切片机上切片, 将干涉颜色为白色的超薄切片捞取到200目铜网上, 用柠檬酸铅和醋酸双氧铀各染色15~20min, 然后在JEM-200CX型和Hitachi-600型透射电镜上观察、拍照。
2 观察结果 2.1 油樟油细胞发育过程的超微结构变化油樟叶中油细胞最早发生于第二叶原基的基本分生组织中(初庆刚等, 1999d), 根据透射电镜观察结果, 油樟叶中油细胞的发育过程可以分为以下4个阶段:
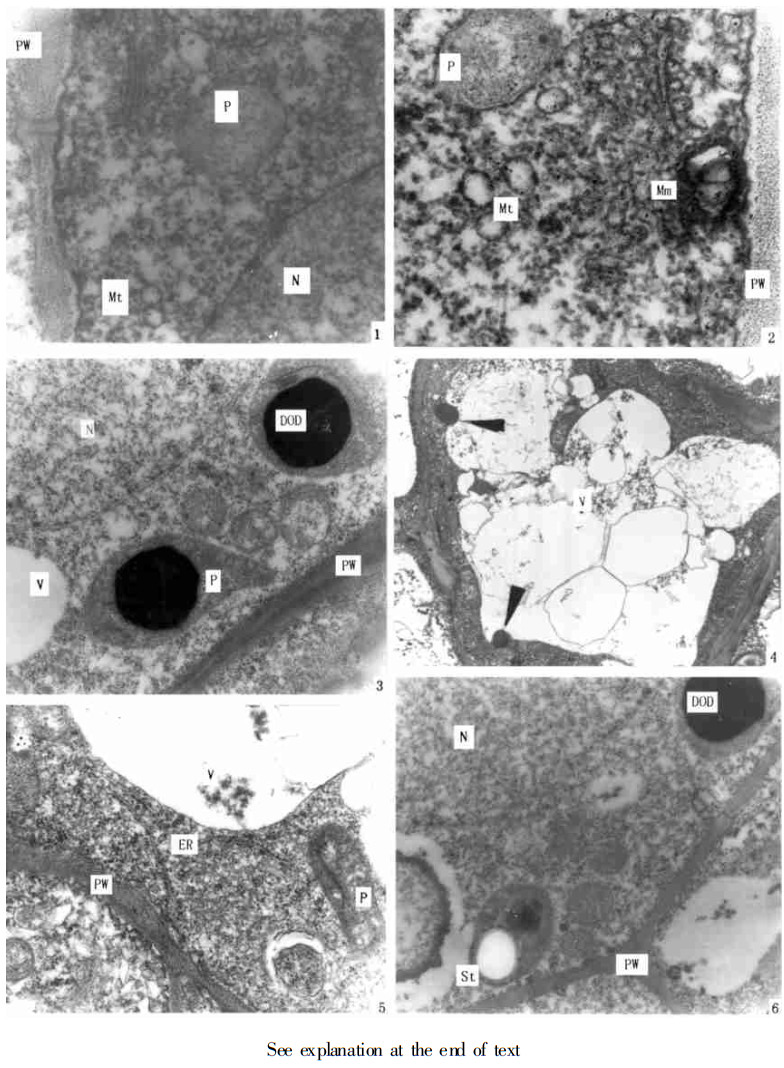
阶段1, 油细胞仅由初生纤维素壁层组成。在此阶段, 油细胞经历了原始细胞和液泡化二时期。原始细胞在尚未分化的叶原基本分生组织中均可发生, 其与周围细胞相比较具有较大的体积, 细胞核、核仁均大而明显, 液泡化程度很底, 仅具少量小的液泡且缺乏淀粉粒。细胞壁仅具初生纤维素壁, 壁与细胞质膜结合紧密(图版Ⅰ, 1~3)。在细胞质中, 可以观察到许多聚集成多核糖体的核糖体颗粒、线粒体、高尔基体、以及多膜小泡(图版Ⅰ, 1, 2)。各种形状的质体均无发育良好的类囊体(图版Ⅰ, 1~3)但质体内的变化却不尽相同, 有的质体呈灰色不透明, 内有电子透明的区域(图版Ⅰ, 1, 2), 有的质体内有大的嗜锇油滴(图版Ⅰ, 3)。原始细胞很快便液泡化, 液泡间相互融合形成中央大液泡, 中央液泡中可看到由于许多膜尚未融合的大小不等的液泡以及嗜锇物质向液泡融合的现象(图版Ⅰ, 4)。此时, 内质网变得清晰可见, 质体中仍有小的和大的嗜锇油滴(图版Ⅰ, 5, 6)。还可见具膜嗜锇油滴与液泡融合(图版Ⅱ, 1)的现象。在个别质体中还出现小的淀粉粒与嗜锇油滴并存的现象(图版Ⅰ, 6)。其它细胞器以及细胞壁等无明显变化。
|
图版Ⅰ Plate Ⅰ |
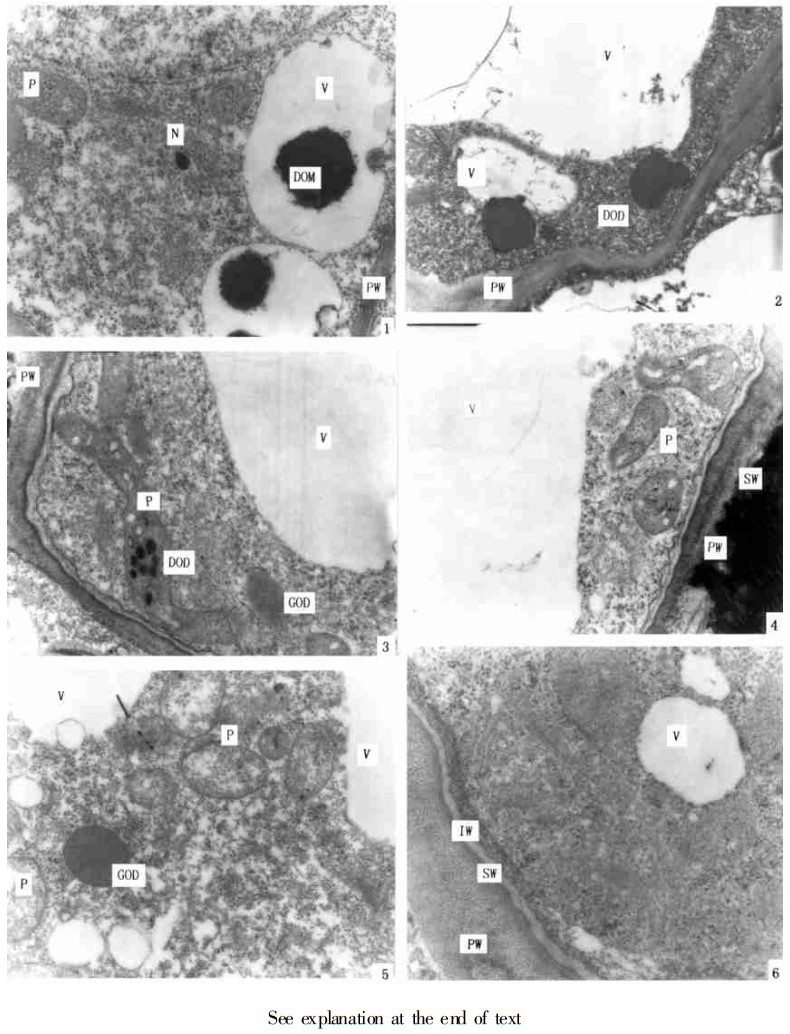
阶段2, 栓质化壁层形成。当开始形成栓质化壁层时, 细胞膜呈波浪形, 且与细胞壁的结合不太紧密(图版Ⅱ,3, 3), 形成的栓质化壁层物质呈片层状结构, 不断叠加在初生纤维素壁上, 细胞质中出现不同电子密度的嗜锇油滴(图版Ⅱ,5), 质体中具有电子透明小泡或同时具有电子透明小泡和电子不透明的油滴(图版Ⅱ, 3, 4)。
|
图版Ⅱ Plate Ⅱ |
阶段3, 内纤维素壁层形成。栓质化壁层形成以后, 内纤维素壁层形成并叠加在栓质化壁层上。栓质化壁层电子透明程度较内纤维素层高, 内纤维素层较初生纤维素壁层松散(图版Ⅱ, 6)。此时, 细胞质中仍有许多核糖体颗粒(图版Ⅱ, 6;图版Ⅲ, 1), 部分质体灰化, 并逐渐变成电子透明的液泡(图版Ⅱ, 6), 在内纤维素壁层形成的后期, 细胞质电子透明度增高。除灰化的质体外, 其它质体中有电子透明小泡和淀粉粒(图版Ⅲ, 1)。
|
图版Ⅲ Plate Ⅲ |
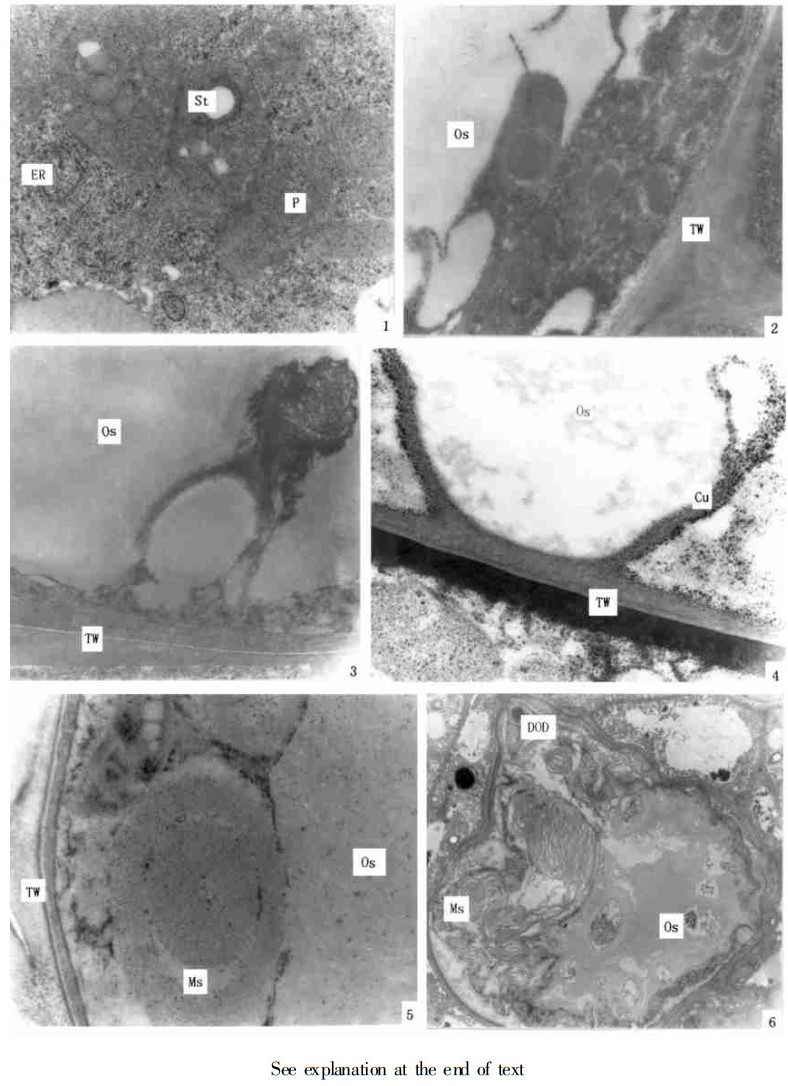
阶段4, 油细胞成熟、细胞质逐渐解体。油细胞3层壁发育完善以后, 贮油的液泡达到最大体积, 细胞质变得非常电子不透明, 以后细胞质开始解体(图版Ⅲ, 2), 并且解体以后融合到贮油液泡中(图版Ⅱ, 3), 最后细胞质基本解体, 仅剩一薄层。在此阶段, 可观察到杯形构造(图版Ⅱ, 4), 它由内纤维壁层向细胞内突起而形成的, 显然是在阶段3内纤维素壁层形成时便开始突起的。
2.2 粘液细胞的发育过程本观察结果说明, 粘液细胞和油细胞是同源的。粘液细胞的发生和早期发育与油细胞类似, 经历3层细胞壁的发育阶段。当油细胞内纤维素壁形成以后, 部分油细胞在靠近油囊边缘的细胞质中最先产生一种体积较大的膜状构造, 其膜以同心圆或螺旋线方式排列(图版Ⅱ, 5)。以后细胞质中仍不断产生这种结构, 并移向细胞中央(图版Ⅲ, 6;图版Ⅳ, 1, 2), 随着这种同心圆结构的大量产生和向细胞中央的推挤, 整个细胞腔中几乎完全由这种类似膜的结构充满(图版Ⅳ, 3)。以后膜的排列逐渐疏松、解体(图版Ⅳ, 4), 最后变成丝状的物质充满细胞腔(图版Ⅳ, 5), 丝状物质连同尚未解体的同心圆结构继续解体, 最后整个细胞腔中便由无定形的不均匀的物质所充满(图版Ⅳ, 6)。粘液细胞发育的另一种情况是在油细胞成熟以后, 细胞质完全解体或尚未完全解体时, 中央贮油囊中的油呈不均匀分布, 电子透明区和电子较不透明区域呈无定形的相间排列(图版Ⅳ, 7), 在这些油中, 逐渐出现物质分解的异常现象(图版Ⅳ, 8), 以后, 解体的范围逐渐扩大(图版Ⅳ, 9), 当油完全分解以后, 细胞腔中便也充满无定形的不均匀物质(图版Ⅳ, 6)。上述两种粘液细胞发育情况均说明, 粘液细胞是由油细胞转化来的, 其细胞壁类似油细胞的, 始终保持3层壁的构造(图版Ⅳ, 6, 9)。

|
图版Ⅳ Plate Ⅳ |
通常认为油细胞的典型构造为3层细胞壁、杯形构造、特化胞间连丝以及油囊(油的质内积累), 而关于栓质化壁层和杯形构造的有无以及油的质外积累等却一直存在争议(Baas et al., 1985)。
外纤维素壁层和内纤维素壁层之间夹着栓质化壁层(Fahn, 1979; Baas et al., 1985), 这是油细胞的典型特征。尽管Postek和Tucker (1983)认为在荷花玉兰(Magnolia grandiflora)油细胞中, 栓质化壁层是不显著、不连续或者在某些细胞中不存在, 但他们对16个科植物油细胞的综述中, 根据显微水平上的研究结果, 表明在15个科67种植物油细胞中存在栓质化壁层。而在超微水平上对北美鹅掌楸(Liriodendron tulipoifera) (Mariani et al., 1989)、菖蒲(Acorus calamus) (Amelunxen et al., 1969)、刺果番荔枝(Annona muricata) (Bakker et al., 1990)、月桂(Laurus nobilis) (Maron et al., 1979)、鳄梨(Persea americana) (Platt-Aloia et al., 1983; 1992)、阴香(Cinnamomum burmanni) (Bakker et al., 1991)、樟属(Cinnamomum) (Bakker et al., 1989; 1993)等以及本文的研究, 均证实栓质化壁层的存在。因此栓质化壁层可能是油细胞中普遍具有的构造。
杯形构造, 是一种杯形壁突起(Fahn, 1979; Baas et al., 1985), 在显微水平或超微水平上均有报道(West, 1969; Maron et al., 1979; Mariani et al., 1989)。但对荷花玉兰(Postek et al., 1983)、沼泽三白草(Saururus cernuus) (Tucker, 1976)以及鳄梨(Platt-Aloia et al., 1983; Platt-Aloia et al., 1992)等植物油细胞的研究, 均报道无杯形构造, Postek和Tucker (1983)把早期在显微水平上观察到杯形构造看作是一种因固定而引起的人为假象。但是许多学者在显微和超微水平上均观察到这一构造, 本文对油樟油细胞超微结构研究以及显微结构研究(油樟油细胞中的杯形构造是在油镜下观察到的) (初庆刚等, 1999d), 均证实了杯形构造的存在, 因此是假象的可能性不大。杯形构造不易看到的原因可能是由于未切到或者因杯形构造太小, 无法在常规放大倍数下分辨。本研究在超微水平上, 对油樟的大量切片和众多油细胞的观察中, 仅在2个油细胞中观察到杯形构造。从中反映出切片切到杯形构造的概率很小。
3.2 油产生的部位和时期油细胞的油通常是在质体中合成, Maron和Fahn (1979)认为油细胞发育早期质体中的白色透明小泡是油被提取后留下的空白, 据此说明质体是产油的主要场所, 但Fahn (1979)所引证的几项研究中, 内质网(光滑或粗糙)、线粒体、细胞基质、高尔基体, 甚至核膜都参加了油的合成, 而Platt-Aloia和Oross等(1983)有关鳄梨果实油细胞的发育研究报道了另一个主要不同, 就是内质网参加了油的积累, 而质体与油的形成没有任何关系。
用多聚甲醛—戊二醛固定的材料进行超微观察, 在油细胞的大部分的发育过程中观察到了嗜锇油脂的产生、运输和贮存。观察结果与其他学者提出的“油是在油细胞内纤维素壁层形成以后在质体或细胞质中产生”的观点不同(Maron et al., 1979; Platt-Aloia et al., 1983; Postek et al., 1983; Mariani et al., 1989; Platt-Aloia et al., 1992)。在阶段1 (即仅有初生纤维素壁层阶段)的细胞液泡化时期, 形态、大小各异的质体中有大小不等的嗜锇油滴, 细胞质中也有膜结构不清楚的嗜锇油滴, 并观察到嗜锇油滴融合到正在相互融合的液泡中, 由此可以说明油最早是在仅具初生纤维素壁层的油细胞中开始产生的。在阶段2, 3的发育时期, 不仅质体有嗜锇油滴, 细胞质中也有, 并且出现灰色嗜锇质体和油滴。根据嗜锇物质的动态变化, 可以推测, 油可能主要在质体中产生, 然后才到细胞质中。黑色嗜锇质体可以淡化成灰色嗜锇质体, 二者也可以淡化成液泡, 最终不同电子透明程度的质体和嗜锇油滴均融合到液泡中。当内纤维素壁层形成后至完全成熟, 中央大液泡变成了贮油囊。
3.3 粘液细胞的发育和典型结构以往在超微水平对樟科植物粘液细胞发育过程的研究, 都侧重于壁构造的发育(Bakker et al., 1989; 1991;1993)。Bakker和Gerritsen (1989)以及Bakker和Gerritsen等(1991)两度对同一种樟科樟属植物—阴香粘液细胞发育进行研究, 观察到了同样的结果。所不同的是前者仅研究粘液细胞的发育, 后者同时比较研究油细胞和粘液细胞的发育过程, 并且更细致、更深入一些。他们将粘液细胞的发育过程分为4个阶段, 阶段1和阶段2与油细胞是相同的, 也就是说在栓质化壁层形成以前是相同的, 但在阶段3以后, 油细胞开始形成内纤维素壁层和油, 而粘液细胞开始形成为粘液, 并且粘液积累在栓质化壁层和质膜之间。Bakker和Baas (1993)对樟科和番荔枝科粘液细胞壁发育的综述性研究报道, 证明最早积累的多糖粘液的性质类似于油细胞中的内纤维素壁层。这些研究报道, 均说明樟科植物粘液细胞的粘液确实积累在质膜以外, 以后细胞壁以内的区域, 被粘液完全充满。遗憾的是尽管两度对同一种植物粘液细胞发育过程进行超微结构研究, 都未能确定粘液到底是产生于何处, 以何方式积累到质外空间中的(Bakker et al., 1989; 1991;1993)。本研究对油樟粘液细胞发育过程的研究结果与上述粘液细胞发育及壁的发育不同:一是粘液细胞是由已形成内纤维素壁层的油细胞或者由已完全成熟且细胞质开始解体的油细胞发育而来; 其次是粘液细胞具有与油细胞相同的3层壁构造。在超微水平, 粘液呈线状或丝状被认为是粘液多糖的典型特征(Trachtenberg, 1984; 施国新等, 1991)。在这种粘液发育的过程中, 未见任何质膜、液泡膜或细胞器等, 因此未观察到粘液在质膜外积累的情况。本研究的两种粘液细胞发育的方式尚未见报道, 但上述粘液细胞在超微水平上的发育过程, 与我们在显微水平上所观察的粘液细胞发育过程相比较, 是相吻合的, 即粘液细胞是由部分已形成内纤维素壁层的油细胞发育而来(初庆刚等, 1999d)。目前, 虽然尚不能据此否认Bakker和Gerritsen (1989)以及Bakker和Gerritsen等(1991)所观察到的粘液细胞发育方式的存在, 但至少说明, 粘液细胞的发育是具有多种方式的。
前人报道, 典型的粘液细胞是没有栓质化壁层的, 且粘液积累在质膜和壁之间(Baas et al., 1985; Gregory et al., 1989)。但在显微水平, 成熟的粘液细胞因充满粘液而无法确定其壁的构造和粘液积累的部位。而根据另一些学者的研究, 粘液细胞的细胞壁有栓质化壁层和特化的胞间连丝(Gregory et al., 1989; Bakker et al., 1989; 1991;1992;1993)。根据油樟粘液细胞的研究结果, 粘液细胞不仅具有栓质化壁层, 而且还有内纤维素壁层, 其粘液也可能不在质外积累。
3.4 油细胞和粘液细胞的关系关于油细胞和粘液细胞的关系问题, Janssonius提出在樟科中油细胞和粘液细胞可以相互替代, 并且它们可能来自相同的原始细胞的观点, 以后Richter通过在显微水平上研究油细胞和粘液细胞的发育过程, 证明并拓广了Janssonius的观察结果(Baas et al., 1985)。West (1969)发现樟科植物粘液细胞是由早期的油细胞发育而来, 油樟油细胞和粘液细胞发育过程的显微研究, 也发现粘液细胞是由液泡化阶段以后的油细胞发育而来(初庆刚等, 1999d)。尽管West (1969)的研究结果目前尚存在疑虑和争论(Baas et al., 1985), 但根据本实验和West的研究结果, 从显微水平上可以确定粘液细胞来自油细胞, 与Janssonius和Richter的结果一致。在超微水平上, Bakker和Gerritsen (1989), Bakker和Gerritsen等(1991)证明油细胞和粘液细胞的发育在阶段3 (即内纤维素壁层开始形成)以前是相同的, 换句话说就是粘液细胞是由早期的油细胞发育而来。尽管本文对油樟油细胞和粘液细胞发育过程研究的结果有别于Bakker和Gerritsen (1989)以及Bakker和Gerritsen等(1991)的结果, 但有一点是相同的就是, 粘液细胞也是由油细胞发育而来的。
油细胞和粘液细胞超微结构上的相同之处以及在显微和超微水平上都证实的粘液细胞来自油细胞, 不仅很好地支持2者同源的问题, 而且也支持粘液细胞起源于油细胞的假说:在较原始的植物类群中, 粘液细胞从与其同源的油细胞遗传了可以沉积栓质化壁层的特性, 而在进化的类群中, 其细胞壁中的栓质壁层退化、消失, 因此粘液细胞中栓质化壁层的存在可以被看作是一原始性的残留(Baas et al., 1985; Bakker et al., 1993)。油细胞可以发育成为粘液细胞可能是我们在众多樟科植物成熟叶片比较解剖研究中, 观察到绝大多数植物中油细胞和粘液细胞并行存在的原因(初庆刚等, 1999a)。
3.5 不同固定方法对油的固定Maron和Fahn (1979)、Mariani和Cappelletti等(1989)以及Postek和Tucker (1983)利用戊二醛预固定、锇酸后固定对不同植物油细胞的发育过程进行研究, 尽管都认为质体是产生油的主要场所, 但都因未固定住油而无法确定油是何时产生的以及成熟以后油囊中油的状态如何, 又有Maron和Fahn (1979)在油细胞即将成熟时, 观察到少量小的嗜锇油滴。而Platt-Aloia和Thomson (1992)以及Platt-Aloia和Oross等(1983)利用多聚甲醛—戊二醛预固定、锇酸后固定对鳄梨果实油细胞进行研究, 在内纤维素壁层形成时, 观察到在细胞质和大小不等的液泡中的嗜锇油滴以及油细胞成熟后油囊中灰色的嗜锇油。本文对油樟油细胞发育过程的研究, 用了上述两种方法:油细胞阶段3以前观察结果是以多聚甲醛—戊二醛预固定的材料取得的, 油细胞阶段3以后所用的材料是戊二醛预固定的。因此在油细胞阶段3以前观察到了质体中、液泡中甚至油囊中不同嗜锇程度的油脂。而在油细胞阶段3以后的质体中和油囊未能观察到油囊中嗜锇油脂物质。对上述利用不同方法得出不同结果进行分析, 认为原因可能有:一是戊二醛对油脂类并不起固定作用, 反而会提取油脂, 而通常的作法是用戊二醛固定并保存材料, 因其渗透速度慢, 对材料固定时间较长, 这样在固定和保存的过程中将油脂提取掉了, 用锇酸后固定时, 已没有油或仅有少量油可以被固定; 再者是多聚甲醛穿透速度快, 能尽快杀死固定组织细胞, 加上戊二醛对细微结构的固定, 两者配合, 且固定后尽快用缓冲液冲液清洗, 便保存了油细胞中的油, 当锇酸后固定时, 油便被锇酸固定下来。因此, 本研究建议对含油较多的组织细胞进行超微结构研究时, 以选择固定速度快的多聚甲醛—戊二醛固定液为好, 固定时间不宜过长, 应尽快进行后固定以及以后的清洗、脱水、包埋等。
图版说明
DOD:黑色嗜锇滴DOM:黑色嗜锇物质Cu:杯形构造ER:内质网G:高尔基体GOD:灰色嗜锇滴GOM:灰色嗜锇物质IW:内纤维素壁层M:粘液Mm:多膜体MS:多膜结构Mt:线粒体N:细胞核O:油Os:油囊P:质体PW:初生纤维素壁层St:淀粉粒SW:栓质化壁层TW:三层细胞壁V:液泡Ve:小泡
图版Ⅰ 1~3.油细胞原始细胞时期。1.示初生纤维素壁、质体、高尔基体、线粒体。×35000 2.示初生纤维素壁、质体、线粒体、多膜体。×30000 3.示细胞核、初生纤维素壁、质体、液泡和质体内的黑色嗜锇滴。×17000 4~6.油细胞液泡化时期。4.示液泡的融合以及黑色嗜锇滴与液泡的融合。×5000 5.示初生纤维素壁、质体、内质网、液泡。×20000 6.示细胞核、初生纤维素壁、质体、淀粉粒和质体内的黑色嗜锇滴。×15000
图版Ⅱ 1, 2.油细胞液泡化时期。1.示细胞核、初生纤维素壁、质体、液泡中的色嗜锇物质。×20000 2.示初生纤维素壁、质体、黑色嗜锇滴与液泡的融合。×12000 3~5.油细胞栓质化壁层形成阶段。3.示初生纤维素壁、栓质化壁层、质体、灰色嗜锇物质和液泡。×15000 4.示初生纤维素壁、栓质化壁层、质体和液泡。×15000 5.示质体、灰色嗜锇滴和液泡。×15000 6.油细胞内纤维素壁层形成阶段, 示初生纤维素壁、栓质化壁层、内纤维素壁层和液泡。×25000
图版Ⅲ 1.油细胞内纤维素壁层形成阶段, 示质体、淀粉粒、内质网和灰色嗜锇物质。×20000 2~4.油细胞成熟及细胞质解体。2.示三层细胞壁、细胞质解体、灰色嗜锇物质、油囊。×20000 3.示三层细胞壁、细胞质解体融入油囊。×15000 4.示杯形构造、油囊。×20000 5.示三层细胞壁, 靠近油囊的细胞质中产生的多膜结构。×17000 6.示细胞质中的多膜结构和油囊的油中形成的解体部位。×3000
图版Ⅳ 1.示细胞质中形成的多膜结构。×17000 2.示靠近三层细胞壁的细胞质中形成的多膜结构。×17000 3.示细胞中多膜结构分布情况。×3500 4.示油囊中形成的多膜结构。×17000 5.示丝状粘液。×2500 6.示三层细胞壁、颗粒状粘液。×30000 7.示油细胞油囊中油的不均匀状态。×10000 8.示不匀质油中产生的降解部位。×2000 9.示三层细胞壁、油降解后的颗粒状粘液。×8000
Explanation of Plate
DOD:dark osmiophilic drop DOM:dark osmiophilic material Cu:cupule ER:endoplasm reticulum G:Golgi apparatus GOD:gray osmiophilic drop GOM :gray osmiophilic material IW:M :mucilage Mm :multi-membrane MS:multi-membrane structure Mt:mitochondrium N:nuclear O : oil Os:oil sac P:plastid PW:primary cellulose layer St:starch grain SW:suberin layer TW:three wall layer V :vacuole Ve :vesicle
PlateⅠ Fig.1~ 3.Oil cell initial.Fig.1.Showing primary cellulose layer, plastid, Golgi apparatus and mitochondrium.×3500 Fig.2.Showing primary cellulose layer, plastid, mitochondrium and multi-membrane.×30000 Fig.3.Showing primary cellulose layer, nuclear, plastid, vacuoles, and dark osmiophilic drops in plastid.×17000 Fig. 4~6.Part of vacuolizing oil cell.Fig.4.Showing that vacuoles coalesce with each other and dark osmiophilic drops coalesce with vacuoles.×5000 Fig.5.Showing primary cellulose layer, plastid, endoplasm reticulum and vacuoles.×20000 Fig.6.Showing primary cellulose layer, nuclear, plastid, starch grain, and dark osmiophilic drops in plastid.×15000
Plate Ⅱ Fig.1, 2.Part of vacuolizing oil cell.Fig.1.Showing primary cellulose layer, nuclear, plastid, and dark osmiophilic materials in vacuoles. ×20000 Fig. 2.Showing primary cellulose layer, plastid, and dark osmiophilic drops coalesce with vacuoles.×12000 Fig. 3~5.Stage of suberized lay er formation of oil cell.Fig.3.Showing primary cellulose layer, suberin layer, plastid, vacuole, gray osmiophilic materials.×15000 Fig.4.Showing primary cellulose layer, suberin layer, plastid, and vacuole.×15000 Fig.5.Showing plastid, gray osmiophilic drops, and vacuole.×15000 Fig.6.Stage of inner cellulose layer formation, showing primary cellulose layer, suberin layer, inner cellulose layer and vacuole.×25000
Plate Ⅲ Fig.1.Stage of inner cellulose layer formation, showing plastid, starch grain, endoplasm reticulum and gray osmiophilic materials.×20000 Fig.2~ 4.Stage of cytoplasm disintegration and mature oil cell.Fig.2.Showing three wall layer, disintegration of cytoplasm, gray osmiophilic materials and oil sac.×20000 Fig. 3.Showing three-wall layer, and disintegrating cytoplasm coalesceswith oil sac.×15000 Fig. 4.Showing cupule and oil sac. ×20000 Fig.5.Showing three wall layer and multi-membrane structure formed in the cytoplasm near oil sac.×17000 Fig.6.Showing three-wall layer, and multi-membrane structure in cytoplasm, and disintegrating site formed in the oil of oil sac.×3000
Plate Ⅳ Fig.1.Showing multi-membrane structure formed in the cytoplasm.×17000 Fig. 2.Showing the multi-membrane structure formed in the cytoplasm near cell wall.×17000 Fig.3.Showing the distribution of multi-membrane structures.×3500 Fig.4.Showing multi-membrane structure fo rmed in oil sac.×17000 Fig. 5.Showing filiform mucilage.×2500 Fig.6.Showing three wall layer, and granular mucilage.×30000 Fig. 7.Showing the inhomogeneous state of oil in oil sac.×10000 Fig.8.Showing the disintegrating site formed in the inhomogeneous oil.×2000 Fig.9.Showing three wall layer, and granular mucilage.×8000
初庆刚, 胡正海. 1999a. 中国樟科植物叶中油细胞和粘液细胞的比较解剖研究. 植物分类学报, 37(6): 529-540. |
初庆刚, 胡正海. 1998. 秦岭木姜子油细胞的分布和结构研究. 西北植物学报, 18(3): 356-360. DOI:10.3321/j.issn:1000-4025.1998.03.009 |
初庆刚, 刘文哲, 胡正海. 1999b. 木姜子油细胞的发育解剖学研究. 西北植物学报, 19(1): 85-88. |
初庆刚, 刘文哲, 胡正海. 1999c. 13种樟科植物叶油细胞和粘液细胞的分布和结构的比较研究. 应用与环境生物学报, 5(2): 165-169. |
初庆刚, 王奎先, 胡正海. 1999d. 油樟油细胞和粘液细胞的发育解剖学研究. 西北植物学报, 19(6): 104-110. |
施国新, 徐祥生, 王文, 等. 1991. 莼菜腺毛的发育及其超微结构研究. 西北植物学报, 11(1): 29-35. DOI:10.3321/j.issn:1000-4025.1991.01.006 |
朱丽霞, 程乃乾, 高信曾. 1983. 生物学中的电子显微镜技术. 北京: 北京大学出版社, 24-25.
|
Amelunxen F, Gronau G. 1969. Elektronen mikroskopische Untersuchungen an den Olzellen von Acorus calamus L. Z Pflanzenphysiol, 60: 156-168. |
Baas P, Gregory M. 1985. A survey of oil cells in the dicotyledons with comments on their replacement by and joint occurrence with mucilage cells. Isr J Bot, 34: 167-186. |
Bakker M E, Bass P. 1993. Cell walls in oil and mucilage cell. Acta Bot Neerl, 42(2): 133-139. DOI:10.1111/j.1438-8677.1993.tb00690.x |
Bakker M E, Gerritsen A F. 1990. Ultrastructure and development of oil idioblasts in Annona muricata L.. Ann Bot, 66: 673-686. DOI:10.1093/oxfordjournals.aob.a088082 |
Bakker M E, Gerritsen A F. 1989. A suberized layer in the cells wall of mucilage cells of Cinnamomum. Ann Bot, 63(4): 441-448. DOI:10.1093/oxfordjournals.aob.a087764 |
Bakker M E, Gerritsen A F, Van Der Schaaf P J. 1991. Development of oil and mucilage cells in Cinnamomum burmanni:An ultrastructural study. Acta Bot Neerl, 40(4): 339-356. DOI:10.1111/j.1438-8677.1991.tb01564.x |
Bakker M E, Gerritsen A F, Van Der Schaaf P J. 1992. Leaf anatomy of Cinnamomum Schaeffer (Lauraceae)with special reference to oil and mucilage cells. Blumea, 37: 1-303. |
Fahn A.Secretory Tissues in Plants.London, New York, San Francisco: Academic Press, 1979, 115~126, 158~221
|
Gregory M, Bass P. 1989. A survey of mucilage cells in vegetative organs of the dicotyledons. Isr J Bot, 38: 125-174. |
Mariani P, Cappletti E M, Campoccia D, Baldan B. 1989. Oil cells ultrastructure and development in Liriodendron tulipifera L. Bot Gaz, 150: 391-396. DOI:10.1086/337784 |
Maron R, Fahn A. 1979. Ultrastructure and development of oil cells in Laurus nobilis L.leaves. Bot J Linn Soc, 78: 31-40. DOI:10.1111/j.1095-8339.1979.tb02184.x |
Metcalf C K, Chalk L.Anatomy of the dicotyledons.Oxford: Clarendon Press, 1st ed.1957, 1145~1156
|
Platt-Aloia K A, Oross J W, Thomson W W. 1983. Ultrastructural study of the development of oil cells in the mesocarp of avocado fruit. Bot Gaz, 144(1): 49-55. DOI:10.1086/337343 |
Platt-Aloia K A, Thomson W W. 1992. Idioblast oil cells of avocado:distribution, isolation, ultrastructure, histochemistry and biochemistry. Int J Plant, 153: 301-310. DOI:10.1086/297033 |
Postek M T, Tucker S C. 1983. Ontogeny and ultrastructure of secretory oil cells in Magnolia grandiflora L.. Bot Gaz, 144: 501-512. DOI:10.1086/337403 |
Trachtenberg S. 1984. Cytochemical and morphological evidence for the involvement of the plasmamembrane and plastids in mucilage secretion in Aloe arborescens. Ann Bot, 53: 227-236. DOI:10.1093/oxfordjournals.aob.a086684 |
Tucker S C. 1976. Intrusive growth of secretary oil cells in Saururus cernuus. Bot Gaz, 137: 342-3474. |
West W E. 1969. Ontogeny of oil cells in the woody Ranales. Bull Torr Bot Club, 96(3): 329-344. DOI:10.2307/2483738 |
 2001, Vol. 37
2001, Vol. 37
