文章信息
- 於朝广, 殷云龙, 徐建华.
- Yu Chaoguang, Yin Yunlong, Xu Jianhua
- 用SRAP标记鉴定落羽杉属植物杂种
- Identification of Taxodium Hybrids by SRAP Analysis
- 林业科学, 2009, 45(2): 142-146.
- Scientia Silvae Sinicae, 2009, 45(2): 142-146.
-
文章历史
- 收稿日期:2008-02-22
-
作者相关文章
落羽杉属(Taxodium)植物为杉科(Taxodiaceae)落叶或半常绿性乔木,该属有3个种,分别是落羽杉(T. distichum)、池杉(T. ascendens)和墨西哥落羽杉(可简称为墨杉)(T. mucronatum)。具生长快、干型直、材质好、树形美和适应性广等特点,是林业和园林建设中很有发展前景的树种。1963年,叶培忠教授采用墨杉(♀)×柳杉(Cryptomeria fortunei)(♂)杂交组合,获得12株杂种苗(杂交墨杉),而后筛选出5株用于繁殖,并取名为东方杉(T. mucronatum × Cryptomeria fortunei),开创了我国落羽杉属杂交育种的先河(张建军等,2003;Creech et al., 2008)。江苏省·中国科学院植物研究所从1973年开始落羽杉属种间杂交优势利用研究,育成了中山杉302[T. distichum(♀) × T. mucronatum(♂)]等一批国家级林木良种无性系(於朝广等,2008),在江苏、上海、浙江等地大面积推广。2004年,该所又采用落羽杉属种间杂交创新组合墨杉(♀)×落羽杉(♂)(专利申请号:200710025662.4)进行试验,获得杂交后代3株,分别为T405、T406和T407。为明确这3株杂交后代的杂种身份,必须通过分子标记等有效手段对其杂种真实性进行鉴定。
在植物新品种保护领域中,分子标记技术在植物新品种实质审查和品种权纠纷司法鉴定中被广泛应用(王琼,2008),同时利用分子标记技术进行落羽杉属植物杂种鉴定和重要性状的早期选择是落羽杉属植物育种的关键技术之一。李涵等(2007)、陈云鹏等(2002)、周玉珍等(2006)、Ling等(2006)分别应用RAPD、PCR-RFLP、AP-PCR及ITS等分子标记技术对落羽杉属植物进行亲缘关系研究、指纹图谱构建及杂种鉴定。其中应用最多的为RAPD标记,但是RAPD所能提供的是显性标记,无法区分纯合型和杂合型基因,部分遗传信息难以表达,并且因为RAPD标记引物序列较短,稳定性和重复性较差。SRAP标记(sequence-related amplified polymorphism,序列相关扩增多态性)是Li和Quiros(2001)开发的一种基于PCR扩增的新型分子标记技术,自开发以来,已在多种植物的遗传图谱构建(王刚等,2004;Lin et al., 2005)、基因克隆(刘雅辉等,2007)、遗传多样性检测(Ferriol et al., 2003;文雁成等,2006;李晓慧等,2007)、基因连锁标记的寻找与基因定位(潘俊松等,2005)、比较基因组学及杂种优势预测(海燕等,2006)等方面得到了较为广泛的应用。
本文首次将SRAP标记应用到落羽杉属植物的研究中,通过SRAP分子标记技术对墨杉和落羽杉的4个杂交后代(正反交)进行杂种真实性鉴定,为杂交后代的进一步开发利用提供技术支持,同时通过本项研究,也使SRAP标记技术在落羽杉属植物的进一步研究中得到广泛应用而提供依据。
1 材料与方法 1.1 材料试验材料为落羽杉、墨杉及墨杉(♀)×落羽杉(♂)的3个杂交后代T405、T406、T407和落羽杉(♀)×墨杉(♂)的1个杂交后代中山杉302。均取自江苏省·中国科学院植物研究所试验苗圃。材料及编号见表 1。
|
|
基因组DNA提取采取CTAB(Cetyltrimethylammonium bromide,十六烷基三甲基溴化胺)法(奥斯伯等,2005),并稍作修改。DNA质量采用0.8%琼脂糖凝胶电泳检测,同时取50 ng·μL-1的λDNA作梯度(上样量分别为1、2、3、4、5、6 μL)。
1.3 SRAP-PCR扩增反应SRAP引物由上海博亚生物技术有限公司合成,dNTPs、10×PCR Buffer、Mg2+和Taq酶均购自南京申能博彩公司。DNA标准品购自南京TaKaRa公司。扩增反应采用10 μL的反应体系,其中包括:1 μL 10×PCR buffer,Mg2+2.0 mmol·L-1,dNTP 100 μmol·L-1,引物0.3 μmol·L-1,Taq DNA聚合酶0.5 U,模板DNA 50 ng。SRAP-PCR扩增程序及扩增产物的检测参照薛丹丹等(2008)的方法。
1.4 杂交亲本间多态性引物筛选根据上述SRAP-PCR反应体系,随机选取48个SRAP引物组合(表 2、3),对2亲本墨杉和落羽杉进行多态性SRAP引物组合的筛选。
|
|
|
|
根据筛选的多态性高、在双亲间有特异带的引物对杂交后代进行真实性鉴定,具有父本特异带的后代即为真杂种。
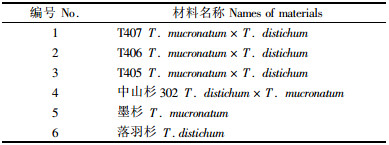
2 结果与分析 2.1 供试材料基因组DNA的检测对所提取DNA进行浓度和质量的检测,检测结果表明,本次试验提取的DNA质量好、浓度高,参试材料均一次性提取成功,本试验最终将各样品的DNA浓度统一稀释到50 ng·μL-1,作为模板DNA的浓度(图 1)。
|
图 1 参试材料DNA原液(上图)及稀释为50 ng·μL-1的电泳检测图(下图) Figure 1 Electrophoresis of genomic DNA (upper) and its 50 ng·μL-1 dilution (lower) for 6 tested samples 上图的前6个样品为λDNA,从左到右分别为50,100,150,200,250,300 ng。 Former 6 s amples in the upper figure are λDNA, from left to right are 50, 100, 150, 200, 250, 300 ng. |
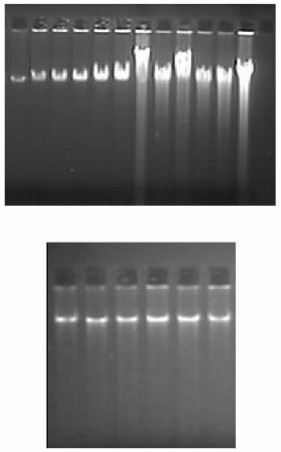
根据SRAP-PCR反应体系,随机组合了48对SRAP引物组合对2亲本材料墨杉和落羽杉进行了SRAP-PCR扩增(部分检测结果见图 2)。结果48个引物组合均扩增出了清晰的谱带。在48个引物组合中,筛选出24对墨杉有特异带的引物组合,19对落羽杉有特异带的引物组合。
|
图 2 1-24号引物组合对墨杉和落羽杉的扩增结果 Figure 2 The results amplified by optimized system in T. mucronatum and T. distichum using 1-24 primer combinations M:DNA Marker;1-24为表 3编号对应的引物组合;每个引物组合的试验材料墨杉(左)落羽杉(右)。 1-24:The No. of the primer combinations (shown in tab. 3); the experimental materials are T. mucronatum and T. distichum from left to right in each primer combinations. |
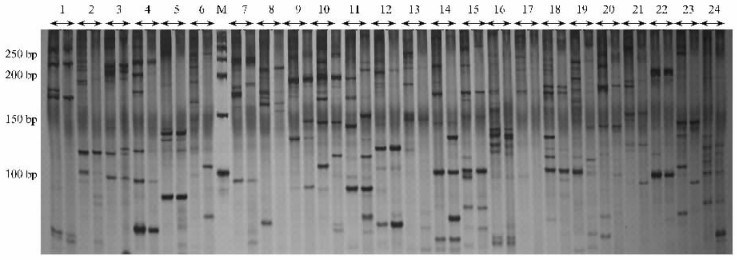
从以上筛选的双亲(墨杉与落羽杉)中有特异带(在图 3中以箭头标注)的引物中,筛选了12对引物,即6、11、14、23、31、33、34、35、36、37、39、44号引物组合(对应表 3编号),对T407、T406、T405和中山杉302进行杂种鉴定。结果发现,这4个后代均为真杂种,其中在引物组合Me9+Em10(35号)的扩增结果中,4个后代均既具有父本的特异带,又具有母本的特异带,因此通过这1对引物就可以鉴定这4个后代杂种的真实性,可以将这4个后代与双亲区分开来。同时也发现,另外还有5对引物(图 3)可以将1个或几个后代鉴定为真杂种,即后代具有父本的特异带。
另外,这6对引物也可以通过一些特征谱带将每个后代及亲本都区分开来。例如:片段Me14+Em8→90 bp与片段Me11+Em9→98 bp为中山杉302所特有(箭头所指),而片段Me9+Em10→90 bp,两亲本及T406、T405、中山杉302均有,只有T407没有。借鉴于常规植物分类方法,根据各后代及亲本某一多态性片段的有或无,将参试材料编制品种检索表,以便更加直观地将这4个后代及亲本区分开来。
1.有Me9+Em10→80 bp片段····························T405、T406、T407、中山杉302、落羽杉
2.有Me9+Em10→125 bp片段········································T405、T406、T407、中山杉302
3.有Me14+Em8→90 bp片段或有Me11+Em9→98 bp片段··························中山杉302
3.无Me14+Em8→90 bp片段或无Me11+Em9→98 bp片段········T405、T406、T407
4.有Me11+Em9→90 bp片段·························································································T405
4.无Me11+Em9→90 bp片段···········································································T406、T407
5.有Me9+Em10→90 bp片段·······················································································T406
5.无Me9+Em10→90 bp片段······················································································T407
2.无Me9+Em10→125 bp片段·························································································落羽杉
1.无Me9+Em10→80 bp片段·································································································墨杉
3 结论与讨论本试验首次将SRAP分子标记技术应用于落羽杉植物的研究中,因此,在应用该标记进行杂种鉴定前,首先采用L9(34)正交试验设计,对SRAP-PCR的反应体系中的各因子,包括Mg2+、dNTP、引物、Taq DNA聚合酶进行4因素3水平最佳组合筛选,本文用的体系即为所筛选的最优体系。应用优化后的体系随机选取了48对SRAP引物进行2亲本落羽杉与墨杉间多态性引物的筛选,结果发现48对引物均可扩增出清晰的谱带,且多态性较高,2份试验材料在48对引物的扩增结果中,有29对为多态性引物,占60.4%,且这29对多态性引物中有14对引物是2材料均有特异带的引物,这说明本试验所建立的SRAP-PCR反应体系不仅稳定性好,而且可以有效地应用于落羽杉属植物的杂种(或品种)鉴定以及遗传多样性的研究中。
如前所述,目前在落羽杉属植物的研究中应用最多的分子标记为RAPD标记,但RAPD标记因为所使用的引物较短,专一性差,极易从模板链上脱落,具有较差的重复性。而SRAP标记既具有RAPD的简捷性,又具备了AFLP的较丰富的多态性及较高的稳定性和可重复性,SRAP标记自开发以来已经在很多植物上开展了一系列的相关研究(李晓慧等,2007)。这种具有诸多优点的分子标记若能在落羽杉属植物研究中得到广泛的应用,将促进落羽杉属植物分子生物学的研究。
本文在筛选落羽杉与墨杉两亲本间多态性SRAP引物的基础上,对落羽杉与墨杉杂交的4个后代进行了杂种真实性鉴定,结果所筛选的多态性引物中,有6对引物可以将4个后代中1个或多个后代分别鉴定为真杂种,其中引物组合Me9+Em10的扩增结果中,4个后代既具有父本的特异带又具有母本的特异带,即仅这1对SRAP引物就可以鉴定4个后代的真实性,大大提高了分子鉴定的效率,并且在本研究中发现通过一些特征谱带可以将每个杂交后代及其2亲本区分开来,因此,本研究在进行杂种鉴定的同时,也建立了这些杂交后代的指纹图谱,为杂交后代的进一步研究及开发利用提供科学依据。SRAP标记的诸多优点及本研究所应用的SRAP-PCR反应体系的稳定性和可重复性在引物筛选与杂种鉴定的过程中得到了进一步的验证与体现。本研究对SRAP分子标记技术的成功应用为今后落羽杉属植物的品种鉴定、遗传多样性研究、指纹图谱构建以及遗传连锁图谱构建等奠定了重要基础,也将促进落羽杉属植物分子标记及遗传育种的研究。
陈云鹏, 潘士华, 张建军, 等. 2002. 利用RAPD检测技术推测杂交落羽杉群落间的亲缘关系. 复旦学报:自然科学版, 41(6): 641-645. |
海燕, 何宁, 康明辉, 等. 2006. 新型分子标记SRAP及其应用. 河南农业科学, (9): 9-12. DOI:10.3969/j.issn.1004-3268.2006.09.002 |
李涵, 殷云龙, 徐朗莱, 等. 2007. 落羽杉属树种及其杂交后代亲缘关系的RAPD分析. 林业科学, 43(2): 48-51. |
李晓慧, 田朝阳, 王从彦. 2007. SRAP分子标记分析西瓜遗传多态性. 生物技术, 17(3): 23-26. DOI:10.3969/j.issn.1004-311X.2007.03.009 |
刘雅辉, 闫红飞, 杨文香, 等. 2007. 小麦抗叶锈病基因Lrl9的SRAP标记. 华北农学报, 22(4): 193-196. |
奥斯伯F M, 金斯顿R E, 塞德曼J G, 等. 2005. 精编分子生物学实验指南. 4版. 北京: 科学出版社, 54-55.
|
潘俊松, 王刚, 李效尊, 等. 2005. 黄瓜SRAP遗传连锁图的构建及始花节位的基因定位. 自然科学进展, 15(2): 167-172. DOI:10.3321/j.issn:1002-008X.2005.02.007 |
王刚, 潘俊松, 李效尊, 等. 2004. 黄瓜SRAP遗传连锁图的构建及侧枝基因定位. 中国科学:C辑(生命科学), 34(6): 510-516. |
王琼, 郑勇奇, 周建仁. 2008. 分子标记在林业植物新品种鉴别中的应用及前景. 林业科学, 44(6): 180-182. DOI:10.3321/j.issn:1001-7488.2008.06.032 |
文雁成, 王汉中, 沈金雄, 等. 2006. 用SRAP标记分析中国甘蓝型油菜品种的遗传多样性和遗传基础. 中国农业科学, 39(2): 246-256. DOI:10.3321/j.issn:0578-1752.2006.02.005 |
薛丹丹, 郑轶琦, 王志勇, 等. 2008. 结缕草属植物SRAP-PCR体系的建立和优化. 草业学报, 17(6): 93-101. DOI:10.3321/j.issn:1004-5759.2008.06.014 |
於朝广, 殷云龙. 2008. 落羽杉属树木种间杂交选育研究进展. 江苏林业科技, 35(2): 39-46. DOI:10.3969/j.issn.1001-7380.2008.02.012 |
张建军, 潘士华, 沈烈英, 等. 2003. 东方杉的树种特征与生态价值. 上海农业学报, 19(3): 56-59. DOI:10.3969/j.issn.1000-3924.2003.03.016 |
周玉珍, 李火根, 张燕梅, 等. 2006. 墨西哥落羽杉无性系RAPD指纹图谱的构建. 南京林业大学学报:自然科学版, 30(5): 29-33. |
Creech D, Yin Yunlong, Xu Hebao, et al. 2008. Will the Real Montezuma Cypress × Japanese Cedar Hybrid Please Stand Up. Conifer Quarterly, 25(1): 40-44. |
Ferriol M, Pico B, Nuez F. 2003. Genetic diversity of a germplasm collection of cucurbitapepo using SRAP and AFLP markers. Theoretical and Applied Genetics, 107(2): 271-282. DOI:10.1007/s00122-003-1242-z |
Li G, Quiros C F. 2001. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica. Theoretical and Applied Genetics, 103: 455-461. DOI:10.1007/s001220100570 |
Lin Z, He D, Zhang X, et al. 2005. Linkage map construction and mapping QTL for cotton fibre quality using SRAP, SSR and RAPD. Plant Breeding, 124(2): 180-187. DOI:10.1111/pbr.2005.124.issue-2 |
Ling Yan, Lu Weifeng, Lu Fan, et al. 2006. PCR-RFLP and AP-PCR of rbcL and ITS of rDNA Show That × Taxodiomeria peizhongii (Taxodium × Cryptomeria) is not an intergeneric hybrid. Journal of Integrative Plant Biology, 48(4): 468-472. DOI:10.1111/jipb.2006.48.issue-4 |
 2009, Vol. 45
2009, Vol. 45